水的离子积和溶液的PH值知识讲解
水的离子积和溶液的pH课件

酸性
中性
碱性
(1)溶液的酸性越强,c(H+)越大,pH
(2)溶液的碱性越强,c(H+)越小,c(OH-) 越 , pH越 。
7
[例3] pH=2的盐酸与pH=6的硫酸等体 积混合,求混合后溶液的pH。 [例4] pH=9与pH=12的NaOH溶液等体 积混合,求混合后溶液的pH。
第二节水的电离 和溶液的pH
1
一、水的电离 1. 25℃纯水中,c(H+)= c(OH-) = (1)试求水的电离度。
(2)往纯水中加入盐酸、NaOH、 NaCl溶液,试分析对水的电离平衡 有何影响?
2
一、水的电离 2.水的离子积(Kw):
Kw = c(H+).c(OH-)
(1)Kw只与温度有关:升温,Kw 变 大 (2)25℃时,无论纯水、中性、碱 性或酸性稀溶液,Kw均为 1×10-14
[例5] pH=2的盐酸和pH=13的NaOH 溶液等体积混合,求混合后溶液的 pH。
8
[思考题1] 将pH=1的硫酸和醋酸分 别稀释到原来的100倍,两者的pH 如何变化? [思考题2] 将pH=12的氨水和NaOH 溶液分别稀释到原来的100倍,c(H+)<c(OH-) <1×10-7 >1×10-7
5
2.溶液的pH:
pH=-lg{c(H+)}
(1)c(H+)≤1mol/L (2)c(H+)=10-pH [例2] 试计算0.1mol/LHCl、0.01mol/L
HCl、纯水、0.01mol/LNaOH溶液的PH
第二节 水的离子积和溶液pH值

第二节水的离子积和溶液pH值[基础知识精析]复习目标:1.水的电离平衡和离子积的概念;2.影响水的电离平衡的因素;3.溶液的酸碱性和pH的关系;4.酸碱指示剂及变色范围和变色原理。
5.掌握水的离子积常数及溶液pH值表示的意义;6.掌握C(H+)、pH值与溶液酸碱性的关系;7.了解指示剂的变色范围,学会pH值的使用方法;8.掌握溶液pH值的有关计算。
一、水的离子积是指水达到电离平衡时的离子浓度的乘积。
通常把K w叫做水的离子积常数,简称水的离子积,K w只与温度有关。
已知在25℃时,水中的H+浓度与OH-浓度均为1×10-7 mol·L-1,所以在25℃时,K w= c(H+)·c(OH-)=1×10-7×1×10-7=1×10-14。
二、影响水的电离的因素页:11.加入酸或碱,抑制水的电离,K w不变;2.加入某些盐,促进水的电离,K w不变;3.电离过程是一个吸热过程,升高温度,促进水的电离,水的离子积增大。
三、溶液的酸碱性和pH值页:11.常温时,由于水的电离平衡的存在,不仅纯水,而且在酸性或碱性的稀溶液中,均存在H+、OH-,且c(H+)·c(OH-)=1×10-14。
中性溶液中,c(H+)=c(OH-)=1×10-7 mol·L-1;酸性溶液中,c(H+)>c(OH-),c(H+)>1×10-7 mol·L-1;碱性溶液中,c(H+)<c(OH-),c(H+)<1×10-7 mol·L-1。
强调:①含水的稀溶液中,H+与OH-共存,H+与OH-的相对多少决定溶液的酸碱性,但二者浓度的积必为常数;②碱性溶液中的c(H+)= K w/c(OH-);同理,酸性溶液中的c(OH-)= K w/ c(H+)。
说明:当我们表示很稀的溶液时,如,c(H+)=1×10-7 mol·L-1,用c(H+)或c(OH-)表示溶液的酸碱性很不方便。
36、何为水的离子积、溶液的pH值

何为水的离子积、溶液的pH值
(1)水的离子积:
纯水是一种很弱的电解质,其电离式如下:
H2O H+ + OH—
在一定温度下,当电离达到平衡时,水中的H+离子和OH—离子浓度的乘积是一个常数,这个常数叫做水的离子积,用Kw表示:
K w = [H+][OH—]
(2)溶液中酸碱性与[H+]和[OH—]的关系:
当溶液中[H+] > [OH—]时,则溶液为酸性;
当溶液中[H+] = [OH—]时,则溶液为中性;
当溶液中[H+] < [OH—]时,则溶液为碱性。
(3)溶液的pH值:
溶液中的酸碱性主要决定于[H+]和[OH—]的相对变化,这种变化可以统一用[H+]来表示。
但是,用[H+]来表示溶液的酸碱度,由于数值太小,运用不便,因此,在化学中通常用pH 值来表示溶液的酸碱度。
pH值就是溶液中氢离子浓度的负对数,即
pH = - lg[H+]
例如,[H+]=10-2mol/L,则pH = - lg-2 = 2。
同理,溶液中的OH—离子的浓度也可以用pOH表示,即,
pOH = - lg[OH—]
在22℃时,纯水中[H+] = [OH—] = 10-7mol/L,因此,pH + pOH = - lgl0-7 + (-lg-7) = 14 pH = 14—pOH。
例如,溶液中[OH—] = 10-2mol/L,则该溶液中:
pOH = -lg[OH—] = - lgl0-2 = 2
p0H = 14—pOH = 14—2 = 12。
水的离子积和溶液酸碱性

酸/碱:
抑制水的电离, KW不变
弱离子:
促进水的电离, KW 不变
二、溶液的酸碱性
1、判断溶液的酸碱性(:25℃ Kw= 1×10—14) 中性溶液 [H+] = [OH-] [H+] = 1×10—7mol/L
[OH-] = 1×10—7mol/L
酸性溶液 [H+] > [OH-] [H+] >1×10—7mol/L
无色
粉
红色
红
色
3.1—4.4 5.0—8.0 8.2—10.0
定量测定:pH试纸法 、pH计法等
二、溶液的酸碱性
3、“pH”的测定方法: 定性测定:酸碱指示剂法(甲基橙、石蕊、酚酞) 定量测定:pH试纸、pH计等
广泛pH试纸(读到整数) pH试纸 精密pH试纸(0.2或0.3) (粗略)
pH计(也叫 酸度计):读到0.01
pH值越小酸性越强,碱性越弱 pH值越大碱性越强,酸性越弱
①pH越小,溶液酸性越强,pH越大碱 性越强
②pH改变n个单位,C(H+)增大到原来的 10n倍或缩小到原来的1/ 10n倍
常温下 (250C)
溶液成中性 pH=7
1000C pH=6
溶液成碱性 pH>7
pH>6
溶液成酸性 pH<7
pH<6
加 碱性 逆向 减小 增大 < 不变
NaOH
(3)加酸或加碱:抑制水的电离,但 水的离子积保持不变。
问题讨论
H2O
H+ + OH-
在一定条件下向水中加入下列固体盐
水的电离平 [H+]变化 [ OH-]
Kw
衡移动方向
变化
化学课件《水的电离和溶液pH值》优秀ppt 人教课标版

(2)找准条件对水的电离平衡的影 响及H+和OH-的来源
(3)以水的电离生成的 C(H+)=C(OH-)为辅
内容提要
例题
总结
习题
解题思路
知识归纳
知识归纳:
1.常温时,某溶液中由水电离产生的C(H+) >1×10-7 mol/l 时,溶液是 能水解的盐(可能是强酸弱碱盐或 强碱弱酸盐等)
2.常温时,某溶液中由水电离产生C(H+)<1×10-7 mol/l 时,溶液是 能抑制水的电离的物质(可能是 酸或碱或其他特殊的物质,如NaHSO4等)
强酸强碱盐
4、温度
内容提要
内容提要
例题
总结
习题
二、影响水的电离平衡的因素
1、酸 2、碱
抑制水的电离,KW保持不变
3、盐
强酸弱碱盐 强碱弱酸盐 促进水的电离,KW保持不变
强酸强碱盐 不影响水的电离,KW保持不变 4、温度 升高温度促进水的电离,KW增大
注意:KW是一个温度函数,只随温度的升高而增大
酸 碱 强酸弱碱盐 强碱弱酸盐 强酸强碱盐 温度
(3)所以答案选D
返回
内容提要
例题
总结
习题
习 题1
习 题2
习 题3
习 题4
习 题5
2、常温时,在PH=8的CH3COONa 和NaOH两种溶液中,设由水电离产生的
C(OH-)分别为Amol/l与Bmol/l,则A和
B的关系为( C)
A、A< B
B、A=10-2B
C、B=10-2A D、A=B
返回
内容提要
94.对一个适度工作的人而言,快乐来自于工作,有如花朵结果前拥有彩色的花瓣。――[约翰·拉斯金] 95.没有比时间更容易浪费的,同时没有比时间更珍贵的了,因为没有时间我们几乎无法做任何事。――[威廉·班] 96.人生真正的欢欣,就是在于你自认正在为一个伟大目标运用自己;而不是源于独自发光.自私渺小的忧烦躯壳,只知抱怨世界无法带给你快乐。――[萧伯纳]
第二节水的离子积常数和溶液的酸碱性

第二节水的离子积常数和溶液的酸碱性班次:姓名:教学目的:1.了解水的离子积的含义掌握,[H+]和[OH-]与溶液酸碱性的关系;初步学会有关水的离子积的简单计算。
教学过程:1、回忆常见弱电解质的类型2、写出常温时,水的电离方程式及电离常数表达式讨论:根据水的电离方程,由水电离出来的[H+]与[OH-]之间有什么关系?那么他们的乘积呢?一.水的离子积常数:1.符号:2、表达式:3.影响因素:(通过观察表格3-2总结)4.在25度时,水的离子积常数为:100℃时,K W=思考:①水的电离是吸热?还是放热?②当温度升高,水的离子积是:_________(“增大”,“减小”或“不变”)③当温度降低,水的离子积是:_________(“增大”,“减小”或“不变”)例1.在某温度时,水的离子积常数为1×10-12,若在此温度下某溶液中H+浓度为1×10-7,那么此溶液中C(O H-)1、分别写出盐酸溶液中、氢氧化钠溶液中存在的电离方程式2、P46思考与交流1、2、3结论:讨论:溶液的酸碱性跟H+和OH-关系酸性溶液:碱性溶液:中性溶液:5.水的离子积是水电离平衡时的性质,它不仅适用于纯水,也适用于任何酸、碱、盐稀溶液。
即溶液中C(H+)×C(O H-)=①酸溶液中C(H+),近似看成是酸电离出来的浓度C(O H-),则来自于水的电离。
C(O H-)=②在碱溶液中,C(O H-)近似看成是碱电离出来的,而C(H+)则是来自于水的电离。
C(H+)=课堂练习:例2.求25℃时0.1mol/L盐酸中的[OH-]。
例3.求25℃时0.0005mol/LBa(OH)2溶液中的[H+]?例4.在某溶液中,由水电离出来的C(H+)为1×10-14mol/L,那么在此溶液中,一定可以大量共存的是()A. CO32-、NO3-、Cl-、Na+B.Ba2+、Cl-、NO3-、K+C. NH4+、Fe2+、SO42-、NO3-D. Mg2+、SO42-、K+、Na+第二节水的离子积常数和溶液的酸碱性(第二课时)班次:姓名:教学目的:初步掌握PH值的概念,PH大小和溶液酸碱性的关系,PH值的简单计算和测定。
水的电离和溶液的pH解析
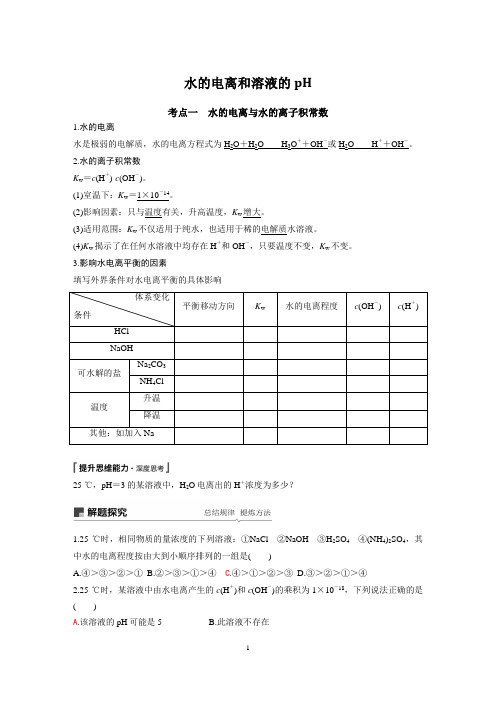
水的电离和溶液的pH考点一水的电离与水的离子积常数1.水的电离水是极弱的电解质,水的电离方程式为H2O+H2O H3O++OH-或H2O H++OH-。
2.水的离子积常数K w=c(H+)·c(OH-)。
(1)室温下:K w=1×10-14。
(2)影响因素:只与温度有关,升高温度,K w增大。
(3)适用范围:K w不仅适用于纯水,也适用于稀的电解质水溶液。
(4)K w揭示了在任何水溶液中均存在H+和OH-,只要温度不变,K w不变。
3.影响水电离平衡的因素填写外界条件对水电离平衡的具体影响体系变化条件平衡移动方向K w水的电离程度c(OH-) c(H+) HClNaOH可水解的盐Na2CO3 NH4Cl温度升温降温其他:如加入Na25 ℃,pH=3的某溶液中,H2O电离出的H+浓度为多少?1.25 ℃时,相同物质的量浓度的下列溶液:①NaCl②NaOH③H2SO4④(NH4)2SO4,其中水的电离程度按由大到小顺序排列的一组是()A.④>③>②>①B.②>③>①>④C.④>①>②>③D.③>②>①>④2.25 ℃时,某溶液中由水电离产生的c(H+)和c(OH-)的乘积为1×10-18,下列说法正确的是()A.该溶液的pH可能是5B.此溶液不存在C.该溶液的pH一定是9D.该溶液的pH可能为73.(2018·北京东城区质检)如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是()A.两条曲线间任意点均有c(H+)·c(OH-)=K wB.M区域内任意点均有c(H+)<c(OH-)C.图中T1<T2D.XZ线上任意点均有pH=74.(2018·韶关模拟)已知NaHSO4在水中的电离方程式为NaHSO4===Na++H++SO2-4。
某温度下,向c(H+)=1×10-6mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的c(H+)=1×10-2 mol·L-1。
水的离子积及PH值计算

水的离子积及PH值计算一、水的电离平衡(属于弱电解质的电离)1.平衡常数表达式:水的离子积常数Kw=C(H+).C(OH-);其中,C(H+)与C(OH-)为溶液中H+和OH-的总浓度,不可片面理解为水电离产生的H+与OH-的浓度。
2.Kw的影响因素:只与温度有关;一般我们认为,常温下25°C时,Kw=10-14;100°C时,Kw=10-12。
3.水的电离平衡移动影响因素(1)温度:温度升高,Kw变大,平衡右移(2)外加酸、碱,可抑制水的电离(相当于“同离子效应”):如在水中加入盐酸、氢氧化钠、硫酸氢钠等,可使水的电离程度变小,但不影响Kw的大小。
(3)外加可水解的盐,可促进水的电离(相当于“离子反应效应”):如在水中加入醋酸钠、氯化铵等,可使水的电离程度变大,但不影响Kw的大小。
(4)加入强酸的酸式盐,相当于加入酸,抑制水的电离;加入弱酸的酸式盐,对水的电离越促进还是抑制作用,则要看是水解程度大,还是电离程度大。
4.水的离子积常数的应用(1)求PH=1的盐酸溶液中,水电离产生的H+浓度;(2)求PH=1的氯化铵溶液中,水电离产生的H+浓度;(3)求PH=13的氢氧化钠溶液中,水电离产生的OH-浓度;(4)求PH=13的醋酸溶液中,水电离产生的OH-浓度(以上溶液均为常温时的溶液)结论:水电离产生的氢离子浓度为10-13的溶液,可能是酸溶液,也可能是强溶液;这一点在离子共存问题中,通常构成隐含条件。
5.PH值的大小与溶液酸碱性(1)溶液的酸、碱性,由C(H+)与C(OH-)的相对大小共同决定的;而溶液的PH=-lg(H+),只与C(H+)有关。
两者没有必然的联系,因此,不能说PH=7的溶液一定是中性的,也不能说PH=6的溶液一定是酸性的。
当溶液温度不是常温时,中性溶液的PH≠7(因Kw≠10-14)。
(2)例题:改变温度,下列溶液的PH值基本不变的是()A.NaOH溶液B.NaCl溶液C.稀硫酸D.NH4Cl溶液6.PH的相关计算(1)单一溶液PH求算(略)(2)溶液的稀释:对于强酸和强碱溶液来说,体积稀释为原来的10n 倍,则PH变化值为n,但要注意“无限稀释7为限”例如:pH=6的HCl溶液稀释100倍,混合PH≈7;对于弱酸和弱碱溶液来说,体积稀释为原来的10n倍,则PH变化值小于n。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
生活中的酸
? 西红柿、柠檬汁等 有酸味
? 食醋也有酸味 ? 它们当中都含有一
类特殊的化合物
6
生活中的碱
? 皮蛋、肥皂、洗衣 粉等洗涤剂有滑腻 感和涩味
? 这些物质中含有另 一类特殊的化合物
7
对于生活中的酸与碱,我们 可通过尝尝,摸摸来区分!
但对于实验室中的酸与碱 呢,我们又如何区分?
8
生活中的酸和碱---开心小魔术
一、水的离子积
水的离子积是指水达到电离平衡时的离子浓度的乘积。通常 把Kw叫做水的离子积常数,简称水的离子积,Kw只与温度有关。
已知在25℃时, 水中的H+浓度与OH-浓度均为1×10-7 mol·L,
所以在25℃时, Kw= c(H+)·c(OH-)=1×10-7×1×10-7=1×10-14。
2.常用指示剂的变色范围:
甲基橙 ; 石蕊 ;
酚酞
生活中的酸和碱
H+
OH -
H OH
1
清晨,一位花匠走进英国化学家波义耳的书房, 将一篮非常好看的深紫色的紫罗兰摆在屋角。美丽的 花朵的诱人的清香使波义耳心旷神怡,他随手拿了一 束花向实验室走去。实验室里,助手正在倒盐酸,波 义耳把花放在桌子上。赶紧去给助手帮忙。淡黄色的 液体在滚滚冒烟,由于飞沫溅到了花上,紫罗兰也冒 起轻烟来,多可惜呀!把这么好的花毁了,得赶快冲 洗一下。波义耳将花放进水里,过了一会儿,奇怪, 紫罗兰颜色变红了!花儿为什么变红呢?
第二节:水的离子积和溶液的PH值
教学目标
1. 水的电离平衡和离子积的概念; 2.影响水的电离平衡的因素; 3.溶液的酸碱性和pH的关系; 4.酸碱指示剂及变色范围和变色原理。 5.掌握水的离子积常数及溶液pH值表示的意义; 6.掌握C(H+)、pH值与溶液酸碱性的 关系; 7.了解指示剂的变色范围,学会pH值的使用方法; 8.掌握溶液pH值的有关计算。
? 试管中的紫色石蕊溶液,在不借助实验室中 任何化学药品的情况下,你能否施展魔力使 之颜色发生变化?
10
识别酸和碱
[ 实验探究一]
紫紫色色石石蕊蕊试试液液遇在碳不酸同变溶红液中的颜色变化
白醋 柠檬汁 石灰水 肥皂水 食盐水 蔗糖水
加入紫色石蕊
试液后的颜色
︸ ︸ ︸ 酸性溶液
碱性溶液 中性溶液
遇到紫酸色和石碱蕊时试能液发遇生酸特变定成的红颜色色变化,化
二、影响水的电离的因素
1.加入酸或碱,抑制水的电离,Kw不变; 2.加入某些盐,促进水的电离,Kw不变 ; 3.电离过程是一个吸热过程,升高温度,促进水的电 离,水的离子积增大
三、溶液的酸碱性和pH值
1.常温时,由于水的电离平衡的存在,不仅纯水,而且在酸性或碱性的 稀溶液中,均存在H+、OH-,且c(H+)·c(OH-)=1×10-14。 中性溶液中,c(H+)=c(OH-)=1×10-7 mol·L-1;
[交流与共享]
? 盐酸溶液中,氢离子、氯离子、水分子,到底 是哪种微粒在作怪,使指示剂变色得呢?
? 为什么食醋中的醋酸、盐酸、硫酸等不同的酸 都能使石蕊试液变红呢?
? HCl=H ++Clˉ H 2SO4=2H++SO42ˉ
? 电离时都生成氢离子(H+)
? 闻气味、通入二氧化碳气体 ? 加入紫色石蕊试液 ? 石蕊试纸 ? 其他方法
14
识别酸和碱
盐酸
硫酸
HCl
[
快 乐 参 与 ]
H2SO 4
H+
和
酸
根
离
子
H+ 、Cl-
H+
、SO
24
电离时生成的阳离子全部是氢离子 (H +)的化
合物叫做酸。
15
识别酸和碱
氢氧化钠 NaOH
[
快 乐 参 与 ]
氢氧化钾 KOH
学上把这紫类色物石质蕊叫试做液酸遇碱碱指变示成剂蓝。色
紫色石蕊试液在中性溶液中仍为紫色
11
识别酸和碱
[ 实验探究二] 无色酚酞试液在不同溶液中颜色变化
白醋 柠檬汁 石灰水 肥皂水 食盐水 蔗糖水
加入无色酚酞
试液后的颜色
︸ ︸ 酸性溶液
碱性溶液
无色酚酞试液遇酸不变色
︸ 中性溶液
无色酚酞试液遇碱变成红色
四、酸碱指示剂及变色范围和变色原理; pH的测定方法
1.常用的试液和试纸,PH试纸的使用,酸碱指示剂的变色范围和变色 原理。
中和滴定时指示剂的选择:强酸和强碱中和滴定时,可选用酚酞或甲基 橙作指示剂;强酸和弱碱中和滴定时,当酸碱反应达到等当点时,溶液 的PH值小于7,一般选用甲基橙作指示剂,而不选用酚酞作指示剂;弱 酸和强碱中和滴定时,当酸碱反应达到等当点时,溶液的PH值大于7, 一般选用酚酞作指示剂,而不选用甲基橙作指示剂。
酸性溶液中,c(H+)>c(OH-),c(H+)>1×10-7 mol·L-1;
碱性溶液中,c(H+)<c(OH-),c(H+)<1×10-7 mol·L-1。 强调: ①含水的稀溶液中,H+与OH-共存,H+与OH-
的相对多少决定溶液的酸碱性,但二者浓度的积必为常数; ②碱性溶液中的c(H+)= Kw/c(OH-) ;同理,酸性溶液中的c(OH- = Kw/ c(H+)。 说明:当我们表示很稀的溶液时,如,c(H+)=1×10-7 mol·L-1,用c (H+)或c(OH-)表示溶液的酸碱性很不方便
无色酚酞试液在中性溶液中仍为无色
12
识别酸和碱
酸碱指示剂 石蕊试纸
红色石蕊试纸(用来检验 碱溶液ຫໍສະໝຸດ :——遇到碱溶液变成 蓝色
蓝色石蕊试纸(用来检验 酸溶液):
——遇到酸溶液变成 红色
13
生活中的酸和碱---实际应用
? 实验室中有三瓶失去标签的无色液体: 白醋、澄清石灰水、食盐水,你能想出几 种办法区分它们?
常温下溶液酸碱性与pH的关系
中性溶液中 c(H+)=1×10-7 mol·L-1,PH=7; 酸性溶液中 c(H+)>1×10-7 mol·L-1,溶液酸性越强,溶液的PH值越小; 碱性溶液中 c(H+)<1×10-7 mol·L-1,PH>7,溶液碱性越强,溶液的PH值越大
PH的计算 PH=—lg【H+】
金 属 离 子 和
OH -
Na+ 、OH -
K+ 、OH -
电离时生成的阴离子全部是氢氧根 离子(OH -)的化合物叫做碱。
16
识别酸和碱
选出所列 物质中的酸 和碱(填序 号)
酸:①⑤ 碱: ③⑥
①HNO 3 ②Na2SO4 ③Ca(OH) 2
④NH4Cl ⑤H2CO 3 ⑥Ba(OH) 2
17
生活中的酸和碱---酸
