2017年高考真题 专题06+物质结构+元素周期律Word版含解析
2017高考化学分类的汇编_专题6物质结构元素周期律

2017年高考真题分类汇编(化学):专题6 物质结构元素周期律一.单选题1.(2017•北京)2016年IUPAC命名117号元素为Ts(中文名“ ”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是()A. Ts是第七周期第ⅦA族元素B. Ts的同位素原子具有相同的电子数C. Ts在同族元素中非金属性最弱D. 中子数为176的T S核素符号是Ts2.(2017•天津)根据元素周期表和元素周期律,判断下列叙述不正确的是()A. 气态氢化物的稳定性:H2O>NH3>SiH4B. 氢元素与其他元素可形成共价化合物或离子化合物C. 如图所示实验可证明元素的非金属性:Cl>C>SiD. 用中文“”(ào)命名的第118号元素在周期表中位于第七周期0族3.(2017•新课标Ⅲ)短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外电子数之和为21.下列关系正确的是()A. 氢化物沸点:W<ZB. 氧化物对应水化物的酸性:Y>WC. 化合物熔点:Y2X3<YZ3D. 简单离子的半径:Y<X4.(2017•新课标Ⅱ)a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族,下列叙述正确的是()A. 原子半径:d>c>b>aB. 4种元素中b的金属性最强C. c的氧化物的水化物是强碱D. d单质的氧化性比a单质的氧化性强5.(2017•新课标Ⅰ)短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的.由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生.下列说法不正确的是()A. X的简单氢化物的热稳定性比W强B. Y的简单离子与X的具有相同的电子层结构C. Y与Z形成的化合物的水溶液可使蓝色石蕊试纸变红D. Z与X属于同一主族,与Y属于同一周期二.推断题6.(2017•海南)X、Y、L、M为核电荷数依次增大的前20号主族元素。
2017年全国高考化学试题---物质结构与性质-专题汇编-含答案与解析

1. (12分)(2017?江苏-21)铁氮化合物(Fe x N y )在磁记录材料领域有着广泛的应用前景。
某Fe x N y 的制备需铁、氮气、丙酮和乙醇参与。
(1) ______________________________________________________________ Fe 3+基态核外电子排布式为 。
(2 )丙酮(CH 3COCH 3)分子中碳原子轨道的杂化类型是 _____________ , 1mol 丙酮分子中含有键的数目为 ______________ 。
(3) ________________________________________________________________ C 、H 、O 三种元素的电负性由小到大的顺序为 ________________________________________________________________________。
(4) ___________________________________________________________ 乙醇的沸点高于丙酮,这是因为 。
(5)某Fe x N y 的晶胞如图-1所示,Cu 可以完全替代该晶体中 a 位置Fe 或者b 位置Fe ,形成Cu 替代型产物Fe (x -n ) Cu n N y . Fe x N y 转化为两种 Cu 替代型产物的能量变化如图- 2所示,其中更稳定的 C u 替代型产物的化学式为 _________________________ 。
1 j^Cu 普地柱 tFdlf 料化过程2] 3-2胡祀过找的齟量变化【答案】⑴[Ar ]3d 5 或 1s 22s 22p 63s 23p 63d 5⑵sp 2 和 sp 3 9N A ⑶ H v C v O⑷乙醇分子间存在氢键⑸Fe 3CuN【解析】(1) Fe 的原子序数为26, Fe 3+基态核外电子数为 23,且3d 电子为半满稳定结构,可知 Fe 3+基态核外电子排布式为[Ar ]3d 5 或 1s 22s 22p 63s 23p 63d 5。
2017年高考化学试题分类汇编—---物质结构--元素周期律(xueshengb)

2017年高考化学真题分类汇编Ⅰ—原子结构1.(2017•北京-8)2016年IUPAC命名117号元素为T S,T S的原子核外最外层电子数是7,下列说法不正确的是A.T S是第七周期第ⅦA族元素 B.T S的同位素原子具有相同的电子数C.T S在同族元素中非金属性最弱 D.中子数为176的T S核素符号是117176Ts2.(2017•新课标Ⅱ-9)a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族,下列叙述正确的是A.原子半径:d>c>b>aB.4种元素中b的金属性最强C.c的氧化物的水化物是强碱D.d单质的氧化性比a单质的氧化性强3.(2017•江苏-2)下列有关化学用语表示正确的是A.质量数为31的磷原子: 3115P B.氟原子的结构示意图:C. CaCl2的电子式: D.明矾的化学式: Al2(SO4)34.(2017•江苏-5)短周期主族元素X、Y、Z、W原子序数依次增大,其中只有Y、Z处于同一周期且相邻,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素.下列说法正确的是A.原子半径:r(X)<r(Y)<r(Z)<r(W) B.W的最高价氧化物的水化物是一种弱碱C.Y的单质的氧化性比Z的强 D.X、Y、Z 三种元素可以组成共价化合物和离子化合物5.(14分)(2017•天津-7)某混合物浆液含有Al(OH) 3、MnO2和少量Na2CrO4。
考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图),使浆液分离成固体混合物和含铬元素溶液,并回收利用.回答Ⅰ和Ⅱ中的问题.Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)(1)反应①所加试剂NaOH的电子式为。
B→C的反应条件为,C→Al的制备方法称为。
(2)该小组探究反应②发生的条件。
D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2.由此判断影响该反应有效进行的因素有(填序号) 。
2017届高考化学:第5章《物质结构元素周期律》(新人教版含答案)课件
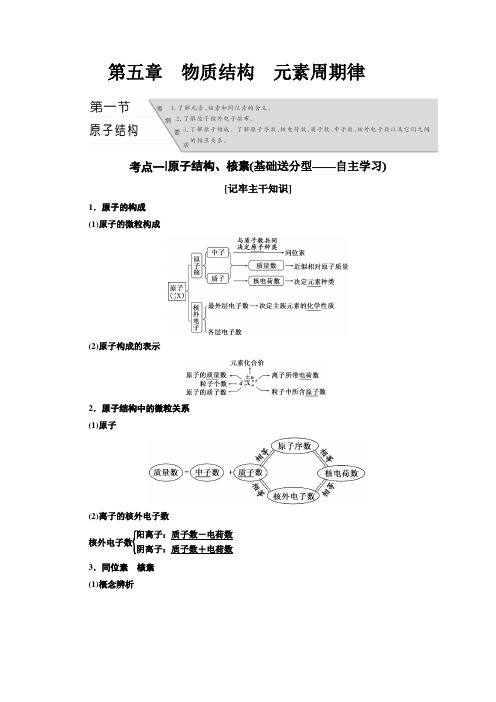
第五章 物质结构 元素周期律考点一| 原子结构、核素(基础送分型——自主学习)[记牢主干知识]1.原子的构成(1)原子的微粒构成(2)原子构成的表示2.原子结构中的微粒关系(1)原子(2)离子的核外电子数核外电子数⎩⎪⎨⎪⎧ 阳离子:质子数-电荷数阴离子:质子数+电荷数 3.同位素 核素(1)概念辨析(2)同位素的特征①相同存在形态的同位素,化学性质几乎完全相同,物理性质不同。
②天然存在的同一元素各核素所占的原子百分数一般不变。
(3)常见的重要核素及其应用一、基础知识全面练1.判断正误(正确的打“√”,错误的打“×”)。
(1)所有的原子中都含有质子和中子(×)(2)34S原子核内中子数为16(×)(3)2H+核外电子数为2 (×)(4)13C和15N核内中子数相差1(√)(5)H3O+和OH-中具有相同的质子数和电子数(×)(6)1H182O的摩尔质量为20 g·mol-1(√)(7)质量数就是元素的相对原子质量(×)(8)质子数相同的粒子一定属于同一种元素(×)(9)一种单质中可能含有多种核素,如O2中含16O、17O、18O三种核素(√)(10)11H+、21H+和31H+互称同位素(×)2.(1)在6Li、7Li、23Na、24Mg、14C、14N六种粒子中,包含______种元素,________种核素,其中互为同位素的是________,中子数相等的核素是__________。
(2)D3O+中的质子数为________,电子数为________,中子数为________。
答案:(1)566Li与7Li23Na与24Mg(2)111011二、常考题点分组练题点(一)原子的表示方法及各微粒数目之间的关系1.下列说法正确的是( )A .(2015·全国卷Ⅱ)235 g 核素235 92U 发生裂变反应:235 92U +10n ――→裂变9038Sr +136 54Xe +1010n ,净产生的中子(10n)数为10N AB .(2014·山东高考)3517Cl 与3717Cl 得电子能力相同C .(2013·江苏高考)中子数为146、质子数为92 的铀(U)原子:146 92UD .(2012·天津高考)235 92U 和238 92U 是中子数不同,质子数相同的同种核素解析:选B 核素235 92U 发生裂变反应,235 92U +10n ――→裂变9038Sr +136 54Xe +1010n ,净产生的中子(10n)数为10-1=9,235 g 核素235 92U 的物质的量为1 mol ,则发生裂变时净产生的中子数为9N A ;C 项中表示铀原子为238 92U ,错误;D 项中235 92U 和238 92U 是不同核素,D 错误。
2017年高考题型揭秘之理综化学 题型04 物质结构 元素周期律 专题03 命题点深入剖析(1) Word版含解析
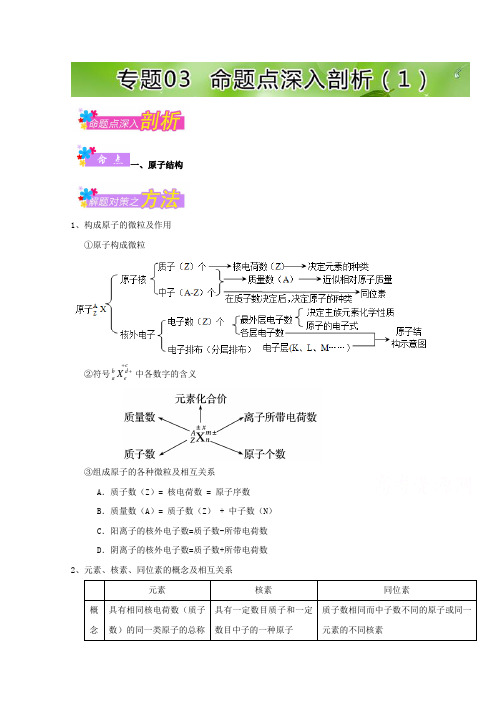
一、原子结构1、构成原子的微粒及作用 ①原子构成微粒②符号c bd aeX++中各数字的含义③组成原子的各种微粒及相互关系A .质子数(Z )= 核电荷数 = 原子序数B .质量数(A )= 质子数(Z ) + 中子数(N )C .阳离子的核外电子数=质子数-所带电荷数D .阴离子的核外电子数=质子数+所带电荷数 2、元素、核素、同位素的概念及相互关系【典例1】科学家宣布发现了铝的“超级原子”结构——Al 13和Al 14。
已知这类“超级原子”最外层电子数之和为40个时处于相对稳定状态.下列说法中,正确的是 ( )A .Al 13、Al 14互为同位素B .Al 13超原子中Al 原子间通过离子键结合C .Al 14最外层电子数之和为42,与第ⅡA 族元素的性质相似D .Al 13和Al 14都具有较强的还原性,容易失去电子生成阳离子 【答案】C3×14=42,易失去电子,形成阳离子,故D 错误;答案为C 。
考点:考查核素、质量数与质子数和中子数之间的相互关系。
【典例2】金属钛对人体体液无毒且能与肌肉和骨骼生长在一起,有“生物金属”之称。
下列有关48Ti和50Ti的说法正确的是()A.48Ti和50Ti的质子数相同,互称同位素B.48Ti和50Ti的质量数不同,属于两种元素C.48Ti和50Ti的质子数相同,是同一种核素D. 48Ti和50Ti的质子数相同,中子数不同,互称同素异形体【答案】A考点:考查原子的组成,同位素、同素异形体的判断。
二、核外电子排布1、电子层的表示方法及能量变化①排布方式分层排布,电子层由里到外依次是:第一、…、七层,符号分别对应:K、L、M、N、O、P、Q。
②表示方法2、核外电子排布规律排布规律①能量最低原则核外电子总是先排布在能量最低的电子层里,然后再按照由里向外的顺序依次排布在能量逐渐升高的电子层里。
②每层最多容纳的电子数为2n2(n代表电子层数)。
③电子一般总是先排在能量低的电子层里,即最先排在 K层,当 K 层排满后,再排 L层,依此类推。
2017年高考化学试题分类解析 考点5 物质结构和元素周期律

温馨提示:此题库为Word版,请按住Ctrl,滑动鼠标滚轴,调节合适的观看比例,关闭Word文档返回原板块。
考点5 物质结构和元素周期律选择题1.(2017·天津高考·5)根据元素周期表和元素周期律,判断下列叙述不正确的是( )A.气态氢化物的稳定性:H2O>NH3>SiH4B.氢元素与其他元素可形成共价化合物或离子化合物C.如图所示实验可证明元素的非金属性:Cl>C>SiD.用中文“”(ào)命名的第118号元素在周期表中位于第七周期0族【命题意图】本题主要考查元素周期表和元素周期律的相关知识,意在考查学生对元素金属性、非金属性的判断依据、同周期的元素性质的递变、化学键与化合物的知识的理解应用能力。
【解析】选C。
元素的非金属性决定气态氢化物的稳定性,由于非金属性O>N>Si,所以气态氢化物的稳定性H2O>NH3>SiH4,A正确;氢元素可以与氧元素、氮元素等形成水、氨气等共价化合物,也可与Na等元素形成离子化合物,B正确;利用最高价氧化物对应水化物的酸性强弱或气态氢化物的稳定性等来比较非金属性,但不能用氢化物的酸性来验证非金属性强弱,即如图所示不能比较Cl、C的非金属性强弱,C不正确;根据元素周期表可知,D正确。
【快速巧解】本题可以利用“排除法”,根据最高价氧化物对应的水化物判断非金属性的强弱,判断C项是不正确的。
2.(2017•乙卷•12)短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。
由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。
下列说法不正确的是( )A.X的简单氢化物的热稳定性比W的强B.Y的简单离子与X的具有相同的电子层结构C.Y与Z形成化合物的水溶液可使蓝色石蕊试纸变红D.Z与X属于同一主族,与Y属于同一周期【命题意图】本题考查元素周期表和元素周期律相关知识,意在考查学生对元素周期表的熟悉程度和对元素周期律的理解、应用能力。
2017年全国高考化学试题 元素周期律 专题汇编 含参考答案与解析

2017年全国高考化学试题元素周期律专题汇编Ⅰ—原子结构1.(2017?北京-8)2016年IUPAC命名117号元素为TS ,TS的原子核外最外层电子数是7,下列说法不正确的是A.TS是第七周期第ⅦA族元素B.TS的同位素原子具有相同的电子数C.TS在同族元素中非金属性最弱D.中子数为176的TS 核素符号是117176Ts【答案】D【解析】A.根据原子核外电子排布规则,该原子结构示意图为,据此判断该元素位于第七周期、第VIIA族,故A正确。
B有相同的电子数,故B正确;C最弱,故C正确;D D错误;【考点】【专题】【点评】明确原子结构与元素周期律的关系为解答2.(2017?a原子核外电子总数与b d与a同族,下列叙述正确的是AB.4C.cD.d【答案】B【解析】由以上分析可知a为O元素、b可能为Na或Mg、c为Al、d为S元素.A.同周期元素从左到右原子半径逐渐减小,应为b>c>d,a为O,原子半径最小,故A错误;B.同周期元素从左到右元素的金属性逐渐降低,则金属性b>c,a、d为非金属,金属性较弱,则4种元素中b的金属性最强,故B正确;C.c为Al,对应的氧化物的水化物为氢氧化铝,为弱碱,故C错误;D.一般来说,元素的非金属性越强,对应的单质的氧化性越强,应为a的单质的氧化性强,故D 错误。
【考点】原子结构与元素周期律的关系【专题】元素周期律与元素周期表专题【点评】本题考查原子结构与元素周期律,为高频考点,侧重考查学生的分析能力,本题注意把握原子核外电子排布的特点,把握性质的比较角度,难度不大。
3.(2017?江苏-2)下列有关化学用语表示正确的是A.质量数为31的磷原子:3115PB.氟原子的结构示意图:C.CaCl2的电子式:D.明矾的化学式:Al2(SO4)3【答案】A【解析】质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数。
A.质量数为31的磷原子的质量数=15+16=31B.氟原子的核电荷数、核外电子总数都是9,故C,故C错误;D2O,故D错误;故选A。
2017年全国高考新课标版化学试题分类汇编之考点5 物质结构和元素周期律

考点5 物质结构和元素周期律选择题1.(2017·天津高考·5)根据元素周期表和元素周期律,判断下列叙述不正确的是()A.气态氢化物的稳定性:H2O>NH3>SiH4B.氢元素与其他元素可形成共价化合物或离子化合物C.如图所示实验可证明元素的非金属性:Cl>C>SiD.用中文“”(ào)命名的第118号元素在周期表中位于第七周期0族【命题意图】本题主要考查元素周期表和元素周期律的相关知识,意在考查学生对元素金属性、非金属性的判断依据、同周期的元素性质的递变、化学键与化合物的知识的理解应用能力。
【试题解析】选C。
元素的非金属性决定气态氢化物的稳定性,由于非金属性O>N>Si,所以气态氢化物的稳定性H2O>NH3>SiH4,A正确;氢元素可以与氧元素、氮元素等形成水、氨气等共价化合物,也可与Na等元素形成离子化合物,B正确;利用最高价氧化物对应水化物的酸性强弱或气态氢化物的稳定性等来比较非金属性,但不能用氢化物的酸性来验证非金属性强弱,即如图所示不能比较Cl、C 的非金属性强弱,C不正确;根据元素周期表可知,D正确。
【快速巧解】本题可以利用“排除法”,根据最高价氧化物对应的水化物判断非金属性的强弱,判断C项是不正确的。
2.(2017•乙卷•12)短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。
由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。
下列说法不正确的是()A.X的简单氢化物的热稳定性比W的强B.Y的简单离子与X的具有相同的电子层结构C.Y与Z形成化合物的水溶液可使蓝色石蕊试纸变红D.Z与X属于同一主族,与Y属于同一周期【命题意图】本题考查元素周期表和元素周期律相关知识,意在考查学生对元素周期表的熟悉程度和对元素周期律的理解、应用能力。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.【2017新课标1卷】短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。
由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。
下列说法不正确的是
A.X的简单氢化物的热稳定性比W强
B.Y的简单离子与X的具有相同的电子层结构
C.Y与Z形成化合物的水溶液可使蓝色石蕊试纸变红
D.Z与X属于同一主族,与Y属于同一周期
【答案】C
【名师点睛】本题考查元素周期表和元素周期律的知识,准确判断出元素是解答的关键,注意从元素及其化合物知识的角度去判断,例如制冷剂、淡黄色沉淀和刺激性气味气体等,然后再根据元素周期律的知识进行解答,这就需要掌握(非)金属性的强弱、微粒半径的大小比较等知识,因此平时学习中要夯实基础知识,同时应注意知识的灵活运用。
元素周期表、元素周期律是学习化学的工具和基本规律。
元素周期表反映了元素的原子结构、元素的性质及相互转化关系的规律,是根据元素周期律的具体表现形式,元素周期律是元素周期表排布的依据。
元素的原子半径、元素的化合价、元素的金属性、非金属性、原子核外电子排布都随着原子序数的递增而呈周期性的变化。
同一周期的元素原子核外电子层数相同,从左到右原子序数逐渐增大;同一主族的元素,原子最外层电子数相同,从上到下原子核外电子层数逐渐增大。
原子核外电子排布的周期性变化是元素周期律变化的原因,掌握元素的单质及化合物的结构、反应条件、物质的物理性质、化学性质等是进行元素及化合物推断的关键。
!
2.【2017新课标2卷】a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b 原子次外层的电子数相同;c所在周期数与族数相同;d与a同族。
下列叙述正确的是
A.原子半径:d>c>b>a B.4种元素中b的金属性最强
C.c的氧化物的水化物是强碱D.d单质的氧化性比a单质的氧化性强
【答案】B
【名师点睛】本题考查元素周期表和元素周期律的知识,首先根据题目信息判断出元素名称,再根据元素周期律进行知识的判断,这就需要掌握(非)金属性的强弱、微粒半径的大小比较等知识,因此平时夯实基础知识是关键,同时应注意知识的灵活运用,审清题意。
元素周期表、元素周期律是学习化学的工具和基本规律。
元素周期表反映了元素的原子结构、元素的性质及相互转化关系的规律,是根据元素周期律的具体表现形式,元素周期律是元素周期表排布的依据。
元素的原子半径、元素的化合价、元素的金属性、非金属性、原子核外电子排布都随着原子序数的递增而呈周期性的变化。
同一周期的元素原子核外电子层数相同,从左到右原子序数逐渐增大;同一主族的元素,原子最外层电子数相同,从上到下原子核外电子层数逐渐增大。
原子核外电子排布的周期性变化是元素周期律变化的原因,掌握元素的单质及化合物的结构、物质的物理性质、化学性质等是进行元素及化合物推断的关键。
3.【2017新课标3卷】短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。
下列关系正确的是
W X
Y Z
A.氢化物沸点:W<Z B.氧化物对应水化物的酸性:Y>W
C.化合物熔点:Y2X3<YZ3D.简单离子的半径:Y<X
【答案】D
【解析】设W原子的最外层电子数为x,由图表可知,四种元素原子的最外层电子数之和=x+x+1+x-2 +x+2=21,解得x=5,则W为N元素、X为O元素、Y为Al元素、Z为Cl元素。
A.NH3分子间有氢键,其沸点比HCl高,故A错误;B.Al(OH)3显两性,N元素的氧化物对应的水化物HNO3、HN O2均显酸性,故B错误;C.Al2O3是离子晶体,高熔点,而AlCl3是分子晶体,熔点低,故C错误;D.Al3+和O2-离子结构相同,核电荷数大,离子半径小,故D正确。
答案选D。
【名师点睛】考查元素周期表的结构及元素周期律的应用,其中微粒的半径大小比较是该题的难点
,比较方法是:(1)同周期元素的微粒:同周期元素的原子或最高价阳离子或最低价阴离子半径随核电荷数增大而逐渐减小(稀有气体元素除外),如Na >Mg >Al >Si ,Na +>Mg 2+>Al 3+,S 2->Cl -;(2)同主族元素的微粒:同主族元素的原子或离子半径随核电荷数增大而逐渐增大,如Li <Na <K ,Li +<Na +<K +;(3)电子层结构相同的微粒:电子层结构相同(核外电子排布相同)的离子半径(包括阴、阳离子)随核电荷数的增加而减小,如O 2->F ->Na +>Mg 2+>Al 3+;
(4)同种元素形成的微粒:同种元素原子形成的微粒电子数越多,半径越大,如Fe 3+<Fe 2+<F e ,H +<H <H -;(5)电子数和核电荷数都不同的,可通过一种参照物进行比较,如比较Al 3+与S 2-的半径大小,可找出与Al 3+电子数相同的O 2-进行比较,Al 3+<O 2-,且O 2-<S 2-,故Al 3+<S 2-。
4.【2017北京卷】2016年IUPAC 命名117号元素为Ts (中文名“
”,tián ),Ts 的原子核外最外层
电子数是7。
下列说法不正确...
的是 A .Ts 是第七周期第ⅦA 族元素
B .Ts 的同位素原子具有相同的电子数
C .Ts 在同族元素中非金属性最弱
D .中子数为176的Ts 核素符号是 【答案】D
【名师点睛】明确元素周期表的结构以及编制原则是解答的关键,元素周期表每一周期元素种类依
次为2、8、8、18、18、32、32(周期表未排满),则每一周期最后一种惰性气体原子序数依次为2、10、18、36、54、86、118,因此只要记住了稀有气体元素的原子序数,就可由主族元素的原子序数推出主族元素的位置。
即(1)若比相应的稀有气体元素多1或2,则应处在下周期的第ⅠA 族或第ⅡA 族,如88号元素:88-86=2,则应在第七周期第ⅡA 族;(2)若比相应的稀有气体元素少1~5时,则应处在同周期的第ⅦA 族~第ⅢA 族,如84号元素应在第六周期第ⅥA 族;(3)若预测新元素,可与未发现的稀有气体元素(118号)比较,按上述方法推测知:117号元素应为第七周期第ⅦA 族。
…网
5.【2017天津卷】根据元素周期表和元素周期律,判断下列叙述不正确...的是
A.气态氢化物的稳定性:H2O>NH3>SiH4
B.氢元素与其他元素可形成共价化合物或离子化合物
C.图1所示实验可证明元素的非金属性:Cl>C>Si
D.用中文“”(ào)命名的第118号元素在周期表中位于第七周期0族
【答案】C
【名师点睛】熟练应用元素周期律是准确解题的核心。
A、C两项元素的非金属性可以用氢化物的稳定性,最高价氧化物对应水化物的酸性,相互置换能力等来判断。
B项则涉及到离子化合物、共价化合物的判断,可以根据组成元素来判断。
6.【2017江苏卷】短周期主族元素X、Y、Z、W原子序数依次增大,其中只有Y、Z处于同一周期且相邻,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素。
下列说法正确的是A.原子半径:r(X) <r(Y) <r(Z) <r(W)
B.W的最高价氧化物的水化物是一种弱碱
C.Y的单质的氧化性比Z的强
D.X、Y、Z三种元素可以组成共价化合物和离子化合物
【答案】D
【解析】地壳中含量最多的是氧,Z为O元素,所以Y为N元素;钠是短周期金属性最强的元素,W
是Na;X原子序数最小且不与Y、Z同周期,所以X是H元素。
A.原子半径N>O,A错误;B.W的最高价的氧化物的水化物是氢氧化钠,是强碱,B错误;C.氮气的氧化性比氧气弱,C错误;D.H、N、O可以组成HNO3等共价化合物,也可以组成NH4NO3等离子化合物,D正确。
【名师点睛】本题考查的是元素周期律,考查学生对元素在元素周期表的位置、原子结构及元素的性质三者之间的关系理解水平。
解题时首先要抓住题干中关键信息,准确推断题给元素;然后确定有关短周期主族元素在周期表中的位置;最后依据同周期、同主族元素性质的递变规律来推断各选项表述是否正确。
