《碳及其重要化合物转化关系》方程式的书写
九年级化学下册《第十单元 酸与碱》单元测试卷(带答案)

九年级化学下册《第十单元酸与碱》单元测试卷(带答案)一、单选题1.价类图是学习物质性质的一种重要工具,如图是碳及其化合物之间的价类转化关系。
下列说法错误的是A.A点可表示多种不同的单质B.A→B→C都只能通过与O2的反应来实现C.C→D的反应类型为化合反应D.E可由C与碱溶液反应制得2.下列有关实验现象的描述中,正确的是()A.打开盛有浓盐酸的试剂瓶,在瓶口观察到白烟B.硫在氧气中燃烧,发出蓝紫色火焰C.细铁丝在空气中燃烧,火星四射,生成黑色固体D.镁条在空气中燃烧发出耀眼的白光,生成氧化镁3.下列描述属于氢氧化钙化学性质的是()A.白色固体B.微溶于水C.溶液有滑腻感D.能与CO2反应4.下列实验现象描述正确的是A.打开盛有浓盐酸的试剂瓶的瓶盖,瓶口出现白烟B.铁与稀盐酸反应,溶液由无色变成浅绿色C.硫在空气中燃烧发出明亮的蓝紫色火焰D.木炭还原氧化铜,生成红色的铜5.下列说法正确的是A.KNO3 20℃时的溶解度大于80℃时溶解度B.氯化钠溶液能够导电是因为溶液中存在自由移动的阴、阳离子C.加热KClO3时,用MnO2作催化剂,能提高氧气的产量D.相同条件下,NaCl溶于水时溶液温度高于NaOH溶于水时溶液温度6.区分下列各组物质,所加试剂或操作方法都正确的是选项需区分的物质方法一方法二A烧碱和熟石灰滴加稀盐酸,观察是否产生气泡溶于水观察溶解性B黄金和黄铜灼烧后观察颜色加入稀盐酸C氧气和氢气通入紫色石蕊试液通过灼热的氧化铜D 食盐水和稀硫酸闻气味滴加硝酸银溶液A.A B.B C.C D.D7.下列有关图中实验的相关判断错误的是A.T1<T2B.固体X可能是CaOC.锥形瓶℃中的溶液为不饱和石灰水D.锥形瓶℃和℃中Ca(OH)2的质量分数相等8.下列对于实验现象的描述正确的是A.红磷在氧气中燃烧产生大量的白雾并发出蓝光B.氧化铜与盐酸反应,溶液颜色变为蓝绿色,加水后,逐渐变为蓝色C.电解水时正负极产生气体体积比是2℃1D.硫在氧气中燃烧产生淡蓝色火焰9.下列实验方法不能达到实验目的的是A.用盐酸清洗水壶中的水垢B.用肥皂水区别硬水和软水C.往饱和石灰水中通入少量二氧化碳,使溶液变成不饱和石灰水D.一氧化碳还原氧化铁的实验中,将尾气通入氢氧化钠溶液,清除剩余的一氧化碳10.硫酸是一种重要的化工原料,下列说法正确的是A.浓硫酸可作所有气体的干燥剂B.稀硫酸不可用于金属表面除锈C.浓硫酸有脱水性,可使木材、纸张炭化D .实验室可用块状石灰石与稀硫酸制备CO 211.下列除杂试剂正确的是A .用过量的2O 除去2CO 中COB .用过量的4FeSO 溶液除去Zn 中FeC .用过量的NaOH 除去2CaCl 溶液中HClD .用过量的HCl 溶液除去Cu 中CuO二、填空题12.氢氧化钠(化学式:__)因有强烈的腐蚀性,故俗称为__、__或__,白色固体,__溶于水,且放出大量的热,暴露在空气中容易吸收水分发生潮解;可用于干燥中性或碱性气体(如O 2、H 2、NH 3等),但不能干燥酸性气体(如__、__、__等)。
高中化学全程学习方略配套课件:碳及其化合物间的转化(鲁科版必修)
课
基
前
础
新 知
【思路点拨】解答本题需注意以下两点:
自 主
初
演
探
练
课
课
堂
后
互
巩
动
固
探
作
究
业
易
思
错
维
案
实
例
验
警
探
示
究
课
基
前
础
新 知
【自主解答】选D。把H2SO4溶液滴加到Na2CO3溶液中,先
自 主
初
演
探 生成NaHCO3,然后才生成CO2,把Na2CO3溶液滴加到H2SO4溶 练
液中,直接生成CO2,所以当H+的物质的量小于CO32-的物
实 验
警
探
示 所以C错,D对。
究
课 3.(双选)下列叙述正确的是( )
基
前
础
新 知
A.水合碳酸钠晶体在干燥空气中失去结晶水是物理变化
自 主
初
演
探 B.碳酸钠和碳酸氢钠都易溶于水
练
C.碳酸钠比碳酸氢钠溶解度小
课
课
堂 互
D.碳酸钠比碳酸氢钠稳定
后 巩
动
探 【解析】选B、D。A中Na2CO3·10H2O失去结晶水变成碳酸
基
前 新
装置序号)_____。
础 自
知 初
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学
主 演
探 方程式为_______________________________________;
练
课 与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)_____;
课
转化关系图

重要的转化关系图1.碳及其化合物的转化关系图2.氮及其化合物的转化关系图NH 4N 324Mg 3N 23·H 2ONH 4+ OH -+Ca(OH)2,△HClH 2,催化剂高温 高压O 2 , 放电O 2H 2O NaOH O 2浓H 2SO 4△①浓酸,Cu ②见光或△③C点燃2O△△O 2 ,催化剂,3.磷及其化合物的转化关系图4.铁及其化合物的转化关系图5.镁及其化合物的转化关系图6氯及其化合物的转化关系图Cl 2CuCl 2PCl 3、PCl HClO O 2Ca(ClO)2①C O 2+H 2O②C l P ,点燃2点燃NaClNaOH H 2S O 4(浓)△MnO 2、△N a , △①电解熔融盐②电解食盐水H 2O光照A gN O3Ag N O 3Ca(OH)27硫及其化合物的转化关系图H 2SSSO 2SO 3Na 2SO 4FeS FeS 2Na 2SO 3H 2SO 3H 2SO 4BaSO 4HClH 2,△O 2,燃烧H 2SO 2,燃烧①加热分解②不完全燃烧O 2,催化剂,△NaOHNaOHO 2BaCl 2H 2OBaCl 2①浓酸,C u ,△②浓酸,C, △H 2OH2S O4O2,高温F e ,△8硅及其化合物的转化关系图[此文档可自行编辑修改,如有侵权请告知删除,感谢您的支持,我们会努力把内容做得更好]。
碳及其化合物化学方程式的书写

碳及其化合物化学方程式的书写1 碳在氧气中燃烧:方程式:(氧气足量)(氧气不足)2 碳和水蒸气反应制备水煤气3 CO2与水4 CO2通入到过量的氢氧化钠溶液化学方程式:。
离子方程式:________________________________________5 用澄清的石灰水检验二氧化碳化学方程式:。
离子方程式:________________________________________6 把二氧化碳通入到碳酸钠溶液中化学方程式:。
离子方程式:________________________________________7实验室制备二氧化碳的原理化学方程式:。
离子方程式:________________________________________8 把碳酸钠溶液滴加到盐酸溶液中制备碱化学方程式:。
离子方程式:________________________________________9把盐酸滴到碳酸钠溶液中化学方程式:。
离子方程式:________________________________________10 碳酸钠与氢氧化钙溶液的反应化学方程式:。
离子方程式:________________________________________11 碳酸氢钠与盐酸的反应化学方程式:。
离子方程式:________________________________________12 碳酸氢钠溶液与氢氧化钠溶液反应化学方程式:。
离子方程式:________________________________________13 把碳酸氢钠溶液滴加到氢氧化钙溶液中化学方程式:。
离子方程式:________________________________________14 把氢氧化钙溶液滴加到碳酸氢钠溶液中化学方程式:。
离子方程式:________________________________________15 用氯化钡溶液区分碳酸氢钠溶液与碳酸钠溶液化学方程式:。
碳及碳的化合物间的所有化学方程式

碳及碳的化合物间的所有化学方程式1碳在氧气中充分燃烧:C + O2点燃CO22碳在氧气中不充分燃烧:2C + O2点燃2CO3一氧化碳在氧气中燃烧:2CO + O2点燃2CO24甲烷在空气中燃烧:CH4+ 2O2 点燃CO2+ 2H2O5酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2+ 3H2O6碳酸不稳定而分解:H2CO3=== H2O + CO2↑7高温煅烧石灰石:CaCO3高温CaO + CO2↑8木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑9焦炭还原氧化铁:3C+ 2Fe2O3高温4Fe + 3CO2↑10焦炭还原四氧化三铁:2C+ Fe3O4高温3Fe + 2CO2↑11一氧化碳还原氧化铜:CO+ CuO △Cu + CO2一氧化碳还原氧化铁:3CO+ Fe2O3高温2Fe + 3CO212一氧化碳还原四氧化三铁:4CO+ Fe3O4高温3Fe + 4CO213苛性钠暴露在空气中变质:2NaOH + CO2==== Na2CO3+ H2O14大理石与稀盐酸反应:CaCO3+ 2HCl ===CaCl2+ H2O + CO2↑15碳酸钠与稀盐酸反应: Na2CO3+ 2HCl===2NaCl + H2O + CO2↑16碳酸镁与稀盐酸反应: MgCO3+ 2HCl ===MgCl2+ H2O + CO2↑17消石灰放在空气中变质:Ca(OH)2+ CO2==== CaCO3↓+ H2O18硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑19二氧化碳溶解于水:CO2 + H2O === H2CO3文案编辑词条B 添加义项?文案,原指放书的桌子,后来指在桌子上写字的人。
现在指的是公司或企业中从事文字工作的职位,就是以文字来表现已经制定的创意策略。
文案它不同于设计师用画面或其他手段的表现手法,它是一个与广告创意先后相继的表现的过程、发展的过程、深化的过程,多存在于广告公司,企业宣传,新闻策划等。
第2课时碳及其化合物间的转化
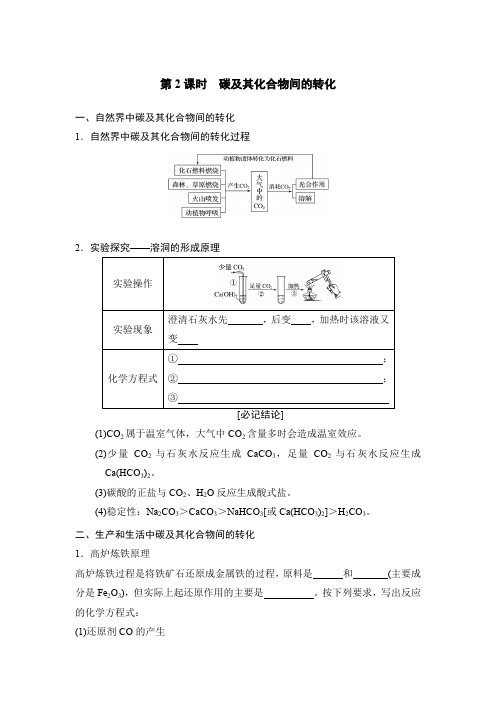
第2课时 碳及其化合物间的转化一、自然界中碳及其化合物间的转化 1.自然界中碳及其化合物间的转化过程2.实验探究——溶洞的形成原理(1)CO 2属于温室气体,大气中CO 2含量多时会造成温室效应。
(2)少量CO 2与石灰水反应生成CaCO 3,足量CO 2与石灰水反应生成Ca(HCO 3)2。
(3)碳酸的正盐与CO 2、H 2O 反应生成酸式盐。
(4)稳定性:Na 2CO 3>CaCO 3>NaHCO 3[或Ca(HCO 3)2]>H 2CO 3。
二、生产和生活中碳及其化合物间的转化 1.高炉炼铁原理高炉炼铁过程是将铁矿石还原成金属铁的过程,原料是 和 (主要成分是Fe 2O 3),但实际上起还原作用的主要是 。
按下列要求,写出反应的化学方程式: (1)还原剂CO 的产生① ; ② 。
(2)CO 还原氧化铁,生成铁 3Fe 2O 3+CO=====高温2Fe 3O 4+CO 2② ③ 2.碳及其化合物之间的转化碳及其化合物间的转化有的属于单质、氧化物和盐之间的转化,有的属于盐与盐、氧化物与氧化物之间的转化,其转化关系为 具体转化的过程如图:写出各步反应的化学方程式:3.我们使用的自来水中往往含有碳酸氢钙和碳酸氢镁,因此水壶、传送热水的管道内壁常常积有水垢。
由此你推测水垢中一定含有哪种物质?它是怎样形成的?如何除去水壶中的水垢?写出相关的化学方程式。
(1)成分: 、Mg(OH)2。
(2)形成过程反应的化学方程式:① 。
②Mg(HCO 3)2=====△MgCO 3↓+H 2O +CO 2↑, MgCO 3+H 2O =====△Mg(OH)2+CO 2↑。
4.碳在无机物和有机物间也可转化。
1828年,德国化学家维勒用无机化合物氰酸铵(NH 4CNO)首次合成了有机化合物 ,开创了以含碳无机化合物合成有机化合物的先河。
[必记结论](1)C 、CO 一般表现还原性,CO 2只有氧化性。
(2)CO 2具有酸性氧化物通性:与水反应生成碳酸;与碱反应生成碳酸盐和水。
鲁科版化学 碳及其化合物间的转化

2.CO2与NaOH溶液反应用量和产物分析
nCO2 nNaOH <1∶2 =1∶2 1 nCO2 < <1 2 nNaOH =1∶1 >1∶1 反应情况 NaOH 过量,只发生反应 (1)(余 NaOH) CO2 与 NaOH 恰好按(1)反应 (1)(2)两个反应均有 恰好发生反应(2) 只发生反应(2),CO2 剩余 生成物
答案:还原剂
还原
还原
1.12
6.72×105
3.高炉炼铁过程中焦炭的作用是什么?
答案:①燃烧提供能量
②与O2反应生成还原剂CO。
1.CO2与碱反应的原理
CO2为酸性氧化物,能与碱反应生成盐和水。
CO2与碱反应时产物与二者的相对量有关,当碱足量
时生成碳酸盐,当CO2足量时,生成碳酸氢盐。如与
NaOH溶液反应:
根据钠元素守恒得:2x+y=0.04 mol;
根据碳元素守恒得:x+y=0.03 mol;
解得:x=0.01 mol,y=0.02 mol,
所以n(Na2CO3)∶n(NaHCO3)=1∶2。
[答案] B
元素守恒(或原子守恒)、质量守恒、电荷(或电子) 守恒,是中学化学常用的解题方法,它可使较复杂的 计算简单化。
同,产物会有所不同,解答此类题目时可依据两个守恒: 钠守恒和碳守恒。 1.6 g n(NaOH) = = 0.04 mol , n(CO2) = 40 g· mol-1 0.672 L 假设混合物中 Na2CO3 和 NaHCO3 -1=0.03 mol, 22.4 L· mol 的物质的量分别为 x 和 y,
(完整版)碳及其化合物的化学方程式和离子方程式答案

碳及其化合物的化学方程式和离子方程式总结(注:带*的不要求记住,但要求能理解)一、碳1、碳在少量的氧气中燃烧:2C+O22CO2、碳在足量的氧气中燃烧:C+O2CO2*3、碳和硫蒸气高温反应:C+2S CS24、碳和氧化铁在高温下反应:2Fe2O3+3C2Fe+3CO2↑5、碳粉与氧化铜共热:2CuO+C2Cu+CO2↑6、碳和水蒸气高温反应:C+H2O(g)CO+H27、碳和二氧化碳在高温下反应:C+CO22CO8、碳与浓硫酸共热:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O9、碳与浓硝酸共热:C+4HNO3(浓)CO2↑+4NO2↑+2H2O10、工业上制备粗硅:SiO2+2C Si+2CO↑*11、工业上制备金刚砂:SiO2+3C SiC+2CO↑*12、工业上制备碳化钙:CaO+3C CaC2+CO↑二、一氧化碳1、一氧化碳在氧气中燃烧:2CO+O22CO22、一氧化碳气体和氧化铁在高温下反应:Fe2O3+3CO2Fe+3CO23、一氧化碳通过灼热的氧化铜:CuO+CO Cu+CO24、一氧化碳和水蒸气反应:CO+H2O(g)CO2+H2三、二氧化碳1、镁在二氧化碳中燃烧:2Mg+CO22MgO+C2、碳和二氧化碳在高温下反应:C+CO22CO3、氧化钠与二氧化碳反应:Na2O+CO2Na2CO34、氧化钙与二氧化碳反应:CaO+CO2CaCO35、过氧化钠与二氧化碳反应:2Na2O2+2CO22Na2CO3+O2↑6、二氧化碳和水反应:CO2+H2O H2CO37、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO2Na2CO3+H2O2OH-+CO2CO32-+H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO2NaHCO3OH-+CO2HCO3-9、工业上生产碳酸氢铵:NH3+CO2+H2O NH4HCO310、向澄清石灰水中通入少量二氧化碳:Ca(OH)2+CO2CaCO3↓+H2OCa2++2OH-+CO2CaCO3↓+H2O11、向澄清石灰水中通入足量二氧化碳:Ca(OH)2+CO2Ca(HCO3)2OH-+CO2 HCO3-12、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3CO32-+CO2+H2O2HCO3-*13、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO32Na++CO32-+CO2+H2O2NaHCO3↓14、向四羟基合铝酸钠溶液中通入少量二氧化碳气体:2Na[Al(OH)4]+CO22Al(OH)3↓+Na2CO3+H2O2[Al(OH)4]-+CO2+3H2O2Al(OH)3↓+CO32-+H2O15、向四羟基合铝酸钠溶液通入足量二氧化碳气体:Na[Al(OH)4]+CO2Al(OH)3↓+NaHCO3[Al(OH)4]-+CO2Al(OH)3↓+HCO3-16、向硅酸钠通入中通入少量的二氧化碳:Na2SiO3+CO2+H2O H2SiO3↓+Na2CO3SiO32-+CO2+H2O CO32-+H2SiO3↓17、向硅酸钠通入中通入过量的二氧化碳:Na2SiO3+2CO2+2H2O H2SiO3↓+2NaHCO3SiO32-+2CO2+2H2O2HCO3-+H2SiO3↓18、向碳酸钙的悬浊液通入二氧化碳气体:CaCO3+CO2+H2O Ca(HCO3)2CaCO3+CO2+H2O Ca2++2HCO3-19、向苯酚钠溶液中通入少量二氧化碳气体:C6H5ONa+CO2+H2O C6H5OH+NaHCO3C6H5O-+CO2+H2O C6H5OH+HCO3-20、向次氯酸钠溶液中通入少量二氧化碳气体:NaClO+CO2+H2O HClO+NaHCO3ClO-+CO2+H2O HClO+HCO3-21、向次氯酸钙溶液中通入少量二氧化碳:Ca(ClO)2+CO2+H2O CaCO3↓+2HClOCa2++2ClO-+CO2+H2O CaCO3↓+2HClO 22、向次氯酸钙溶液中通入足量二氧化碳:Ca(ClO)2+2CO2+2H2O Ca(HCO3)2+2HClOClO-+CO2+H2O HCO3-+HClO四、碳酸钙1、碳酸钙溶于稀盐酸:CaCO3+2HCl CaCl2+CO2↑+H2OCaCO3+2H+Ca2++CO2↑+H2O2、碳酸钙溶于醋酸:CaCO3+2CH3COOH(CH3COO)2Ca+CO2↑+2H2OCaCO3+2CH3COOH2CH3COO-+Ca2++CO2↑+H2O*3、碳酸钙溶于氯化铁溶液:3CaCO3+2FeCl3+3H2O2Fe(OH)3+3CaCl2+3CO2↑3CaCO3+2Fe3++3H2O2Fe(OH)3+3CO2↑+3Ca2+4、碳酸钙高温条件下与二氧化硅反应:CaCO3+SiO2CaSiO3+CO2↑5、高温分解碳酸钙:CaCO3CaO+CO2↑6、向碳酸钙的悬浊液通入二氧化碳气体:CaCO3+CO2+H2O Ca(HCO3)2CaCO3+CO2+H2O Ca2++2HCO3-五、碳酸氢钙1、碳酸氢钙与盐酸反应:Ca(HCO3)2+2HCl CaCl2+2CO2↑+2H2OHCO3-+H+CO2↑+H2O2、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH-CaCO3↓+H2O3、向碳酸氢钙溶液中加入足量氢氧化钠溶液:Ca(HCO3)2+2NaOH CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3↓+CO32-+2H2O 4、向碳酸氢钙溶液中加入石灰水:Ca(HCO3)2+Ca(OH)22CaCO3↓+2H2OCa2++HCO3-+OH-CaCO3↓+H2O5、加热碳酸氢钙:Ca(HCO3)2CaCO3↓+CO2↑+H2O6、碳酸氢钙溶液与碳酸钠溶液反应:Ca(HCO3)2+Na2CO3CaCO3↓+2NaHCO3Ca2++CO32-CaCO3↓六、碳酸钠1、向碳酸钠溶液中逐滴加入稀盐酸至过量:Na2CO3+HCl NaCl+NaHCO3 NaHCO3+HCl NaCl+CO2↑+H2O总式:Na2CO3+2HCl2NaCl+CO2↑+H2O 离:CO32-+2H+CO2↑+H2O2、碳酸钠溶液与氢氧化钙溶液反应:Na2CO3+Ca(OH)22NaOH+CaCO3↓Ca2++CO32-CaCO3↓3、碳酸钠溶液与氯化钙溶液反应:Na2CO3+CaCl22NaCl+CaCO3↓Ca2++CO32-CaCO3↓七、碳酸氢钠1、向碳酸氢钠溶液中加入稀盐酸:NaHCO3+HCl NaCl+CO2↑+H2OHCO3-+H+CO2↑+H2O2、碳酸氢钠溶液与少量氢氧化钙溶液反应:Ca(OH)2+2NaHCO3CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3↓+CO32-+2H2O 3、碳酸氢钠溶液与足量氢氧化钙溶液反应:Ca(OH)2+NaHCO3 CaCO3↓+NaOH+H2OCa2++HCO3-+OH-CaCO3↓+H2O4、碳酸氢钠溶液与氢氧化钠溶液反应:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH- CO32-+H2O5、加热碳酸氢钠:2NaHCO3Na2CO3+CO2↑+H2O。
