溶解度专题
溶解度计算专题练习001A及答案

溶解度计算专题练习001(A卷)(总分:100.0 考试时间:107分钟)学校________________________ 班级_______________ 准考证号________________ 姓名___________ 得分_____一、选择题一(只有一个正确答案):本大题共8小题,从第1小题到第8小题每题1.0分小计8.0分;共计8.0分。
1、影响硝酸钾溶解度大小的因素是[ ]A.溶质的质量B.溶剂的体积C.溶剂的温度D.溶液的压强2、当打开汽水瓶盖时,就有气体冒出,此时有关的下列说法中不正确的是[ ] A.溶液的溶质的量减少B.溶液的溶质的量不变C.溶解度减少D.饱和溶液变为不饱和溶液3、t3时,将A、B、C三种固体物质分别溶于100g水中,刚好都制成了饱和溶液(它们均不与水反应),它们的溶解度随温度而变化的曲线如图所示,以下说法正确的是[ ]A.t3时,A溶液的质量分数最小B.t2时,A、C两种溶液的质量分数相等C.t1时,三种溶液的质量分数相等D.C溶液的质量分数最小4、将某温度下接近饱和的溶液变为饱和溶液,下列的方法中正确的一组是[ ]①降低温度②长高温度③温度不变时加入晶体④温度不变时加适量的水⑤蒸发一定量水,再恢复到原温度A.①②③B.②④⑤C.①③⑤D.①③④5、实验室电解水时,常在水中加入少量硫酸以增强水的导电性.若用9%的硫酸50g通直流电进行电解水,过一段时间后,溶液中溶质硫酸的质量分数变为10%,则被电解的水的质量为[ ] A.10g B.7gC.5g D.3g6、下列叙述正确的是[ ] A.在饱和溶液中再加入任何物质都不可能溶解B.不改变溶剂的量,饱和溶液不可能变成不饱和溶液C.某种溶液可以是稀溶液,但同时又可以是饱和溶液D.浓溶液中溶解的溶质多,这时的溶液肯定是饱和溶液7、实验室里用已知溶质的质量分数的浓盐酸(密度已知),配制一定溶质的质量分数的稀盐酸。
初中化学溶解度简答题专题训练含答案

初中化学溶解度简答题专题训练含答案姓名:__________ 班级:__________考号:__________一、简答题(共15题)1、从微观角度说明为什么在溶液中进行的化学反应比较快?并举例说明这一道理在实验室或日常生活中的应用.2、试用三种不同的方法将不饱和石灰水变为饱和石灰水.3、厨房有两瓶白色固体分别为食盐和蔗糖,请你选择合适的方法加以区分.4、化学与生活密切相关.(1)夏天天气炎热时,鱼塘里的鱼为什么总是接近水面游动?(2)废弃塑料的急剧增加会带来“白色污染”,请你为解决“白色污染”问题提出一条合理化建议.(3)有些胃药中含有氢氧化镁,它起什么作用?5、汽水中溶有较多的二氧化碳,称为碳酸饮料.(1)打开汽水瓶盖时,汽水泡沫会自动喷出,请解释其中的原因.(2)喝了汽水后,常常会打嗝,请解释其中的原因.6、目前市场上销售的汽水饮料大多数是碳酸饮料,其中溶有二氧化碳气体.打开汽水瓶盖时,汽水会自动喷出来.原因是什么?喝了汽水后,常常会打嗝.原因是什么?7、 19.下表列出了硝酸钾在不同温度下的溶解度。
(1)从上表你可以得到什么信息(写一条即可)?(2)20℃时,欲使一定量的硝酸钾不饱和溶液变为饱和溶液,可采取哪两种措施?8、小华用热水配制了大半烧杯硝酸钾的饱和溶液,让一个较大的塑料块浮在液面上,然后小华让溶液冷却至室温(已知溶液的温度约为60℃,室温为20℃)。
请你说出小华会看到的两个现象,并用学过的理化知识解释。
9、家庭饲养金鱼,常常向鱼缸里通入空气,目的是____________________,天气闷热时,鱼塘里的鱼会接近水面游动的原因是______________________________。
10、汽水中溶有较多的二氧化碳,称为碳酸饮料.(1)打开汽水瓶盖时,汽水泡沫会自动喷出,请解释其中的原因.(2)喝了汽水后,常常会打嗝,请解释其中的原因.11、若将少量生石灰加入到某氢氧化钙的饱和溶液中,保持温度不变,所得溶液的质量和溶质的质量分数与原溶液相比会有变化吗?(有变化的需要指出是变大还是变小)12、把20℃的282g硝酸钾饱和溶液加热,升温到60℃,需要加入多少克硝酸钾才能使溶液重新达到饱和?(已知20℃时硝酸钾的溶解度为31.6g,60℃时为110g)。
溶解度48题专题练习
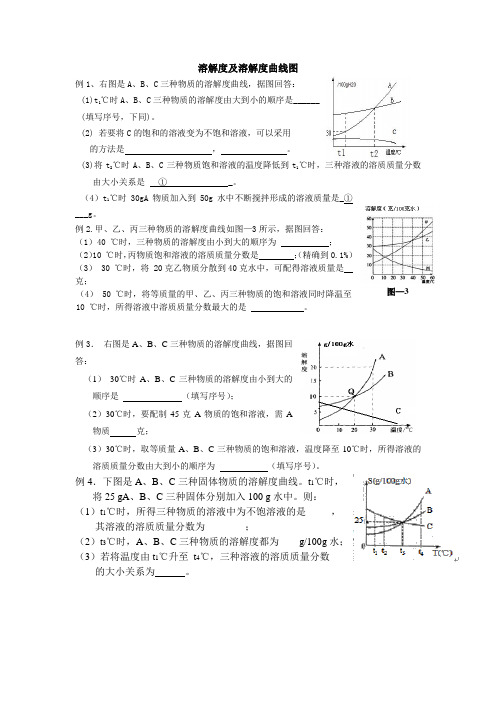
溶解度及溶解度曲线图例1、右图是A 、B 、C 三种物质的溶解度曲线,据图回答: (1)t 1℃时A 、B 、C 三种物质的溶解度由大到小的顺序是______ (填写序号,下同)。
(2) 若要将C 的饱和的溶液变为不饱和溶液,可以采用 的方法是 , 。
(3)将t 2℃时A 、B 、C 三种物质饱和溶液的温度降低到t 1℃时,三种溶液的溶质质量分数由大小关系是 ① _。
(4)t 1℃时30gA 物质加入到50g 水中不断搅拌形成的溶液质量是_①___g 。
例2.甲、乙、丙三种物质的溶解度曲线如图—3所示,据图回答: (1)40 ℃时,三种物质的溶解度由小到大的顺序为 ; (2)10 ℃时,丙物质饱和溶液的溶质质量分数是 ;(精确到0.1%) (3) 30 ℃时,将 20克乙物质分散到40克水中,可配得溶液质量是 克;(4) 50 ℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10 ℃时,所得溶液中溶质质量分数最大的是 。
例3. 右图是A 、B 、C 三种物质的溶解度曲线,据图回答:(1) 30℃时A 、B 、C 三种物质的溶解度由小到大的顺序是 (填写序号);(2)30℃时,要配制45克A 物质的饱和溶液,需A 物质 克;(3)30℃时,取等质量A 、B 、C 三种物质的饱和溶液,温度降至10℃时,所得溶液的溶质质量分数由大到小的顺序为 (填写序号)。
例4.下图是A 、B 、C 三种固体物质的溶解度曲线。
t 1℃时, 将25 gA 、B 、C 三种固体分别加入100 g 水中。
则: (1)t 1℃时,所得三种物质的溶液中为不饱溶液的是_____, 其溶液的溶质质量分数为________;(2)t 3℃时,A 、B 、C 三种物质的溶解度都为____g/100g 水; (3)若将温度由t 1℃升至 t 4℃,三种溶液的溶质质量分数的大小关系为 。
图—3溶解度及溶解度曲线图(专题一) 2011-4-281、右图是A 、B 、C 三种物质的溶解度曲线,据图回答: (1)t 1℃时A 、B 、C 三种物质的溶解度由大到小的顺序是______ (填写序号,下同)。
溶解度计算专题练习(含答案)

#溶解度计算专题练习3(含答案)基础练习1.食盐的溶解度是36g,这句话最主要的错误是未指明()A.100g水中B.是否达到饱和状态C.温度D.36g为最大量2.在一定温度时,某物质的饱和溶液中加入一些水后,溶质的溶解度()A.变小B.变大C.不变 D.不一定变<3.与固体溶解度无关的因素是()A.溶质和溶剂的量 B.溶液的温度C.溶质的性质 D.溶剂的性质4.当温度升高时,其溶解度降低的物质是()A.硝酸钾B.氯化钠 C.氢氧化钙 D.氧气5.溶解度曲线图可表示的意义是()①同一种物质在不同温度下的溶解度大小②不同种物质在同一温度时的不同溶解度数值<③物质溶解度受温度变化影响大小④比较某一温度下各种物质溶解度的大小A.全部B.①②C.①②③ D.①②④6.氯化钠溶解度曲线是()A.一条略为上升的曲线B.一条略为上升的直线C.一条陡峭上升的曲线D.一条略为下降的曲线7.在0℃,压强为101kPa时,1L水里最多能溶解5L气体A,则0℃时,A压强的溶解度为()A.5L B.5 C.500L D.<8.在20℃时,氧气的溶解度为,其含义是()A.20℃时,100g水中溶解氧气形成饱和溶液B.20℃时,1体积的水中最多溶解体积的氧气C.20℃时,压强为101kPa时,1体积水最多能溶解氧气D.20℃时,氧气压强为101kPa时,1体积水最多能溶解体积的氧气9.增大气体在水中的溶解度可采用的方法有:①增大压强;②减小压强;③升高温度;④降低温度,其中可行的是()A.①③B.②③C.①④ D.②④、10.已知硝酸钾的溶解度随着温度升高而增大,有下列方法:A.升高温度B.降低温度 C.加水 D.加硝酸钾(1)能使接近饱和的硝酸钾溶液变成饱和溶液的方法是________(填序号,下同);(2)能使饱和的硝酸钾溶液变成不饱和溶液的方法是________;(3)能增大硝酸钾溶解度的方法是________;(4)能减小硝酸钾溶解度的方法是________。
溶解度计算专题复习有答案

溶解度计算专题复习有答案溶解度计算题1. 已知一定温度下,饱和溶液中溶质的质量和溶剂的质量。
求该温度下的溶解度。
(1)把20℃时53.6克氯化钾饱和溶液蒸干,得到13.6克氯化钾。
求20℃时,氯化钾的溶解度? 溶解度为34克(2)20℃时,把4克氯化钠固体放入11克水中,恰好形成饱和溶液。
求20℃时,氯化钠的溶解度? 溶解度为36.4克2. 已知某温度时物质的溶解度,求此温度下饱和溶液中的溶质或溶剂的质量。
例如:把100克20℃时硝酸钾的饱和溶液蒸干,得到24克硝酸钾。
则:(1)若配制350克20℃的硝酸钾的饱和溶液,需硝酸钾和水各多少克?(2)若将78克硝酸钾配成20℃时的饱和溶液,需水多少克?x=84g y=266g z=247g【典型例题】[例1] 已知氯化铵在30℃时的溶解度为45.8克。
30℃时将68.7克氯化铵配制成400克的溶液,通过计算:(1)溶液是否饱和?(2)若不饱和,为了使其饱和,可用下面的方法:①蒸发溶剂法:需蒸发多少克水才能成为饱和溶液?②加溶质法:需再加入多少克氯化铵,溶液才能成为饱和溶液?(1)是不饱和溶液。
(2)①181.3g ②83.0g[例2] t℃时,硝酸钠的溶解度是25g,现向盛有200g 10%硝酸钠溶液的烧杯中,加入30g 硝酸钠固体,则此时烧杯中( D )A. 溶液质量是230gB. 溶质质量是50gC. 溶剂质量是170gD. 溶质质量是45g [例3] 将两杯20℃时的食盐饱和溶液,甲为500g,乙为1000g,在温度不变的情况下分别蒸发掉15g水,析出的食盐晶体的质量( A )A. 甲=乙B. 甲<乙C. 甲>乙D. 无法判断[例4] 现有500g20℃的A物质溶液,若保持温度不变,蒸发掉20g水后,有5gA 析出,若再蒸发掉20g水后,又有7gA 析出,则在20℃时A物质的溶解度是__35g_。
[例5] t℃,将一定量A(不含结晶水)的不饱和溶液分成三等份,分别加热蒸发水,然后冷却至t℃,已知三份溶液分别蒸发水10g、20g、30g,析出A依次为ag、bg、cg,则a、b、c三者之间的关系是( B )A. c=a+bB. c=2b-aC. c=2a+bD. c=2a-b[例6] 20℃时,将一定质量的硝酸铵完全溶解于100g水中,将所得溶液分成两等份,其中一份蒸发18.75g水,可使溶液饱和,另一份加入36g 硝酸铵也达饱和,求⑴20℃时,硝酸铵的溶解度。
2023年中考真题专题溶解度

中考真题专题汇编——溶解度1.(深圳)下图是甲、乙两种固体物质(不含结晶水)旳溶解度曲线。
下列说法对旳旳是(C)A、甲旳溶解度不小于乙旳溶解度B、a1℃时,甲、乙饱和溶液旳温度升温至a2℃时,均有固体析出C、a2℃时,M点对应旳甲溶液不饱和D、a2℃时,乙饱和溶液旳质量分数为20%2.(随州)如图,是甲、乙两种固体物质旳溶解度曲线,下列说法对旳旳是( D )A. 20℃时,甲、乙两种固体物质旳溶解度都是30B. 40℃时,甲旳饱和溶液中溶质质量分数为50%C. 40℃时,将50g乙物质所有溶于水中,恰好能得到150g乙旳饱和溶液D.将130g 20℃甲旳饱和溶液升温到40℃,最多还能溶解甲物质20g3.(孝感)甲、乙两种固体物质(均不含结晶水)旳溶解度曲线如右图所示。
下列说法对旳旳是(B)A. t1℃时,甲旳溶解度不小于乙旳溶解度B.t2℃时,乙旳饱和溶液升温或降温均会析出晶体C.乙溶液从t3℃降温到t1℃,乙溶液中旳溶质质量分数会发生变化D. t3℃时,50g水中加入40g旳甲物质充足溶解可得到90g甲旳饱和溶液4.(苏州)氯化钠和硝酸钾两种固体旳溶解度曲线如右图所示。
下列说法对旳旳是(C)A.硝酸钾旳溶解度不小于氯化钠旳溶解度B.常用冷却结晶旳措施从氯化钠溶液中获得其晶体C.40℃时,将35 g硝酸钾晶体放入50 g水中,充足搅拌后,所得溶液旳溶质质量分数为39.0%D.将20℃旳硝酸钾饱和溶液升温至60℃,溶液旳溶质质量分数增大(忽视水分蒸发)5.(宿迁)右图是甲、乙、丙三种固体物质(均不含结晶水)旳溶解度曲线,下列说法对旳旳是(C)A.t1℃时,甲与丙两种物质旳饱和溶液中溶质质量相似B. 乙中混有少许甲时,应采用降温结晶旳措施提纯乙C.甲属于易溶物质D.t2℃时,30g甲能溶解于50g水中形成80g溶液6.(临沂)甲、乙两种固体物质旳溶解度曲线如右图所示。
下列说法对旳旳是( D )A. 20℃时,甲溶液中溶质旳质量分数一定比乙溶液旳大B.将40℃时甲旳一定量饱和溶液降温至20℃,溶液质量不变C.甲旳溶解度不小于乙旳溶解度D. 40℃时,分别在100g水中各加入30g甲、乙,同步降温至20℃,甲、乙溶液均为饱和溶液7.(泰安)量旳硝酸钾和氣化钾分别加入到各盛有100g水旳两个烧杯中,充足搅拌后现象如图1所示,硝酸钾和氣化钾旳瑢解度曲线如图2所示。
初中化学溶解度计算题专题训练含答案

初中化学溶解度计算题专题训练含答案姓名:__________ 班级:__________考号:__________一、计算题(共10题)1、将 80g 质量分数为 20% 的氯化钠溶液稀释成质量分数为 10% 的氯化钠溶液,需加水的质量为 _______ 。
2、把20℃时53.6克氯化钾饱和溶液蒸干,得到13.6克氯化钾。
求20℃时,氯化钾的溶解度?3、20℃时,把4克氯化钠固体放入11克水中,恰好形成饱和溶液。
求20℃时,氯化钠的溶解度?4、已知硝酸钾在不同温度下的溶解度入下表:现有20℃时硝酸钾饱和溶液100g,若将其升温至60℃,还需加入多少克硝酸钾才能饱和?若降温至10℃,可得饱和溶液多少克?5、已知15℃时碘化钾的溶解度为140g,计算在该温度下250g水中最多能溶解多少克碘化钾?6、有60℃时A物质的溶液100g,若温度不变,蒸发掉10g水时,有4gA的晶体析出(不含结晶水),再蒸发掉10g水时,又有6gA的晶体析出,求60℃时A物质的溶解度是多少克。
7、已知30℃时硝酸钾的溶解度为45.8g。
在这温度时,某硝酸钾溶液500g中溶有硝酸钾137.4g。
如果蒸发掉90g水后,再冷却到30℃,可析出多少克硝酸钾?8、在20℃时某物质的不饱和溶液50g,平均分成两等份。
一份中加入0.7g该物质,另一份蒸发掉5g水,结果两份溶液都达饱和。
那么该物质在此温度下的溶解度为多少克?9、一定温度下质量分数为a%的硝酸钾溶液,将其分成两份,一份等温蒸发10g水,的溶解度为多少?得0.5g晶体;另一份等温蒸发12.5g水得1.5g晶体,该温度下KNO310、黄铜是铜和锌的合金。
向一定质量的黄铜样品中加入154.7g稀硫酸,恰好完全反应,产生0.2g氢气。
(1)求所用稀硫酸的溶质质量分数(2)除了可求出稀硫酸的溶质质量分数外,你还能求出的化学量有。
(填序号)①锌的质量②铜的质量分数③锌的质量分数④硫酸锌的质量⑤硫酸溶液的体积⑥反应后溶液溶质质量分数============参考答案============一、计算题1、解:需要加入水的质量为x80g×20%= ( 80g+ x )×10%x =80g答:需要加入水的质量为 80g 。
中考化学溶解度专题复习

1、下表是KNO 3、NaCl在不同温度下的溶解度(单位:g/100g水)温度0102030405060708090100(℃)KNO313.320.93245.86485.5110138169202246 NaCl35.735.83636.336.63737.337.838.43939.8①以上两种物质溶解度的变化受温度影响较大的是________。
②30℃时,KNO3的溶解度是___________。
③KNO3溶液中含有少量NaCl时,可通过____________的方法提纯。
④对③析出的晶体和剩余溶液描述正确的是________(填写编号)。
Ⅰ.剩余溶液一定是KNO3饱和溶液Ⅱ.剩余溶液一定是NaCl不饱和溶液Ⅲ.上述方法可以将两者完全分离Ⅳ.析出的晶体中只含有KNO3⑤在一定温度下,将含69gKNO3、18gNaCl的混合物完全溶解在50g水中。
改变温度使KNO3析出,NaCl不析出,则温度T(℃)的范围是_____________(硝酸钾和氯化钠溶解度互不影响)。
2、溶解度可表示物质溶解性的大小。
①右下图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。
Ⅰ.20℃时,甲的溶解度________(填“>”、“<”或“=”)乙的溶解度。
Ⅱ.40℃时,乙和丙________(填“能”或“不能”)形成溶质质量分数相同的饱和溶液。
Ⅲ.20℃时,烧杯中分别盛有相同质量甲、乙、丙的饱和溶液,各加入等质量的对应固体,并升温至50℃。
请填写下表。
烧杯中的溶质烧杯中固体的变化甲_____________________________乙固体逐渐减少至全部溶解丙_____________________________②气体的溶解度也有一定的变化规律。
Ⅰ.打开可乐瓶,逸出大量气泡。
由此可见,压强越小,CO2的溶解度越_________。
为增大CO2的溶解度,可采用的一种方法是________。
Ⅱ.不同温度下,氧气的溶解度随压强的变化如右图所示,图中t1对应的温度为40℃,则t2对应的温度________(填编号)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
对于曲线下部面积上的任何点,依其数据配制的溶 液为对应温度时的不饱和溶液;曲线上部面积上的 点,依其数据配制的溶液为对应温度时的饱和溶液, 且溶质有剩余。要使不饱和溶液(曲线下部的一点) 变成对应温度下的饱和溶液,有三种方法:
两条溶解度曲线的交点便是该店所示的温 度下两物质的溶解度相同,此时两种物质
饱和溶液的溶质质量分数也相同。
第一类:大部分固体物质的溶解度随温度的升高而升高,曲线 为“陡升型”,如硝酸铵。 第二类:少数固体物质的溶解度随温度的升高变化不明显,曲 线为“缓升型”,如氯化钠。
第三类:极少数固体物质的溶解度随温度的升高而降低,曲线
为“下降型”,如氢氧化钙
2018中考
溶 液
定义: 特征:均一、稳定 组成:溶质、溶剂 扩散过程:吸热 决定溶液的温 溶解过程: 度变化 水合过程:放热 乳化现象 饱和溶液 分类 不饱和溶液
溶 解 度 固体溶解度 定义 影响因素 溶解度曲线 定义 影响因素 解释与应用 定义 数学表达式 溶液的稀释问题
气体溶解度
溶质的质量分数
溶液的配制
实验用品:天平、烧杯、玻璃棒、药、量筒 实验步骤:计算、称量、溶解
溶解度曲线上的点有三个方面的作用: ①根据已知温度查出有关物质的溶解度。
10
②根据物质的溶解度查出对应的温度。 ③可比较相同温度下不同物质溶解度的大小或饱 和溶液中溶质质量分数的大小。
溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温 度的变化情况。曲线的坡度越大,说明溶解度受温度影响越 大;反之,说明受温度影响较小。溶解度曲线作用体现于如 下三个方面: ①根据溶解度曲线,可以看出物质的溶解度随着温度的变化 情况。 ②根据溶解度曲线,比较在一定温度范围内的物质的溶解度 大小。 ③根据溶解度曲线,选择分离某些可溶性混合物的方法
