专题练习溶解度Word版
溶解度练习 Microsoft Word 文档

1.(2014广东省)KCl 与KNO 3在不同温度的溶解度数据如右表。
则下列说法正确的是( ) A .KNO 3比KCl 的溶解度大B .两物质的溶解度相等的温度在20-30℃间C .在20℃时,10g 水中加入5gKCl 可得到33.3% 的KCl 溶液D .在50℃时,两物质各5g 分别加入l0g 水中, 充分溶解,均有固体剩余2. (2014安徽)甲、乙两种物质的溶解度曲线如图。
t 1℃时,在两支试管中分别加入等质量的两种物质,再分别加入等量的蒸馏水,充分振荡后,试管底部均有未溶解的固体。
再将两支试管升温到t 2℃(不考虑溶剂质量变化)。
由t 1℃到t 2℃的过程中,下列说法正确的是( )A .甲溶液中溶质的质量分数减小B .装有乙物质的试管中剩余的固体增多C .甲、乙两种物质的溶解度都增大D .两支试管里剩余的固体质量相同3.(2014玉林)右图是A 、B 、C 三种物质的溶解度曲线,下列说法错误的是( )A .t 1℃时,A 、B 、C 三种物质的溶解度由大到小的顺序是C >B >AB .当A 中含有少量B 时,可以通过冷却热饱和溶液的方法提纯AC .升高温度可使接近饱和的C 溶液变为饱和D .将t 2℃时A 、B 、C 的饱和溶液同时降温至t 1℃后,所得溶液中溶质的质量分数由大到小的顺序C >B >A 4.(2014北京)a 、b 两种物质的溶解度曲线如图所示.下列说法不正确的是( )20.(2014龙岩)右图为硫酸钠和氯化钠的溶解度曲线。
下列说法正确的是( )A .温度升高,两种物质的溶解度都增大B .50℃的Na 2SO 4饱和溶液降到40℃时有晶体析出C .40℃时,75g 饱和Na 2SO 4溶液中含25g Na 2SO 4D .可用降温结晶的方法提纯含少量Na 2SO 4的NaCl 21.(2014泉州)甲、乙两种固体物质的溶解度曲线如右图所示。
下列说法正确的是( ) A .甲的溶解度大于乙的溶解度B .降低温度可使甲的饱和溶液变为不饱和溶液C .t 1℃时,甲、乙两种饱和溶液的溶质质量分数相等D .t 2℃时,50g 乙加入100g 水中得到乙的不饱和溶液22、(2014毕节)如图所示,甲、乙是两种物质的溶解度曲线,下列叙述正确的是下是 ( )A.60℃时,在100g 水中加入100g 甲,充分溶解后溶液的质量是200gB.40℃时,甲、乙两种物质的溶解度相等C.20℃时甲的溶解度大于乙的溶解度D.采用降温的方法可将乙的不饱和溶液转化为饱和溶液 23.(2014厦门)如图是三种固体物质的溶解度曲线,下列说法正确的是( )A . 物质c 的溶解度随温度的升高而增大B .物质a 的溶解度大于物质c 的溶解度A . 15℃时,a 、b 的溶解度均为20gB .加水或升温均可使b 的饱和溶液变为不饱和溶液 C .将 30℃时a 的饱和溶液降温至15℃,溶质的质量分数不变 D . 分别向100g 水中加入20ga 和 b ,升温至30℃,所得溶液均 为饱和溶液C . t 2℃时,60g 物质a 与100g 水充分混合后所得溶液的总质量为160g D . 将t 1℃b ,c 两种物质的饱和溶液升温至t 2℃,溶液中溶质质量分数不变的是b 溶液24.(2014武威)如图为甲、乙两种固体物质在水中的溶解度曲线.下列说法错误的是( )线.下列说法中不正确的是( )A . t 1℃时,甲和乙的溶解度相等B .t 1℃时,30g 乙加到100g 水中形成饱和溶液 C . t 2℃时,各100g 饱和溶液降温至t 1℃析出固体甲多于乙D . t 2℃时,75g 甲的饱和溶液中加100g 水得到20%的溶液26. (2014哈尔滨)右图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法错误的是( )A. 20℃时,100g 甲溶液中含甲物质的质量小于25gB. 20℃时,等质量甲、乙饱和溶液中含溶质的质量相等C. 30℃时,甲物质的溶解度大于乙物质的溶解度D. 50℃时,将甲、乙两种物质的饱和溶液分别降温至20℃析出晶体的质量甲大于乙27.(2014大庆)图中a 、b 、c 分别表示KNO3、NaCl 、Ca (OH )2溶解度曲线,下列说法错误的是( )A . T 1时,KNO 3和NaCl 的饱和溶液溶质的质量分数相等B .T 2时,A 点表示KNO 3的不饱和溶液,降温至T 1时有晶体析出,且变为T 1时KNO 3的饱和溶液C .T 1时,将Ca (OH )2饱和溶液升温至T 2变为不饱和溶液D . 温度高于T 1时,KNO 3溶解度大于NaCl 溶解度,温度低于T 1时,KNO 3溶解度小于NaCl 溶解度2 到100g 甲溶液 B .t 2℃时配制等质量的三种物质的饱和溶液,甲所需 要的水最少 C .分别将t 2℃时三种物质的饱和溶液降温至t 1℃, 所得溶液中溶质的质量分数的大小关系为乙>甲=丙 D .分别将t 2℃时三种物质的饱和溶液降温到t 1℃, 甲溶液中析出的晶体最多,丙溶液中无晶体析出 29.(2014黄冈)下图是a 、b 、c 三种物质的溶解度曲线,下列分析不正确的是( ) A .t 2 ℃时a 、b 、c 三种物质的溶解度由大到小的顺序是a>b>c B .t 2 ℃时,将50g a 物质放入100g 水中充分溶解得到a 的饱和溶液 (a 物质不含结晶水) C .将t 2 ℃时a 、b 、c 三种物质的饱和溶液降温至t 1 ℃时,所得溶 液的溶质质量分数关系是b > a=cD .将c 的饱和溶液变为不饱和溶液,可采用降温的方法30.(2014咸宁)右图是甲、乙两种固体物质的溶解度曲线,下列说法中正确的是( ) A .将等质量的甲、乙的饱和溶液分别由t 2℃降温至t 1℃,析出甲多 B .t 2℃时,甲、乙两溶液中溶质的质量分数相等 C .将甲溶液从t 2℃降温到t 1℃时,一定有晶体析出 D .将t 2℃时乙的饱和溶液变为不饱和溶液,可采取降温的方法1 231.(2014孝感)右图是A 、B 、C 三种固体物质的溶解度曲线。
【化学】 溶液 溶解度练习题(含答案)(word)

【化学】溶液溶解度练习题(含答案)(word)一、溶液选择题1.甲、乙两种物质的溶解度曲线如图所示。
下列说法正确的是()A.a1℃时甲和乙的饱和溶液,升温到a2℃时仍是饱和溶液B.甲和乙的溶解度相等C.a2℃时,在 100 g 水中加入 60 g 甲,形成 160 g 溶液D.a1℃时,甲和乙各 30 g 分别加入 100 g 水中,均形成饱和溶液【答案】D【解析】A、由图象可知,甲、乙的溶解度随着温度的升高而增大,因此a1℃时甲和乙的饱和溶液,升温到a2℃时变为不饱和溶液,错误;B、物质的溶解度与温度有关,a1℃时,甲和乙的溶解度相等,不是a1℃时,甲和乙的溶解度不等,错误;C、a2℃时,甲的溶解度为50g,在100g水中加入60g甲,形成饱和溶液,并有10g甲溶解不了,错误;D、a1℃时,甲和乙的溶解度均为30g,所以甲和乙各30g分别加入100g水中,均形成饱和溶液,正确。
故选D。
2.下表是KCl与KNO3在不同温度的溶解度。
下列说法不正确...的是()温20304050度/℃KCl34.0g37.0g40.0g42.6gKNO331.6g45.8g63.9g85.5gA.20℃时,KC1的溶解度大于KNO3的溶解度B.两物质溶解度相等的温度在20~30℃之间C.40℃时,5gKCl中加10g水可得33.3%溶液D.50℃时,10g KNO3中加20g水,充分溶解后再降温到30℃,有KNO3固体析出【答案】C【解析】试题分析:由两种物质的溶解度可知20℃时,KNO3溶解度小于KC1的溶解度,A正确;由表格数据可知温度在20~30℃时,两物质的溶解度有相同的部分,即两物质溶解度相等的温度在20~30℃之间,B正确;40℃时,KCl的溶解度为40g,即该温度下40g氯化钾溶解在100g水中恰好形成饱和溶液,那么10g水中最多溶解4g氯化钾,形成的溶液的溶质质量分数=4g/14g ×100%=28.6%,C错误;30℃时硝酸钾的溶解度为45.8g,即该温度下45.8g硝酸钾溶解在100g水中恰好形成饱和溶液,那么20g水中最多溶解硝酸钾9.16g,即50℃时,10g KNO3中加20g水,充分溶解,再降温到30℃,有KNO3固体析出,D正确。
溶液 溶解度专项练习经典(word)
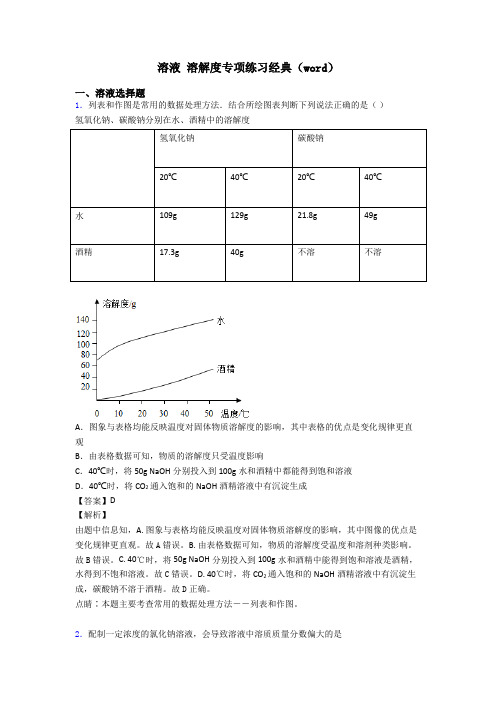
溶液溶解度专项练习经典(word)一、溶液选择题1.列表和作图是常用的数据处理方法.结合所绘图表判断下列说法正确的是()氢氧化钠、碳酸钠分别在水、酒精中的溶解度氢氧化钠碳酸钠20℃40℃20℃40℃水109g129g21.8g49g酒精17.3g40g不溶不溶A.图象与表格均能反映温度对固体物质溶解度的影响,其中表格的优点是变化规律更直观B.由表格数据可知,物质的溶解度只受温度影响C.40℃时,将50g NaOH分别投入到100g水和酒精中都能得到饱和溶液D.40℃时,将CO2通入饱和的NaOH酒精溶液中有沉淀生成【答案】D【解析】由题中信息知,A. 图象与表格均能反映温度对固体物质溶解度的影响,其中图像的优点是变化规律更直观。
故A错误。
B. 由表格数据可知,物质的溶解度受温度和溶剂种类影响。
故B错误。
C. 40℃时,将50g NaOH分别投入到100g水和酒精中能得到饱和溶液是酒精,水得到不饱和溶液。
故C错误。
D. 40℃时,将CO2通入饱和的NaOH酒精溶液中有沉淀生成,碳酸钠不溶于酒精。
故D正确。
点睛∶本题主要考查常用的数据处理方法--列表和作图。
2.配制一定浓度的氯化钠溶液,会导致溶液中溶质质量分数偏大的是A.用量筒量取水时仰视读数B.配制溶液的烧杯用少量蒸馏水润洗C.用托盘天平称量氯化钠时,放砝码的托盘上忘了放纸D.将水倒入烧杯时,有少量水溅出【答案】D【解析】A. 用量筒量取水时仰视读数,量取实际水的体积偏大,故溶液中溶质的质量分数偏小,错误;B. 配制溶液的烧杯用少量蒸馏水润洗相当于溶剂水的体积偏大,故溶液中溶质的质量分数偏小,错误;C. 用托盘天平称量氯化钠时,放砝码的托盘上忘了放纸相当于称量氯化钠的质量偏小,故配得的溶液中溶质的质量分数偏小,错误;D. 将水倒入烧杯时,有少量水溅出,相当于溶液中水的体积偏小,故溶液中溶质的质量分数偏大,正确。
故选D。
3.右图是a、b、c 三种物质的溶解度曲线,下列分析不正确的是A.t2℃时,a、b、c三种物质的溶解度由大到小的顺序是a>b>cB.t2℃时,将50ga物质放入100g水中充分溶解恰好得到a的饱和溶液(a物质不含结晶水) C.将t2℃时a、b、c三种物质的饱和溶液降温至t1℃时,所得溶液的溶质质量分数关系b >c=aD.将c的饱和溶液变为不饱和溶液,可采用降温的方法【答案】C【解析】【详解】A.通过分析溶解度曲线可知,t2℃时,a、b、c三种物质溶解度由大到小的顺序是a>b>c,故A正确;B.t2℃时,a物质的溶解度是50g,所以将50g a物质(不含结晶水)放入100g水中充分溶解得到150ga的饱和溶液,故B正确;C.t1℃时,b物质的溶解度最大,a物质次之,降低温度,a、b物质会析出晶体,c物质降低温度不会析出晶体,应该按照50℃时的溶解度进行计算,所以将50℃时a、b、c三种物质的饱和溶液降温至20℃时,这三种溶液的溶质质量分数的大小关系是b>a>c,故C错误;D.c物质的溶解度随温度的升高而减小,所以将c的饱和溶液变为不饱和溶液,可采用降低温度的方法,故D正确;故选C。
(完整版)溶解度习题(含答案)(可编辑修改word版)

溶解度计算题1.要使溶解度增大采用的方法是()A.增加水B.增加C.不断搅拌D.升高温度2.下列物质中,随着温度的升高,在水中的溶解度减小的是()A.熟石灰B.食盐C.硝酸钾D.氮气3.在30℃时,50g水中最多溶解A物质5g,在60℃时50g水最多能溶解B物质10g则()A.A的溶解度比B大B.B的溶解度比A大C.二者的溶解度相等D.无法比较4.在20℃时,30g水最多溶解1.3g的某物质,则该物质为()A.难溶物质B.可溶物质C.微溶物质D.易溶物质5.20℃时,甲、乙两烧杯内依次放入饱和的溶液100g、200g,若各蒸发5g水,再恢复到20℃后,两杯中析出晶体质量为()A.甲>乙B.甲<乙C.甲=乙D.不一定6.不能影响物质溶解度大小的因素是()A.温度高低B.溶质、溶剂的量C.溶剂种类D.溶质种类7.将80℃的饱和溶液冷却至20℃,有晶体析出,此刻得到的溶液为20℃时的()A.饱和溶液B.不饱和溶液C.稀溶液D.浓溶液8.计算物质的溶解度时,该溶液一定是()A.浓溶液B.稀溶液C.饱和溶液D.不饱和溶液9.已知在60℃时,溶液加热蒸发水分后,得到晶体,则下列说法正确的是()A.原溶液一定是饱和溶液B.60℃时的溶解度为50gC.60℃时的溶解度为100g D.无法计算它的溶解度10.有t℃时浓度相同的两份溶液A和B,A为100g,B为80g,将其恒温蒸发20g水后,A刚好饱和,则关于B 溶液正确的说法是()A.也刚好是饱和溶液B.仍是不饱和溶液C.是饱和溶液,并有晶体析出D.有晶体析出剩余不饱和溶液11.要增大在水中的溶解度,可采用的方法是()A.加压降温B.加压升温C.减压降温D.减压升温12.下列说法正确的是()A.一定温度和压强下,一定量的饱和溶液所含该溶质的量一定是该条件下的最大值B.所有物质的溶解度都随温度的升高而增大C.在温度一定时,同一物质的饱和溶液一定比不饱和溶液的浓度大D.对于任何固体物质来说,用加热的方法都可以得到它的浓溶液13.已知下列物质在20℃时的溶解度,其中属于可溶物质的是()A.为0.0013g B.食盐为36g C.熟石灰为0.17g D.为7.4g14.t℃时,某物质的溶液220g,蒸发去15g水后,析出晶体6g,又蒸发去10g水,析出6g晶体,再蒸去10g水又析出晶体的质量为()A.4g B.6g C.10g D.15g答案:1.D 2.A、D 3.D 4.B 5.C 6.B 7.A 8.C 9.D 10.C 11.A 12.A、C 13.D 14.B例析溶解度曲线试题[例1](江苏赛题)a、b、c 三种物质的溶解度曲线如右图所示。
人教版九年级化学下册 溶解度曲线 专题训练(word版,含答案)

溶解度曲线专题训练1.如图是甲乙两种物质的溶解度曲线。
下列说法正确的是A.甲的溶解度比乙的溶解度大B.a2℃时,将30g甲放入50g水中充分搅拌可得80g溶液C.a1℃时甲、乙两种物质的饱和溶液溶质的质量分数相同D.将a1℃时甲、乙两种物质的饱和溶液升温至a2℃,溶质的质量分数都增大2.如图是a、b、c三种固体物质的溶解度曲线图,请判断下列说法,其中正确的是()A.使a、c的饱和溶液析出晶体的方法都可以是降温结晶B.t1℃时,a、c两种物质的溶液的溶质质量分数一定相等C.在t2℃时,将a物质30g加入50g水中,充分溶解,所得溶液质量为80gD.t2℃时,a、b、c三种物质的饱和溶液的溶质质量分数由大到小的关系是:a>b>c3.如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是A.甲物质的溶解度随温度的升高而增大B.t2℃时,甲、乙两种物质的溶解度相等C.t1℃时,丙的饱和溶液中溶质的质量分数为40%D.当甲中混有少量丙时,可采用降温结晶的方法提纯4.如图是a、b、c三种固体物质(不含结晶水)的溶解度曲线,下列说法正确的是()A.a的溶解度大于b的溶解度B.P点表示t1℃时a、c两物质溶解度相等C.将t1℃饱和的c溶液升温到t2℃,得到的是不饱和溶液D.将t2℃,a、b、c三种物质的饱和溶液降温到t1℃时,所得溶液中溶质质最分数由大到小的顺序为:b>a=c5.甲、乙两种固体的溶解度曲线如右图所示,下列说法正确的是A.甲的溶解度大于乙的溶解度B. t1°C时,甲乙饱和溶液中溶质的质量分数相等C. t2°C时,60g 甲的饱和溶液稀释到20%需加水10gD.将t1°C时相等质量的甲、乙的饱和溶液升温到t2°C,溶液中溶质的质量甲大于乙6.A、B、C三种固体物质的溶解度曲线如图所示,下列说法正确的是()A.阴影区域中,A、C均处于不饱和状态B.除去B固体中含有的少量A杂质,可采用配成热饱和溶液,降温结晶、过滤、洗涤、干燥的方法提纯BC.将A和B的饱和溶液从t2℃降到t1℃时,析出晶体的质量关系为A>BD.t1℃时,将50g固体A加入到200g水中,所得溶液溶质的质量分数约为16.7%7.甲、乙两种物质溶解度曲线如图所示。
(完整word版)溶解度专项练习题

溶解度练习题A. 20g B . 33.3g C. 40g D . 66.7g7.在4C 时,将100mL 密度为1.84g/cm 3,溶质的质量分数为98%的浓硫酸与100mL 的水均匀混合,待温度恢复到 4C 时,下列关于混合后的溶液叙述正确的是( )A .密度为1.42g/cm 3 B.溶质质量分数为 63.5% C .体积为200mL D.溶液的质量为 280g8. 根据实验操作所绘制的图像中,正确的是()气体质量/g 加入固体质量/g 加入金属质量/g 加入硫酸铜溶液质量/g①② ③④A .图①是高温煅烧石灰石, 固体剩余物的质量与产生气体的质量天糸B. 图②是向一定质量的水中不断加入蔗糖,加入固体质量与形成溶液质量的关系C.图③是向等质量、等质量分数的稀硫酸中分别加入过量的金属镁与铝,加入金属质量与产生氢气质量的关系D. 图④是向一定质量铁粉中加入硫酸铜溶液,加入硫酸铜溶液与形成溶液总质量的 9 •下列图像与实验相符合的是()1 .下列说法正确的是()A •凡是均一的、稳定的液体都是溶液 C .可用水区分NaOH 固体和2 .下列关于溶液的说法正确的是( A •一种溶液中只能有一种溶质 C .溶液的各部分性质均相同3 .下列关于溶液的说法正确的是(NH 4NO 3固体) B •溶液都是无色透明的 D •面粉溶于水形成溶液B .澄清透明的液体就是溶液 D .溶液都具有导电性A .饱和溶液析出晶体后就变成不饱和溶液 C .溶液上层的密度小,下层的密度大4 .将下列固体分别溶解于水中,温度明显降低的是( A .硝酸铵 5.已知在20C 时, 量为( )B .氢氧化钠 氯化钠的溶解度为 C.蔗糖 B .溶液中的溶质可以是一种或多种 D .溶液一定是无色透明的 )D .氯化钠36g 。
在此温度下, 20g 水中最多能溶解氯化钠的质D . 10g20 C 时有2g 晶体析出,此时溶液 的溶质质量分数为 40%,则该物质在20C 是的溶解度是(B . 3.6g A . 36g 6 .把一定质量的30%的某溶液加热蒸发 C. 7.2g10g 水,冷却至反战时问團①EiJ'V.H'i 冋闺③A .图①表示镁带在空气中燃烧B. 图②表示将饱和 Ca (OH 》溶液升温C. 图③表示等质量的稀硫酸中加入足量的镁粉和锌粉D. 图④表示向含少量 Cu 粉的铁粉中滴加稀盐酸至过量A. 向氯化钠的饱和溶液中加入氯化钾B. 向灼热的赤铁矿中通入 COC. 向等质量的Al 和Mg 中加入足量的等质量等溶质质量分数的稀盐酸D. 将饱和的氯化钠溶液恒温蒸发水11.右图为A 、B 、C 三种固体物质(不含结晶水)的溶解度曲线。
人教版化学九年级下册同步提优练习:第九单元 课题2 溶解度(word版有答案)

课题2溶解度第1课时饱和溶液判断正误:(在括号内打“√”或“×”)(1)饱和溶液就是不能再溶解任何物质的溶液()(2)析出晶体后的溶液是该晶体在该温度下的饱和溶液()(3)同种溶质的饱和溶液,一定比它的不饱和溶液的浓度大()(4)升温能使接近饱和的KNO3溶液变成饱和溶液()(5)在一定温度下,使固体物质的饱和溶液变为不饱和溶液最可靠的方法是加入溶质或蒸发溶剂()(6)通常采取降温结晶的方法得到食盐()[核心知识]1.饱和溶液三要素:一定温度、一定量溶剂、不能再继续溶解该溶质。
2.一般情况下饱和溶液与不饱和溶液的转化关系:不饱和溶液饱和溶液注意:Ca(OH)2在上述过程中温度的改变方向相反。
3.结晶方法:(1)蒸发结晶(蒸发溶剂);(2)降温结晶(冷却热饱和溶液)。
[易错点拨]溶液中如果没有溶质固体存在,溶液可能饱和,也可能不饱和。
1.下列关于溶液的说法正确的是 ()A.将饱和溶液升温后一定变为不饱和溶液B.溶液一定是混合物C.稀溶液一定是不饱和溶液D.饱和溶液所含溶质一定比不饱和溶液多2.如,将红砂糖倒入一杯开水中,充分溶解。
能作为判断砂糖水是饱和溶液的依据是()A.砂糖水颜色很深B.砂糖水味道很甜C.砂糖溶解得很快D.砂糖固体有剩余3.能将不饱和KCl溶液变为饱和KCl溶液的方法是()A.升高温度B.加水C.加KCl固体D.倒出部分溶液4.下列关于海水晒盐原理的分析正确的是 ()A.利用阳光照射,使海水升温可得到食盐B.利用海风降温可析出食盐晶体C.利用海水在阳光下发生分解反应可制得食盐D.利用阳光和风力使水分蒸发可得到食盐5.室温下,将盛有接近饱和的硝酸钾溶液的小烧杯放在盛水的大烧杯中(如所示),欲使硝酸钾溶液变为饱和溶液,可向大烧杯中加入的固体物质是()A.生石灰B.氯化钠C.硝酸铵D.氢氧化钠6.将50 ℃的硝酸钠饱和溶液降温到20 ℃,有晶体析出(晶体中不含水)。
下列有关量中没有发生改变的是()A.溶液的质量B.溶液中溶质的质量C.溶液中溶剂的质量D.溶液中溶质的质量与溶液的质量比7.在萝卜上挖一个孔,向其中注入饱和食盐水,一段时间后将食盐水倒出,向倒出的食盐水中加足量食盐使之饱和(设温度不变),则食盐水的质量 ()A.增加B.减小C.不变D.无法判断8.某次蔗糖溶解实验过程如所示,不考虑水分蒸发,下列判断错误的是()A.②中溶液是饱和溶液B.③中溶液一定是不饱和溶液C.若要判断③中溶液是否饱和,可在烧杯中加入少量蔗糖D.③中溶液的溶质质量大于②中溶液的溶质质量9.20 ℃时,四个实验小组分别取不同质量的NaCl,逐渐加入各盛有50 g水的烧杯中,不断搅拌直到不再溶解,然后分别称量剩余NaCl的质量。
【化学】 【初中化学】 溶液 溶解度练习题 人教版(word)
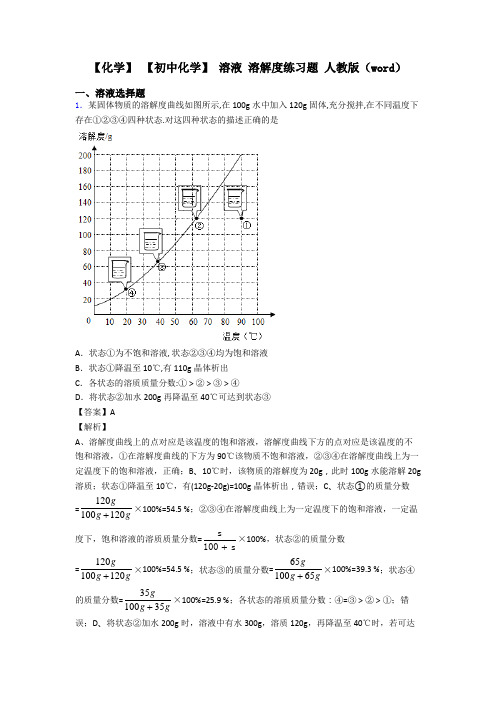
【化学】【初中化学】溶液溶解度练习题人教版(word)一、溶液选择题1.某固体物质的溶解度曲线如图所示,在100g水中加入120g固体,充分搅拌,在不同温度下存在①②③④四种状态.对这四种状态的描述正确的是A.状态①为不饱和溶液, 状态②③④均为饱和溶液B.状态①降温至10℃,有110g晶体析出C.各状态的溶质质量分数:①>②>③>④D.将状态②加水200g再降温至40℃可达到状态③【答案】A【解析】A、溶解度曲线上的点对应是该温度的饱和溶液,溶解度曲线下方的点对应是该温度的不饱和溶液,①在溶解度曲线的下方为90℃该物质不饱和溶液,②③④在溶解度曲线上为一定温度下的饱和溶液,正确;B、10℃时,该物质的溶解度为20g,此时100g水能溶解20g 溶质;状态①降温至10℃,有(120g-20g)=100g晶体析出,错误;C、状态①的质量分数=120100120gg g+×100%=54.5 %;②③④在溶解度曲线上为一定温度下的饱和溶液,一定温度下,饱和溶液的溶质质量分数=s100s+×100%,状态②的质量分数=120100120gg g+×100%=54.5 %;状态③的质量分数=6510065gg g+×100%=39.3 %;状态④的质量分数=3510035gg g+×100%=25.9 %;各状态的溶质质量分数:④=③>②>①;错误;D、将状态②加水200g时,溶液中有水300g,溶质120g,再降温至40℃时,若可达到状态③,则40℃时该物质的溶解度为40g,根据溶解度曲线可知40℃时,该物质的溶解度大于60g,错误。
故选A。
点睛:一定温度下,饱和溶液的溶质质量分数=s100s+×100%。
2.如图是甲、乙、丙三种物质的溶解度曲线,下列说法正确的是( )A.t1℃时,30g甲物质溶于70g水中得到30%的甲溶液B.将t3℃时甲、乙、丙三种物质的饱和溶液降温到t1℃,所得溶液溶质的质量分数关系是乙>甲>丙C.t2℃时,甲、丙溶液中溶质的质量分数甲>丙D.t3℃时将甲、乙两物质的饱和溶液降温到t2℃,析出晶体质量甲>乙【答案】B【解析】【分析】【详解】A、t1℃时,甲物质的溶解度是30g,根据溶解度概念可知,30g甲物质溶于70g水中,达到饱和状态,饱和溶液的质量分数=30g100%23.1%30g+100g⨯=,不能得到30%的甲溶液,故A错误;B、将t3℃时A、B、C三种物质的饱和溶液降温到t1℃时,甲、乙的溶解度减小,丙的溶解度随温度的降低而增大,甲、乙有晶体析出,质量分数变小,溶液仍为饱和溶液,丙没有晶体析出,质量分数不变,一定温度下饱和溶液的溶质分数=s100%100g+s⨯,溶解度越大,质量分数越大,t1℃时乙的溶解度大于甲的溶解度大于t3℃时丙的溶解度,所以t1℃时三种物质的溶质质量分数由大到小的顺序是乙>甲>丙,故B正确;C、t2℃时,甲、丙溶液的状态没有确定,溶液中溶质的质量分数也不能确定,故C错误;D、t3℃时,将甲、乙两物质的饱和溶液降温到t2℃,饱和溶液的质量没有确定,析出晶体质量也不能确定,故D错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶解度\克t /℃ ·P 00171.20℃时澄清的饱和石灰水,发生如下不同变化,其中不会出现白色浑浊的是A 降低温度B 升高温度C 温度不变,蒸发溶剂D 通入CO 22.要使wg 10%的NaCl 溶液的溶质的质量分数增至20%,可采用的方法是A 再加入w 10g 固体NaClB 蒸发浓缩成w 2g NaCl 溶液 C 蒸发掉一半溶剂 D 再加入2wg 25%的NaCl 溶液3.右图是某固态物质的溶解度曲线,试判断该溶液在A 、B 、C 、D 四种状态时,属于不饱和溶液的是A AB BC CD D4.在下列四图中纵、横轴的单位分别相同时,有关氯化钠溶解度曲线(a )和氢氧化钙溶解度曲线(b )的关系示意图基本合理的是A B C D5.A 、B 两种物质的饱和溶液的百分比浓度随温度变化的曲线如右图:现分别在50g A 和80g B 中各加水150g ,加热溶解后并都蒸发水50g ,冷却到t 1℃,下列叙述正确的是A t 1℃时溶液中A 、B 的质量百分比浓度相等B t 1℃时溶液中A 的浓度小于B 的浓度C t 1℃时两者均无固体析出D t 1℃时析出固体B6.分别取等质量80℃的甲、乙两种化合物的饱和溶液,降温至20℃后,所析出的甲的质量比乙的大(甲和乙均无结晶水)。
下列关于甲、乙的溶解度的叙述中肯定正确的是A 20℃时,乙的溶解度比甲的大B 80℃时,甲的溶解度比乙的大C 温度对乙的溶解度影响较大D 温度对甲的溶解度影响较大 7.右图是物质M 的溶解度曲线图,则P 点表示A 饱和溶液B 不饱和溶液C M 未完全溶解D 无法配制8.向某一饱和硫酸铜溶液中,加入含18O 的带标记的无水硫酸铜粉末ag ,如果保持温度不变,其结果是A 无水硫酸铜不再溶解,ag 粉末不变B 溶液中可找到带标记的SO 42-,而且白色粉末变为蓝色晶体,其质量大于agC 溶液中可找到带标记的SO 42-,而且白色粉末变为蓝色晶体,其质量小于agD 溶液中找不到带标记的SO 42-,但白色粉末逐渐变为蓝色晶体,其质量大于ag9.向一定量的饱和NaOH 溶液中加入少量Na 2O 固体,恢复到原来温度时,下列说法中正确的是A 溶液中的Na +总数不变B 单位体积内的OH -数目不变C 溶质的质量分数不变D 溶液的质量不变10.将40℃的饱和石灰水冷却至10℃或温度仍为40℃而加入少量CaO ,这两种情况下都不改变的是A Ca(OH)2的溶解度B 溶液的质量分数(百分比浓度)C 溶液的质量D 溶液中Ca 2+的数目11.将5g 纯净物A 投入95g 水中,使之完全溶解,所得溶液的质量分数为A 一定等于5%B 一定大于5%C 一定小于5%D 可能等于也可能大于或小于5%12.向100g 饱和硫酸铜溶液中加入1.6g 白色硫酸铜粉末,此时析出的晶体质量是A 2.5gB 1.6gC 大于2.5gD 1.6~2.5g13.有一杯t ℃时的硝酸铵溶液,在该溶液中加入x g 硝酸铵晶体,充分搅拌后有y g 未溶;若将原溶液加热蒸发掉2g 水再冷却至原温度,溶液恰好达到饱和,则t ℃时硝酸铵的溶解度 A 1002x g B x y -+2200g C 1002()x y -g D ()x y -200g 14.有ag KCl 不饱和溶液,其质量分数为c %,采取措施后使其变为饱和溶液bg ,溶质质量分数为d %,下列说法正确的是A a <bB ac %一定等于bd %C 原条件下溶解度大于cD c %一定小于d %15. 在一定温度下,某无水盐R 在水中溶解度为23g ,向R 的饱和溶液中加入Bg 该无水盐,保持温度不变,析出R 的结晶水合物Wg ,从原饱和溶液中析出溶质R 的质量为A 23(W -B)/123gB 23(W -B)/77gC 23(W -B)/100gD (W -77B/23)/g16.在烧杯中盛有10%的CaCl 2溶液,然后向烧杯中逐滴加入10%的Na 2CO 3溶液至不再生成沉淀为止,过滤得到CaCO 3沉淀10g ,再将滤液蒸发掉90g 水后,所剩溶液的质量分数是多少?A 11.7%B 10%C 9.2%D 5.85%17.在25℃时,将某浓度的芒硝溶液分为等质量的两份溶液,一份加热蒸发掉20g 水后降至25℃成为饱和溶液,另一份加入10g 芒硝晶体后也成为饱和溶液。
则25℃时芒硝的溶解度是A 20gB 17.23gC 30gD 22.05g18.t ℃时,CuSO 4在水中溶解度为25g ,将32g CuSO 4白色粉末加入到mg 水中,形成饱和CuSO 4溶液,并有CuSO 4·5H 2O 晶体析出,则m 的取值范围是A 18g ≤m ≤128gB 36g <m <180gC 18g <m <128gD 36g ≤m ≤180g19.t ℃时,某硫酸铜溶液中加入14.2g 无水硫酸铜粉末或投入25g CuSO 4·5H 2O 晶体,均完全溶解得某炮和溶液,则t ℃时CuSO 4的溶解度为A 20gB 43.2gC 120gD 158g20.某温度下,在100g 水中加入mg CuSO 4或加入ng CuSO 4·5H 2O ,均可使溶液恰好达到饱和,则m 与n 的关系符合A m =n 250160B m =n n 925001600+C m =n n 1625001600+D m =nn 2525001600+ 21.在t ℃时,取可溶物A 其浓度为a%的溶液100g ,蒸发掉p g 水,冷却到t ℃,析出A 的不含结晶水的晶体g g ,则在t ℃时,A 的溶解度为A )100()(100p a g a ---gB )(100)100(g a g a ---gC )100(100a a -gD )()(100p a g a --g 22. T ℃时,在含有m g Na 2CO 3的100g 饱和溶液中,通入足量的CO 2后有Xg 气体参加了反应,同时有n g NaHCO 3晶体析出。
下列表达式中不能用来表达NaHCO 3在T ℃时的溶解度(g )的是A 16844100100X n m--⨯ B 1681061001844100m n m X ---⨯ C m n m m 10616810010618100⨯---⨯⨯ D 1684410018106100X n m m ---⨯00181.某温度下,氯化镁饱和溶液浓度为40%,在足量的此溶液中加入4.6g 无水氯化镁,最终析出结晶水合物40.6g,则该结晶水合物的化学式是A MgCl2·7H2OB MgCl2·2H2OC MgCl2·6H2OD MgCl2·5H2O2.某温度时,硫酸镁饱和溶液中溶剂和溶质的质量比为3︰1,在温度不变的条件下,若使在此饱和溶液中析出2.46g七水硫酸镁,需向溶液中加入无水硫酸镁A 1.26gB 1.20gC 0.78gD 0.42g3.在一定温度下,将一包白色的无水硫酸铜粉未投入150g蒸馏水中充分搅拌并过滤,得到一定质量的蓝色晶体和84g滤液,若此温度下无水硫酸铜的溶解度为40g,则这包无水硫酸铜的质量是A 66gB 184gC 160gD 90g4.电解水时,常在水中加入少量硫酸以增加水的导电性,若用8%硫酸25g,通入直流电进行电解水的实验,过一段时间后,硫酸的质量分数为10%,则电解水的质量为A 2.5gB 5gC 8gD 10g5.已知某盐的溶解度曲线如图:现将一定量的该盐溶液由50℃逐渐冷却,当温度降至30~20℃时,才发现有一定量的晶体析出。
则原盐液的质量百分比浓度可能的是A 15%B 20%C 18%D 22%6.已知某盐的溶解度曲线如图:现将一定量的该盐溶液由50℃逐渐冷却,当温度降至30~20℃时,发现有一定量的晶体析出。
则原盐液的质量百分比浓度不可能的是A 15%B 20%C 18%D 22%7.加热氯酸钾和二氧化锰的混合物使之完全反应,在t℃时将残留固体加入10克水中,充分搅拌后有7.6克固体未溶;保持温度不变,再缓慢加入5.0克水恰至固体质量不再变化,此时仍有5.0克固体未溶。
则t℃时氯化钾的溶解度可能是A 91.2克B 65.2克C 52克D 15.2克8.在60℃恒温条件下,取200g A物质的溶液蒸发掉20g水后,析出10g A的无水晶体,再蒸发掉20g 水后,又析出20g A的无水晶体,则原溶液中溶质的质量分数为A 64.4%B 50.0%C 47.5%D 33.3%9.t℃时,Na2CO3溶解度为Ag,现有饱和Na2CO3溶液 (100+A)g,溶质质量分数为a%;向该溶液中投入无水碳酸钠Ag,静置后析出碳酸钠晶体(Na2CO3·10H2O)Bg;加水使晶体全部溶解,所得溶液质量分数为a%,则加入水的质量为A (100+A)gB 100gC (100-180A/286)gD (100-A·a%)g10.一定温度下,某饱和碳酸钠溶液中碳酸钠的质量分数为w%,加入ag无水碳酸钠可析出bg碳酸钠晶体(Na2CO3·10H2O),则溶液中溶质质量减少A (b-a) gB (b—a)×w gC (53b/143-a) gD (b-a)×w% g11.下列有关溶液的叙述中,正确的是A 强电解质在水中的溶解度一定大于弱电解质在水中的溶解度B 将20℃时KCl溶液降低温度,所得溶液的质量分数一定会减小C某物质饱和溶液的质量分数为a%,该温度下该物质的溶解度一定大于a g/100g水D 将标准状况下的饱和CO2水溶液置于常温下,一定会放出CO2气体12.某温度下,向一定质量的饱和石灰水中加入少量生石灰,并恢复到原温度,则A溶质的溶解度不变 B 溶液中溶质的质量增加C 溶质的质量分数减少D 溶质的质量分数增大13.Ca(OH)2在80℃时的溶解度为x g,20℃时溶解度为y g,取80℃时Ca(OH)2的饱和溶液a g蒸发掉w g 水后,再恢复至20℃,滤去折出固体,滤液中Ca(OH)2的质量分数为z%,则x、y、z的关系正确的是A x>y>zB y<z<xC x<yD y>z14.常温分别将10g下列固体与90g水充分反应混和,所得溶液的溶质质量分数最小的是A CuSO4·5H2OB Na2OC KNO3D CaO15.40℃时,等质量的两份饱和石灰水,-份冷却至1℃,另-份加少量CaO并保持温度仍为40℃,这两种情况都不改变的是A Ca(OH)2的溶解度B 溶液的质量C溶质的质量分数 D 溶液中Ca2+数目16.有m1g KCl饱和溶液,其溶质的质量分数为c1%。
