学大伟业清华北大化学竞赛专题(无机化学)5
2023年北大春联无机作业题+答案

2023年北京大学中学生化学竞赛春季研讨营晚自习无机化学作业题2023.2.2关于试题的一些说明与提示:一、本试题为北京大学化学与分子工程学院命制二、为尽量增强图片的可读性,本文档中部分题目(第3题、第4题)中的插图进行了增强处理,略去了实际曲线中的噪声,实际情况请以现场下发的原件为准。
三、凡题目中要求书写反应方程式,如无特殊说明,须配平且系数为最简整数比。
四、可能用到的常数:法拉第常数F = 96485 C mol-1;气体常数R = 8.3145 J mol-1 K-1;A vogadro常数N A = 6.0221×1023 mol-1。
第1题(18分)13、14族元素的簇合物化学1-1B5H9(C4v点群)与C2H2在放电条件反应可以得到通式为B n C2H n + 2的碳硼烷。
给出B5H9的结构(2分,氢桥用B-H-B表示)。
给出n = 3的碳硼烷的结构(具有三重对称轴)和点群(3分),给出n = 10的碳硼烷的稳定异构体总数m(1分)。
1-2给出[Si5]2-的结构(2分)。
解释你的推理过程(2分)。
1-3填空:Zintl离子[Sn9]4-有x对骨架电子分布在y个Sn原子之间。
由于x-y = z,根据Wade规则,[Sn9]4-具有[closo, nido, arachno]型结构(5分;提示[B6H6]2-是closo,B5H9是nido,B4H10是arachno),画出[Sn9]4-的多面体结构(3分,不必示出Sn原子或电荷,不必给出推理过程)。
第2题(20分)元素推断从低价铜矿中电解精炼铜时的阳极泥是提取某元素X的主要原料,阳极泥(主要成分为A)中的X主要以阴离子形式存在。
典型的提取步骤为将混有碳酸钠的阳极泥A于650 ℃在空气中燃烧(反应1),然后浸水过滤。
滤液用稀硫酸中和后,过滤得含有X的B溶液(反应2)。
往该溶液中通入SO2,沉淀出X单质(反应3),如果不加碳酸钠进行焙烧,则得到固体C(反应4),但该方法的X产率比碳酸钠法低得多,这是因为C是一种不稳定的链状聚合物,有两种长度的共价键:178 pm和173 pm。
学大伟业清华北大化学竞赛专题(无机化学)10

大学化学之无机化学例题精讲主讲:清华大学马长捷第十讲副族元素(一)知识结构1、副族元素通性总结2、Cr副族1、副族元素通性总结二、同周期的d或ds区元素的相似性1、金属性:称为“过渡金属”。
因为其最外层电子数少(s层),容易失去。
2、d层电子容易发生跃迁,因而会显示不同的颜色。
3、氧化态:大部分存在多种氧化态,而且相邻氧化态之差很小。
Eg:Mn 氧化态有-1,0,1,2,3,4,5,6,7.跟p区不同。
除了VIII之外,最高氧化态和族号相等。
高氧化态一般以氧化物形式存在低氧化态一般以配合物形式存在4、同多酸:同一种含氧酸分子缩合而成多酸如:H2Mo4O13(四钼酸)、H10W12O41 (十二钨酸) 杂多酸:两种不同含氧酸分子缩合而成12MoO42- + 3NH4+ + HPO42- + 23 H+ ==(NH4)3[P(Mo12O40)]·6H2O↓(淡黄色)+ 6 H2O磷钼酸铵十二钼磷杂多酸的阴离子([PMo12O40]3−)是一种 1:12A 型杂多酸阴离子,1826年首先由贝采利乌斯发现。
这类 1:12A 型的结构首先由 Keggin 测得,因此常称为 Keggin 结构。
其基本结构单元是四组三个钼氧八面体,每一组中三个钼氧八面体共用顶角上的氧原子,结合成 Mo 3O 10单元。
四个 Mo 3O 10单元的四个三方共用的氧原子位于中心四面体的棱角上,构成四面体穴,而磷原子位于四面体穴的中心。
5、过渡元素容易形成配合物:过渡元素的原子或离子具有部分空的(n-1)d, ns、空的np轨道可接受配体的孤对电子。
过渡元素的离子一般具有较高的电荷、较小的半径,极化力强, 对配体有较强的吸引力。
所以过渡元素常成为催化剂:催化剂反应Fe/Mo 合成氨Pt/Rh 氨氧化为NOV2O5 SO2氧化为SO3Pd Raney Ni催化加氢2、Cr、Mo、W铬分族知识概括:1、铬族元素电势图-0.13 -1.1 -1.4 -1.2 E B θ: CrO 42- ——Cr(OH)3———Cr(OH)2——Cr —— CrO 2 1.33 -0.41 -0.91 E A θ: Cr 2O 72-————Cr 3+————Cr 2+————Cr 酸性介质Cr 2O 72-氧化性强,碱性介质Cr(OH)3还原性强。
学大伟业清华北大化学竞赛专题(无机化学)1pdf.doc

学大伟业清华北大化学竞赛专题(无机化学)l.pdf大学化学之主讲:清华大学马长捷无机化学竞赛大纲耍求:气无机化学竞赛大纲要求:气体理想气体标准状况(态)。
理想气体状态方程。
气体常量R。
体系标准压力。
分压定律。
气体相对分子质量测定原理。
气体溶解度(亨利定律)。
无机化学竞赛大纲要求:溶无机化学竞赛大纲要求:溶液溶液浓度。
溶解度。
浓度。
溶解度。
浓度和溶解度的单位与换算。
溶液配制(仪器的选择)。
重结晶方法以及溶质/溶剂相对量的溶剂相对量的估算。
过滤与洗涤(洗涤液选择、洗涤方式洗涤液选择、洗涤方式选择)。
重结晶和洗涤溶剂(包括混合溶剂洗涤溶剂(包括混合溶剂)的选择。
胶体。
合溶剂)的选择。
胶体。
分散相和连续相。
胶体的形成和破坏。
胶体的分类。
胶粒的基木结构。
无机化学竞赛大纲要求:元素元素周期律与元素周期系周期。
1〜18族。
主族与副族。
族。
主族与副族。
过渡元素。
主、副族同族元素从上到下性质变化一般规律;同周期元素从左到右性质变化一般规律。
原子半径和离子半径。
左到右性质变化一般规律。
原子半径和离子半径。
s、p、d、ds、f区元素的基本化学本化学性质和原子的电子构型。
元素在周期表中的位置与核外电子结构(电子层数、价电子层与价电子数)的数、价电子层与价电子数)的关系。
最高氧化态与族序数的关系。
对角线规则。
金属与非金属在周期表中的位置。
半金属(类金属)。
主、副族的重要而常见元素的名称、符号及在周期表屮的位置、常见氧化态及其主要形体。
铂系元素的概念。
无机化学竞赛大纲要求:无机化学竞赛大纲要求:配合物路易斯酸碱。
配位键。
重要而重要而常见的配合物的中心离子(原子)和重要而常见的配体(水、羟离子、卤离子、拟卤离子、氨、酸根离子、不饱和烃等)。
螯合物及螯合效应。
重要而常见的配合反应。
配合反应与酸碱反应、沉淀反应、氧化还原反应的关系(定性说明)。
配合物几何构型和异构明)。
配合物几何构型和异构现象的基木概念和基木事实。
配合物的杂化轨道理论。
高中化学无机化学竞赛辅导课件.ppt
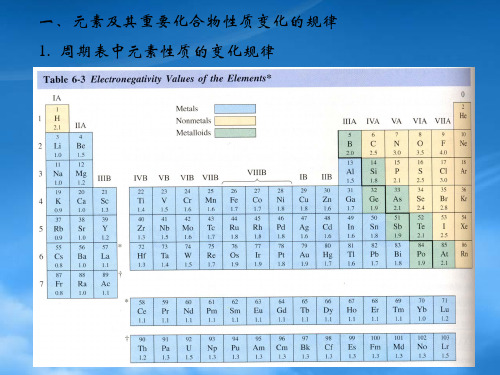
• d区元素的化合物
• 离子极化对ds区元素化合物性质的影响
•
颜色
•
溶解
•
HgF2 HgCl2 HgBr2 HgI2 水解性质
• Hg2+ 与卤素及拟卤离子形成的配合物 HgX42-
• HgNH2X
4) 常见配位化合物及配位数 Cu(I) Cu(NH3)2+ CuCl3- Cu(CN)43Cu(II) 配位数通常为4 CuCl42- Cu(NH3)42+ Cu(CN)42Ag(I) 配位数通常为2 Ag(NH3)2+ Ag(S2O3)23- Ag(CN)2Zn(II) 配位数为4和6 ZnCl42- Zn(NH3)42+ Zn(NH3)62+ Cd(II) 常见配位数为4 Hg(II) 配位数为4 与卤素和类卤离子
• 氢键
•
强弱次序:
F—H ···F > O—H ···O > O—H ···N &g ···Cl > O—H ···S
特点: 是特殊的分子间作用力
具有方向性和饱和性
晶体结构
1. 晶格和点阵、晶胞 晶系:立方 四方 正交 单斜 三斜 三方 六方
2. 金属晶体—堆积 非密置层的堆积:简单立方和体心立方 密堆积:立方密堆—面心立方 六方密堆—六方晶胞 空间利用率及配位数
• 离子晶体 • CsCl 负离子成简单立方堆积,正离子占据立方体间隙。
NaCl 负离子成面心立方堆积,正离子占据八面体体间隙。
ZnS 负离子成面心立方堆积,正离子占据四面体间隙。
• 分子晶体
• 共价晶体
•
金刚石和石墨的结构
• 离子极化 • 离子的极化能力 • 离子的变形性 • 离子极化对键型和晶型的影响
清北学堂-化学竞赛练习题

的杂化情况。
第 16 题 碳化钙 CaC2 在 1100℃与氮气反应生成单质碳和一种
8
清北学堂—刘奉岭老师
钙盐,这种钙盐与 CO2 和 H2O 反应生成含氮 66.64%的一 种 5 原子分子 A 和另一种盐。A 很容易聚合,其二聚体有 多种结构。写出上述反应的方程式,画出 A 的 3 种原子 排布次序不同的二聚体的结构。
第 13 题 配离子[N{(RuCl4(H2O)}2]3-中两个中心离子及桥连配
体是直线形,若水分子看成一个整体,该离子有五个镜面, 画出其结构。
第 14 题 化学家在羰基原子簇化合物方面进行过许多研究,曾
经制得过多种原子簇化合物。一种含 Fe 元素的原子簇 Fe4C(CO)n 是由 Fe 和 C 原子形成多面体骨架,CO 在骨 架外配位,在骨架内相邻 2 个原子之间形成正常的双电子 键,Fe 原子满足 18 电子规则,骨架结构没有 C3 轴(考 虑骨架对称性时可不考虑 CO 配体)。画出骨架结构,求 出 Fe4C(CO)n 中的 n 值。
Fe 满足 18 电子规则,画出[(CO)2Fe(2-L)2Fe(CO)2]的结 构简图。
9-2 在 冰 醋 酸 热 溶 液 中 , 用 KMnO4 氧 化 Mn(CH3COO)23H2O,得到含 3 个 Mn(III)离子的络离子 A+,A+中的 CH3COO- 2 个氧原子都配位、每个 Mn(III) 离子各有 1 个水分子与之配位,络离子有三重旋转轴。写
出生成 A+的方程式,用 O O 表示 CH3COO-, 画出 A+ 的结构简图。
9-3 减压蒸馏不带结晶水的醋酸锌,得到一种结晶 形的中性配合物 X,配合物 X 由 4 个 Zn 离子与配体形成,
第32届全国高中化学竞赛清北学堂模拟试卷5
第32届全国高中化学竞赛清北学堂模拟试卷五·竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
·试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
·姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
第1题(17分)在有机反应中,碳正离子重排反应有着重要的地位,它常常难以预测的在反应釜中发生,对目标产物的合成带来了一定困难,然而同时使有机分子的结构更加丰富多彩。
相比之下,碳负离子重排好像并不那么常见。
根据Woodward-Hoffman 规则,碳负离子同面迁移中的1,2-迁移、1,6-迁移等是对称性禁阻的,而1,4-迁移则对称性允许。
为加深对碳负离子重排的了解,有人利用计算化学方法对下列两个反应进行了处理:反应一:反应二:对于反应一的底物和产物进行结构优化,结果如下图所示:1-1-1碳负离子重排与碳正离子重排在基团迁移的方向上有什么不同,根据所给信息,简要说明原因?1-1-2分别写出“自由”碳正离子和“自由”碳负离子中心碳“原子”的杂化方式并说明为什么二者杂化方式不同。
1-1-3请利用共振论解释反应物1a、反应物1b和产物2的能量差别。
1-2了解一个反应的趋向,不仅要研究该反应的底物和产物,还要研究该反应的过渡态。
理论化学对于反应一和反应二的计算结果如图所示:1-2-1画出碳负离子1,2-迁移和1,4-迁移过渡态中轨道作用示意图。
1-2-2请利用休克尔理论解释两个反应活化能的差异。
第2题(15分)EDTA能与许多金属阳离子反应生成1 : 1的络合物。
2-1-1画出EDTA与铜离子所形成络离子的结构。
2-1-2指出这种络离子所属点群。
2-2以下是hcp堆积和ccp堆积中原子的配位多面体,指出这两种配位多面体的所属点群。
2016年暑假学大伟业化学竞赛模拟试卷8
(3 分 写成离子得 1 分) 键级为 4(1 分) 2-2-2 为什么经过反应 Re2 的键没有断开? 因为铼铼四重键很稳定,可以承受较强条件。 (1 分) 2-3 (4 分) PH3 的配位性能比 NH4 好很多, 但 PH3 的碱性相比于 NH3 却极弱, 这是为什么? 请从结构角度解释之。 P 原子的 3d 轨道是空的,可以与 M 形成 d-d π 键,键级变大(2 分) ;而在碱性的分析中, P 的 3P 轨道没有 N 与 H 的 1s 轨道重合得好(电负性) (2 分)
单位地址:北京大学资源东楼ห้องสมุดไป่ตู้1311 室
中国顶尖大学自主招生网
客服热线 400-026-2017
北京学大伟业教育科技有限公司
共育人才
开创未来
第5题 (共 9 分) 在 HgI2 固体上滴加过量碘酸, 使得固体完全溶解, 调 PH 至 7, 加入 AgNO3 溶解,体系中出现黄色不溶物,过滤出该晶体,洗净干燥并加热,晶体转变为红色。经χ射 线衍射研究,该晶体的变色现象是晶相转变所致。其中,黄色晶体 a=b=c ,α=β=γ=90° ,晶 体中有一个四次对称轴。 其晶体中 Ag+和 Hg2+呈现相间的层状分布, 堆积层结构垂直于晶体 的四次对称轴。而红色晶体晶包参数与黄色晶体几乎相等,但晶体中有四个三次对称轴, Ag+,Hg2+完全是统计分布,与晶体中统计分布的空穴一起组成了 ccp 堆积,已知黄、红色晶 体的离子分布均类似于立方 ZnS,且晶体中金属离子的位置上均存在统计分布的空穴。 5-1 试写出 HgI2 溶于氢碘酸的离子方程式 5-2 试根据题中叙述,判断黄红二晶体的所属晶系 5-3 写出该晶体的化学式 5-4 试画出黄红二晶体的正当晶胞,并简要描述红色晶体的三次对称轴位置(晶胞当中请标 注出统计原子的成分)
2020全国高中化学竞赛 无机化学北大版 金属原子簇和金属金属多重键共33张
(+3)
(+3)
级键)
Re —Re 3.8486? 不存在金属 -金属键
[Re 2Cl8]2- + PEt2H ( HCl ,苯 )? 1,2,5,6-Re 2Cl4(? -PEt2)(PEt 2H)4
(+3)
(+4)
Trinuclear complexes
di-2-pyridylamine (dpa -)
=6
TEC 和簇合物结构的关系
簇合物
总电子 骨架 数TEC 电子
对数
S
母体多面 体顶点数
n
Rh 6(CO) 16
86
7
Os5(CO) 16
72
6
Os5C(CO) 15
74
7
Fe 4C(CO)
2?
12
62
7
H3Ru 4(CO) 12?
60
6
金属原
子数
6 5 5 4
4
结构
闭式
闭式
巢式
蛛网式 巢式
原子簇的电子计数
Co
Co
Co
CH
Co 4(CO) 12
CH
Co Co
Co
Co(CO) 3
Co3(CO) 9CH ( carbyne)
若干p区和 d 区的等瓣分子片
等瓣相似的分子轨道示意图
CH
CpNi
Co(CO) 3
15e
CH 2
Ni(CO)3
CH3
CH 4
Mn(CO) 5
Ni(CO)4
Fe(CO) 4
16e
Angew. Chemie. Vol 21, 10(1982)711-724
化学竞赛无机化学绝密课件 氢和稀有气体
精品PPT
17. 2 氢化物
碱金属和碱土金属与氢生成离 子型氢化物。
其中 LiH 和 BaH2 较稳定。
精品PPT
BeH2 可以利用 LiAlH4 在乙醚 介质中还原铍的化合物制得
(CH3)2Be + LiAlH4 ——
BeH2 + LiAlH(2 CH3)2
精品PPT
许多种金属硫化物,高温下可
以被 H2 还原,例如
—— > 900℃
FeS2 + 2 H2
Fe + 2 H2S
精品PPT
在特定的温度、压力下,采用 特定的催化剂,H2 和 CO 反应可 以合成一些有机化合物 CO + 2 H2 —C—u,—Zn—O CH3OH(g)
精品PPT
17. 1. 2 氢气的制备 实验室制 H2 常采用稀盐酸与 金属锌反应的方法。 但是由于金属锌中有时含有砷 化物、磷化物等杂质,致使制得的 H2 不纯。
H2 和 Cl2 的混合物在光照下爆 炸化合。
H2 和 F2 的混合物在没有光照 时亦将爆炸化合。
精品PPT
高温下,H2 与活泼金属反 应,生成金属氢化物
H2 + 2 Na —— 2 NaH H2 + Ca —— CaH2
精品PPT
高温下 H2 能还原许多种金属 氧化物
CuO + H2 —— Cu + H2O WO3 + 3 H2 —— W + 3 H2O
精品PPT
巴特利特曾使 O2 同六氟化铂 反应,生成一种新的化合物
O2+ [ PtF6 ]-
电离 能相比较
Xe I1 1170.3 kJ·mol-1 O2 I1 1175.7 kJ·mol-1 由两者第一电离能的接近,他 推测到 PtF6 氧化 Xe 的可能性 。
中学化学竞赛试题资源库——无机化工
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
无机化学例题精讲大学化学之
主讲:清华大学马长捷
第五讲配位化合物(二)
第一部分:配合物命名练习
物命名练习
中性及阳离子配体配合物命名:
2014/12/7
中
性及
阳离
子
配
2014/12/7
体
配
合
物
命
名:
2014/12/7
2014/12/7
2014/12/7
2014/12/7
如果配体中的链或者环上所有原子都键合
2014/12/7
如果配体中的链或者环上所有原子都键合于一个中心原子,则在配体名称前加上词头η
2、配合物推断及异构问题、配合物推断及异构问题
已知某配合物的组成为CoCl3·5 N 液显弱酸性,加入强碱并加热至沸腾有氨放出,同时产生Co2O3沉淀;加AgNO3于该
AgCl沉淀生成,过滤后再加AgN 变化,但加热至沸腾有AgCl沉淀第一次沉淀量的二分之一。
则该配合物的化学式最可能为__________。
写出其中文名称2014/12/7
(A)(B)[ Co (NH3 )5 (H2O)]Cl3 (C)[CoCl2 (NH3 )3 (H2O)]C
(D)[ CoCl (NH3 )5 ]Cl2·H2O
CoCl3·5 NH3·H2O。
其水溶热至沸腾有氨放出,同时于该化合物溶液中,有AgNO3溶液于滤液中无沉淀生成,且其质量为则该配合物的化学式最可。
写出其中文名称__________。
·NH3·H2O
[ CoCl2 (NH3 )4 ]Cl·NH3·H2O [ Co (NH3 )5 (H2O)]Cl3
[CoCl2 (NH3 )3 (H2O)]Cl·2 NH3 [ CoCl (NH3 )5 ]Cl2·H2O
[CrCl(H2O)5]Cl2·H2O 和[CrCl2(H2O)4]Cl·
型?
(A )几何异构(B )水合异构键合异构
2014/12/7
[CrCl2(H2O)4]Cl·2H2O 属于什么异构类(C )电离异构(D )
请判断下列两个化合物的异构类型:
2014/12/7
画出[PtCl
2(NO 2)2(NH 3)2]2-配合物的几种
指出其中哪一种具有光学活性?
2014/12/7
配合物的几种几何异构体?并
向含[cis-Co(NH3)4(H2O)2]3+的溶液中加{Co[Co(NH3)4(OH)2]3}6+的难溶盐。
{ Co[Co(NH3)4(OH)2]3}6+ 是以羟基为桥
具有手性。
画出其结构。
2014/12/7
的溶液中加入氨水,析出含是以羟基为桥键的多核络离子,。
