醌氧化还原介质对厌氧氨氧化生物活性的影响全解
厌氧氨氧化

厌氧氨氧化厌氧氨氧化作用即在厌氧条件下由厌氧氨氧化菌利用亚硝酸盐为电子受体,将氨氮氧化为氮气的生物反应过程。
这种反应通常对外界条件(pH 值、温度、溶解氧等)的要求比较苛刻,但这种反应由于不需要氧气和有机物的参与,因此对其研究和工艺的开发具有可持续发展的意义。
厌氧氨氮化一般前置短程硝化工艺,将废水中的一部分氨氮转化成亚硝酸盐。
目前在处理焦化废水、垃圾渗滤液等废水方面已经有成功的运用实例。
厌氧氨氧化是一个微生物反应,反应产物为氮气。
具有一些优点:由于氨直接作反硝化反应的电子供体,可免去外源有机物(甲醇),既可节约运行费用,也可防止二次污染;由于氧得到有效利用,供氧能耗下降;由于部分氨没有经过硝化作用而直接参与厌氧氨氧化反应,产酸量下降,产碱量为零,这样可以减少中和所需的化学试剂,降低运行费用,也可以减轻二次污染。
厌氧氨氧化(Anammox)厌氧氨氧化的发现Broda 的预言1977年,奥地利理论化学家 Broda根据化学反应热力学,预言自然界存在以硝酸盐或亚硝酸盐为氧化剂的氨氧化反应,因为与以氧为氧化剂的氨氧化反应相比,它们释放出的自由能一点也不逊色。
序号电子受体化学反应Δ G/ ( KJ/mol)1 氧2NH4++3O22NO2-+2H2O+4H+ -2412 亚硝酸盐NH4++NO2- →N2+2H2O -3353 硝酸盐5NH4++3NO3- →4N2+9H2O+2H+ -278既然自然界存在自养型亚硝化细菌,能够催化反应1,那么理论上也应该存在另一种自养型细菌,能够催化反应2和反应3。
由于当时这种细菌还没有被发现,所以,Broda 认为它们是隐藏于自然界的自养型细菌。
Mulder 的发现20世纪80年代末,荷兰Delft 工业大学开始研究三级生物处理系统。
在试运期间, Mulder 等人发现,生物脱氮流化床反应器除了进行人们所熟知的反硝化外,还进行着人们未知的某个反应使氨消失了。
进一步观察发现,除了氨不明去向外,硝酸盐和亚硝酸盐也有一半以上不明去向。
醌类的生物活性
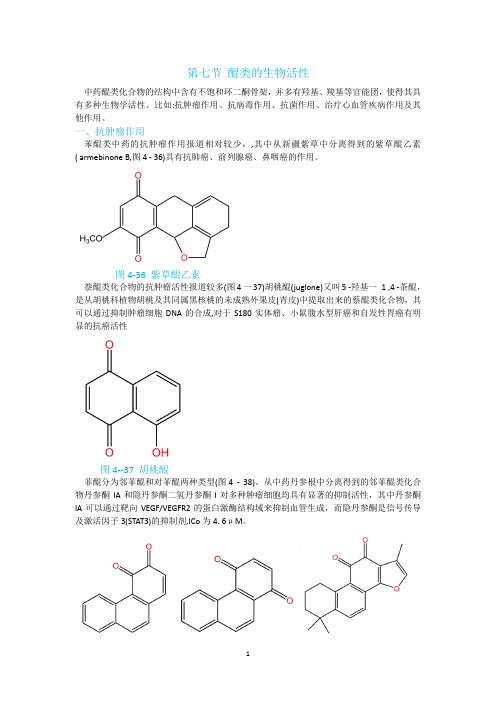
第七节醌类的生物活性中药醌类化合物的结构中含有不饱和环二酮骨架,并多有羟基、羧基等官能团,使得其具有多种生物学活性。
比如:抗肿瘤作用、抗病毒作用、抗菌作用、治疗心血管疾病作用及其他作用。
一、抗肿瘤作用苯醌类中药的抗肿瘤作用报道相对较少,,其中从新疆紫草中分离得到的紫草醌乙素( armebinone B,图4 - 36)具有抗肺癌、前列腺癌、鼻咽癌的作用。
图4-36 紫草醌乙素萘醌类化合物的抗肿瘤活性报道较多(图4一37)胡桃醌(juglone)又叫5 -羟基一1 ,4 -茶醌,是从胡桃科植物胡桃及其同属黑核桃的未成熟外果皮(青皮)中提取出来的蔡醌类化合物,其可以通过抑制肿瘤细胞DNA的合成,对于S180实体瘤、小鼠腹水型肝癌和自发性胃癌有明显的抗癌活性图4--37 胡桃醌菲醌分为邻菲醌和对菲醌两种类型(图4 -38)。
从中药丹参根中分离得到的邻菲醌类化合物丹参酮IA和隐丹参酮二氢丹参酮I对多种肿瘤细胞均具有显著的抑制活性,其中丹参酮IA可以通过靶向VEGF/VEGFR2的蛋白激酶结构域来抑制血管生成,而隐丹参酮是信号传导及激活因子3(STAT3)的抑制剂,ICo为4. 6μM。
邻菲醌对菲醌丹参酮IIA隐丹参酮二氢丹参酮I图4-38 抗肿瘤活性菲醌类化合物蒽醌分为单蒽核类及双蒽核类(图439)。
大黄索类化合物大黄素、大黄酸和芦荟大黄素具有-定的抗肿瘤作用。
大黄素大黄酸芦荟大黄素图4-39抗肿瘤活性蒽醌类化合物二、抗病毒作用有一些醌类化合物在抗病毒方面也具有非常好的效果(图4-40)。
比如:金丝桃素在体外可以抑制多种逆转录病毒。
紫草素是中药紫草的主要成分,对肠道病毒71型(Entervius 71,EV71)、甲型流感病毒( HINI、HIV -1病毒新型冠状病毒(SARS - CoV2)有一定的抑制活性。
金丝桃素紫草素图4-40. 抗病毒作用的醌类化合物三、抗菌作用中药意配类化合物大黄素芦荟大黄索、大黄酸对革兰氏阳性菌和革兰氏阴性菌都有品者的抗菌效果。
醌类化合物催化氧化性能的研究

醌类化合物催化氧化性能的研究在过去的几十年里,醌类化合物及其内含的活性中心在环境领域和生物化学研究中发挥了重要作用。
特别是,醌类化合物的活性中心对各种氧化反应具有良好的催化性能。
在最近的几十年里,很多研究表明,醌类物质通过不同的氧化动力学在环境空气中催化氧化有机污染物,是研究环境污染过程中污染物去除的最重要组成部分。
醌类化合物可以促进各种氧化反应,最常用的氧化反应是光解氧化,包括过氧化物氧化、活性自由基氧化和电子捕获氧化。
醌类物质的活性中心的氧化作用,主要是由醌类化合物的核心氧化中心来完成的。
通过调控活性中心的氧化性能,可以有效控制氧化反应的速率,并且由活性中心的种类和结构来影响反应的路径,从而影响氧化反应的效果,达到减少有毒有害物质的目的。
近年来,大量研究表明,引入各种官能团和多原子结构到醌类中心结构,可以显著改善醌类物质的氧化性能,有效提高氧化反应的速率和活性中心的稳定性,进而促进环境污染物的氧化。
同时,还有研究为醌类中心结构的超级电子捕获和氧化过程提供逼真的框架,以帮助理解氧化反应中极性物质和有机物在醌类配体中的变化作用机制,并优化结构以改善醌类物质的氧化性能。
此外,在有机污染物氧化过程中,电子转移也是很重要的因素,不同污染物的电子转移能力不同,因此研究机构也着眼于开发新的醌类物质,以促进有机污染物的电子传递。
通过开发新的醌类物质和结构,可以改善有机物的电子转移,提高有机物的氧化能力,以实现根本上的污染物的治理。
综上所述,醌类化合物的氧化性能极大地促进了环境污染物的氧化去除。
同时,研究人员们还在测试不同类型的醌类物质,以开发新的催化材料,以改善氧化性能,有助于污染物去除和减少有毒有害物质的排放,达到保护环境和人类健康的目的。
偶氮染料废水厌氧生物脱色强化

偶氮染料废水厌氧生物脱色强化魏亮;陈小光;黄波;唐丽娟;王玉【期刊名称】《纺织学报》【年(卷),期】2018(039)008【摘要】针对偶氮染料废水的生物降解难题,通过对比投加不同浓度的电子供体(葡萄糖)和氧化还原介体(RM)蒽醌-2,6-二磺酸钠盐和活性炭对偶氮染料的厌氧生物脱色果的影响,探究增强偶氮染料厌氧生物脱色的条件.结果表明:投加电子供体或RM 均可有效强化偶氮染料废水厌氧生物脱色;投加300 mg/L葡萄糖时脱色率可高达53.35%,投加200 mmol/L蒽醌-2,6-二磺酸钠盐时脱色率为34.59%,与投加0.6 g/L活性炭的脱色率(35.26%)相当;投加葡萄糖0~24 h的脱色速率最快为1.47%/h,36 h脱色率接近最大值为46.49%;投加蒽醌-2,6-二磺酸钠盐时0~12 h的脱色速率最快为1.03%/h,60 h脱色率接近最大值为33.30%;投加活性炭时0~30 h 的脱色速率最快为0.79%/h,60 h脱色率接近最大值为33.65%.【总页数】5页(P83-87)【作者】魏亮;陈小光;黄波;唐丽娟;王玉【作者单位】东华大学环境科学与工程学院, 上海 201620;东华大学国家环境保护纺织工业污染防治工程技术中心,上海 201620;东华大学环境科学与工程学院, 上海 201620;东华大学国家环境保护纺织工业污染防治工程技术中心,上海201620;四川理工学院过程装备与控制工程四川省高校重点实验室, 四川自贡643000;四川理工学院过程装备与控制工程四川省高校重点实验室, 四川自贡643000;东华大学环境科学与工程学院, 上海 201620;东华大学国家环境保护纺织工业污染防治工程技术中心,上海 201620;东华大学环境科学与工程学院, 上海201620;东华大学国家环境保护纺织工业污染防治工程技术中心,上海 201620【正文语种】中文【中图分类】X703【相关文献】1.厌氧光生物转盘-好氧生物膜久理偶氮染料废水 [J], 郑慧;王兴祖;孙德智2.固定化微生物厌氧移动床——好氧法处理偶氮染料废水 [J], 罗志腾;刘义3.生物强化-氧化还原介体联合强化高盐偶氮染料废水生物脱色的研究 [J], 谭靓;宁淑香;王颖4.高效脱色菌的特性及其在染化废水厌氧处理中的生物强化作用 [J], 徐向阳;张明洲;俞秀娥5.偶氮染料循环伏安行为和生物厌氧脱色相关性研究 [J], 郭建博;周集体;王栋;田存萍;葛君;王平;喻晖因版权原因,仅展示原文概要,查看原文内容请购买。
厌氧氨氧化菌活性的快速恢复及运行

厌氧氨氧化菌活性的快速恢复及运行作者:杨开亮占志强王莹时继东廖德祥逯焕波许乐平来源:《上海海事大学学报》2017年第04期摘要:为研究厌氧氨氧化(anaerobic ammonium oxidizing, ANAMMOX)菌的活性恢复,采用SBR工艺对长时间(100 d左右)停止运行的反应器中ANAMMOX菌进行活性培养。
经过22 d的恢复试验,ANAMMOX菌活性基本恢复,在第17 天,NH+4—N和NO-2—N的转化率均在90%以上,TN的去除率在80%以上。
在培养过程中,载体的颜色由白色逐渐变成淡黄色。
结果表明,在常温闲置较长时间的反应器中ANAMMOX菌的活性可恢复性强,恢复周期短,恢复后的脱氮性能良好;ANAMMOX反应器通过对生物膜载体的培养可以使ANAMMOX菌的活性快速恢复。
关键词:厌氧氨氧化(ANAMMOX);活性恢复; SBR;脱氮中图分类号: X703.1 文献标志码: AAbstract: To study the activity recovery of anaerobic ammonium oxidizing (ANAMMOX)bacteria, the SBR process is used to carry out the activity cultivation of ANAMMOX bacteria in the reactor that has stopped running for a long time (about 100 d). After 22 d recovery test, the activity of ANAMMOX bacteria is almost recovered. At 17th day, the conversion rates of NH+4—N and NO-2—N are above 90%, and the removal rate of TN is above 80%. In the process of culture, the color of the carrier changes from white to light yellow. The results show that:ANAMMOX bacteria in SBR with a long idle time at the normal atmospheric temperature can be easily recovered, the recovery period is short, and the nitrogen removal performance is good after the recovery; through the cultivation of the biofilm carrier, ANAMMOX reactor can make the activity of ANAMMOX bacteria recover quickly.Key words: anaerobic ammonium oxidizing ( ANAMMOX); activity recovery; SBR;nitrogen removal引言厌氧氨氧化(anaerobic ammonium oxidizing, ANAMMOX)工艺无需外加有机碳源作为电子供体,可在节约成本的同时,防止投加碳源产生的二次污染,不会像传统硝化-反硝化工艺那样产生温室气体,同时ANAMMOX反应器占地空间也很小[1-3]。
醌氧化还原介质对厌氧氨氧化生物活性的影响模板

醌氧化还原介质对厌氧氨氧化生物活性的影响锦集RMS 通过厌氧氨氧化生物抑制TN的去除性能RMs 可以显著提高厌氧氨氧化菌关键酶的活性RMs是推断发挥作用的Q/QH2在厌氧氨氧化过程作为主要的原因,可能会阻止ladderane RMs 和关键酶之间的联系文章信息1.文章历史2013年9月修订2013年10月31日修订编版2013年11月1日被接受2013年11月10日在网上发布2.关键词厌氧氨氧化氧化还原介质肼脱氢酶亚硝酸盐还原酶硝酸还原酶3.摘要本研究首先探讨厌氧氨氧化生物/关键酶和醌的氧化还原介质之间的活动关系,其中蒽醌-2,6-二磺酸(AQDS),2-羟基-1,4- napthoqui-无(LAW)和蒽醌-2-羧酸(AQC)。
实验结果表明,总脱氮性能随三种氧化还原介质(RMS)用量的增加而呈下降趋势。
例如,当AQC增加到0.8毫米,TN的去除率急剧减少到17.2mg-N/gVSS/h,只能控制大约20%。
这种现象可能是微生物中毒与细胞外的RM增加而引起的。
然而,粗肼脱氢酶,亚硝酸盐还原酶,和硝酸还原酶的活性增强比没有RMS的对照实验约0.6-3倍。
RMS被推断在厌氧氨氧化过程中发挥辅酶/泛醌(Q/QH2)作用。
此外,具体ladderane 膜结构可以阻隔RMS和厌氧氨氧化膜内的关键酶。
主要原因可能是RMS 对厌氧氨氧化生物和关键酶的反向影响。
1.简介厌氧氨氧化(ANAMMOX)现在被确认为是一种新颖的重要的生物脱氮工艺。
它可以在厌氧条件下将NH4与NO2直接转化成N2(Strouset等人,1999)。
与传统工艺相比(硝化反硝化生物),厌氧氨氧化过程提供了显著的优点,如对氧气和有机碳,低污泥产量和减少CO2和NO2的排放(Opden Campet等人,2006)。
近日,唐等人(2010)报告了一个高达74.3-76.7 kg-N/m3/d的脱氮率在一个实验室规模的厌氧氨氧化UASB反应器,在废水生物脱氮的厌氧氨氧化工艺的高电位。
纳米材料对厌氧氨氧化菌的影响

纳米材料对厌氧氨氧化菌的影响纳米材料由于其独特的性质已被广泛使用,其应用过程中的副产品之一就是纳米颗粒,纳米颗粒粒径通常在40~100nm之间,其中40~60nm的纳米颗粒占比达到了46.1%。
在制造、运输和应用的过程中,纳米颗粒(Nanoparticles,NPs)不可避免地会被释放到环境中,最终在污水中被无害化处理。
现阶段,在许多污水中都能检测到纳米颗粒的存在,例如在纺织废水中,纳米氧化锌累积浓度可达到150μg/L。
而市政污水中纳米银的浓度范围主要在0.1~0.2μg/L之间,同时在市政污水中检测到纳米二氧化钛的浓度为181~1233μg/L,这是由于纳米二氧化钛在医药、表面涂料和化妆品中被广泛使用。
尽管目前污水中部分纳米颗粒的浓度还未达到较高水平,但是随着纳米科技的快速发展,含纳米材料的消费品将呈显著上升趋势,纳米颗粒在环境中的浓度将不断增加,其对污水处理的潜在影响不能被忽视。
厌氧氨氧化(AnaerobicAmmoniumOxidation,Anammox)作为一种新型的自养脱氮工艺,被认为是最高效、最具经济效益的污水脱氮技术之一。
然而,厌氧氨氧化菌很容易受到进水水质波动的影响,污水中的纳米颗粒会对其产生正面或负面的影响。
到目前为止,许多试验研究结果表明纳米材料对细菌、藻类和哺乳动物都具有一定的毒性,但是不同类型的纳米材料之间的毒性效果并不一致。
为此,笔者从厌氧氨氧化工艺的角度出发,结合现有研究文献,从长期和短期影响、毒性机理、微生物的抗毒机制等角度综述纳米颗粒对厌氧氨氧化过程的影响,同时还提出今后的发展趋势和研究方向。
1、纳米材料对厌氧氨氧化菌活性的影响根据最近的纳米技术与材料消费品目录,金属和金属氧化物纳米材料是使用最广泛的两种纳米材料,占全球纳米产品总量的37%。
不同纳米材料的理化性质随着尺寸、形状、化学成分和表面结构而变化,因此,上述这些材料对厌氧氨氧化菌所造成的影响也不尽相同。
醌类氧化还原介体

醌类氧化还原介体醌类化合物作为一类重要的氧化还原介体,在化学领域中起着极为重要的作用。
它们具有独特的结构和性质,可以广泛应用于催化、药物合成、染料和材料科学等多个领域。
首先,让我们来了解一下醌类化合物的结构特点。
醌类化合物的分子结构由两个氧原子和苯环组成,其中一个氧原子与苯环上的碳原子相连,另一个氧原子与苯环上的氢原子相连。
这种结构使其具有良好的氧化还原性质,可在化学反应中充当氧化剂或还原剂。
醌类化合物的氧化还原性质使其在催化领域中有着广泛的应用。
例如,它们可以作为催化剂参与氧化反应,如醌类氧化剂可以将有机化合物氧化为其对应的醇或醛。
同时,它们也可以作为还原剂参与反应,如醌类还原剂可以将有机化合物还原为醌类化合物或醇。
通过调节醌类化合物的结构和反应条件,我们可以精确控制氧化还原反应的发生,从而实现有机合成中的选择性合成。
此外,醌类化合物在药物合成中也发挥着重要的作用。
以维生素K 为例,它是一种醌类化合物,参与了人体中凝血机制的调节。
通过维生素K的氧化还原循环,可以确保血液凝块的正常形成和溶解,进而预防血栓症等疾病的发生。
因此,对醌类化合物的深入研究不仅有助于药物的合成和疾病治疗,同时也有助于理解人体生理过程的机理。
另外,醌类化合物在染料和材料科学中的应用也非常广泛。
由于其独特的结构和性质,醌类化合物可以作为染料分子或光敏化合物应用于染料敏化太阳能电池和光伏材料中。
醌类化合物灵活的氧化还原性质可以实现光能的捕获和转换,提高能量转化效率。
此外,在材料科学中,醌类化合物还可以作为纳米材料的合成前体,用于制备具有特殊形貌和性能的纳米材料。
总之,醌类化合物作为一类重要的氧化还原介体,在化学领域中具有丰富的应用前景。
通过进一步深入研究醌类化合物的结构和性质,我们可以开发出更多的氧化还原催化剂,加速药物的合成和疾病治疗,同时也有助于开发新型染料和材料。
对于广大化学科研工作者来说,我们应该深入理解醌类化合物的氧化还原性质,并将其应用于实际的研究和创新中,为人类的发展做出更大的贡献。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
醌氧化还原介质对厌氧氨氧化生物活性的影响锦集RMS 通过厌氧氨氧化生物抑制TN的去除性能RMs 可以显著提高厌氧氨氧化菌关键酶的活性RMs是推断发挥作用的Q/QH2在厌氧氨氧化过程作为主要的原因,可能会阻止ladderane RMs 和关键酶之间的联系文章信息1.文章历史2013年9月修订2013年10月31日修订编版2013年11月1日被接受2013年11月10日在网上发布2.关键词厌氧氨氧化氧化还原介质肼脱氢酶亚硝酸盐还原酶硝酸还原酶3.摘要本研究首先探讨厌氧氨氧化生物/关键酶和醌的氧化还原介质之间的活动关系,其中蒽醌-2,6-二磺酸(AQDS),2-羟基-1,4- napthoqui-无(LAW)和蒽醌-2-羧酸(AQC)。
实验结果表明,总脱氮性能随三种氧化还原介质(RMS)用量的增加而呈下降趋势。
例如,当AQC增加到0.8毫米,TN的去除率急剧减少到17.2mg-N/gVSS/h,只能控制大约20%。
这种现象可能是微生物中毒与细胞外的RM增加而引起的。
然而,粗肼脱氢酶,亚硝酸盐还原酶,和硝酸还原酶的活性增强比没有RMS的对照实验约0.6-3倍。
RMS被推断在厌氧氨氧化过程中发挥辅酶/泛醌(Q/QH2)作用。
此外,具体ladderane 膜结构可以阻隔RMS和厌氧氨氧化膜内的关键酶。
主要原因可能是RMS 对厌氧氨氧化生物和关键酶的反向影响。
1.简介厌氧氨氧化(ANAMMOX)现在被确认为是一种新颖的重要的生物脱氮工艺。
它可以在厌氧条件下将NH4与NO2直接转化成N2(Strouset等人,1999)。
与传统工艺相比(硝化反硝化生物),厌氧氨氧化过程提供了显著的优点,如对氧气和有机碳,低污泥产量和减少CO2和NO2的排放(Opden Campet等人,2006)。
近日,唐等人(2010)报告了一个高达74.3-76.7 kg-N/m3/d的脱氮率在一个实验室规模的厌氧氨氧化UASB反应器,在废水生物脱氮的厌氧氨氧化工艺的高电位。
然而,如此高的脱氮率(NRR)是通过连续添加厌氧氨氧化污泥到目标反应器,其中生物量浓度的增加高达42-57.7VSS/L(唐等人,2010)。
此外,厌氧氨氧化菌相对长的培养时间为也会导致较长的启动时间,通过降低厌氧氨氧化菌的丰度使厌氧氨氧化系统更加脆弱。
因此,提高生物质厌氧氨氧化菌活性,并进一步缩短厌氧氨氧反应器的启动是很趣味性和挑战性的课题。
研究人员已经进行了大量的努力,通过外场能量(磁场力,低强度超声)或添加几种微量营养元素增加厌氧氨氧化菌的活性。
例如,刘等。
(2008)施加的磁场成功地提高厌氧氨氧化菌的活性,在60T的磁化率下,最大脱氮率提高了30%。
类似地,段等,(2011)表明,总氮(TN)厌氧氨氧化菌的去除率提高25.5%,通过施加0.3W/cm2超声强度与4分钟的最佳照射时间,这个效果可以持续6天左右。
除了外部领域的应用,乔等(2012)表明Mno2粉末的加入也可以使厌氧氨氧化菌的脱氮率为无二氧化锰粉的2倍。
近日,氧化还原介质(RMS)被发现在有机和无机污染物的厌氧生物转化中起着重要的作用(范德齐和塞万提斯,2009)。
有一些研究集中在氧化还原介质的反硝酸化脱氮工艺中的作用。
阿兰达泰马瑞等人(2007)通过反硝化生物,包括蒽醌-2,6-二磺酸(AQDS),1,2-萘醌-4-磺酸酯e(NQS).2,6-disulfonate(AQDS), 2-羟基-1,4-萘醌,研究了同时转换硫化物和硝酸盐不同醌的氧化还原介质的影响。
他们证明,NQS必须使用硫化氢作为电子供体的最高硝酸盐还原率(荷兰达泰马瑞等人,2007)。
Guoet等人(2010)探讨了氧化还原介质催化脱氮工艺与蒽醌(AQ)由海藻酸钙固定。
他们还发现,加入500个蒽醌固定化珠会加速脱氮约两倍。
刘等(2012)证明,固定到功能聚合生物载体2-磺酸蒽醌(00.4mmol/L),可以提高脱氮率约1.5倍。
直到现在还没有关于RMS对厌氧氨氧化生物有影响的报告。
反硝化生物量最关键酶位于细胞膜或细胞膜外介质。
因此,RMS 可以接触这些酶和加快硝酸盐或亚硝酸盐的生物降解速率。
然而,厌氧氨氧化菌的关键酶是位于厌氧氨氧化菌膜内,并在其膜引起质子动力势和随后的由膜结合ATP酶合成ATP(图1中示出)。
从厌氧氨氧化菌外面进入厌氧氨氧化膜,RMS必须穿过细胞壁,细胞质膜,卵胞浆内膜和厌氧氨氧化膜以便与关键酶接触。
厌氧氨氧化菌膜结构由C18和C20脂肪酸组成,包括3个或5个线性级链环丁烷(sinningheet 等人,2002)。
它们被脂结合到甘油骨架或醚结合的烷基链(sinningheet等人,2005)。
因此,ladderane可能会阻止RMS和厌氧氨氧化膜内部的关键酶之间的接触。
本研究的目的是讨调查三种RMS对厌氧氨氧化生物活性的影响。
厌氧氨氧化菌的关键酶(肼脱氢酶硝酸还原酶、亚硝酸还原酶)上RMS的影响也进行了研究。
还讨论了在两个厌氧氨氧化生物和关键酶上的效果的可能机制。
所测试的RMS包括蒽醌-2,6-二磺酸(AQDS),2-羟基-1,4-萘醌(法)和蒽醌-2-羧酸(AQC)。
2.方法2.1. 微生物与资料媒体厌氧氨氧化污泥用于接种源自形反应器的厌氧氨氧化实验规模的实验室。
反应器的内径和高度分别为8和45厘米。
这种反应器在670天的操作的总脱氮(TN)率为8.0 kg-N/m3/d 。
KSU-1株(AB057453.1)的厌氧氨氧化菌约占种子的总生物量的70–75%。
在实验中使用的介质主要是由在(NH4)2SO4和亚硝酸钠中的铵和亚硝酸盐的形式。
该微量矿物质培养基的组成如范德格拉夫等人描述(1996)。
2.2 批量测试为了确定不同的RMS浓度对特殊厌氧氨氧化活性的影响,制定了七组是RMS从0到0.8毫米不同浓度的实验。
该实验是在七个120毫升含100毫升培养基瓶的血清瓶,每个包含厌氧氨氧化的生物质具有不同的RMS(MLVSS浓度2000 mg/L)。
生物样品取自反应器并在矿物质中洗涤三次,以除去残留的氮气。
将pH值调整至7.5,将温度保持在35± 1 °C左右的水域摇床。
摇动转速设定为150转的转速,保持生物量和媒体之间的充分接触。
血清瓶内容物与二氮的气体被洗清以除去溶解的氧。
初始NH4 -N和NO2 -N浓度都设定在50毫克/升。
特别厌氧氨氧化活性,随着时间流逝由在瓶里的氨和亚硝酸的浓度每单位生物量降低浓度曲线峰值改变。
使用无菌注射器每小时收集一次样品,并通过0.45lm孔径的膜吹扫来分析NH4 -N,NO2- N,NO3- N,和RMS浓度。
2.3分析方法Concentrations of nitrite and nitrate were determined by using on-exchange chromatography (ICS-1100, DIONEX, AR, USA) with an Ion Pac AS18 anion column after ltration with 0.22 lm poresize membranes. NH4-N, MLSS and MLVSS concentrations were measured according to the Standard Methods (APHA, 1995).硝酸盐和亚硝酸盐的浓度通过使用离子交换色谱测定法(ics-1100,Dionex,AR,USA)与0.22ml 孔径膜过滤PAC AS18阴离子柱。
NH4-N,MLSS和MLVSS浓度按标准方法测定(APHA,1995)。
pH值的测量是通过使用一个数字pH计(phs-25,雷磁公司,中国),而DO使用数字DO做计进行测量(YSI,模型55,美国)。
使用分光AQDS,AQC和规律浓度均在其最大吸光度采用分光光度法测量(k = 328,336,452 nm)用分光光度计(v-560uv /VIS分光光度计,日本)根据哈藤巴赫等人。
(2008)和劳等人。
(2002)2.4生物质提取物的制备及酶活性的测定从我们的实验室规模的反应器中量取5克(湿重)厌氧氨氧化生物质。
生物样品离心8000 rpm离心转,在4°C进行20 分钟,随后用磷酸钠缓冲溶液洗涤两次(20毫米,pH 7.0)。
洗涤后的沉淀在20毫升缓冲液溶解再沉淀后超声(225 W,4°C 30分钟,超声波处理器CPX 750,美国)。
细胞团通过离心(22000转)分离,在4°C进行30分钟。
将上清液储存在4°C作为蛋白质和酶活性测定细胞提取物。
蛋白质浓度的测量根据布拉德福德(布拉德福德法,1976),以牛血清白蛋白为标准。
据岛村等人描述的肼脱氢酶酶活性方法测定(2007),并且反应用分光光度计描绘为在550 纳米处增加在标注混合物中细胞色素C的吸光度(v-560紫外可见分光光度计,雅有限公司,日本)。
该混合物由100毫米磷酸钾缓冲液(pH 7.0),50lm马心脏细胞色素C(氧化型),酶解液适量,和25lm肼。
肼脱氢酶(HDH)活性表示为细胞色素减少/毫克蛋白/分钟。
硝酸还原酶(NAR)的活性测定Meincke等人(1992)通过测定亚硝酸盐消耗方法。
氯酸钠作为电子受体。
测定含有22 mm NaClO3和11毫米50毫米亚硝酸钠钾磷酸盐缓冲液,pH值7。
反应通过加入酶开始。
一个单位的酶活性被denedaslmol亚硝酸盐还原酶(NIR)的活性作为赛义德在Hira等人描述的方法的基础上(2012)以减少甲基紫(MV)作为电子供体。
反应混合物含有100 毫米磷酸钾缓冲液(pH7.0),MV(3毫米),亚硝酸钠(6毫米)和0.1毫升的生物质提取物在塞紧的4毫升试管内制备。
反应是由连二亚硫酸钠的注射开始(12毫米)。
酶活性被作为亚硝酸盐的还原。
所有的测定混合物要在35± 1°C进行。
2.5系统分析所有在本文中提出的数据是一式三份,实验的数据的平均值。
通过使用单因素方差分析每与邓肯的多范围检验(SPSS 19),和每次形成统计分析的P<0.05值被认为是统计学显著性。
英语原文Effects of quinoid redox mediators on the activity of anammox biomasshighlightsRMs addition depressed TN removal performance by anammox biomass. RMs could markedly enhance the key enzymes activities of anammox bacteria.RMs was inferred to play the role as Q/QH2 during anammox process. Ladderane as the main reason might block the contact between RMs and key enzymes.Article infoArticle history:Received 19 September 2013Received in revised form 31 October 2013Accepted 1 November 2013Available online 10 November 2013Keywords:AnammoxRedox mediatorHydrazine dehydrogenaseNitrite reductaseNitrate reductaseabstractThis study rst explored the relationship between the activity of anammox biomass/key enzymes and quinoid redox mediators, which were anthraquinone-2,6- disulfonate (AQDS),2-hydroxy-1,4-napthoqui-none (LAW) and anthraquinone-2-carboxylic acid (AQC). Experimental results demonstrated that the total nitrogen removal performance showed a downward trend with all three redox mediators (RMs) dosage increasing. For instance, when the AQC addition increased to 0.8 mM, the TN removal rate sharply reduced to 17.2 mg-N/gVSS/h, only about 20% of the control. This phenomenon might be caused by microbial poisoning with the extracellular RMs additions. Nevertheless, the crude hydrazine dehydroge-nase, nitrite reductase, and nitrate reductase activities were enhanced with RMs addition, about 0.6–3folds compared to the control experiments without RMs addition. The RMs was inferred to play the role as ubiquinol/ubiquinone (Q/QH2) during the anammox process. Furthermore, the specic ladderane membrane structure could block the contacting between RMs and the key enzymes inside anammox-some. This might be the mainreason for the contrary effects of RMs on anammox biomass and the key enzymes.1. IntroductionAnaerobic ammonium oxidation (anammox) process is now recognized as a novel and important process in biological nitrogen removal, which can directly convert NO 2 to N2 gas with NH4 under anaerobic conditions (Strous et al., 1999). Compared with the conventional biological processes (nitrication–denitrication),anammox process offers signicant advantages such as no demand for oxygen and organic carbon, low sludge production and reduced CO2 or N2O emissions (Opden Campet al., 2006).Recently, Tang et al. (2010) reported a very high nitrogen removal rate of 74.3–76.7 kg-N/m3/d in a lab-scale anammox UASB reactor, which demonstrated high potential of anammox process in biological nitrogen removal from wastewaters. However, such a high nitrogen removalrate (NRR) was achieved through the continuous addition of anammox seed sludge into the targeted reactor, in which the biomass concentration increased as high as 42.0–57.7 g-VSS/L (Tanget al.,2010). Furthermore, the relative long doubling time of anammox bacteria will also cause a longerstartup period and make the anammox system more vulnerable with low anammox bacteria abundance. Consequently, enhancing the bacterial activity of anammox biomass and further shortening the start-up period of anammox reactors are subjects of great interest and challenge.Researchers have made numerous efforts to increase the activity of anammox biomass by utilizing external eld energy (mag-netic eld, low intensity ultrasound) or adding some kinds of micronutrient. For instance, Liu et al. (2008) applied magnetic eld successfully to enhance the activity of anammox bacteria whereby the maximum nitrogen removal rate increased by 30% at magnetic value of 60.0 mT in long term. Similarly, Duan et al. (2011) demon-strated that total nitrogen (TN) removal rate of anammox bacteria increased by 25.5% by applying ultrasound intensity of 0.3 W/cm2 with the optimal irradiation time of 4 min, and this effect could last for about 6 days. Besides the application of external eld, Qiaoet al. (2012) demonstrated that the addition of MnO2 powder could also increase the nitrogen removal rate ofanammox biomass about 2 times as high as that without MnO2 powder addition.Recently, redox mediators (RMs) were found to play an important role in the anaerobic transformation of organic and inorganic contaminants (Van der Zee and Cervantes, 2009).There were a few studies focused on the role of redox mediators on nitrogen removal by denitrication process. Aranda-Tamaura et al.(2007) investi-gated the impacts of different quinoid redox mediators on the simultaneous conversion of sulphide and nitrate by denitrifying biomass, including anthraquinone-2,6- disulfonate (AQDS), 2-hy-droxy-1,4-naphthoquinone and 1,2-naphthoquinone-4-sulphonate(NQS).They demonstrated that NQS had the highest nitrate reduc- tion rate using sulphide as electron donor (Aranda- Tamaura et al.2007). Guo et al. (2010) explored the possibility of redox mediator catalyzing denitrication process with anthraquinone (AQ) immo-bilized by calcium alginate. They also found that addition of 500 anthraquinone immobilization beads would accelerate the denitri-fying rate about 2 times. Liu et al. (2012) demonstrated that anthraquinone-2-sulfonate (0.04mmol/L) immobilized into the functional electropolymerization biocarriers could increase the denitrication rate about 1.5 folds. Until now there was no report on the effects of RMs on anammox biomass. Most key enzymes of denitrifying biomass are located on the cell membrane or the cell membrane periplasma. Thus, RMs could contact these enzymes and accelerate the biodegradation rate of nitrate or nitrite. However, all the key enzymes of anammox bac-teria are located inside anammoxosome, and on its membrane giving rise to a proton-motive-force and subsequent ATP synthesis by Membrane-bound ATPases (shown in Fig.1). From the outside of anammox bacteria into anammoxosome, RMs must cross cell wall,cytoplasmic membrane, intracytoplasmic membrane and anammox some membrane in order to contact with the key enzymes.The ladderane of the anammoxosome membrane consist of C18 and C20 fatty acids including either 3 or 5 linearly concatenated cyclobutane rings (Sinninghe et al., 2002). They are ester bound to a glycerol backbone or ether bound as alkyl chains (Sinninghe et al., 2005). Therefore, theladderane might block the contacting between RMs and the key enzymes inside anammoxosome.The objective of this study was to investigate the effects of three kinds of RMs on the activity of anammox biomass. The effects of RMs on the key enzymes (hydrazine dehydrogenase nitrate reductase and nitrite reductase) of anammox bacteria were also studied.The possible mechanisms of effects on both anammox biomass and the key enzymes were also discussed. The tested RMs included anthraquinone-2,6-disulfonate (AQDS), 2-hydroxy-1,4-naphtho-quinone (LAW) and anthraquinone-2-carboxylic acid (AQC).2. Methods2.1. Microorganisms and feed mediaThe anammox sludge used for inoculation originated from a laboratory-scale anammox upow column reactor in our lab. The inner diameter and height of the column-type reactor were 8 and 45 cm, respectively. The working volume of this reactor was 2 Land continuously operated under 35 ±1 °C. The total nitrogen(TN) removal rate of this reactor reached 8.0 kg-N/m3/d during 670 days’operation.Anammox bacteria of KSU-1 strain(AB057453.1) accounted for about 70–75% of the total biomass in seed biomass. The media used in the experiments mainly consisted of ammonium and nitrite in the form of (NH4)2SO4 and NaNO2. The composition of the trace mineral medium was as described by vander Graaf et al. (1996).2.2. Batch experimentsIn order to ascertain the effects of different RMs concentrations on specic anammox activity, seven sets of batch experiments were conducted with the RM concentration from 0 to 0.8 mM.The tests were carried out in seven 120 ml serum vials containing 100 ml medium, each containing anammox biomass (MLVSS con-centration of 2000 mg/L) with varied RMs additions. Biomass sam-ples were taken from the reactors and washed three times with mineral medium to remove residual nitrogen. The pH was adjusted to 7.5 and the temperature was maintained at 35 ± 1 °C in a water bath shaker. The shaking speed was set at 150 rpm to keep the full contact between biomass and media. The serum bottle contents were purged with dinitrogen gas to remove dissolved oxygen. Ini-tial NH 4 -N and NO2 -N concentrations were set at 50 mg-N/L. Spe-cic anammox activity was estimated from the peak of the curve indicated by the decrease of ammonium and nitrite concentrations per unit biomass concentration in the vials as time lapsed. The samples were collected every hour using a sterile syringe and purged through 0.45 lm pore size membranes to analyze the NH4 -N, NO2 -N, NO3 -N and RMs concentrations.2.3. Analytical methodsConcentrations of nitrite and nitrate were determined by using ion-exchange chromatography (ICS-1100, DIONEX, AR, USA) with an IonPac AS18 anion column after ltration with 0.22lm pore size membranes. NH4-N, MLSS and MLVSS concentrations were measured according to the Standard Methods (APHA, 1995). pH measurement was done using a digital pH meter (PHS-25, Leici Company, China), while DO was measured using a digital DO meter(YSI, Model 55, USA). The concentrations of AQDS, AQC and LAW were measured spectrophotometrically at their absorbance maxi-mum (k = 328, 336 and 452 nm, respectively) using a spectropho- tometer(V-560UV/VIS Spectrophotometer,Jasco,Japan) according to Hartenbach et al. (2008) and Rau et al. (2002).2.4. Preparation of biomass extracts and determination of enzyme activity5 g (wet weight) anammox biomass was taken from our lab-scale reactor. The biomass samples were centrifuged at 8000 rpm at 4 掳C for 20 min followed by washing twice with sodium phos-phate buffer solution (20 mM, pH 7.0). The washed pellets were then resuspended in 20 ml of the same buffer and lysed by freezing and thawing followed by sonication (225 W, at 4 掳C for 30 min,Ultrasonic processor CPX 750, USA). Cell mass was separated by centrifugation (22 000 rpm), at 4 掳C for 30 min. The supernatant was stored at 4 掳C and used as cell extract in the determination of protein and enzyme activity. Protein concentration was measured according to the Bradford procedure (Bradford, 1976), using BSA as a standard. Enzyme activity of hydrazine dehydrogenase was according to the methods described by Shimamuraet al. (2007), and the reactions were depicted as an increase in the absorbance of cytochrome c at 550 nm in the standard mixture using a spectrophotometer (V-560 UV/VIS Spectrophotometer, Jas-co, Japan). The mixture consisted of 100 mM potassium phosphate buffer (pH 7.0),50lM horse heart cytochrome c (oxidized form),an appropriate amount of enzyme solution, and 25 lM hydrazine.The hydrazine dehydrogenase (HDH) activity was expressed as lmol of cytochrome c reduced/mg protein/min. Nitrate reductase (Nar) activity was assayed in accordance with the methods re-corded by Meincke et al. (1992) by measuring the nitrite consump-tion. NaClO3 was used as electron acceptor. Assays contained 22 mM NaClO3 and 11 mM NaNO2 in 50 mM potassium phosphate buffer, pH 7.0. The reaction was started by the addition of the en-zyme. One unit of enzyme activity was dened as lmol of nitrite oxidized/mg protein/min. Nitrite reductase (Nir) activity was as-sayed on the basis of the methods described by Hira et al. (2012)using reduced methyl viologen (MV) as electron donors. The reac-tion mixture containing 100 mM potassium phosphate buffer (pH 7.0), MV (3 mM), sodium nitrite (6 mM) and 0.1 ml biomass extracts was anaerobically prepared in a stoppered 4.0 ml cuvette. The reac-tion was started by the injection of sodium dithionite (12 mM). Aunit of enzyme activity was dened as lmol of nitrite reduced/mg protein/min. All the assay mixtures were incubated at 35 卤 1 掳 C 2.5. Statistical analysisAll the data presented in this paper were the mean values of data from triplicate experiments. Statistical analysis was per-formed by using one-way ANOVA with the Duncan’s multiple range test (SPSS 19.0) and values of p < 0.05 were considered to be statistically signicant.。
