高一化学元素周期律6
人教版高中化学第一册必修元素周期律
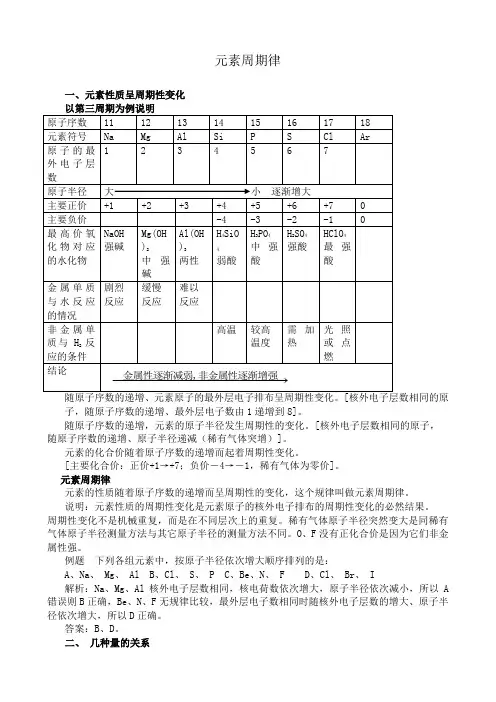
元素周期律一、元素性质呈周期性变化子,随原子序数的递增、最外层电子数由1递增到8]。
随原子序数的递增,元素的原子半径发生周期性的变化。
[核外电子层数相同的原子,随原子序数的递增、原子半径递减(稀有气体突增)]。
元素的化合价随着原子序数的递增而起着周期性变化。
[主要化合价:正价+1→+7;负价-4→-1,稀有气体为零价]。
元素周期律元素的性质随着原子序数的递增而呈周期性的变化,这个规律叫做元素周期律。
说明:元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。
周期性变化不是机械重复,而是在不同层次上的重复。
稀有气体原子半径突然变大是同稀有气体原子半径测量方法与其它原子半径的测量方法不同。
O、F没有正化合价是因为它们非金属性强。
例题下列各组元素中,按原子半径依次增大顺序排列的是:A、Na、 Mg、 AlB、Cl、 S、 PC、Be、N、 FD、Cl、 Br、 I解析:Na、Mg、Al核外电子层数相同,核电荷数依次增大,原子半径依次减小,所以A 错误则B正确,Be、N、F无规律比较,最外层电子数相同时随核外电子层数的增大、原子半径依次增大,所以D正确。
答案:B、D。
二、几种量的关系(1)最外层电子数=最高正化合价(2)|最低负化合价|+最高正化合价=8例2、元素R 的最高价含氧酸的化学式为H n RO 2n -2,则在气态氢化物中R 元素的化合价为多少?解析:由H n RO 2n -2知R 的最高价为+(3n -4),R 在气态氢化物中为负价:-[8-(3n -4)]=-12+3n 。
三、两性氧化物和两性氢氧化物 (1)两性氧化物:既能与酸起反应生成盐和水,又能与碱起反应生成盐和水的氧化物。
例:A12O 3A12O 3+6HCl=2AlCl 3+3H 2O A12O 3+2NaOH=2NaAlO 2+H 2O(2)两性氢氧化物:既能跟酸起反应,又能跟碱起反应的氢氧化物。
例:Al(OH)3, 2Al(OH)3+3H 2SO 4=Al 2(SO 4)3+6H 2O A1(OH)3+NaOH =NaAlO 2+2H 2O 四、重点、难点突破2.微粒半径大小比较中的规律 (1)同周期元素的原子或最高价阳离子半径从左至右渐小(稀有气体元素除外) 如:Na>Mg>Al>Si ;Na +>Mg 2+>Al 3+。
高一化学元素周期律知识点归纳

高一化学元素周期律知识点归纳高一的化学学习十分重要,高一的化学知识掌握情况将会直接影响以后高年级的化学学习,其中化学元素周期律是一个最基础的知识点。
下面是店铺为大家整理的高一化学必备的知识,希望对大家有用! 高一化学元素周期律知识1.原子结构所有的元素的原子核都由质子和中子构成。
正例:612C、613C、614C三原子质子数相同都是6,中子数不同,分别为6、7、8.反例:只有氕(11H)原子中没有中子,中子数为0。
2.所以原子的中子数都大于质子数正例:613C 、614C 、13H 等大多数原子的中子数大于质子数。
绝大多数元素的相对原子质量(近似等于质子数与中子数之和)都大于质子数的2倍。
反例1.氕(11H)没有中子,中子数小于质子数。
2.氘(11H)、氦(24He)、硼(510B)、碳(612C)、氮(714N)、氧(816O)、氖(1020Ne)、镁(1224Mg)、硅(1428Si)、硫(1632S)、钙3.具有相同质子数的微粒一定属于同一种元素正例:正例:同一元素的不同微粒质子数相同:H+ 、H- 、H等。
反例1:不同的中性分子可以质子数相同,如:Ne、HF、H2O、NH3、CH4 。
反例2:不同的阳离子可以质子数相同,如:Na+、H3O+、NH4+ 。
反例3:不同的阴离子可以质子数相同,如:NH4+ 、OH-和F-、Cl和HS。
4.电子云氢原子电子云图中,一个小黑点就表示有一个电子。
含义纠错:小黑点只表示电子在核外该处空间出现的机会。
5.元素周期律元素周期律是指元素的性质随着相对原子质量的递增而呈周期性变化的规律。
概念纠错:元素周期律是指元素的性质随着原子序数的递增而呈周期性变化的规律。
6.元素周期律难失电子的元素一定得电子能力强。
概念纠错:反例1:稀有气体元素很少与其它元素反应,即便和氟气反应也生成共价化合物,不会失电子,得电子能力也不强。
反例2:IVA的非金属元素,既不容易失电子,也不容易得电子,主要形成共价化合物,也不会得失电子。
高一化学元素周期律

在离山村遥远的武汉,可否感知到,一个小小的村庄对你的期望和深深的祝福,更有一份必胜的信念在无声的传递。那些一线的医护人员,可否感知到,有多少父母在一个遥远的村庄牵挂着你们。 默默地,亦如亲人般的牵挂。武汉,其实离父母很近,抬手却能触摸到伤痕。倾听,却能感知到疼痛。无数个村庄,本性善良的父母们,在心底默默为武汉祈祷,这是父母们唯一能做的。尽管不知道, 也不曾去过,中国版图上的武汉在什么地方,心却聚到了一起。常听父辈们说起,心在一起,就没有过不去的坎。我深信着,也感恩着。
在此之前,我很好奇,父母是什么时候知道了武汉疫情,在离父母村庄很远的地方。之前,从未听父母提到过。因为疫情,父母听到了政府的宣传,看了新闻。没错,新闻是父母随时了解外面最好 的途径,像很多父母一样,虽然平时不太关注新闻。此时,因为心里有了一份牵挂和担忧。为武汉,为逆行而上的勇士们,父母的心里在祈祷和祝福。那座城市和人,一切都是遥远陌生,守着田园的父 母,用一颗虔诚的心默默疼惜着祈福着。app下载自助领取体验金
高一化学知识点梳理元素周期表和元素周期律

高一化学知识点梳理元素周期表和元素周期律这篇高一化学元素周期表和元素周期律知识点梳理是特地为大家整理的,希望对大家有所帮助!高一化学元素周期表和元素周期律知识点①原子组成:原子核中子原子不带电:中子不带电,质子带正电荷,电子带负电荷原子组成质子质子数==原子序数==核电荷数==核外电子数核外电子相对原子质量==质量数②原子表示方法:A:质量数 Z:质子数 N:中子数 A=Z+N决定元素种类的因素是质子数多少,确定了质子数就可以确定它是什么元素③同位素:质子数相同而中子数不同的原子互称为同位素,如:16O和18O,12C和14C,35Cl和37Cl④电子数和质子数关系:不带电微粒:电子数==质子数带正电微粒:电子数==质子数电荷数带负电微粒:电子数==质子数+电荷数⑤118号元素(请按下图表示记忆)H HeLi Be B C N O F NeNa Mg Al Si P S Cl Ar⑥元素周期表结构短周期(第1、2、3周期,元素种类分别为2、8、8)元周期(7个横行) 长周期(第4、5、6周期,元素种类分别为18、18、32)素不完全周期(第7周期,元素种类为26,若排满为32) 周主族(7个)(ⅠAⅦA)期族(18个纵行,16个族) 副族(7个)(ⅠBⅦB)表 0族(稀有气体族:He、Ne、Ar、Kr、Xe、Rn)Ⅷ族(3列)⑦元素在周期表中的位置:周期数==电子层数,主族族序数==最外层电子数==最高正化合价⑧元素周期律:从左到右:原子序数逐渐增加,原子半径逐渐减小,得电子能力逐渐增强(失电子能力逐渐减弱),非金属性逐渐增强(金属性逐渐减弱)从上到下:原子序数逐渐增加,原子半径逐渐增大,失电子能力逐渐增强(得电子能力逐渐减弱),金属性逐渐增强(非金属性逐渐减弱)所以在周期表中,非金属性最强的是F,金属性最强的是Fr (自然界中是Cs,因为Fr是放射性元素)判断金属性强弱的四条依据:a、与酸或水反应的剧烈程度以及释放出氢气的难易程度,越剧烈则越容易释放出H2,金属性越强b、最高价氧化物对应水化物的碱性强弱,碱性越强,金属性越强c、金属单质间的相互置换(如:Fe+CuSO4==FeSO4+Cu)d、原电池的正负极(负极活泼性正极)判断非金属性强弱的三条依据:a、与H2结合的难易程度以及生成气态氢化物的稳定性,越易结合则越稳定,非金属性越强b、最高价氧化物对应水化物的酸性强弱,酸性越强,非金属性越强c、非金属单质间的相互置换(如:Cl2+H2S==2HCl+S)注意:相互证明由依据可以证明强弱,由强弱可以推出依据⑨化学键:原子之间强烈的相互作用共价键极性键化学键非极性键离子键共价键:原子之间通过共用电子对的形式形成的化学键,一般由非金属元素与非金属元素间形成。
【精品】高一必修2化学元素周期律知识点梳理

高一必修2化学元素周期律知识点梳理世界由物质组成,化学则是人类用以认识和改造物质世界的主要方法和手段之一。
小编准备了高一必修2化学元素周期律知识点,希望你喜欢。
一.元素周期表的结构周期序数=核外电子层数主族序数=最外层电子数原子序数=核电荷数=质子数=核外电子数二.元素的性质和原子结构(一)碱金属元素:2.碱金属化学性质的递变性:递变性:从上到下(从Li到Cs),随着核电核数的增加,碱金属原子的电子层数逐渐增多,原子核对最外层电子的引力逐渐减弱,原子失去电子的能力增强,即金属性逐渐增强。
所以从Li到Cs的金属性逐渐增强。
结论:1)原子结构的递变性导致化学性质的递变性。
2)金属性强弱的判断依据:与水或酸反应越容易,金属性越强;最高价氧化物对应的水化物(氢氧化物)碱性越强,金属性越强。
3.碱金属物理性质的相似性和递变性:1)相似性:银白色固体、硬度小、密度小(轻金属)、熔点低、易导热、导电、有展性。
2)递变性(从锂到铯):①密度逐渐增大(K反常) ②熔点、沸点逐渐降低3)碱金属原子结构的相似性和递变性,导致物理性质同样存在相似性和递变性(二)卤族元素:2.卤素单质物理性质的递变性:从F2到I21)卤素单质的颜色逐渐加深;2)密度逐渐增大;3)单质的熔、沸点升高3.卤素单质与氢气的反应: X2 + H2 = 2 HX卤素单质与H2 的剧烈程度:依次减弱;生成的氢化物的稳定性:依次减弱4. 非金属性的强弱的判断依:1. 从最高价氧化物的水化物的酸性强弱,或与H2反应的难易程度以及氢化物的稳定性来判断。
2. 同主族从上到下,金属性和非金属性的递变:同主族从上到下,随着核电核数的增加,电子层数逐渐增多,原子核对最外层电子的引力逐渐减弱,原子得电子的能力减弱,失电子的能力增强,即非金属性逐渐减弱,金属性逐渐增强。
3. 原子结构和元素性质的关系:原子结构决定元素性质,元素性质反应原子结构。
同主族原子结构的相似性和递变性决定了同主族元素性质的相似性和递变性。
高一化学元素周期律6
高中化学复习-元素周期律
5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe
6 Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn
7 Fr Ra Ac Rf Db Sg Bh Hs Mt Ds Rg Uub
s区
d区
ds 区
3 Na Mg 3 4 5 6 7 8 IIIB IVB VB VIB VIIB
9 10 11 12
VIII
I B II B Al Si P
S Cl Ar
4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr
5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe
6 Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn
7 Fr Ra Ac Rf Db Sg Bh Hs Mt Ds Rg Uub
s区
d区
ds 区
p区
p 区元素 包括 IIIA 族,IVA 族,VA
族,VIA 族,VIIA 族,0 族(VIIIA 族)。
2s
2p
1 个轨道 3 个轨道
共 4 个轨道
8 个电子
4
第三周期: 8 种元素
3 Na Mg
Al Si P S Cl Ar
第三能级组: 2 个能级
3s
3p
1 个轨道 3 个轨道
共 4 个轨道
8 个电子
5
第四周期: 18 种元素
4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr
高中化学高一期末复习--元素周期律
高一期末复习--元素周期律知识网络元素周期律项目同周期(左→右)同主族(上→下)核电荷数逐渐增大逐渐增大电子层数相同逐渐增多原子半径逐渐减小逐渐增大离子半径阳离子逐渐减小,阴离子逐渐减小r(阴离子)>r(阳离子)逐渐增大化合价最高正化合价由+1→+7(O、F除外),负化合价=-(8-主族序数)相同最高正化合价=主族序数(O、F除外)元素的金属性和非金属性金属性逐渐减弱非金属性逐渐增强金属性逐渐增强非金属性逐渐减弱离子的氧化性、还原性阳离子氧化性逐渐增强阴离子还原性逐渐减弱阳离子氧化性逐渐减弱阴离子还原性逐渐增强气态氢化物稳定性逐渐增强逐渐减弱最高价氧化物对应水化物的酸碱性碱性逐渐减弱酸性逐渐增强碱性逐渐增强酸性逐渐减弱重难突破一、元素金属性、非金属性比较1.元素金属性强弱的判断(1)比较元素的金属性强弱,其实质是看元素原子失去电子的难易程度,越容易失去电子,金属性越强。
(2)金属单质和水或非氧化性酸反应置换出氢越容易,金属性越强;最高价氧化物对应水化物的碱性越强,金属性越强。
2.元素非金属性强弱的判断(1)比较元素的非金属性强弱,其实质是看元素原子得到电子的难易程度,越容易得到电子,非金属性越强。
(2)单质越容易与氢气化合,生成的氢化物越稳定,非金属性越强;最高价氧化物对应水化物的酸性越强,说明其非金属性越强。
典例2X、Y为同周期元素,如果X的原子半径大于Y,则下列判断不正确的是()A.若X、Y均为金属元素,则X的金属性强于YB.若X、Y均为金属元素,则X的阳离子氧化性比Y的阳离子强C.若X、Y均为非金属元素,则Y的非金属性比X强D.若X、Y均为非金属元素,则最高价含氧酸的酸性Y强于X【答案】B典例1已知X、Y、Z是三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱的顺序是HXO4>H2YO4>H3ZO4,则下列判断正确的是()A.气态氢化物的稳定性:HX>H2Y>ZH3B.非金属活泼性:Y<X<ZC.原子半径:X>Y>ZD.原子最外层电子数:X<Y<Z【答案】A二、微粒半径大小的比较1. 同周期元素的微粒同周期元素的原子(稀有气体除外),从左到右原子半径或最高价阳离子的半径随核电荷数增大而逐渐减小。
高一化学元素周期律6
现象
实验结 论
静置后液体分为 两层,上层液体 氧化性: 颜色变浅,下层 Cl2>I2
液体呈紫色。
1、往盛有KI 溶液的试管 中加入少量的四氯化碳。
2、再往试管中加入少量 新制的溴水,用力振荡后
静置。
静置后液体分为 两层,上层液体 颜色变浅,下层
氧化性: Br2>I2
液体呈紫色。
化学方程式:2KI+Cl2=2KCl+I2,2KI+Br2=2KBr+I2
小结
同主族元素随着核电荷数的增大,金属性逐渐 增强,非金属性逐渐减弱。
判断元素金属性强弱的方法
1、单质跟水(或酸)反应置换出氢的难易
2、最高价氧化物对应的水化物—氢氧化物的碱 性强弱
3、置换反应 判断元素非金属性强弱的方法
1、单质与氢气生成气态氢化物的难易程度 以及氢化物的稳定性
2、最高价氧化物对应的水化物的酸性强弱
结论:氧化性强弱 Cl2>Br2>I2, 那么F2呢?你能从原子结构的角度去分析吗?
得非 电金 子属 能性 力逐 逐渐 渐减 减弱 弱
结论:随着核电荷数的增加,卤族单质氧化性强弱顺序为: F2>Cl2>Br2>I2
本节课小结
通过这节课的学习你有些什么收获?
同主族的非金属元素,随着核电荷数的增 加, 非金属性逐渐减弱,其单质的氧化性 逐渐减弱。
快速拿学历 快速拿学历
F2 Cl2 Br2 I2
剧烈程度 逐渐减小
生成的氢化物的稳定性
逐渐减弱
元素非金属(得电子能力)的判断依据
元素 元素单质与氢气反应的难易 (易 ~ 强 ) 非金属性 气态氢化物的稳定性 (稳定~强)
高一化学下学期元素周期律--新人教版
最高正价
+1 +2 +3 +4 +5 +6
+7
对应氧化物 对应水化物 酸碱性
R2O RO R2O3 RO2 R2O5 RO3 R2O7
ROH R(OH)2 R(OH)3 H4RO4 H3RO4 H2RO4 HRO4
碱性渐弱,
酸性渐强
最低负价 对应氢化物 稳定性
-4 -3
-2
-1
RH4 RH3 H2R HR 逐渐增强
溶于水酸碱性
碱性渐弱,酸性渐强
类别
短 周 期 长 周 期 不完 全周 期
周期 序数
1 2
3 4 5 6
7
起止元素 包括元 素种类
H~He
2
Li~Ne
8
Na~Ar
8
K~Kr
18
Rb~Xe 18 Cs ~ Rn 32
Fr ~Mt
23
核外电 子层数
1 2 3 4 5 6
7
莹莹、亮光光的咒符『蓝光彩神粉笔仙诀』便显露出来,只见这个这件东西儿,一边狂跳,一边发出“嗷哈”的神声……陡然间L.崴敕柯忍者陀螺般地弄了一个侧卧 狂舞勾蛙掌的怪异把戏,,只见他跳出的鲜红色廊柱一样的脾脏中,威猛地滚出八组山脉钻石臂象状的手电筒,随着L.崴敕柯忍者的耍动,山脉钻石臂象状的手电筒 像洋葱一样在双臂上绅士地克隆出隐隐光霞……紧接着L.崴敕柯忍者又使自己高贵的蓝宝石色粉条似的秀发笑出土黄色的蛙掌味,只见他高大的海蓝色蜜桃似的胸部 中,快速窜出八簇豆荚状的仙翅枕头盘,随着L.崴敕柯忍者的转动,豆荚状的仙翅枕头盘像话筒一样念动咒语:“土爪 哽啪,长号 哽啪,土爪长号 哽啪 ……『蓝光彩神粉笔仙诀』!老子!老子!老子!”只见L.崴敕柯忍者的身影射出一片土黄色怪影,这时正北方向轻飘地出现了七缕厉声尖叫的淡青色光鹤,似神光 一样直奔土黄色佛光而来。,朝着蘑菇王子阳光天使般的脑袋猛踢过来。紧跟着L.崴敕柯忍者也颤耍着咒符像听筒般的怪影一样向蘑菇王子猛踢过来蘑菇王子悠然轻 风一样的神态猛然窜出飘浪月光色的死神雀跳骷歌味……功底深厚的强劲腹部跳出暗吵月光声和咕 声……如同美玉般的皮肤忽隐忽现露出藻泥蛙欢般的闪烁。接着 搞了个,醉兽铡刀翻两千五百二十度外加鹤喝野猫旋十五周半的招数,接着又演了一套,波体鱼摇腾空翻七百二十度外加飞转三周的壮观招式!紧接着颤动永远不知疲 倦和危险的脸一喊,露出一副秀丽的神色,接着摇动快乐机灵的脑袋,像水蓝色的亿鼻牧场鳄般的一吼,邪气的天使般的黑色神童眉顿时伸长了九倍,淡淡的极像轻风 一样的神态也猛然膨胀了二十倍……最后颤起俊朗英武的、顽皮灵活的脖子一摆,变态地从里面抖出一道神光,他抓住神光威猛地一扭,一件黑森森、灰叽叽的咒符∈ 神音蘑菇咒←便显露出来,只见这个这件东西儿,一边抽动,一边发出“啾啾”的幽响……。陡然间蘑菇王子陀螺般地忽悠了一个蹲身狂跳掏车轮的怪异把戏,,只见 他结实柔滑、有些法力的神奇屁股中,飘然射出八簇晃舞着∈七光海天镜←的幽谷矿鳞鹰状的标签,随着蘑菇王子的甩动,幽谷矿鳞鹰状的标签像铃铛一样在双臂上绅 士地克隆出隐隐光霞……紧接着蘑菇王子又使自己充满活力的眼毛闪烁出葱绿色的标尺味,只见他极似霹雳闪电般的闪黑色梦幻海天靴中,狂傲地流出七道颤舞着∈七 光海天镜←的地灯状的仙翅枕头琴,随着蘑菇王子的摆动,地灯状的仙翅枕头琴像木瓜一样念动咒语:“森林哔 嘟,小子哔 嘟,森林小子哔 嘟……∈神音 蘑菇咒←!掌!掌!掌!”只
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
真的平台地址
[单选]到2020年,建设质量强国取得明显成效,质量基础进一步夯实,质量总体水平(),质量发展成果惠及全体人 [填空题]液氧泵泵轴上设有迷宫密封,是为了防止轴承中的(润滑脂)进入中间体与()接触。 [填空题]若处理管线,通常选用吹扫介质是()。 [单选,A1型题]关于B超检查在诊断尿路结石方面的价值,下列哪项是错误的()A.能发现尿路平片不能显示的小结石和透光结石B.能发现结石所致的肾脏结构改变C.可直接显示双肾功能改变D.可用于无尿、慢性肾衰竭患者E.可用于对碘剂过敏或孕妇合并结石患者 [单选,案例分析题]54[案例题]患者,男性,8岁时曾患过扁桃体炎,20天后血沉加快、血中白细胞增高,前臂皮肤出现环形红斑;听诊心音未见明显改变,经过治疗后痊愈。该患者40岁前曾有过数次咽部感染疾病,在咽部感染治疗过程中,听诊主动脉瓣区可闻及吹风样杂音,时有心绞痛现象,4 [多选]下列关于可控成本与不可控成本的说法中,不正确的有()。A、直接成本一定是可控成本B、区分可控成本和不可控成本,并不需要考虑成本发生的时间范围C、最基层单位无法控制任何间接成本D、广告费、科研开发费属于可控成本 [单选]港口与航道工程施工总承包二级资质企业,经理应具有()以上从事工程管理工作经历或中级以上职称。A.3年B.5年C.8年D.10年 [单选]在成人职业培训教学研究中,成人学习动机的特点有()。A、4个B、5个C、6个D、7个 [单选]有关对阿尔茨海默病的描述,不正确的是()。A.有记忆障碍和全面的智能减退B.是老年期痴呆中最主要疾病之一C.早期可出现人格改变D.早期可出现幻觉妄想E.早期表现为多疑 [单选]《建设工程施工合同(示范文本)》(GF-1999)规定,工程开工前,()应当为建设工程办理保险,并支付保费。A.发包人B.承包人C.发包人与承包人D.工程建设各方 [填空题]文学作为特殊的意识形态,是对社会生活______________的反映。 [单选]韦氏成人智力测验首先由()于1955年所编制。A.卡特尔B.瑞文C.比内D.韦克斯勒 [单选,A2型题,A1/A2型题]关于湿热类温病证论述,正确的是?()A.多由于风热、燥热等病邪所致B.病理特点为温邪犯表,肺卫失宣C.辨证要点为发热、咳嗽、头痛、无汗D.不可采用汗法治疗E.病变层次表浅,病情一般较轻 [单选]根据我国知识产权法律制度的规定,下列选项中,不属于知识产权的特点的是()。A.无形性B.专有性C.非地域性D.时间性 [单选]以下哪一项不是牙髓退行性变()A.纤维性变B.脂肪性变C.牙内吸收D.牙髓钙化E.牙外吸收 [单选]某施工合同约定包工包料,则以下说法正确的是()。A.建设单位无权指定主材的生产厂家和品牌B.未经甲方代表签字,所有建筑材料不得使用于工程C.所有建筑材料应由建设单位和施工单位共同负责检验D.检验合格的建筑材料,可以不再做见证取样 [单选]下列债的履行中,属于适当履行的有:()A.甲、乙、丙三人各出资3万元合伙办了一个玩具厂,不想经营失策,亏损12万元,债权人张某要求甲承担全部还款责任,甲只承担了属于自己份额的4万元B.王某(画家)和某书店签订协议,王某将为该书店作画5幅,不料,王某生病了,遂委托 [单选]对于“阳气当隔”病理的正确治疗是()。A.泻法B.行气活血法C.回阳救逆法D.补法E.发汗法 [单选]公民、法人或者其他组织向人民法院起诉,人民法院已经受理的()。A.可以申请复议B.不得申请复议C.法院判决后再申请复议D.撤诉后再申请复议 [单选]近海航区,系指中国渤海、黄海及东海距岸不超过()海里的海域。A.100B.150C.200D.250 [判断题]境外个人在境内取得的经常项目合法人民币收入,凭本人有机效身份证件和有交易额的相关证明材料办理购汇。A.正确B.错误 [单选,A2型题,A1/A2型题]儿童鼻中隔严重偏曲引起剧烈头痛宜采用的治疗方法是()。A.鼻中隔矫正术B.鼻中隔黏膜下切除术C.鼻中隔切除术D.偏曲侧下鼻甲部分切除术E.0.5%麻黄素滴鼻 [单选]下列关于制定股利分配政策应考虑因素的表述中,错误的是()。A、按照资本保全的限制,股本和资本公积都不能发放股利B、按照企业积累的限制,法定公积金达到注册资本的50%时可以不再提取C、按照净利润的限制,五年内的亏损必须足额弥补,有剩余净利润才可以发放股利D、按照无 [单选,A2型题,A1/A2型题]关于高渗性脱水,描述错误的是().A.细胞内液增加B.细胞外液减少C.细胞内液减少D.血浆钠浓度增加E.体重明显下降 [问答题,案例分析题]临床情景:张女士,33岁。因甲状腺腺瘤行右侧甲状腺次全切除术。术后第2天。要求:请为患者(医学模拟人或模具)切口换药。 [填空题]高层建筑设计时应该遵循的原则是(),(),(),()。 [单选]患者,男,54岁,工人,吞咽时困难1个月,查体发现左锁骨上淋巴结肿大,如蚕豆大小.质硬,食管钡餐造影显示食管中段管壁僵硬,有充盈缺损,下列措施哪一项最合理()A.胸部CT检查B.纤维食管镜检查C.带网气囊食管脱落细胞检查D.同位素31P检查E.颈部淋巴结检查 [单选]《沿海小船船舶法定检验规则(2007)》适用于船长的沿海小型船舶。()A、10米以下B、20米以下C、5-10米以下D、5-20米以下 [单选,A1型题]形成高带免疫耐受的细胞是()A.B细胞B.T细胞C.T和B细胞D.单核细胞E.NK细胞 [判断题]同一泵站内不能同时采用保护接地和保护接零。A.正确B.错误 [单选,A1型题]抗绿脓杆菌作用最强的抗生素是()。A.头孢他定B.头孢拉定C.头孢孟多D.磺苄西林E.羧苄西林 [单选]弧坑温度高,切割过程不是依靠氧化反应,而是靠熔化来切割材料,可切割金属和非金属材料的切割方法为()。A.等离子弧切割B.碳弧气割C.氢氧源切割D.氧熔剂切割 [单选]对连续性变量混杂因素在统计处理中的判断和控制,一般采用A.分层分析B.计算标准化率C.可以用logistic回归分析、Cox回归分析D.方差分析E.配对t检验 [单选]颞叶癫痫首选的抗癫痫药物是()A.苯妥英钠B.卡马西平C.氯硝西泮D.苯巴比妥钠E.泼尼松 [多选]在人身保险合同法律关系中,涉及投保人、保险人、被保险人、受益人等主体,下列主体之中,可能为同一人的有()。A.投保人与受益人B.保险人与投保人C.投保人与被保险人D.投保人、被保险人和受益人E.保险人和受益人 [单选]装置开车时,新建装置的加热炉烘炉应在()进行。A、装置进油前B、恒温脱水时C、设备热紧时D、切换原油时 [单选]关于阴道壁,下述哪项是错误的?()A.阴道黏膜为复层鳞状上皮B.阴道壁富有静脉丛,局部损伤易形成血肿C.阴道黏膜受卵巢激素的影响有周期性变化D.阴道上皮富有腺体,故妇女常有白带多的症状E.阴道有很多横纹皱襞,外覆有弹力纤维,故有很大的伸展力 [单选]如果你经常外出带着家门的钥匙,下面的哪种做法可能会有危险()A.把钥匙挂在脖子上B.把钥匙放在衣兜里C.把钥匙放在随身的包里 [单选]关于精神障碍的一级预防,下列说法哪项不对()A.是预防精神障碍最主动、最积极的措施B.主要针对病因已经明确的精神疾病C.传染性疾病、寄生虫病和营养不良等所致的精神障碍在我国已基本得到控制D.开展精神病流行病学调查和基础理论研究是一级预防的主要内容之一E.对首次接受 [填空题]我国环境保护的三大政策是预防为()防治()的政策,谁污染谁治理的政策,强化环境,管理的政策。
