氢键
化学反应机理中的氢键作用

化学反应机理中的氢键作用化学反应机理是指描述化学反应过程中原子、离子或分子之间的变化和相互作用的过程。
其中,氢键作用是一种重要的相互作用方式,它对于很多化学反应的发生和速率都具有关键的影响。
本文将深入探讨化学反应机理中的氢键作用。
1. 氢键的定义和特点氢键是指氢原子与带有电负性原子的非金属原子间的相互作用力。
在化学反应中,氢键的形成主要依赖于氢原子与其他原子间的电负性差异。
具体而言,当氢原子与电负性原子(如氧、氮、氟等)之间形成较强的电荷分布不平衡时,氢键就会被形成。
氢键具有以下几个特点:1.1 高方向性:氢键通常以直线形式存在,氢原子位于电负性原子的延长线上。
这种直线排列使得氢键具有明显的方向性。
1.2 弱相互作用:相对于共价键和离子键,氢键的结合能较低。
这一特性使氢键能够在一些具有较小能量阈值的反应中发挥作用。
1.3 长程作用:氢键的作用距离较长,通常在0.15到0.35纳米之间。
这种作用距离决定了氢键对于反应物和产物之间的相互作用的范围。
2. 氢键在化学反应机理中的功能2.1 改变反应物结构:氢键能够通过在反应物分子之间的形成和断裂过程中改变它们的空间结构。
这种结构的调整可以使得分子间的相对位置和取向产生变化,为反应提供必要的条件。
2.2 调控反应速率:氢键的形成和断裂过程通常涉及能量变化。
在反应物转化为产物的过程中,氢键能够通过提供或吸收能量来影响反应的速率。
这种调控作用在很多化学反应中起着重要的作用。
2.3 形成反应中间体:在某些反应中,氢键能够促使反应物形成稳定的反应中间体。
这些中间体对于进一步反应的进行起到关键的催化作用。
3. 实例分析:酶催化反应中的氢键作用酶是生物体内一种重要的催化剂,它能够促进生物体内多种反应的进行。
在酶催化的化学反应中,氢键起着重要的作用。
以酶催化的酯羧化反应为例,该反应需要氢键的参与。
在反应中,酶通过与底物分子形成氢键的方式,调整底物的构象,使得底物更容易发生酯羧化反应。
氢键

氢键(hydrogenbond),电负性原子和与另一个电负性原子共价结合的氢原子间形成的键,与电负性强的原子连接的氢原子趋向带部分正电。
在这种形式的键中,氢原子在两个电负性原子间不等分配。
与氢原子共价结合的原子为氢供体,另一个电负性原子为氢受体。
表示为X-H…Y氢键(hydrogenbond),电负性原子和与另一个电负性原子共价结合的氢原子间形成的键,与电负性强的原子连接的氢原子趋向带部分正电。
在这种形式的键中,氢原子在两个电负性原子间不等分配。
与氢原子共价结合的原子为氢供体,另一个电负性原子为氢受体。
表示为X-H…Y∙其中X-H是强极性键,X带负电荷,H带正电荷∙·氢键是由两个电负性都很高的元素(例如F、O、N等)通过H原子形成三中心四电子键∙H和Y上的孤对电子产生强烈的吸引作用而形成氢键∙氢键的键能一般在40kJ·mol以下,比一般共价键键能小得多∙氢键的键长指X和Y间的距离在X——H……Y中:H—与电负性大、半径小的元素(X)成强极性共价键的氢;Y—有孤对电子、电负性大、半径小的元素(F、O、N)。
于是在H与Y间以静电引力结合,成第二键,称氢键,较弱。
如HF、H2O中氢键的形成:氢键也可在分子内形成。
(1)弱作用力,与分子间力相当;小于40kJ·mol-1 。
(2)有方向性(Y的孤对电子有方向);有饱和性(H+ 排斥可能与Y电子云相吸引的其它H+)。
某些物质的物理性质和化学性质在很大程度上受到氢键的影响,如物质的熔点、沸点、溶解度和酸碱性等例如:冰中每个H2O 水分子都按四面体方向参与形成4个O-H…O氢键,水的沸点和冰的熔点都要比同系物高得多。
氢键
氢键的键参数主要有键长和键能
氢键的键长一般定义为X—H…Y的长度, 取决于共价键的键长以及Y的半径
氢键的键能一般不超过40KJ 强度:化学键>>氢键>范德华力
5.氢键的应用:
⑴比较物质的熔沸点 (一般分子晶体比较熔沸点时先看氢键再比 较相对分子质量) (注:分子内氢键使物质熔沸点降低,分子 间氢键使物质熔沸点升高)
氢键具有方向性
3.一个H2O分子能形成两个氢键,说明氢键具有饱和性 H2O的熔沸点高于HF的原因是因为一个H2O分子能形成 两个氢键,而一个HF分子能形成一个氢键
结合氢键的饱和性和方向性分析以下问题
3.氢键
活动与探究 3 观察分析 下图液 态水分 子、固 态水分 子中氢 键的形 成情况 及下 表 中的数据 ,回答 下列问 题: (1 )为什 么水结 成冰之 后体积 膨胀? (2)为什么水在 4 ℃时密度最大?
⑵氢键的存在使物质的溶解度增大 (比较溶解度时,考虑相似相溶、氢键与水 反应三个方面,例如NH3) (3)影响物质密度。水结冰时密度变化
(4)硬度:冰的硬度一般大于其他分子晶体
1.整理氢键的形成条件,应用;利用 氢键解释生活中的常见现象
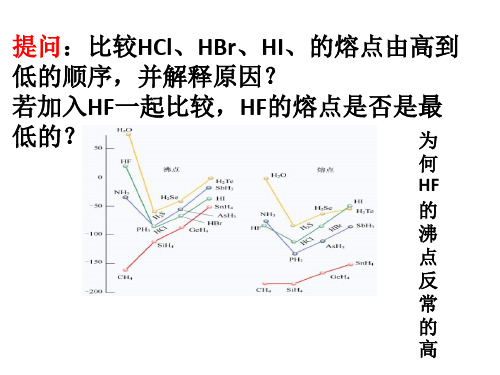
2.提问:(1)比较图中熔沸点高低判定 主族和物质 (2)为何H2O比H2S稳定
液态水中的氢键
水的 水的 水在 0 ℃
熔点 ℃
沸点 ℃
时密度 (g·mL-1)
0.00 100.00 0.999 841
冰的晶体结构
水在 4 ℃ 水在 20 ℃
时密度
时密度
(g·mL-1) (g·mL-1)
1.000 000 0.998 203
水在 100 ℃ 时密度
氢键的形成条件及特点

氢键是指在分子中两个原子之间所形成的特殊类型的化学键。
氢键是一种较弱的化学键,它的形成条件是两个原子中必须同时存在氢原子。
氢键的形成条件一般有以下几点:
1.两个原子中必须同时存在氢原子,例如水分子中的氢键。
2.两个原子中必须存在具有高度的电负性的原子,例如氧原子。
3.两个原子之间的距离要较近,通常在0.1-0.3nm之间。
氢键具有以下几个特点:
1.氢键是一种非常弱的化学键,其能量一般在2-40kJ/mol之间。
2.氢键是一种相对性质,它的强度受到周围分子的影响。
3.氢键的形成有利于提高分子的稳定性,使分子更加稳定。
4.氢键对提高液体的沸点、降低气体的扩散性有一定的影响。
氢键名词解释

氢键名词解释
氢键是一种分子间相互作用的力,主要存在于含有氢原子的分子与带有高电负性原子(如氧、氮和氟)的分子之间。
氢键是一种相对较强的作用力,可以导致分子的聚集和结合。
氢键是靠氢原子与带有高电负性原子(通常是氧、氮、氟)之间的电负性相互作用而形成的。
在氢键中,氢原子与较电负的原子发生极性吸引,形成了一个非共价的化学键。
氢键的强度比氢键所涉及的化学键要弱,但比一般的分子间力要强。
氢键对于物质的许多性质和现象具有重要的影响。
首先,氢键能够引起分子间的吸引力,使得物质具有较高的熔点和沸点,从而提高物质的稳定性。
例如,水的氢键导致其熔点和沸点都相对较高,这使得水在地球表面下常见的液态状态存在。
其次,氢键也对物质的溶解性起着重要作用。
许多物质的溶解性取决于其与溶剂之间氢键的形成与破坏。
此外,氢键还能够影响分子的空间结构和化学反应的速率。
许多生物分子的结构和功能都受到氢键的影响。
氢键在生物学中起着重要的作用。
许多生物大分子(如蛋白质和核酸)的稳定结构和功能都依赖于氢键的形成和破坏。
例如,蛋白质的二级结构(如α螺旋和β折叠)是通过氢键在蛋白质链的不同部分之间形成的。
此外,DNA双螺旋结构的稳定性
也是由氢键维持的。
通过调节氢键的形成和破坏,生物体可以调控分子的结构和功能,实现生命的各种活动。
总之,氢键是一种分子间相互作用力,通过氢原子与带有高电
负性原子之间的相互作用而形成。
它对物质的聚集、结合、溶解性、空间结构和化学反应具有重要影响,并在生物学中发挥着重要作用。
氢键的结构简式

氢键的结构简式通常用X-H…Y来表示,其中:
- X是带有孤对电子并且电负性较大的原子,如氮(N)、氧(O)或氟(F);
- H是与X共享电子形成共价键的氢原子;
- … 表示氢原子与其相邻的高电负性原子Y之间存在着显著的静电相互作用,这种作用力是由氢原子上的正电荷部分与Y原子上的孤对电子云之间的吸引形成的;
- Y同样也是电负性大、半径小的原子,它可以与上述X原子不同,也可以相同,比如在水分子(H2O)中,两个水分子之间可以形成氢键,其中一个水分子中的氢原子作为供体,另一个水分子中的氧原子作为受体。
因此,一个具体的氢键结构简例如下:
O-H…O
这里表示的是一个水分子中的氢原子通过氢键与另一个水分子中的氧原子相连的情况。
氢键的表征

氢键的表征
氢键是指由一对原子之间的电荷作用形成的相互作用力,其中一个原子是氢原子,它与一个电负性较高的原子(如氮、氧、氟等)的非共价电子对形成键。
氢键是分子间相互作用力的一种,通常具有以下特征:
1. 氢键是静电作用力,只有在极性分子之间才会出现。
2. 氢键的作用力强度较小,通常在10~40kJ/mol之间。
3. 氢键的方向性非常强,因此在分子内部和分子之间可以形成非常复杂的结构。
4. 氢键的作用距离通常在0.1~0.4nm之间,比共价键要长得多。
5. 氢键的能量通常比分子间的范德华作用力要强,但比离子键要弱。
6. 氢键对生命的重要性非常大,许多生物分子的结构和功能都与氢键的存在密切相关。
★氢键

氢键在HX熔、沸点变化出现反常,这是因除分子间力外,还有氢键。
1、氢键的形成氢键的生成,主要是由偶极与偶极之间的静电吸引作用。
当氢原子与电负性甚强的原子(如A)结合时,因极化效应,其键间的电荷分布不均,氢原子变成近乎氢正离子状态。
此时再与另一电负性甚强的原子(如B)相遇时,即发生静电吸引。
因此结合可视为以H离子为桥梁而形成的,故称为氢键。
⑴氢键的表示:A─H---B其中A、B是氧、氮或氟等电负性大且原子半径比较小的原子。
生成氢键时,给出氢原子的A—H基叫做氢给予基,与氢原子配位的电负性较大的原子B 或基叫氢接受基,具有氢给予基的分子叫氢给予体。
把氢键看作是由B给出电子向H配对,电子给予体B是氢接受体,电子接受体A─H是氢给予体。
⑵强度用键能表示⑶键能:指A─H---B分解成A-H和B-H所需的能量。
一般在42kJ·mol-1以下,比共价键键能小很多,而与分子间力更接近。
例如H2O中,=463 kJ·mol-1,而氢键键能仅为18.83 kJ·mol-1。
⑷键长:指A原子中心到B原子中心的距离氢键的形成,既可以是一个分子在其分子内形成,也可以是两个或多个分子在其分子间形成。
例如:水扬醛和2—甲基—2—芳氧基丙酸分别在其分子内形成了氢键,而氟化氢和甲醇则是在其分子之间形成氢键。
OHθHOE-氢键并不限于在同类分子之间形成.不同类分子之间亦可形成氢键,如醇、醚、酮、胺等相混时,都能生成类似O一H…O状的氢键。
例如,醇与胺相混合即形成下列形式的氢键:一般认为,在氢键A—H…B中,A—H键基本上是共价键,而H…B键则是一种较弱的有方向性的范德华引力。
因为原子A的电负性较大,所以A—H的偶极距比较大,使氢原子带有部分正电荷,而氢原于又没有内层电子,同时原子半径(约30pm)又很小,因而可以允许另一个带有部分负电何的原子B来充分接近它,从而产生强烈的静电吸引作用,形成氢键。
2、氢键的特点⑴氢键的饱和性由于氢原子特别小而原子A和B比较大,所以A—H中的氢原子只能和一个B原子结合形成氢键。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
A. 每个水分子内含有两个氢键
B. 在所有的水蒸气、水、冰中都含有氢键
C. 分子间能形成氢键,使物质的熔沸点升高
D. HF稳定性很强,是因为其分子间能形成氢键
小 结:
范德华力 定义
分子间普遍 存在的作用 力
氢键
已经与电负性很强的 原子形成共价键的氢 原子与另一分子中电 负性很强的原子之间 的作用力 分子间或分子内氢原子与电 负性很强的F、O、N之间 较强 对某些物质(如水、氨 气)的溶解性、熔沸点 都产生影响
(2)如果溶质与溶剂之间能形成氢键,则溶解度增大,
且氢键越强,溶解性越好。
对比:丙醇、丙三醇;
乙醇、戊醇
“相似相溶”还O2。
思考与交流
1. NH3是极性分子,CH4为非极性分子,而水是极性分 子,根据“相似相溶”规律, NH3易溶于水,而CH4 不易溶于水。并且NH3与水分子之间还可以形成氢键, 使得NH3更易溶于水。 2. 油漆是非极性分子,有机溶剂如(乙酸乙酯)也是 非极性溶剂,而水为极性溶剂,根据“相似相溶”规 律,应当用有机溶剂溶解油漆而不能用水溶解油漆。 3. 实验表明碘在四氯化碳溶液中的溶解性较好。这是 因为碘和四氯化碳都是非极性分子,非极性溶质一般 能溶于非极性溶剂,而水是极性分子。
3、氢键强弱的影响因素: 与X和Y原子的电负性或半径大小有关,通常 电负性大,半径小,则氢键强。氢键非化学键。 与成键的分子类型有关。
F—H…F 氢键键能 (kJ/mol) 范德华力 (kJ/mol) 共价键键能 (kJ/mol O—H…O N—H…N
28.1
13.4 568
18.8
16.4 462.8
NH3溶于水形成 氢键示意图如右 对比:乙醇、二甲醚 丙醇 、丙三醇
(3)氢键对水的密度的影响 在水蒸气中,水以单个 H2O 分子形式存在; 在液态水中,几个水分子通过氢键结合形成 (H2O)n缔合分子; 在固态水(冰)中,水分子大范围地以氢键 互相联结。
练习:
(04广东)下列关于氢键的说法中正确的是( C )
17.9
12.1 390.8
4、氢键的种类 分子内氢键 (不属于分子间作用力) 分子间氢键 (属于分子间作用力) 沸点: 196℃ 246.6 ℃
5. 氢键对物质物理性质的影响
(1) 分子间氢键使物质熔沸点升高,分子内氢 键使物质熔沸点降低 (2)物质的溶解性 分子与水形成氢键,溶解度增大
思考:NH3为什么极易溶于水?
共价键
原子之间通过 共用电子对形 成的化学键
作用微粒 强弱 对物质性 质的影响
分子之间
相邻原子之间
弱
范德华力越 大,物质熔 沸点越高
很强
物质的稳定性
四、溶解性
1、影响溶解度的外因:
固体:温度
气体: 温度、压强 2、内因: 思考: 为什么蔗糖和氨易溶于水,难溶于四氯化碳; 而碘却易溶于四氯化碳,难溶于水? (1) “相似相溶”规律: 非极性溶质一般易溶于非极 性溶剂,极性溶质一般易溶于极性溶剂。 例:NaCl在水中、乙醇中、四氯化碳中的分散情况。
