选修三第三章第三节离子晶体
人教版高中化学选修三 3.4 离子晶体 课堂课件

一、离子晶体
1、定义 离子间通过离子键结合而成的晶体 微粒:离子 作用力:离子键
2、常见的离子晶体 强碱、部分金属氧化物、大部分盐类
3、离子晶体中的离子配位数 (C.N.) 离子周围最邻近的异电性离子的数目
2Na + Cl2 == 2NaCl
Na
+11
+17
Cl
Na+
+11
、几种典型离子晶体的结构
分析思考: 1、Na+配位数? Cl-配位数?
66
NaCl晶体中阴、阳离子配位数
分析思考: 2、NaCl晶体中每个Cl-周围最近且 等距离的Cl-有几个?每个Na+周围
最近且等距离的Na+有几个 12
4、几种典型离子晶体的结构
分析思考:
1、Cs+配位数?8
Cl-配位数? 8
C.液溴的汽化和钠的熔化
D.HCl和NaCl溶于水
3、下面图像是从NaCl或CsCl晶体结构
图中分割出来的部分结构图,试判断
属于NaCl晶体结构的是( C
)
(1)
(2)
(3)
A.①和③ C.①和④
(4)
B.②和③ D.只有①
二、晶格能
1、定义: 气态离子形成1mol离子晶体时释放的能量 常取正值,单位:kJ/mol
AB型离子晶体的晶格能
NaF NaCl NaBr
离子
电荷 1 1
1
晶格能
kJ/mol 923 786 747
NaI MgO CaO SrO BaO
1 222 2 704 3791 3401 3223 3054
2、影响晶格能大小的因素 ⑴ 离子的电荷数 相同类型的离子晶体,离子电荷越大, 晶格能越大 ⑵ 离子的核间距 离子电荷数相同的同类型的离子晶体, 离子核间距越小,晶格能越大
人教高中化学选修3第三章晶体结构与性质知识点填空

人教高中化学选修3第三章晶体结构与性质知识点填空晶体是指具有一定空间有序性的固体物质,是由经过长程有序排列的原子、离子或分子组成的。
晶体结构与性质是化学选修3第三章的内容,下面将对该章的主要知识点进行填空。
1.晶体的结构主要包括(1)晶格、(2)晶胞、(3)晶体结构。
(1)晶格是指由无限多几何平面上的点构成的集合,三维空间中的晶格是无穷多平行平面上点的无限点阵。
晶格可以分为能量、距离和方向三种类型。
(2)晶胞是晶格的最小单元,具有对称性。
晶胞由晶体中的原子、离子或分子排列成一定的几何形状,一般为立方体、四方体或其他形状。
(3)晶体结构是指晶体中原子、离子或分子组成的排列方式。
晶体结构可以分为离子晶体结构、原子晶体结构和分子晶体结构三类。
2.离子晶体结构是指晶体由离子形成的结构。
离子晶体的特点是离子之间的相互作用力强,有规则的排列方式。
离子晶体可以根据离子的大小和电荷进行分类,常见的有(1)正离子负离子型离子晶体、(2)阳离子阴离子型离子晶体、(3)阳离子周期表电子构型型离子晶体、(4)绝对化合物型离子晶体和(5)复式离子型离子晶体。
3.原子晶体结构是指晶体由原子形成的结构。
原子晶体的特点是原子之间的相互作用力弱,有规则的排列方式。
原子晶体可以根据原子的配位数和密堆度进行分类,常见的有(1)体心立方晶格、(2)面心立方晶格、(3)密堆充分立方晶格和(4)六方密堆晶格。
4.分子晶体结构是指晶体由分子形成的结构。
分子晶体的特点是分子之间通过分子间力进行相互作用,有较弱的相互作用力。
分子晶体可以根据分子的形状和相互作用类型进行分类,常见的有(1)极性分子晶体、(2)非极性分子晶体、(3)氢键分子晶体和(4)范德华力分子晶体。
5.晶体的性质与其结构密切相关。
根据晶体的导电性可将晶体分为导体、绝缘体和半导体三类。
导体的晶体具有较好的导电性,绝缘体的晶体导电性极差,而半导体的导电性介于导体和绝缘体之间。
晶体的导电性主要与其组成离子、原子或分子的性质以及晶体的结构有关。
2019年《离子晶体》课件_新人教版选修3精品教育.ppt
各类型离子晶体晶胞的比较
晶体 晶胞 类型 类型
晶胞结构 示意图
距离最近 每个晶 配位数 且相等的 胞含有
相反离子 离子数
实例
NaCl 型
AB CsCl 型
Na+:6 Na+:6 Cl-: 6 Cl-: 6
Cs+:8 Cs+:8 Cl-: 8 Cl-: 8
Na+:4 Cl-: 4 Cs+:1 Cl-:1
离子晶体 NaCl CsCl
阴离子的配位数
6 8
阳离子的配位数
6 8
科学探究:
你认为是什么因素决定了离子晶体中离子
的配位数?根据表3—5、表3—6分析影响 离子晶体中离子配位数的因素。
配位数 半径比 空间构型
4
0.2~0.4
ZnS
6
0.4~0.7
NaCl
8
0.7~1.0
CsCl
决定离子晶体结构的因素
KBr AgCl、 MgO、CaS、 BaSe
CsCl、CsBr、 CsI、TlCl
ZnS型
Zn2+:4 Zn2+:4 Zn2+:4 ZnS、AgI、 S2-: 4 S2-: 4 S2-:4 BeO
AB2 CaF2 型
Ca2+:8 Ca2+:8 Ca2+:4 F-: 4 F-: 4 F-: 8
碱土金属卤化 物、碱金属氧 化物。
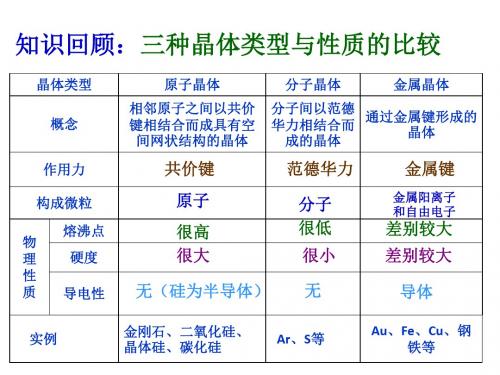
知识回顾:三种晶体类型与性质的比较
晶体类型
概念
作用力
构成微粒 熔沸点
物 理 硬度 性 质 导电性
原子晶体
相邻原子之间以共价 键相结合而成具有空
间网状结构的晶体
分子晶体
《离子晶体》高二上册化学选修三PPT课件

(2)在氯化铯晶体中,每个Cs+周围与之最接近且距离相等的Cl-共有 ;这几 个Cl-在空间构成的几何构型为 。
(3)在每个Cl-周围距离相等且最近的Cs+共有 ;这几个Cs+ 在空间构成的几何构型
。
(3)CaF2型晶胞
1、一个CaF2晶胞中含: 4个Ca2+和8个F¯
2、Ca2+的配位数: 8
F-的配位数: 4
3.下列物质中,化学式能准确表示该物质分子组成的是( C )
A.NH4Cl B.SiO2 C.P4 D.Na2SO4
问题反思——化学式能否表示分子,关键能判断该物质是否分子晶体
4:下列热化学方程式中,能直接表示出氯化钠晶格能的是___B___
A、 Na (s) + 1/2Cl2 (g) = NaCl(s); △H
△H =△H1 +△H2+△H3 +△H4 +△H5
高中生物选修三
谢谢观看
晶体机构与性质
CRYSTAL STRUCTURE AND PROPERTIES
老师:
授课时间:20XX
交流与讨论
NaCl CsCl
熔点℃ 801 645
沸点℃ 1413 1290
为什么NaCl的熔沸点比CsCl高?
结论: 对于组成和结构相似的物质,阴、阳离子半径越小,离子键越强,
熔沸点较高,晶体越稳定。 离子键的强弱在一定程度上可以用离子晶体的晶格能来衡量。
(二)离子晶体的晶格能
1.概念:气态离子形成1摩尔离子晶体释放的能量,通常取正值。或指拆开1mol离子晶 体使之形成气态阴离子和气态阳离子所吸收的能量 2.影响晶格能大小因素 离子晶体中阴阳离子半径越小,所带电荷越多,离子键越强,晶格能越大 3.晶格能的作用: (1)晶格能越大,离子晶体越稳定,离子晶体的熔沸点越高,硬度越大。 (2)岩浆晶出规则与晶格能的关系
高二人教版化学选修三离子晶体授课课件

答案:(1)
如图(答案不惟一,合理即可) (2)12 (3)4 8×18+6×12=4 4 12×14+1=4(答案不惟一,只要与第 1 问对 应即可)
•
1.情节是叙事性文学作品内容构成的 要素之 一,是叙 事作品 中表现 人物之 间相互 关系的 一系列 生活事 件的发 展过程 。
•
2.它由一系列展示人物性格,反映人物 与人物 、人物 与环境 之间相 互关系 的具体 事件构 成。
(1)请将其中代表Cl-的圆圈涂黑(不必考虑体积大 小),以完成NaCl晶体结构示意图。 (2)晶体中,在每个Na+的周围与它最接近的且距 离相等的Na+共有________个。 (3)在NaCl晶胞中正六面体的顶角上、面上、棱上 的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一 个晶胞中Cl-的个数等于________,即 ________(填计算式);Na+的个数等于________, 即________(填计算式)。
AB2 CaF2 型
Ca2+:8 Ca2+:8 Ca2+:4 F-: 4 F-: 4 F-: 8
碱土金属卤化 物、碱金属氧 化物。
• 讨论
• 1、在NaCI和CsCI晶体中,阴阳离子个数比 都是1:1都属于AB型离子晶体,为什么二者 配位数不同、晶体结构不同?
• 2、为什么在NaCI(或CsCI)晶体中,正负 离子的配位数相同,而在CaF2晶体中的配位 数不相同?
感谢观看,欢迎指导!
第三章 晶体的结构与性质
第四节 离子晶体
一、离子晶体
1、离子晶体
概念:
由阳离子和阴离子通过离子键结合而成的晶 体叫做离子晶体
组成微粒: 阴阳 离子
粒子间作用力:离子键
2022届高考化学大一轮复习教师用书:选修3 第3节 考点3 几种常见的晶体 Word版含解析
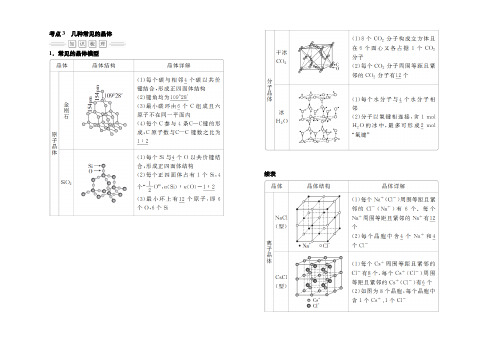
考点3几种常见的晶体1.常见的晶体模型续表2.石墨晶体石墨晶体是混合型晶体,呈层状结构。
同层内碳原子以共价键形成正六边形平面网状结构,平均每个正六边形拥有的碳原子个数是2,C 原子实行的杂化方式是sp2。
层与层之间以分子间作用力结合。
所以石墨晶体熔、沸点很高,但硬度不大,有滑腻感,能导电。
易错警示推断某种粒子四周等距且紧邻的粒子数目时,要留意运用三维想象法。
如NaCl 晶体中,Na +四周的Na +数目(Na +用“”表示):每个面上有4个,共计12个。
推断正误,正确的画“√”,错误的画“×”。
(1)1 mol 金刚石和SiO 2中含有的共价键数目均为4N A 。
(×)(2)金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子。
(√)(3)氯化钠晶体中,每个Na +四周距离相等且最近的Na +共有6个。
(×) (4)冰中包含的作用力有范德华力、氢键和共价键。
(√)(5)金属晶体能导电是由于金属晶体在外加电场作用下可失去电子。
(×)题组一 依据晶胞结构推断晶体类型 1.下图为几种晶体或晶胞的示意图:请回答下列问题:(1)上述晶体中,粒子之间以共价键结合形成的晶体是________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的挨次为____________________________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能________(填“大于”或“小于”)MgO晶体,缘由是_________________________________________________________________________________。
(4)每个Cu晶胞中实际占有________个铜原子,CaCl2晶体中Ca2+的配位数为________。
答案(1)金刚石晶体(2)金刚石、MgO、CaCl2、冰、干冰(3)小于MgO晶体中离子的电荷数大于NaCl晶体中离子电荷数;且r(Mg2+)<r(Na+)、r(O2-)<r(Cl-)(4)4 8解析(1)冰晶体、干冰晶体均为分子晶体,粒子间通过分子间作用力结合成晶体,Cu晶体中微粒间通过金属键结合形成晶体,MgO和CaCl2晶体中微粒之间通过离子键结合形成晶体。
高中化学选修3 第三章晶体结构与性质 讲义及习题.含答案解析

高中化学选修三第三章晶体结构与性质一、晶体常识1、晶体与非晶体比较自范性:晶体的适宜的条件下能自发的呈现封闭的,规则的多面体外形。
对称性:晶面、顶点、晶棱等有规律的重复各向异性:沿晶格的不同方向,原子排列的周期性和疏密程度不尽相同,因此导致的在不同方向的物理化学特性也不尽相同。
2、获得晶体的三条途径①熔融态物质凝固。
②气态物质冷却不经液态直接凝固(凝华)。
③溶质从溶液中析出。
3、晶胞晶胞是描述晶体结构的基本单元。
晶胞在晶体中的排列呈“无隙并置”。
4、晶胞中微粒数的计算方法——均摊法某粒子为n个晶胞所共有,则该粒子有1/n属于这个晶胞。
中学常见的晶胞为立方晶胞。
立方晶胞中微粒数的计算方法如下:①晶胞顶角粒子为8个晶胞共用,每个晶胞占1/8②晶胞棱上粒子为4个晶胞共用,每个晶胞占1/4③晶胞面上粒子为2个晶胞共用,每个晶胞占1/2④晶胞内部粒子为1个晶胞独自占有,即为1注意:在使用“均摊法”计算晶胞中粒子个数时要注意晶胞的形状。
二、构成物质的四种晶体1、四种晶体的比较(1)不同类型晶体的熔、沸点高低一般规律:原子晶体>离子晶体>分子晶体。
金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。
(2)原子晶体由共价键形成的原子晶体中,原子半径小的键长短,键能大,晶体的熔、沸点高。
如熔点:金刚石>碳化硅>硅(3)离子晶体一般地说,阴阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,相应的晶格能大,其晶体的熔、沸点就越高。
晶格能:1mol气态阳离子和1mol气态阴离子结合生成1mol离子晶体释放出的能量。
(4)分子晶体①分子间作用力越大,物质熔、沸点越高;具有氢键的分子晶体熔、沸点反常的高。
②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。
③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,熔、沸点越高。
④同分异构体,支链越多,熔、沸点越低。
(5)金属晶体金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高。
【华一课件】(选修三)第三章 第3节【金属晶体】

晶体的结构与性质
华师一附中
高一年级
第三节
金属晶体
金属样品
Ti
一、金属的原子结构和通性
1.金属在周期表中的位置
2.金属元素原子结构特征 3.金属的物理性质
大多数呈银白色固体,不透明,有金属光泽,容易 导电、导热、有延展性、熔沸点、硬度、密度有很 大差别。
资料
金属之最
熔点最低的金属是-------- 汞 [-38.87℃] 熔点最高的金属是-------- 钨 [3410℃] 密度最小的金属是-------- 锂 [0.53g/cm3] 密度最大的金属是-------- 锇 [22.57g/cm3]
1.
练习
3.下列叙述正确的是( B ) A.任何晶体中,若含有阳离子也一定含有阴 离子 B.原子晶体中只含有共价键 C.离子晶体中只含有离子键,不含有共价键 D.分子晶体中只存在分子间作用力,不含 有其他化学键 4.为什么碱金属单质的熔沸点从上到下逐渐 降低,而卤素单质的熔沸点从上到下却升高?
知识回顾:三种晶体类型与性质的比较
四、金属晶体的熔点变化规律:
(1)金属晶体熔点变化差别较大。如汞在常温下是液 体,熔点很低(-38.9。C)。而铁等金属熔点很高 (1535。C)。这是由于金属晶体紧密堆积方式、金属阳 离子与自由电子的静电作用力不同而造成的差别。 (2)一般情况下(同类型的金属晶体),金属晶体的 熔点由金属阳离子半径、所带的电荷数、自由电子的多少 而定。阳离子半径越小,所带的电荷越多, 自由电子越 多,相互作用就越大, 熔点就会越高。
晶胞的形状是什么? 含几个原子?
1、简单立方堆积
[ Po ]
配位数: 6 空间占有率: 52%
每个晶胞含原子数: 1
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
选修三第三章第三节金属晶体
(共1课时)
教学目标
1.了解典型离子晶体的结构特征,了解离子晶体配位数及其影响因素。
2.能说明离子键的形成,能根据离子晶体的结构特征解释其物理性质。
3.了解晶格能的应用,知道晶格能的大小可以衡量离子晶体中离子键的强弱。
课前复习
一、离子键的形成
1. 概念:_______________间通过____________形成的化学键叫做离子键。
2. 形成:在离子化合物中,阴、阳离子之间的_____________使阴、阳离子相互吸引
阴离子的核外电子与阳离子的核外电子之间、阴离子的原子核与阳离子的原子核之间的____________使阴、阳离子相互排斥。
当阴、阳离子之间的静电引力和静电斥力达到__________时,阴、阳离子保持一定的平衡核间距,形成稳定的____________,整个体系达到______________状态。
3. 根据元素的金属性和非金属性差异,金属性较强的金属原子与非金属性较强的非金属原子间易形成离子键。
例如,ⅠA、ⅡA族元素与ⅥA、ⅦA族元素易形成离子键。
4. 离子键的特点:离子键没有_________性和__________性。
5.存在:离子键只存在于离子化合物中。
强碱、活泼金属氧化物、大多数盐类是离子化合物。
想一想 1.离子晶体一定含离子键,一定不含共价键吗?
教学过程
一、离子晶体
1.概念
离子晶体是由_______和_______通过______结合而成的晶体。
2.决定晶体结构的因素
(1)几何因素:晶体中正负离子的_______。
(2)电荷因素:晶体中正负离子的_______。
(3)键性因素:离子键的纯粹程度。
3.物理性质
在离子晶体中,由于离子间存在着较强的离子键,使离子晶体的硬度_____、难于压缩;具有_____的熔点和沸点,难溶于有机溶剂。
二、晶格能
1.概念:离子晶体的晶格能是指__________形成1摩离子晶体_____的能量,通常取_____,单位为 __________。
2.晶格能对离子晶体性质的影响:晶格能是最能反映离子晶体________的数据。
晶格能越大,形成的离子晶体越______,而且熔点_____,硬度______。
想一想
2.NaCl与KCl,NaCl与MgCl2哪一个晶格能更大?
自主体验
1.(2012·哈尔滨高二质检)离子晶体不可能具有的性质是( )
A.较高的熔、沸点B.良好的导电性
C.硬度大 D.溶于四氯化碳
2.下列物质中,含有共价键的离子晶体是
( )
A.NaCl B.SiO2
C.KOH D.I2
3.下列有关晶格能的叙述中,不正确的是( )
A.最能反映离子晶体稳定性的数据是晶格能
B.晶格能越大,则离子晶体越稳定
C.晶格能越大,则离子晶体的硬度越小
D.晶格能越大,则离子晶体的熔点越高
三离子晶体常见类型
(1)NaCl型晶体结构模型
①Na+的配位数是6:每个Na+周围同时吸引着最近且等距离的Cl-是6个(上、下、左、右、前、后),构成正八面体;同样,Cl-的配位数也是6:每个Cl-周围同时吸引着最近且等距离的Na+是6个,构成正八面体。
由此可推知该晶体的化学式为NaCl。
②每个Na+周围与它最近且等距离的Na+有12个(上层4个,同层4个,下层4个),同样,每个Cl-周围与它最近且等距离的Cl-也有12个。
③每个晶胞中平均含有Na+的数目是1+12×1/4=4,Cl-的数目是8×1/8+6×1/2=4,由此亦可推知该晶体的化学式为NaCl。
(2)CsCl型晶体结构模型
①Cs+的配位数是8:每个Cs+周围同时吸引着最近且等距离的Cl-是8个,构成正六面体;同样,Cl-的配位数也是8:每个Cl-周围同时吸引着最近且等距离的Cs+是8个,构成正六面体。
由此可推知该晶体的化学式为CsCl。
②每个Cs+周围与它最近且等距离的Cs+有6个(上、下、左、右、前、后),构成正八面体;
同样,每个Cl-周围与它最近且等距离的Cl-也有6个,构成正八面体。
③每个晶胞中平均含有Cs+的数目是8×1/8=1,Cl-的数目也是1,由此亦可推知该晶体的化学式为CsCl。
(3)CaF2型晶体结构模型
①Ca2+的配位数是8:每个Ca2+周围同时吸引着最近且等距离的F-是8个,构成正六面体;F-的配位数也是4:每个F-周围同时吸引着最近且等距离的Ca2+是4个,构成正四面体。
由此可推知该晶体的化学式为CaF2。
②每个 Ca2+周围与它最近且等距离的Ca2+有12个,每个F-周围
与它最近且等距离的F-有6个。
③ Ca2+处于晶胞的顶点和面上,F-处于晶胞体内。
每个晶胞中平
均含有Ca2+的数目是8×1/8+6×1/2=4,F-的数目是1×8=8,
此亦可推知该晶体的化学式为CaF2。
特别提醒
1.离子晶体中不存在分子,化学式仅表示晶体中阴、阳离子个数比的最简式。
如:在NaCl 和CsCl晶体中,都不存在单个的NaCl和CsCl分子。
而Na2O2的阴离子为,阳离子为Na+,故晶体中阴、阳离子的个数比为1∶2,而不是1∶1。
2.属于NaCl型的离子晶体还有KCl、NaBr、LiF、CaO、MgO、CaS等;属于CsCl型的离子晶体还有CsBr 、CsI、 NH4Cl等。
自主体验
1.下列关于氯化铯晶体的叙述中,不正确的是( )
A.1 mol氯化铯中有NA个CsCl分子
B.氯化铯晶体中,每个Cs+周围与它最近且等距离的Cs+有6个
C.氯化铯晶体中,Cs+和Cl-的配位数都是8
D.每个晶胞中平均含有1个Cs+和1个Cl-
2.如图是从NaCl或CsCl晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是( )
A.(1)和(3) B.(2)和(3)
C.(1)和(4) D.只有(4)
当堂反馈
1.下列性质适合于离子晶体的是( )
①熔点1070 ℃,易溶于水,水溶液能导电②熔点10.31 ℃,液态不导电,水溶液导电
③熔点112.8 ℃,沸点444.6 ℃,能溶于CS2 ④熔点97.81 ℃,质软,导电,密度0.97 g·cm-3 ⑤熔点-218 ℃,难溶于水⑥熔点3900 ℃,硬度很大,不导电
⑦难溶于水,固态时导电,升温时导电能力减弱⑧难溶于水,熔点高,固体不导电,熔化时导电A.①⑧ B.②③⑥
C.①④⑦ D.②⑤
2. 含有非极性键和离子键的晶体是( )
A.N2B.Na2O2
C.金刚石D.NH4Cl
3.下列性质中,可以较充分地说明某晶体是离子晶体的是( )
A.具有较高的熔点
B.可溶于水
C.固态不导电,熔融状态能导电
D.固态不导电,水溶液能导电
4.(2012·青岛高二调研)根据下列性质判断,属于离子晶体的物质是( )
A.熔点2700 ℃,导电性好,延展性强
B.无色晶体,熔点3550 ℃,不导电,质硬,难溶于水和有机溶剂
C.无色晶体,能溶于水,质硬而脆,熔点为800 ℃,熔化时能导电
D.熔点-56.6 ℃,微溶于水,硬度小,固态或液态时不导电
4.已知三种氟化物的晶格能。
化学式NaF MgF2AlF3
晶格能/ kJ·mol-1923 2957 5492
这三种氟化物的晶格能递变的原因是
________________________________________________________________________。
6.(2012·中山高二检测)如图表示NaCl晶胞,直线交点处的圆圈为Na+或Cl-所处的位置。
这两种离子在空间三个互相垂直的方向上都是等距离排列的。
(1)请将其中代表Cl-的圆圈涂黑(不必考虑体积大小),以完成NaCl晶胞示意图。
(2)晶体中,在每个Na+的周围与它最接近且距离相等的Na+共有________个。
(3)在NaCl晶胞中正六面体的顶角上、面上、棱上的Na+或Cl-为该晶胞与其相邻的晶胞所
共有,一个晶胞中Cl-的个数等于________,即________(填计算式);Na+的个数等于
________,即________(填计算式)。
