第二章 锌锰干电池
第二章锌锰电池资料

第二章锌锰电池资料1.介绍锌锰电池是一种以锌和二氧化锰作为正负极材料的原电池,广泛应用于家用电器、农业、医疗等领域。
它具有体积小、重量轻、电能密度高等优点,是一种理想的便携式电源。
2.锌锰电池的工作原理锌锰电池的正极由氢氧化锌和二氧化锰组成。
当电池接通电路后,氢离子在正极释放出电子,在电路中流动至负极。
同时,在负极与正极之间的电解质中,锌离子会迁移至负极,与电子反应生成锌金属。
在电解质中,二氧化锰会接受负极电子,同时与电解质中的氢离子发生反应,生成氧气和水。
这样,正负极的反应可持续进行,电池就能提供电能。
3.锌锰电池的特点(1)体积小、重量轻:锌锰电池的正负极材料都是粉末状,容易压制成薄片,从而使电池体积小、重量轻。
(2)电能密度高:由于锌和二氧化锰的化学反应比较激烈,所以锌锰电池的电能密度较高,能够提供较多的电力。
(3)自放电率低:锌锰电池的自放电率相对较低,能够保持长时间的储存。
(4)无汞:与传统的碱性电池相比,锌锰电池不含汞,对环境友好。
4.锌锰电池的应用领域(1)家用电器:锌锰电池广泛应用于手电筒、遥控器、闹钟等家用电器中,由于体积小、重量轻,方便携带。
(2)农业:锌锰电池可用于农业灌溉系统、环境监测仪器等方面,提供稳定的电源。
(3)医疗:锌锰电池有时被用于医疗设备、急救设备等,可以提供可靠的电力支持。
5.锌锰电池的改进与发展为了提高锌锰电池的性能,人们还进行了许多研究。
例如,采用纳米材料制备锌锰电池正负极材料,可以提高电导率、增加表面积,从而提高电池的性能。
6.锌锰电池的注意事项(1)避免过度放电:锌锰电池使用过程中要避免过度放电,以防止电池性能下降。
(2)正确处理废旧电池:废旧锌锰电池需正确回收处理,以减少对环境的污染。
7.结论锌锰电池以其体积小、重量轻、电能密度高等特点,在各个领域得到了广泛应用。
随着科技的不断进步,人们对锌锰电池的改进研究也在进行中,相信其在未来将有更加广阔的应用前景。
第二讲 锌锰电池

(3)大电流连续放电其容量是酸性锌锰电池 的5倍左右;
(4)贮存寿命长。
碱性锌锰电池
表示。用于大电流放电和连续使用的用电器具,如放录机、BP机、 照相机、电动玩具等。根据电池中汞含量的高低,分为含汞电池、 低汞电池和无汞电池。 扣式电池采用电解二氧化锰与石墨混合压成片状正极,氢氧化 钾水溶液作电解液,锌粉压成片状作负极,正负极间用隔膜隔开。
锌离子的存在形式
pH值
电液导电能力
大,正极极化大
好
小电流间放
不好
大电流连放、防漏性能好
结论
中性锌锰电池:
一、将旧电池拆开,按物质初 类,并了解电池的构造。基本原理 中性锌锰电池结构 下:
)Zn NH4Cl ZnCl2 MnO2 , C(
铜帽 封蜡 锌筒 多孔纸 石墨电极
NH4Cl 和 MnO2
锌负极的自放电
○ 锌电极产生自放电的原因
氢离子的阴极还原所引起的锌的自放电
氧的阴极还原所引起的锌电极的自放电 电解液中的杂质所引起的锌电极的自放电
○ 引起锌电极自放电的主要原因是氢的阴极析出所引起
的锌的腐蚀,即析氢腐蚀
○ 影响锌电极自放电的因素
锌的纯度及表面均匀性的影响 溶液pH 值的影响 电液中NH4Cl、ZnCl2浓度对自放电的影响 温度的影响
水蒸气压/Pa 2933 2340
Zn2+离子状态 [Zn(H2O)]2+ [ZnCl4]2—
两电池比较
差异 氯化铵型 氯化锌型
好,不容易漏液
反应式不同
蒸气压 产物不同
无水生成和消耗 消耗大量的水,防漏性能
低
Zn(NH3)2Cl2, 致密而坚硬的沉淀 ,小电流间放 负离子,负极极化大 高,密封要求高 ZnCl2· 4 ZnO· 5 H2 O, 水泥效应,大电流连放 正离子,负极极化小 小,正极极化小
第章锌锰电池PPT课件
电极的总反应为: MnO2+4H++2e- Mn2++2H2O
2).水锰石在碱性溶液中的转移—固相质子扩散
• MnOOH只能靠固相中的质子扩散来转移。 “特殊”浓差极化或固相浓差极化。
3). 水锰石在中性溶液中的转移—混合方式
• 有 43 %的 MnOOH 是通过歧化反应来转移的, 有57%是通过固相扩散来转移的。
• • • • • 负极自放电(主要) 电液干涸 气胀 冒浆 铜冒生锈
2.6 糊式锌-锰电池
• • • • • • • 2.6.2 制造工艺及分析 一、生产流程 碳棒的制造 正极电芯的制造 负极锌筒的制造 电液及电糊的配制 装配
二、碳棒的制造
• 正极电芯的集流体,传导电流
三、正极的制造
拌粉、成型(打电芯)和包纸扎线等工序 • 1).拌粉
2. MnO2电极 阴极还原的次级过程
• MnOOH转移步骤即二次过程是整个MnO2阴极还原 的控制步骤
1). 水锰石在酸性溶液中的转移—歧化反应: 在酸性溶液中,MnO2放电的一次过程为: 2MnOOH 2MnO2+2H++2e-
歧化反应: 2MnOOH+2H+
MnO2+Mn2++2H2O
锌锰干电池
• 1868年 Leclanche发明 以NH4Cl为电解液 的Zn-MnO2电池 • 1888年Gassner 成功构成干电池 并商品化
氯化铵型电e dioxide)
电池组成 (-)Zn/KOH(aq) /MnO2(+) 额定电压:1.5V 可制成二次电池
2+ Zn+2e Zn + 2H +2e H2
第二章 第二节 第2课时

相关视频 答案
3.燃料电池
(1)燃料电池是通过 燃料气体
与氧气 分别在两个电极上发生 电
反应,
氧化还原能直接转化为化学 能的装置。 将
答案
(2)燃料电池与火力发电相比,其燃料的利用率高、能量转化率高 。 与 干
相关视频
答案
2.充电电池 (1)充电电池又称二次电池。充电电池在放电时所进行的 氧化还原 反应, 在充电时又可以 逆向 生成 进行, 反应 物重新转化为 物,
使充电、放电可在一定时期内循环进行。充电电池中能量的转化关系是
放电 。 化学能 ____________________ 充电 电能
第二章 第二节 化学能与电能
பைடு நூலகம்
第2课时 发展中的化学电源
学习目标定位 1.知道干电池、充电电池、燃料电池等发展中的化学电源的特点。 3.能正确书写简单化学电源的电极反应式。 内容索引
2.认识提高燃料的燃烧效率、开发高能清洁燃料和研制新型电池的重要性。
一 常见的化学电源
二 原电池电极反应式的书写方法
当堂检测 40分钟课时作业
解析答案
1
2
3
4
5
6 7
8
9
10
11
12
13
14
5. 日常所用干电池的电极分别为碳棒 ( 上面有铜帽 ) 和锌皮,以糊状
NH4Cl和ZnCl2作电解质 ( 其中加入 MnO2吸收H2),电极反应式可简化为
-===2NH ↑+H ↑(NH 与Zn2+能生成一 Zn-2e-===Zn2+, 2NH+ + 2e 3 2 3 4
第二章锌锰电池

第二章锌锰电池1.介绍锌锰电池锌锰电池是一种基于氧化还原反应原理的化学电源,由锌负极、锰阳极和电解液组成。
它是一种常见的一次性电池,广泛应用于电子产品、医疗器械、照相机等设备中。
2.锌锰电池的构成锌锰电池由锌阴极、锰阳极和电解液三部分组成。
锌阴极是由金属锌制成的,锰阳极则由金属锰制成。
电解液主要由碱性溶液和盐组成,用于提供离子介质。
3.锌锰电池的工作原理当锌锰电池连接外电路后,锌负极发生氧化反应,转化为锌离子离开电极。
锰阳极则发生还原反应,接收锌离子并减少为锌金属。
这个过程产生了电流,用于给外部设备供电。
4.锌锰电池的优点锌锰电池具有很多优点。
首先,它具有较高的能量密度,可以提供持久的电力供应。
其次,它的成本相对较低,易于生产和大规模应用。
此外,它是一次性电池,无需充电,使用起来非常方便。
5.锌锰电池的应用锌锰电池广泛应用于各种电子产品和设备中。
例如,遥控器、闹钟、手电筒、遥控车等小型电子设备常常使用锌锰电池作为电源。
此外,它还可以用于医疗器械、照相机和无线设备等。
6.锌锰电池的环保性能锌锰电池相对较为环保。
它的原材料几乎可以完全回收利用,减少了对环境的污染。
同时,由于是一次性电池,不需要频繁更换或充电,也减少了电池废弃物的产生。
7.锌锰电池的缺点锌锰电池虽然有很多优点,但也存在一些缺点。
首先,由于其体积较大,不适合用于微型电子设备。
其次,一旦电池内部产生氢气,就可能破裂或泄漏,对环境造成污染。
8.锌锰电池的维护方法为了延长锌锰电池的寿命,我们可以采取一些维护措施。
首先,不使用时应将电池取出,以避免能量消耗。
其次,存放时要注意避免高温和潮湿环境,以免损坏电池结构。
9.锌锰电池的未来发展随着科技的不断进步,锌锰电池正在不断改进。
新型材料和技术的引入使其能量密度和循环寿命得到提升。
未来,锌锰电池将更加节能环保,成为可持续发展的重要能源。
总结:锌锰电池作为一次性电池,具有较高的能量密度、低成本、方便使用等优点。
第二章 锌锰电池

代汞缓蚀剂的要求
能有效地抑制锌的腐蚀
耐碱性电解液的腐蚀 对锌粉电极无不良影响
(Al? Ni?)
有害元素或杂质含量低 材料成本增加不明显
(Au?Pt?)
在锌电极中加入代汞金属元素 的方法(合金化)
直接在高纯锌中添加代汞元素,通
过共熔制造锌合金粉 把代汞金属(和化合物)添加在电解 质溶液中,通过置换反应使微量代 汞金属元素沉积在金属锌粉的表面, 从而改变锌电极的表面性能
三、有机缓蚀剂
有机缓蚀剂一般为非离子型表面活
性剂(共价型,C、H、N、O、S等, 一般不含金属。) 分子一端是极性基团,另一端为非 极性基团 连接两个基团的一般有-NH-,-S-, -COO-,-CON-,-SON-等
有机缓蚀剂的种类
聚乙二醇衍生物 芳烃衍生物
聚乙烯氧化物
胺类及肟类
亚乙基二醇类
碱性锌锰电池
按外形 分类
中性和 酸性锌 锰电池
碱性锌 锰电池
筒式 迭层式 薄层纸式 筒式
扣式
扁平式
2.1.1 勒克朗谢电池
( ) Zn NH 4 Cl, ZnCl 2 MnO 2 C( )
正极活性物质用天然MnO2(70~75%)
负极活性物质用Zn筒
隔膜为淀粉糨糊隔离层(糊状物)
锌电 极分 类
2.2.1 锌电极类型
锌筒
片状锌 锌合金粉
汞齐锌粉
无汞齐锌粉
无铅 锌粉
有铅 锌粉
几种电池中的锌电极 (1) 勒克朗谢电池中的锌电极
典型的电解液为4.96M
ZnCl2。 电池在放电和储存过程中,会发生析 氢反应,氢离子浓度降低,pH值不断 升高,在pH为5.1-5.8时,锌以离子进 入溶液,在5.8-7.9范围时,锌表面产 生不溶性ZnCl2.2NH3晶体,在大于7.9 时, ZnCl2.2NH3晶体会溶解产生 Zn(NH3)42+。
人教版必修2化学课件:第二章 第二节 第2课时 发展中的化学电源

①放电后可 再充电使活 性物质获得 再生 ②可以多次 充电,重复 使用
①电极本身不包含活性 物质,只是一个催化转换 元件 ②工作时,燃料和氧化剂 连续地由外部供给,在电 极上不断地进行反应,生 成物不断地被排出
举 例
普通的锌锰电池、 碱性锌锰电池、银 锌电池等
铅蓄电池、 锂电池、镍 镉电池等
氢氧燃料电池、CH4 燃料 电池、CH3OH 燃料电池 等
一二
二、电极反应式、原电池反应式的书写
1.电极反应式的书写 (1)根据原电池的装置书写电极反应式。 负极:①金属失电子后生成的金属阳离子不与电解质溶液的成 分反应,M-ne- Mn+。 ②金属失电子后生成的金属阳离子与电解质溶液的成分反应, 要将金属失电子反应和阳离子反应叠加在一起,如铅蓄电池的负 极:Pb+SO42- − 2e − PbSO4。 燃料电池负极材料本身不反应,要将燃料失电子的反应及其产 物与电解质溶液中的反应叠加在一起书写,如 H2-O2(KOH 溶液)电池 的负极反应为 H2+2OH--2e- 2H2O。
第2课时 发展中的化学电源
1.能说出常用的化学电池。 2.会运用燃料电池的工作原理。
一二三
一、干电池 最早使用的化学电池是锌锰电池,它是一种一次性电池,放完电 后不能再使用。
负极:锌筒 1.锌锰电池 正极:石墨棒
电解质:NH4 Cl
2.碱性锌锰电池:将锌锰干电池中的电解质NH4Cl换成湿的KOH, 并在构造上作了改进。
②找出氧化剂、还原剂和电子转移数,分别写出电极反应式,负 极:还原剂-ne- 氧化产物,正极:氧化剂+ne- 还原产物。
③验证:两电极反应式相加所得式子和原化学方程式相同,则书 写正确,即正极反应式+负极反应式=电池的总反应式。
第二章 锌锰干电池

17
2. 锌锰干电池的工作原理
随着放电时间的延长,二氧化锰电极表面层中的 H+ 浓度不断 增加 O2- 离子浓度不断降低,在电极内部产生了浓度梯度。由于 增加, 离子浓度不断降低 在电极内部产生了浓度梯度 由于 这种浓度梯度的存在,H+ 由二氧化锰电极表面向内层扩散,并与 O2- 离子结合。同时二氧化锰表面层的电子也向内层扩散。这个过 程就好象电极表面低价锰化合物 MnOOH,不断向电极深处转移。 而电极内部的 MnO2 不断向表面转移。但是由于H+在固相中的扩 散速度非常缓慢,因而使 MnO2 放电反应困难。导致正极发生严重 极化,正极电位下降。这种由于固相 MnO2中 O2- 离子浓度剃度 而造成的特殊的浓度极化,叫做“固相浓度极化”。
& 2.1 锌锰干电池 & 2.2 2 2 铅酸蓄电池 & 2.3 碱性蓄电池
1
1. 概述
以MnO2为正极,Zn为负极,并以NH4Cl水溶液为主电解液, 用纸、棉或淀粉等将电解液凝胶化,使其不流出,具有这种结构 的电池叫做锌锰干电池。
Zn NH4Cl ZnCl2 MnO2
这种电池最早在1868年法国人勒克朗谢设计的,开始电解质 仍是流动的。 Zn NH 4 Cl MnO2 (C ) 并把细砂、锯末等物质加在电解 质中,使其成为糊状物。 质中 使其成为糊状物
4
1. 概述
筒形电池的锌极兼作电池的容器。MnO2 电极压成圆柱形的电芯,炭棒在电芯的中央 作为正极导体,电芯外面包有绵纸,以防芯 绵 粉脱落;锌筒底部的绝缘垫片,是用来防止 正负极间的短路;电糊起离子的导电作用和 正负极间的隔离物的作用。上部的气室是为 气体或电糊膨胀而留的余地;封口剂和电池 盖都是为了密封电池,防止电解质干固。 迭层电池的锌极为锌片,炭饼为正极,在 炭饼和锌片之间置有涂过凝胶电解质的浆层纸 隔膜 锌极的另 面紧贴有电子导电的导电膜, 隔膜。锌极的另一面紧贴有电子导电的导电膜, 用于电池串联。每个单体电池之间的外面有绝 缘套,并兼作电池的容器。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
21
2. 锌锰干电池的工作原理
二氧化锰阴极还原的控制步骤:
研究表明,在 MnO2 的阴极还原过程中国,初级过程 MnOOH 的生成反应即电化学反应的速度是较快的,而二次过程 M OOH 的转移速度相对是比较慢的,因此, MnOOH 的转移速度相对是比较慢的 因此 MnOOH M OOH 转移步骤 即次级过程是整个 MnO2 阴极还原的控制步骤。 在不同 pH H 的介质中水锰石的转移方式不同,因此相应的控 的介质中水锰石的转移方式不同 因此相应的控 制步骤也有所不同。在酸性溶液中水锰石的歧化反应是 MnO2 阴 极还原的控制步骤,在碱性溶液中质子的固相扩散过程是 MnO2 阴极还原的控制步骤,在中性水溶液中水锰石的歧化反应和质子 的固相扩散过程共同构成了 MnO2 阴极还原的控制步骤。
MnO
2
RT ln( M OH ) F
(2 3)
11
由该式可知,电池放电时,正极附近溶液中PH值增加,会导致 二氧化锰电极电位的下降。但是若对实验结果,图( 2-1)进行分 析可知:利用(2-3)式进行计算,因PH值上升而引起的正极电位 的下降值还不到二氧化锰电极电位的总值的1/3。故可以说电解液PH 值的变化还不是引起二氧化锰电极电势下降的主要因素。进一步的研 究表明 电化学极化和电阻极化亦不是主要因素 而是产生了特殊的 究表明,电化学极化和电阻极化亦不是主要因素。而是产生了特殊的 二氧化锰放电机理—固相浓差极化(也叫电子-质子机理)。
22
2. 锌锰干电池的工作原理
二. 负极的工作原理 干电池的电解质 PH=5。锌极开始放电时的电极反应为:
Zn 2e Zn
12
2. 锌锰干电池的工作原理
双电层的形成
当二氧化锰与电糊相接触时,溶液中的 H+ 离子便向二氧化锰 电极表面转移,使二氧化锰电极表面侧产生 H+ 过剩。电糊侧产生 OH-过剩。因而形成了一个双电层,产生了一定的电位差,如图 所示:
13
2. 锌锰干电池的工作原理
二氧化锰阴极还原的初级过程
当二氧化锰电极放电时,溶液中的H+便向二氧化锰晶格中转 移,与 O2- 离子结合生成 OH-。与此同时二氧化锰接受外来的 电子,即 Mn4+ 还原成 Mn3+(MnOOH)。(如图所示)。
MnO2 4H 2e Mn2 2H2O MnO2 H2O e MnOOH OH
10
(2 1) (2 2)
2. 锌锰干电池的工作原理
通过对产物的分析,表明Mn2+是少量的,Mn3+化合物 MnOOH 是主要的。所以一般将二氧化锰电极反应写成(2-2) 式。因此二氧化锰电极的电位可表示为:
4
1. 概述
筒形电池的锌极兼作电池的容器。MnO2 电极压成圆柱形的电芯,炭棒在电芯的中央 作为正极导体,电芯外面包有绵纸,以防芯 绵 粉脱落;锌筒底部的绝缘垫片,是用来防止 正负极间的短路;电糊起离子的导电作用和 正负极间的隔离物的作用。上部的气室是为 气体或电糊膨胀而留的余地;封口剂和电池 盖都是为了密封电池,防止电解质干固。 迭层电池的锌极为锌片,炭饼为正极,在 炭饼和锌片之间置有涂过凝胶电解质的浆层纸 隔膜 锌极的另 面紧贴有电子导电的导电膜, 隔膜。锌极的另一面紧贴有电子导电的导电膜, 用于电池串联。每个单体电池之间的外面有绝 缘套,并兼作电池的容器。
第 章 一次电池及二次电池 第二章 次电池及 次电池
& 2.1 锌锰干电池 & 2.2 2 2 铅酸蓄电池 & 2.3 碱性蓄电池
1
1. 概述
以MnO2为正极,Zn为负极,并以NH4Cl水溶液为主电解液, 用纸、棉或淀粉等将电解液凝胶化,使其不流出,具有这种结构 的电池叫做锌锰干电池。
Zn NH4Cl ZnCl2 MnO2
14
2. 锌锰干电池的工作原理
二氧化锰阴极还原的次级过程
在初级反应过程中 MnO2 颗粒表面上生成的水锰石使液相 中质子进 步进入固相受到阻滞,电化学反应若要继续进行,固 中质子进一步进入固相受到阻滞,电化学反应若要继续进行,固 相表面的水锰石必须清除。水锰石的转移有两种方式:歧化反应 和固相质子扩散(如图所示)。
16
2. 锌锰干电池的工作原理
固相质子扩散:
水锰石首先产生在 MnO2 颗粒的表面,因此表面处质子浓度 高,而颗粒内部的质子浓度低,即存在着质子的浓度梯度。在这 一浓度梯度的作用下,质子可以在 浓度梯度的作用下 质子可以在 MnO M O2 晶格中向内部进行扩散, 晶格中向内部进行扩散 这种扩散称为固相中的质子扩散。
6
1. 概述
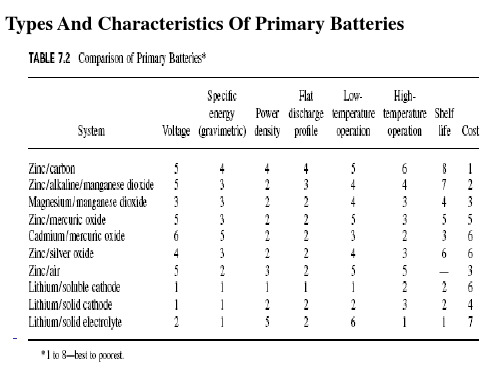
IEC标准及各国锌锰电池型号、名称和标准尺寸
7
2. 锌锰干电池的工作原理
锌锰干电池的工作原理,主要在于叙述电池工作时两电极的电 化学反应、反应速度以及电池的电动势(热力学性质)。 一. 二氧化锰电极的工作原理:
8
图2-1 MnO2-Zn电池放电电压及电极反应随时间的变化曲线
2. 锌锰干电池的工作原理
2 位置向内部的 O22 位置转 随着质子(H+)从表面层中的 O2移,在内部的 O2- 处形成 OH-。由于电场的作用,在原来电极表 面 OH- 附近的 Mn3+ 上的束缚电子也跳到电极内部的 OH- 附近的 Mn4+ 处使之还原为 Mn3+,这就相当于表面层中的 MnOOH 向内 转移,使得电极表面层中的电化学反应得以继续进行。
这种电池最早在1868年法国人勒克朗谢设计的,开始电解质 仍是流动的。 Zn NH 4 Cl MnO2 (C ) 并把细砂、锯末等物质加在电解 质中,使其成为糊状物。 质中 使其成为糊状物
2
1. 概述
到了1886年,由美国的加斯纳,设计了一种将电解液用石膏固 化,而锌电极制成圆筒形的电池。这种电池即使倾斜电解液也 不会流出。
1 2
9
O2 (C ) 2e 2H H 2O
2. 锌锰干电池的工作原理
随着反应的进行,因外部的氧气向电极扩散困难,使反应的阻 力变大,电极极化很大。因而使电极电位在一开始很快下降,并引起 极化电流的重新分配,使部分电流通过与石墨紧密相连 的二氧化锰 表面,还原二氧化锰,随着进一步的极化,导致电极反映全部移至二 氧化锰电极上 这时石墨 乙炔黑仅起导电作用 氧化锰电极上。这时石墨、乙炔黑仅起导电作用。 目前公认二氧化锰电极反应有两个:
Z NH4Cl,ZnO,ZnCl Zn Cl Z O Z Cl2(石膏)MnO (石膏)M O2 (C)
美国在1890年开始生产了这种电池。之后又经过不断的改进, 年开始生产了这种电池 之后又经过不断的改进 发展到目前的干电池。 说明 石来自(CaSO 说明: 石膏(C SO
1 ) 烧石膏(CaSO C SO4 H2O) 4 2H2O 2
18
2. 锌锰干电池的工作原理
另外,利用这种“固相浓度极化”理论恰可较好的解释 Zn- MnO2 电池的间歇放电特性。
图2-4. MnO2电极间歇放电电极电势的变化
19
2. 锌锰干电池的工作原理
所谓间歇放电特性(如图2-4所示)即放电间歇进行。以R20为 例:一般用5欧姆电阻,以每周放5天,每天连续放30分钟,刚开始 测一次,以后每10分钟测一次。由图2-4可知,停放后,二氧化锰 电极的电位逐渐向未工作时的数值恢复。显然单靠 OH- 扩散,是 不可能引起那样大的幅度 这主要是由于停止放电后 二氧化锰颗 不可能引起那样大的幅度,这主要是由于停止放电后,二氧化锰颗 粒表面层的 H+ 仍继续不断的向颗粒内部扩散,从而逐渐消除了放 电时所产生的固相浓度极化,结果使电位得到恢复。从恢复曲线还 可看出,刚一停放的时间电压恢复快,随后恢复变慢。这是由于故 相中H+浓度剃度的减小,电压恢复的速度也相应变慢。同时由于活 性物质的消耗, PH值增大,电位不可能完全恢复到放电前的数值 。
17
2. 锌锰干电池的工作原理
随着放电时间的延长,二氧化锰电极表面层中的 H+ 浓度不断 增加 O2- 离子浓度不断降低,在电极内部产生了浓度梯度。由于 增加, 离子浓度不断降低 在电极内部产生了浓度梯度 由于 这种浓度梯度的存在,H+ 由二氧化锰电极表面向内层扩散,并与 O2- 离子结合。同时二氧化锰表面层的电子也向内层扩散。这个过 程就好象电极表面低价锰化合物 MnOOH,不断向电极深处转移。 而电极内部的 MnO2 不断向表面转移。但是由于H+在固相中的扩 散速度非常缓慢,因而使 MnO2 放电反应困难。导致正极发生严重 极化,正极电位下降。这种由于固相 MnO2中 O2- 离子浓度剃度 而造成的特殊的浓度极化,叫做“固相浓度极化”。
20
2. 锌锰干电池的工作原理
图2-5. 2 5 锌锰干电池放电电压 (1)5 连续放电 (2)5 间歇放电
由于Mn电极具有这种电位恢复的特性,所以 Zn-MnO2干电池 间歇放电时的放电曲线为锯齿状 如图2-5所示,间歇放电曲线比 间歇放电时的放电曲线为锯齿状。如图 所示 间歇放电曲线比 连续放电曲线平坦。 所以说 Zn Z -MnO M O2 电池适宜于电流和电压间歇放电。 电池适宜于电流和电压间歇放电
15
2. 锌锰干电池的工作原理
歧化反应:
当 pH 值较低时,水锰石的转移通过下述反应进行:
2MnOOH+2H + MnO 2 +Mn 2+ +2H 2 O
该反应中,两个水锰石分子发生自身氧化还原反应,一个分 子被氧化为 MnO2,一个分子被还原为 Mn2+。此反应可使 MnO2 晶体表面积累的水锰石得以消除。在酸性溶液中,pH 值小, H+ 浓度大,有利于歧化反应进行。而随着 pH 值得增大,歧化反应 进行的速率减慢。 进行的速率减慢
由图中的曲线可知,电池在放电初期,电压的变化较大,这主 要是由电池正极所决定的。二氧化锰电极的电位在开始放电的一瞬 间,变化很快,稍后才是较为平稳的下降,这是由于二氧化锰中加 入了乙炔黑、石墨、氯化铵等混合物后,至使电极的导电性增加了 。但是电极反应也变得更为复杂了,构成了 但是电极反应也变得更为复杂了 构成了MnO2-C多电极体系。 多电极体系 由于碳能吸附一定量的氧气所以它实际上构成了氧电极,由于石墨 、乙炔黑的导电性大于二氧化锰,故最初参与放电的是氧电极: 乙炔黑的导电性大于二氧化锰 故最初参与放电的是氧电极:
