南昌大学06-07学年分析化学末考试题及答案
南昌大学 2006~2007学年第一学期期末考试 有机化学C卷(含答案)
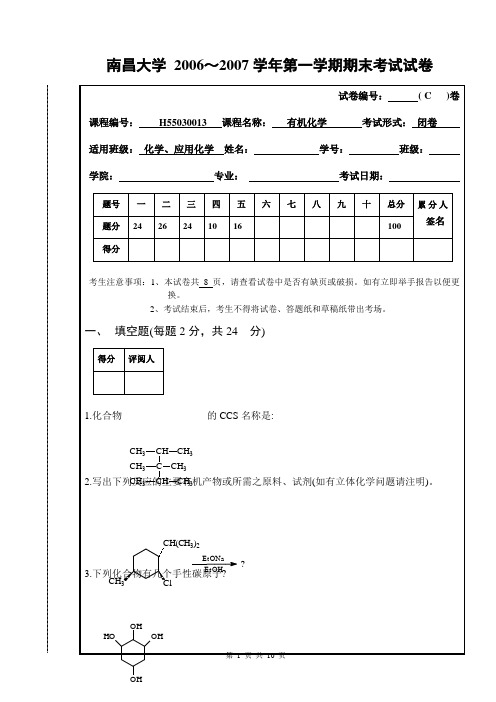
南昌大学2006~2007学年第一学期期末考试试卷南昌大学 2006~2007学年第一学期期末考试有机化学C 卷 答案一、填空题 ( 每题2分,共24分 )1. [解]2,3,3,4-四甲基戊烷2. [解]3. [解] 4个。
4. [解]5. [解]6. [解]2,2,4,7-四甲基-5-乙基-3-辛烯7. [解] C 6H 5CH(OCH 3)─CH 2CH 3 (±)8. [解] 羧酸 9. [解]10. [解]ClNO 2Cl11. [解]12. [解] (CH 3)2CHBr二、选择题 ( 每题2分,共26分 )1. [解](B)2. [解](A)3. [解](A)4. [解](B)5. [解] (A)6. [解] (B)7. [解] (D)8. [解](B)9. [解](B) 10. [解](B) 11. [解](D) 12. [解](A) 13. [解] (D)三、合成题 ( 每题4分,共24分 )1. [参解] 由1-丁醇 (1) 浓H 2SO 4,△ (2)Br 22. [参解] 2-丁烯 ①H 2SO 4,H 2O ②Na 2Cr 2O 7 得(A)乙烯 ③HBr ④Mg,乙醚,得(B) (A) + (B) 得(C), (C) ⑤H +,△ ⑥Br 2,CCl 4 3. [参解] ①Br 2 ②KOH / 醇,△ (-2HBr) ③Lindlars,H 2 4. [参解] 3)2CH 3BrICH 2CH 2CHCH 2CH 3C C CH 3H CH 3HC(CH 3)32CH(CH 3)25. [参解] 丙烯酸乙酯,2-甲基-1,3-丁二烯 ① Diels-Alder 反应 ② 2CH 3MgBr,H 3+O6. [参解] 先由乙烯制得环氧乙烷与乙醛, 丙烯(1) HBr (2) Mg(乙醚) (3) 环氧乙烷,H 3O +(4) HBr ⑸ Mg(乙醚) ⑹ 乙醛,H 3O +四、推结构题 ( 每题5分,共10分 )1. [解]CH 3COCH 32. [解]五、机理题 ( 每题4分,共16分 )1. [解]自由基加成反应。
南昌大学 2006~2007学年第二学期有机化学期末考试试卷B(含答案)

南昌大学2006~2007学年第二学期期末考试试卷南昌大学 2006~2007学年第二学期期末考试试卷(B)答案及评分细则一. 填空题(26分) 1. 2 分[解]2-甲基-5-乙基庚烷 2. 2 分 (8259)[解] 3,3- 二甲基 -2- 氯戊烷 3. 4 分 (7203)[参解] (1) CH 3CH 2CH(CH 3)C ≡CH (2) CH 3CH 2CH(CH 3)CH=CH 2 4. 4 分 (8011)[解] (CH 3)2CHCH 2CH 2OH 5. 2 分[解] CH 3CH 2CH 2I 6. 2 分 (8034)[解]7. 2 分[解] (Z )-3-乙基-2-己烯 8. 2 分 [解]邻间对写对其中一个就给2分 9. 4 分 (5589)[解]10. 2 分[解]1,2-环氧丁烷 二.选择题(30分)1. 2 分[解](C)2. 2 分 [解](A)3. 2 分 [解](B)4. 2 分[解](C)5. 2 分[解] (A)6. 2 分[解] (D)7. 2 分[解](C)8. 2 分[解](B)9. 2 分[解](B) 10. 2 分 [解](A) 11. 2 分 [解](A) 12. 2 分[解](A)13. 2 分[解](D) 14. 2 分[解](C) 15. 2 分[解](C)三.合成题(20分)1. [参解] ①NBS,△, 2分②HBr,过氧化物3分2. [参解] ①H 2SO 4,△ ②HBr,过氧化物 1分③叔丁醇钠,得Hofmann 烯 1分④Br 2 1分⑤NaNH 2,得炔 1分⑥NaNH 2,CH 3I 1分 NO 2CH(CH 3)2,第 11 页 共 11 页 3.[参解](1) 3-氯丙烯 ①Cl 2,H 2O ②Ca(OH)2 环氧化(2) 邻苯二酚单甲醚 ①NaOH ②③H 3+O 每步1分4.[参解] 由乙烯制得环氧乙烷.1分乙烯 (1) HBr (2) Mg(乙醚) 1分 (3)环氧乙烷(4) H 3O + 1分 (5) HBr,Mg(乙醚) 1分 (6) HCHO,H 3O + 1分四.推结构题(12分)1. [解](A)环己烯 3分 (B)环己烷 3分2. [解]CH 3CCl 2CH 3 6分五机理题(12分)1. [解]S N 1机理。
(最新整理)分析化学期末试题及参考答案

A、相等;B、浓度大突跃大; C、浓度小的滴定突 跃大; D、无法判断.
8、用 K 2Cr2O7 法测定 Fe 时,若 SnCl2 量加入不足, 则 导致测定结果 ( B )。
A、偏高; B、偏低;C、无影响; D、无法判断。
9、碘量法测铜时,加入 KI 的目的是( C )。
A、氧化剂 络合剂 掩蔽剂; 、缓冲剂 络合剂 预处理剂。
10、对于 AgCl 沉淀,在酸性溶液中进行沉淀时,使 沉淀溶解度减小的因素
***
是( A
分析化学期末试题及参考答案
)。
A、同离子效应; B、盐效应; C、酸效应; D、络 合效应.
11、在重量分析中,洗涤无定形沉淀的洗涤液应该是(
C
)。
A、冷水; B、含沉淀剂的稀溶液; C、热的电解 质溶液; D、热水。
12、在沉淀形成过程中,与待测离子半径相近的杂质 离子常与待测离子一道
与构晶离子形成( B ).
A、吸留; B、混晶;C、包藏;D、继沉淀。
13、将磷矿石中的磷以 MgNH 4PO4 形式沉淀、再灼烧 为 Mg2P2O7 形式称量,
分析化学期末试题及参考答案
分析化学期末试题及参考答案 编辑整理:
尊敬的读者朋友们: 这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们 对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(分析化学期末试题及参考 答案)的内容能够给您的工作和学习带来便利。同时也真诚的希望收到您的建议和反馈,这将是 我们进步的源泉,前进的动力。 本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快 业绩进步,以 下为分析化学期末试题及参考答案的全部内容。
***
南昌大学 2006

南昌大学06-07有机化学期末考试(A)试卷及参考答案有机化学试题及参考答案(下)-3一、命名或根据名称写结构式(10分)。
1、CH 3CH 2NCH 2CH 2CH 3CH 32、H 333、32COOH8、苄基三甲基溴化铵β — D — 麦芽糖9、对氨基苯磺酸L __ 苯丙氨酸二、完成下列反应(30分)。
1、2、+BrCH 2CH 2CH 2CH 2Br3、3CH 3I (过量)Ag 2O (湿) 10、4、57、N-COOH -COOH6NO 242N-甲基-N-乙基丙胺N-甲基-对甲基苯胺α、β-吡啶二甲酸甲基-α-D-吡喃葡萄糖苷β-吲哚乙酸α-呋喃甲醛 或 糠 醛COOHH 2N H HH-CH 2N +(CH 3)3Br -H 2N--SO 3H22Br -N33H 34、2CH 2+NCH 2CH 3CH 3CH 3[ ]OH △-CH = CH 25、=O+1、BrCH 2 CCH 32、H 3+O[ ]6、7、H32O=Ac 2O5℃8、39、42510、311、△光照12、+△[ ][ ]3H 3 1. ClCH 2CH = CH 2243NN=O=O _CH 2 CCH 3=OHNO 2SO 3HNCH 3I -N3H 322CH 3CH 33O13、OH (CH 3)2SO 4H 3+OCHO OCH 3H H H 3COOCH 3H OHHCH 2OCH 314、HIO 4CHO OH H HHO CH 2OH3+2[ ]+15、三、根据题目要求回答问题(26分)1、2Zn — NaOH 的产物是()。
2、CHO CHOA B C 、D 3、进行亲电取代反应活性由高→ 低的顺序:NA 、C 、D 、E 、B +A 、B B 2D 、+△的主要产物是()。
[ ]3)22(CH (CH 2+33H 333H 3H 22H 2N H 3C 、OCH 34、下列情况下无变旋现象的是( 、 )。
2006-2007《分析化学》期末考试试卷(B)

二、回答问题(每题6分,共42分,写试卷纸上)1.已知某NaOH标准溶液吸收了二氧化碳,有部分NaOH变成了Na2CO3。
用此NaOH 溶液测定HCl的含量,以甲基红为指示剂,对测定结果有何影响,为什么?若使用酚酞作指示剂又如何。
2.什么是配合物的条件稳定常数和配位反应的副反应系数,它们之间的关系如何?3.电对的条件电势大小与哪些因素有关?4.吸光光度法中透光率和吸光度的关系式是什么?5.解释下列现象:(1) 用KMnO4滴定C2O42-时,滴入KMnO4的红色消失速度由慢到快;(2) 间接碘量法测铜时,若试液中有Fe 3+ 和AsO43-,它们都可将I-氧化成I2,加入NH4HF2可消除两者的干扰,解释其中原因。
6.用吸光光度法测定某一金属离子,共存离子组分会干扰,有哪些办法可以消除干扰?7.有一新有机显色剂为弱酸,采用吸光光度法测定其离解常数,请阐述理论依据和测定过程。
三、计算题(每题8分,共32分)1.二元弱酸H2B,已知pH=1.92时,δH2B =δHB-;pH=6.22时δHB-=δB2-。
计算:(1)H2B的K a1和K a2。
(2)如果以0.100 mol/L的NaOH溶液滴定0.100 mol/L的H2B,滴定至第一和第二化学计量点时,溶液的pH值各为多少?各选用何种指示剂?2. 25.00mL KI溶液,用10.00mL 0.0500mol/L KIO3溶液处理后,煮沸溶液除去I2。
冷却后加入过量KI溶液使之与剩余KIO3反应,然后将溶液调整至中性。
析出的I2用0.1008mol/L Na2S2O3溶液滴定,消耗21.14mL,求原KI溶液的浓度(10分)。
3.某矿石含铜约0.12%,用双环己酮草酰二腙显色光度法测定。
试样溶解后转入100ml容量瓶中,在适宜条件下显色,定容.用1cm比色皿,在波长600nm测定吸光度,要求测量误差最小,应该称取试样多少克?ε=1.68×104(L·mol-1·cm-1),M Cu=63.5)4.用有机溶剂从100mL水溶液中萃取某药物成分A两次,每次用有机溶剂10mL,欲使总萃取率达99%以上, 则A在两相中的分配比D应为多大? 萃取完后将有机相合并,用等体积水洗涤一次, 则将损失多大比例?(不考虑溶液中的其它因素影响)一.填空(每空1分,共26分,写在试卷上)1. 将0.20mol/LSO42-和0.10mol/LBa2+等体积混合,欲通过加动物胶(p Ka1=2.0,p K a2=8.5 )促其凝聚,这时沉淀溶液的pH值应为___小于2.0______。
完整版)分析化学考试题库有答案

完整版)分析化学考试题库有答案分析化学题库第一、二章:绪论、误差判断题:1.根据测定原理,分析化学可分为化学分析和仪器分析两大类。
(√)2.分析化学的任务包括定性分析、定量分析、结构分析和形态分析。
(×)3.用高锰酸钾法测定双氧水中过氧化氢的含量属于滴定分析。
(√)4.偶然误差是定量分析中误差的主要来源,它会影响分析结果的精密度。
(√)5.可疑值(或逸出值)必须被舍去。
(×)6.被分析的物质称为样品,与样品发生化学反应的物质称为试剂,以化学反应为基础的分析方法称为化学分析法。
(√)7.偏差是测量值与平均值之间的差异。
(×)8.绝对误差是测量值与真实值之间的差异。
(√)9.增加平行测定次数,可以减少系统误差。
(×)10.当偶然误差被消除后,分析结果的精密度越高,准确度越高。
(×)11.在滴定分析中,测定结果的精密度越高,其准确度也越高。
(×)12.相对平均偏差、样本标准偏差、总体标准偏差都可用来表示测定值的分散程度。
(×)13.增加测定次数可以提高分析结果的准确度。
(×)14.用20 mL 移液管移取 NaOH 溶液,体积数应记为 20.00 mL。
(×)15.根据测定原理,分析化学可分为化学分析和仪器分析两大类。
(√)16.用酸碱滴定法测定醋酸的含量属于化学分析。
(√)17.化学分析是分析化学的基础,仪器分析是分析化学发展的方向。
(√)18.在一定称量范围内,被称样品的质量越大,称量的相对误差就越小。
(√)19.滴定管的初读数必须为“0.00 mL”。
(×)20.测定 0.8 mL 样品溶液的含量,属于常量分析。
(×)21.测定值与真实值相接近的程度称为准确度。
(√)填空题:1.配制用的蒸馏水中含有少量被测组分,此情况属于系统误差。
2.用 50 mL 移液管移取 NaOH 溶液,体积数应记为 50.00 mL。
南昌大学分析化学期末试题
一、选择题( 共9题18分) ACBCD 6-9.DCCB)1. 2 分(4281)对于下列四种表述,不正确的是----------------(a )(1) 为了减小测量误差,称样量越大越好(2) 仪器分析方法因使用仪器,因此准确度高(3) 增加平行测定次数不能消除系统误差(4) 做空白试验可消除系统误差(A)1,2 (B)1,2,4 (C)1,3,4 (D)1,2,32. 2 分(1070)用沉淀滴定法测定银,下列方式中适宜的是-----------------( c )(A) 莫尔法直接滴定(B) 莫尔法间接滴定(C) 佛尔哈德法直接滴定(D) 佛尔哈德法间接滴定3. 2 分(2762)用NaOH标准溶液测定FeCl3溶液中的游离HCl时,Fe3+将产生沉淀而引起干扰,可消除其干扰的物质是-----------------------( b )(A) Na2H2Y (B) CaY2- (C) 柠檬酸三钠(D)三乙醇胺4. 2 分(2269)2269某有色络合物溶液的透射比T = 9.77%,则吸光度值lg(1/T)为------------------( c )(A)1.0 (B)1.01 (C)1.010 (D)1.01015. 2 分(1025)移取饱和Ca(OH)2溶液50.00mL,用0.05000mol/L HCl标准溶液滴定,终点时, 耗去20.00mL,由此得Ca(OH)2沉淀的Ksp为-------------------------(d )(A) 1.6×10-5 (B) 8.0×10-6(C) 2.0×10-6 (D) 4.0×10-66. 2 分(0704)若络合滴定反应为: M + Y = MY,则酸效应系数aY(H)表示--------------------( d )│H+HiY(i=1-6)(A) [Y]/c(Y) (B) ∑[HiY]/c(Y)(C) [Y]/([Y]+∑[HiY])(D) ([Y]+∑[HiY])/[Y]7. 2 分(2756)在一定酸度下,用EDTA滴定金属离子M。
《分析化学》期末考试试卷及答案a
《分析化学》A考试试卷1.写出下列各体系的质子条件式:(1)c1(mol/L) NH4 H2PO4(2)c1(mol/L)NaAc+ c2(mol/L)H3BO32.符合朗伯-比尔定律的有色溶液,当有色物质的浓度增大时,其最大吸收波长,透10.以波长为横坐标,吸光度为纵坐标,测量某物质对不同波长光的吸收程度,所获得的曲线称谓;光吸收最大处的波长叫做,可用符号表示。
11.已知Zn(NH3)42+的各级累积形成常数logβ1—logβ4分别为2.3、4.6、7.0和9.0,则它们的第四级形成常数logK4= 。
12. 分光光度法的基础是,其相对误差一般为。
此法适用于量组分的测定。
13.在纸色谱分离中,是固定相。
14.晶形沉淀的条件述为①在的溶液中进行;②在下,加入沉淀剂;③在溶液中进行;④。
15沉淀滴定法中莫尔法、佛尔哈德法、法扬司法的指示剂分别是:、、。
A、0.1mol/L HClB、0.1mol/L HAcC、1mol/L NH3·H2OD、1mol/L HAc + 1mol/L NaAc7、用EDTA滴定M2+时,下列情况能够增大滴定突跃的是:A、固定C M使K/MY减小B、使K/MY固定减小C MC、增大C M和K/MYD、减小C M和K/MY8、当金属离子M 和N 共存时,欲以EDTA 滴定其中的M ,若c M =10c N ,TE=0.1%, ΔpM=0.2。
则要求ΔlgK 的大小是:A 、5B 、6C 、4D 、79、下列关于滴定度的叙述,正确的是:A 、1g 标准溶液相当被测物的体积(mL)B 、1ml 标准溶液相当被测物的质量(g)C 、1g 标准溶液相当被测物的质量(mg)D 、1mL 标准溶液相当被测物的体积(mL)10、已知在酸性介质中E θ’(Cr 2O 72-/Cr 3+)=1.00V ;E θ’(Fe 3+/Fe 2+)=0.68V 。
以0.03333mol/L K 2Cr 2O 7标准溶液滴定0.2000 mol/L Fe 2+溶液,计量点电位为( )。
南昌大学分析化学题库
一、选择题( 共11题20分)1. 2 分(1107)1107以下说法错误的是--------------------------------------------------------------------------------( A )(A) 摩尔吸光系数ε随浓度增大而增大(B) 吸光度A随浓度增大而增大(C) 透射比T随浓度增大而减小(D) 透射比T随比色皿加厚而减小2. 2 分(1069)0813以某吸附指示剂(p K a=5.0)作银量法的指示剂,测定的pH应控制在--------------------( C )(A) pH<5.0 (B) pH>5.0(C) 5<pH<10.0 (D) pH>10.03. 2 分(0417)0417今欲用H3PO4与Na2HPO4来配制pH = 7.2的缓冲溶液,则H3PO4与Na2HPO4物质的量之比n(H3PO4)∶n(Na2HPO4)应当是---------------------------------------------------------------( C ) (H3PO4的p K a1~p K a3分别是2.12,7.20,12.36)(A) 1:1 (B) 1:2 (C) 1:3 (D) 3:14. 2 分(1101)1101符合朗伯-比尔定律的一有色溶液,当有色物质的浓度增加时,最大吸收波长和吸光度分别是-------------------------------------------------------------------------------------------------------( A )(A) 不变、增加(B) 不变、减少(C) 增加、不变(D) 减少、不变5. 2 分(0808)0808在pH=5.0时, 用EDTA溶液滴定含有Al3+,Zn2+,Mg2+和大量F-等离子的溶液, 已知lg K(AlY)=16.3, lg K(ZnY)=16.5, lg K(MgY)=8.7, lgαY(H)=6.5, 则测得的是---------------( C )(A) Al,Zn,Mg总量(B) Zn和Mg的总量(C) Zn的含量(D) Mg的含量6. 2 分(0335)0335用NaOH溶液滴定H3PO4溶液至pH = 4.7时,溶液的简化质子条件为--------------( C )(H3PO4的p K a1~p K a3分别是2.12、7.20、12.36)(A) [H3PO4] = [H2PO4-] (B) [H2PO4-] = [HPO42-](C) [H3PO4] = [HPO42-] (D) [H3PO4] = 2[PO43-]7. 2 分(0818)在络合滴定中有时采用辅助络合剂, 其主要作用是---------------------------------------( B )(A) 控制溶液的酸度(B) 将被测离子保持在溶液中(C) 作指示剂(D) 掩蔽干扰离子8. 2 分(2321)以下溶液稀释10倍时,pH改变最小的是-------------------------------------------------( B )(A) 0.1mol/L HAc (B) 0.1mol/L NH4Ac(C) 0.1mol/L NaAc (D) 0.1mol/L NH4Cl9. 2 分(0812)用EDTA滴定Bi3+时, 消除Fe3+干扰宜采用-----------------------------------------------( B )(A) 加NaOH (B) 加抗坏血酸(C) 加三乙醇胺(D) 加氰化钾10. 1 分(0819)EDTA与金属离子络合时, 一分子的EDTA可提供的配位原子数是------------------( C )(A) 2 (B) 4 (C) 6 (D) 811. 1 分(1068)1068莫尔法测定Cl-含量时,要求介质的pH在6.5~10范围内,若酸度过高则---------------( C )(A) AgCl沉淀不完全(B) AgCl吸附Cl-增强(C) Ag2CrO4沉淀不易形成(D) AgCl沉淀易胶溶二、填空题( 共10题20分)12. 2 分(1114)1114一符合比尔定律的有色溶液,当浓度为c时,透射比为T,若其它条件不变,浓度为c/3时,T 为_________,浓度为2c时,T为_____________。
《分析化学》期末试卷及答案.doc
________ 系—级 ______________ 班 姓名 __________________ 学号 成绩 ____________•、填空(每空1分,共20分)1819201 •间接碘量法加入淀粉指示齐啲时间是(B )o A.滴定开始前 B.滴定金接近终点时C.滴定至中途D.滴定碘的颜色褪去 2. 用佛尔哈徳法测定的条件是(D )。
A.碱性B.不要求C.中性D.酸性莫尔法适用于测CT 和BF 而不适用于测「是因为(A )oA.AgI 强烈吸附]B.没有合适的指示剂C.选择酸碱指示剂时,下歹哪种因素不需考虑(A.化学计量点的pHB.指示剂变色范围下列各数中,有效数字位数为四位的是(CA. [BT] =0.0003mol*L _,B.pH=10.42C.W (MgO ) =19.96%6. 下列仪器不用所装溶液润贬次的是(B )oA.滴定管B.容量瓶C.移液管D.试剂瓶7. 下歹恪条件屮何者不是晶形沉淀所要求的沉淀条件(A )oA.沉淀作用宜在较浓溶液中进行;B.应在不断的搅拌下加入沉淀剂;C.沉淀作用宜在热溶液中进行;D.应进行沉淀的陈化。
&用法扬司法测CT 时,常加入糊精,其作用是(B )oA.掩蔽干扰离子B.防止AgCl 凝聚C.防止AgCl 沉淀转化D.防止AgCl 感光 9. 用法扬司法测定卤化物时,为使滴定终点变色明显,则应该 (C )。
A.使被测离子的浓度人些;B.保持溶液为酸性;C.避光;D.使胶粒对指示剂的吸附能力人于对被测离子的吸附能力; 10. 下列要求屮不属于重量分析对称量形式的要求的是 (B )。
A.相对摩尔质量耍大B.表面积耍大C.耍稳定D.组成耍与化学式完全符合11. 品形沉淀的沉淀条件是(C )oA.浓、冷、慢、搅、陈;B.稀、热、快、搅、陈;C.稀、热、慢、搅、陈;D.稀、冷、慢、搅、陈;12.下列物质中能作为基准试剂的是( A )o A. K^C R O?B. H3PO4C. HC1D. NaOH13.pH=l0.05的有效数字的位数为(B )o A. 1位B.2位C3位 D.4位3.《分析化学》期末考试试卷出卷人: ____________ 审核人: ______________4.5. "、稳定易被氧化D. C )oC.扌旨示剂的物质的量KspAgi < KspAgCl D.滴定方向D.400014.下列情况屮会引起偶然误差的是(D )oA.祛码腐蚀B.天平两臂不等长C.试齐忡含有微量待测组分D电压的微小变化15.下列条件中属于品型沉淀条件的是(A )。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分析化学课试卷 (A卷)(答题纸在另页)一.选择题(每题1分,共35分)1.按被测组分含量来分,分析方法中常量组分分析指含量( D )A.<0.1%B.>0.1%C.<1%D.>1%2.比较两组测定结果的精密度( B )甲组:0.19%,0.19%,0.20%, 0.21%, 0.21%乙组:0.18%,0.20%,0.20%, 0.21%, 0.22%A.甲.乙两组相同B.甲组比乙组高C.乙组比甲组高D.无法判别3.国家标准规定的实验室用水分为( C )级。
A.4B.5C.3D.24.分析纯化学试剂标签颜色为( C )A.绿色B.棕色C.红色D.蓝色5.可用下列何种方法减免分析测试中的系统误差( A )A.进行仪器校正B.增加测定次数C.认真细心操作D.测定时保证环境的湿度一致6.测定试样中CaO的质量分数,称取试样0.9080g,滴定耗去EDTA标准溶液20.50mL,以下结果表示正确的是 ( C )A.10%B.10.1%C.10.08%D.10.077%7.在滴定分析中,一般用指示剂颜色的突变来判断化学计量点的到达,在指示剂变色时停止滴定。
这一点称为( C )A.化学计量点B.滴定误差C.滴定终点D.滴定分析8.滴定管可估读到±0.01mL,若要求滴定的相对误差小于0.1%,至少应耗用体积( B )mLA. 10B. 20C. 30D. 409.使用分析天平时,加减砝码和取放物体必须休止天平,这是为了( B )A . 防止天平盘的摆动;B . 减少玛瑙刀口的磨损;C . 增加天平的稳定性; D. 加块称量速度;10.共轭酸碱对的Ka 与Kb的关系是( B )A. Ka Kb= 1 B. KaKb=KwC. Ka/Kb=KwD. Kb/Ka=Kw11.酸碱滴定中选择指示剂的原则是( C )A.指示剂变色范围与化学计量点完全符合B.指示剂应在pH =7.00时变色C.指示剂的变色范围应全部或部分落入滴定pH突跃范围之内D.指示剂变色范围应全部落在滴定pH突跃范围之内12.测定(NH4)2SO4中的氮时,不能用NaOH直接滴定,这是因为( D )A. NH3的Kb太小 B. (NH4)2SO4不是酸C. (NH4)2SO4中含游离H2SO4D. NH4+的Ka太小13.指出下列滴定分析操作中,规范的操作是( A )A.滴定之前,用待装标准溶液润洗滴定管三次B.滴定时摇动锥形瓶有少量溶液溅出C.在滴定前,锥形瓶应用待测液淋洗三次D.向滴定管中加溶液距离零刻度1cm时,用滴管加溶液至溶液弯月面最下端与“0”刻度相切14.没有磨口部件的玻璃仪器是( A )A.碱式滴定管B.碘瓶C.酸式滴定管D.称量瓶15.欲配制0.2mol/L 的H2SO4溶液和0.2mol/L的HCl溶液,应选用( A )量取浓酸。
A.量筒B.容量瓶C.酸式滴定管D.移液管16.将称量瓶置于烘箱中干燥时,应将瓶盖( A )A.横放在瓶口上B.盖紧C.取下D.任意放置17.用酸碱滴定法测定工业醋酸中的乙酸含量,应选择的指示剂是( A )A.酚酞B.甲基橙C.甲基红D.甲基红-次甲基蓝18.一般情况下,EDTA与金属离子形成的配合物的配位比是( C )A. 1:3B. 1:2C. 1:1D. 2:119.铝盐药物的测定常用配位滴定法。
加入过量EDTA,加热煮沸片刻后,再用标准锌溶液滴定。
该滴定方式是( C )。
A.直接滴定法B.置换滴定法C.返滴定法D.间接滴定法20.对高锰酸钾滴定法,下列说法错误的是( A )A.可在盐酸介质中进行滴定B.直接法可测定还原性物质C.标准滴定溶液用标定法制备D.在硫酸介质中进行滴定21.在CH3OH + 6MnO4- + 8OH- = 6MnO42- + CO32- + 6H2O反应中,CH3OH的基本单元是( D )。
A.CH3OH B.1/2 CH3OH C.1/3 CH3OH D.1/6 CH3OH22.以K2Cr2O7法测定铁矿石中铁含量时,用0.02mol/L的K2Cr2O7标液滴定,欲消耗25mL左右。
设试样含铁以Fe2O3(其摩尔质量为159.7g/mol)计约为50%,则试样称取量应为( D )A. 0.1g左右;B. 0.2g左右;C. 1g左右;D. 0.5g左右。
23.配制I2标准溶液时,是将I2溶解在( B )中。
A.水B.KI溶液C.HCl溶液D.KOH溶液24.间接碘量法中加入淀粉指示剂的适宜时间是( B )。
A.滴定开始前B.滴定至近终点时C.滴定开始后D.滴定至红棕色褪尽至无色时25.过滤BaSO4沉淀应选用( C )A.快速滤纸;B.中速滤纸;C.慢速滤纸;D.4# 玻璃砂芯坩埚。
26.下述( B )说法是正确的。
A.称量形式和沉淀形式应该相同B.称量形式和沉淀形式可以不同C.称量形式和沉淀形式必须不同D.称量形式和沉淀形式中都不能含有水分子27.晶形沉淀的沉淀条件是( D )A. 稀、热、快、搅、陈B. 浓、热、快、搅、陈C. 稀、冷、慢、搅、陈D. 稀、热、慢、搅、陈28.关于以K2CrO4为指示剂的莫尔法,下列说法正确的是( A )A.本法可测定Cl-和Br-,但不能测定I-或SCN-B.滴定应在弱酸性介质中进行C.指示剂K2CrO4的量越少越好D.莫尔法的选择性较强29.下述操作中正确的是( C )A.比色皿外壁有水珠B.手捏比色皿的磨光面C.手捏比色皿的毛面D.用报纸去擦比色皿外壁的水30.邻二氮菲分光光度法测水中微量铁的试样中,参比溶液是采用( B )A.溶液参比B.空白溶液C.样品参比D.褪色参比31.在目视比色法中,常用的标准系列法是比较( D )A.入射光的强度B.透过溶液后的强度C.透过溶液后的吸收光的强度D.一定厚度溶液的颜色深浅32.有a.b两份不同浓度的有色溶液,a溶液用1.0cm吸收池,b溶液用3.0cm吸收池,在同一波长下测得的吸光度值相等,则它们的浓度关系为 ( D )A. a是b的1/3B. a等于bC. b是a的3倍D. b是a的1/333.( B )是取得准确分析结果最关键的一步。
A.化验准确B.采样准确C.计算准确D.记录准确34.纸层析法的固定相是( C )A.层析纸上游离的水B.层析纸上纤维素C.层析纸上纤维素键合的水D.层析纸上吸附的吸附剂35.对于相似元素Li+、Na+、K+的分离常用( C )法。
A.萃取分离法B.色谱分离法C.离子交换分离法D.沉淀分离法二、判断题(每题1.5分,共30分)36.测定的精密度好,但准确度不一定好,消除了系统误差后,精密度好的,结果准确度就好。
37.电子天平一定比普通电光天平的精度高。
38.直接法配制标准溶液必需使用基准试剂。
39.用移液管移取溶液时,残留于移液管管尖处的溶液应该用洗耳球吹入容器中。
40.国标规定,一般滴定分析用标准溶液在常温(15~25℃)下使用两个月后,必须重新标定浓度。
41.溶解基准物质时用移液管移取20~30ml水加入。
42.H2SO4是二元酸,因此用NaOH滴定有两个突跃。
43.常用的酸碱指示剂大多是弱酸或弱碱,所以滴加指示剂的多少及时间的早晚不会影响分析结果。
44.EDTA酸效应系数αY(H)随溶液中pH值变化而变化;pH值低,则αY(H)值高,对配位滴定有利。
45.滴定Ca2+、Mg2+总量时要控制pH≈10,而滴定Ca2+分量时要控制pH为12~13。
若pH>13时测Ca2+则无法确定终点。
46.用高锰酸钾法测定H2O2时,需通过加热来加速反应。
47.配制好的Na2S2O3标准溶液应立即用基准物质标定。
48.由于混晶而带入沉淀中的杂质通过洗涤是不能除掉的。
49.强酸性阳离子交换树脂含有的交换基团是—SO3H。
50.试样的制备通常应经过破碎、过筛、混匀、缩分四个基本步骤。
51.四分法缩分样品,弃去相邻的两个扇形样品,留下另两个相邻的扇形样品。
52.不同浓度的高锰酸钾溶液,它们的最大吸收波长也不同。
53.不少显色反应需要一定时间才能完成,而且形成的有色配合物的稳定性也不一样,因此必须在显色后一定时间内进行测定。
54.滴定管、容量瓶、移液管在使用之前都需要用试剂溶液进行润洗。
55.纸层析分离时,溶解度较小的组分,沿着滤纸向上移动较快,停留在滤纸的较上端。
三.计算题:(35分)56.用沉淀滴定法测定NaCl中氯的质量分数(ω),得到以下结果:0.6056、0.6046、0.6070、0.6065、0.6069。
试计算:(1)平均结果;(2)平均结果的绝对误差;(3)相对误差;(4)中位数;(5)平均偏差;(6)相对平均偏差。
已知钠和氯的相对原子质量分别22.99和35.45(本题6分)57.市售盐酸的密度为1.18g/mL, HCl的含量为 36%~38%,欲用此盐酸配制500mL0.1mol/L的HCl溶液,应量取多少mL? 已知HCl的摩尔质量为36.46 g/mol(本题4分)58.分析铜锌合金,称取0.5000g试样,处理成溶液后定容至100mL。
取25.00mL,调至pH=6,以PAN 为指示剂,用0.05000mol·L-1EDTA溶液滴定Cu2+和Zn2+用去了37.30mL。
另取一份25.00mL试样溶液用KCN以掩蔽Cu2+和Zn2+,用同浓度的EDTA溶液滴定Mg2+,用去4.10mL。
然后再加甲醛以解蔽Zn2+,用同浓度的EDTA溶液滴定,用去13.40mL。
计算试样中铜、锌、镁的质量分数。
已知铜、锌、镁的相对原子质量分别63.55、65.39、24.31(本题9分)59.有一浓度为0.01726mol/L K2Cr2O7标准溶液,求其对Fe和Fe2O3的滴定度。
称取某铁试样0.2150g,用HCl溶解后,加入SnCl2将溶液中的Fe3+还原为Fe2+,然后用上述K2Cr2O7标准溶液滴定,用去22.32ml。
求试样中的铁含量,分别以Fe和Fe2O3的质量分数表示。
已知Fe和Fe2O3的摩尔质量分别为55.85和159.7g/mol(本题10分)60.现取某含铁试液2.00ml定容至100ml,从中吸取2.00ml显色定容至50ml,用1cm 吸收池测得透射比为39.8%,已知显色络合物的摩尔吸光系数为1.1×104L·mol-1·cm-1。
求某含铁试液中铁的含量(以g·L-1计)已知Fe的摩尔质量分别为55.85 g/mol(本题6分)(2006/2007学年第一学期)分析化学 A 答案一、选择题(35分,将选定的符号写在相应题号后面)二、判断题(30分,在相应的题号后,对的打√;错的打×)三、计算题(35分)56.(6分)解: 0.6061;-0.0005;-0.82‰;0.6065;0.0008;2‰57.(4分)解: 4.1~4.3mL58.(9分)ω(Mg)= 3.99%;ω(Zn)= 35.04%;ω(Cu)= 60.75%59.(10分)解:5.784×10-3g/mL;8.269×10-3g/mL;60.05%;85.84%60.(6分)解:2.54g·L-1。
