高考化学一轮复习一遍过专题08钠及其重要化合物含解析
高考一轮复习钠及其化合物
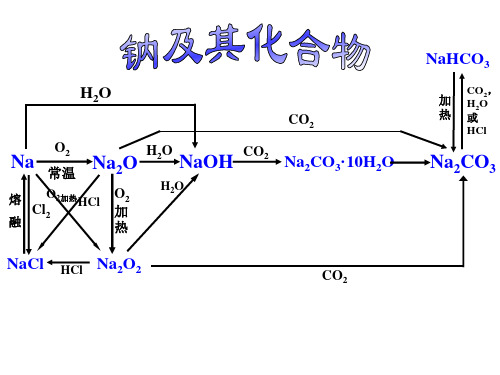
Na2CO3、NaOH
CO2,
H2O 或
HCl
Na2CO3
练习:向含a摩尔NaOH的溶液中,缓慢通入 b摩尔CO2气体,充分反应后,在低温低压下 蒸发溶液,得到不含结晶水的白色固体。 白色固体有四种可能组成,请填写下表:
a/b的取值范围
白色固体组成
1 a/b≤1 2 1< a/b<2 3 a/b=2 4 a/b>2
NaHCO3 Na2CO3、NaHCO3
H2O
CO2
Na
O2 常温
Na2O H2O NaOH CO2
熔 融
O2加热
Cl2
HCl
O2 加
热
H2O
Na2CO3·10H2O
NaCl HCl Na2O2
CO2
NaHCO3
加 热
CO2,
H2O 或
HCl
Na2CO3
一、钠
1、钠的物理性质:
颜色 光泽 状态 密度 硬度
银白色 金属光泽 固态
比水小 比煤油大
四、NaOH
1.俗名: 烧碱、火碱、苛性钠 2.潮解
43..工氢业氧2制化、法钠固氢体溶氧于化水会钠放出N大a量O的H热.
电解
2NaCl + H2O = 2NaOH + H2 ↑ +Cl2 ↑ 5. 碱的通性
与CO2反应的量的关系
2NaOH + CO2 = Na2CO3 + H2O
NaOH + CO2 = NaHCO3 nco2:nNaOH=1:2时,产物只有Na2CO3
HCO3-+H+=CO2↑+H2O
与强碱
HCO3-+OH-=CO32-+H2O
高考化学一轮总复习 钠及其重要化合物作业(含解析)新人教版-新人教版高三全册化学试题

钠及其重要化合物一、选择题1.下列关于金属钠的叙述错误的是( )A.金属钠保存在煤油中B.钠元素只能以化合态存在于自然界C.实验室取用金属钠至少需要3种用品D.钠元素在自然界主要以NaCl的形式存在【解析】选C。
金属钠在空气中就会发生变化,由于钠的密度比煤油大,故钠可以保存在煤油中,A项正确;金属钠性质活泼,在自然界无游离态,B项正确;实验室取用金属钠时,需要用镊子取钠、用滤纸吸干煤油或液体石蜡、用小刀切割、用玻璃皿盛放,所以所需的用品至少有4种,C项错误;海水中含有大量的食盐,钠元素在自然界主要以NaCl的形式存在,D项正确。
2.(2019·大庆模拟)下列有关钠及其化合物的性质说法正确的是( )A.CO2气体使Na2O2固体变白,CO2气体被还原B.除去NaHCO3固体中的Na2CO3,可以将固体加热至恒重C.Na2O2吸收CO2产生O2,所以Na2O2可用作呼吸面具供氧剂D.钠与水反应Na+2H2O Na++2OH-+H2↑【解析】选C。
A、CO2与Na2O2固体反应生成白色固体碳酸钠,其中Na2O2既作氧化剂又作还原剂,二氧化碳中化合价没有变化,所以没有被氧化或被还原,故A错误;B、Na2CO3的热稳定性强于NaHCO3,NaHCO3和Na2CO3混合固体加热至恒重,最终只剩Na2CO3固体,达不到实验目的,故B错误;C、Na2O2吸收CO2产生O2,所以Na2O2可用作呼吸面具供氧剂,故C正确;D、该选项中的离子反应没有配平,将其配平后为2Na+2H2O2Na++2OH-+H2↑,故D错误。
3.为除去括号内的杂质,所选用的试剂或方法不正确的是( )A.Na2CO3溶液(NaHCO3),选用适量的NaOH溶液B.NaHCO3溶液(Na2CO3),应通入过量的CO2气体C.Na2O2粉末(Na2O),将混合物在氧气中加热D.Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤【解析】选D。
新高考化学一轮总复习讲解资料-钠及其化合物
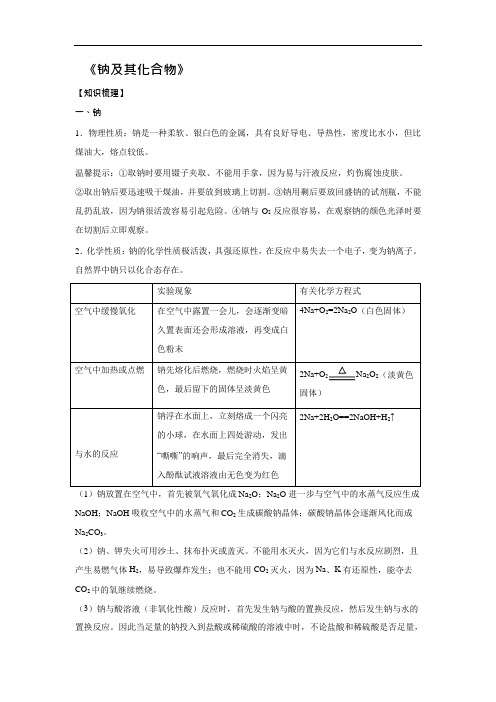
《钠及其化合物》【知识梳理】一、钠1.物理性质:钠是一种柔软、银白色的金属,具有良好导电、导热性,密度比水小,但比煤油大,熔点较低。
温馨提示:①取钠时要用镊子夹取、不能用手拿,因为易与汗液反应,灼伤腐蚀皮肤。
②取出钠后要迅速吸干煤油,并要放到玻璃上切割。
③钠用剩后要放回盛钠的试剂瓶,不能乱扔乱放,因为钠很活泼容易引起危险。
④钠与O2反应很容易,在观察钠的颜色光泽时要在切割后立即观察。
2.化学性质:钠的化学性质极活泼,具强还原性,在反应中易失去一个电子,变为钠离子。
自然界中钠只以化合态存在。
2Na+O2Na2O2(淡黄色固体)(1)钠放置在空气中,首先被氧气氧化成Na2O;Na2O 进一步与空气中的水蒸气反应生成NaOH;NaOH 吸收空气中的水蒸气和CO2 生成碳酸钠晶体;碳酸钠晶体会逐渐风化而成Na2CO3。
(2)钠、钾失火可用沙土、抹布扑灭或盖灭。
不能用水灭火,因为它们与水反应剧烈,且产生易燃气体H2,易导致爆炸发生;也不能用CO2灭火,因为Na、K 有还原性,能夺去CO2 中的氧继续燃烧。
(3)钠与酸溶液(非氧化性酸)反应时,首先发生钠与酸的置换反应,然后发生钠与水的置换反应。
因此当足量的钠投入到盐酸或稀硫酸的溶液中时,不论盐酸和稀硫酸是否足量,金属钠均能完全反应,产生氢气的多少由金属钠决定。
(4)钠与盐溶液反应时,首先发生钠与水的反应,生成NaOH 和H2;然后发生NaOH 溶液与盐溶液的反应。
如钠与硫酸铜溶液的反应,现象为:钠浮在水面上,迅速地熔化为小球,在水面上四处游动,并发出嘶嘶响声,同时溶液中生成蓝色沉淀。
反应过程为:2Na+2H2O =2NaOH+H2↑、CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;总反应为:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑。
3.保存:钠很容易跟空气中的氧气和水起反应,因此在实验室中,通常将钠保存在煤油里,由于ρ(Na)>ρ(煤油),钠沉在煤油下面,将钠与氧气和水隔绝。
2024届高三化学高考备考一轮复习专题:钠及其重要化合物课件

、
g。
(5)无水Na 2 CO 3 可作为基准物质标定盐酸浓度。称量前,若无水Na 2 CO 3
保存不当,吸收了一定量水分,用其标定盐酸浓度时,会使结
果
A.偏高
答案:A
(填字母)。
B.偏低
C.不变
1.侯氏制碱法
(1)制备原料
食盐、氨气、二氧化碳——合成氨厂用水煤气制取氢气时的废气,其反应为C+
B.在Na2O2与CO2的反应中,氧化剂是Na2O2,还原剂是CO2
C.Na和O2在加热时反应生成Na2O2,在常温下反应生成Na2O
D.Na2O2能与水反应,生成NaOH,所以Na2O2是碱性氧化物
2.对Na2O2与CO2和H2O(g)混合气体的反应来说,下列说法错误的是(D
)
A.只要参加反应的Na2O2一定,反应生成的氧气就一定
答案:aefbcg
(2)B中使用雾化装置的优点是
。
答案:增大接触面积,使反应更充分
(3)生成NaHCO3的总反应的化学方程式为
。
答案:CO2+NH3+NaCl+H2O
NaHCO3↓+NH4Cl
(4)反应完成后,将B中U形管内的混合物处理得到固体NaHCO3和滤液:
①对固体NaHCO3充分加热,产生的气体先通过足量浓硫酸,再通过足量
Na2O2,Na2O2增重0.14 g,则固体NaHCO3的质量为
②向滤液中加入NaCl粉末,存在NaCl
(s)+NH4Cl(aq)
NaCl(aq)+
NH4Cl(s)过程。为使NH4Cl沉淀充分析
出并分离,根据NaCl和NH4Cl的溶解度曲
线,需采用的操作为
高考化学一轮必刷题 专题08 钠及其重要化合物(含答案解析)

专题08 钠及其重要化合物1.下列实验中,实验操作和现象,以及得出的结论均正确的是2.某同学用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)。
下列分析推理正确的是( )A.盐酸的物质的量浓度为6.0 mol/LB.当混合物质量为9.2 g时,50 mL盐酸恰好完全反应C.混合物中NaHCO3、KHCO3的物质的量之比为1∶1D.根据表中数据不能计算出混合物中NaHCO3的质量分数3.以CO2和Na2O2为原料,制取纯净干燥的O2,实验装置如下:下列说法不正确...的是A.装置②中试剂可以是NaOH溶液B.装置③的作用是干燥O2C.收集氧气应选择装置aD.装置②、③之间应增加盛澄清石灰水的洗气瓶4.某探究活动小组根据侯德榜制碱原理,按下面设计的方案制备碳酸氢钠。
实验装置如下图所示(图中夹持、固定用的仪器未画出)。
下列说法正确的是A.乙装置中盛放的是饱和食盐水B.丙装置中的溶液变浑浊,因有碳酸氢钠晶体析出C.丁装置中倒扣的漏斗主要作用是防止产生的气体污染空气D.实验结束后,分离碳酸氢钠的操作是蒸发结晶5.下列有关物质性质与用途具有对应关系的是A.NaHCO3能与碱反应,因此食品工业上可用作焙制糕点的膨松剂B.Na2O2与CO2可以发生反应,常用作潜水艇中的供氧剂C.N2性质稳定,工业生产金属镁时,为防止其氧化,可以用N2作保护气D.次氯酸有酸性,可用于自来水的杀菌消毒6.“侯氏制碱法”是我国化工专家候德榜为世界制碱工业作出的突出贡献。
某实验小组模拟“侯氏制碱法”的工艺流程及实验装置(部分夹持装置省略)如下:下列叙述错误的是A.实验时先点燃装置①的酒精灯,过一段时间后再打开装置③中分液漏斗的旋塞B.装置②的干燥管中可盛放蘸稀硫酸的脱脂棉,作用是吸收多余的NH3C.向步骤Ⅰ所得滤液中通入氨气,加入细小的食盐颗粒并降温,可析出NH4ClD.用装置④加热碳酸氢钠可实现步骤Ⅱ的转化,所得CO2可循环使用7.化学在生活中有着广泛的应用,下列对应关系....正确的个数是()①Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂②ClO2具有还原性,可用于自来水的杀菌消毒③SiO2硬度大,用于制造光导纤维④NH3易溶于水,可用作制冷剂⑤次氯酸盐具有氧化性,因而能漂白织物⑥二氧化硅是酸性氧化物,它不溶于任何酸⑦SO2具有还原性,可用于漂白纸浆⑧晶体硅是半导体材料,可做晶体管A.1 B.2 C.3 D.48.向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol·L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是A.OA段所发生反应的离子方程式:H+ + OH-= H2OB.产生的CO2体积(标准状况下)为0.056 LC.原NaOH溶液的物质的量浓度为0.75 mol·L-1D.NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:19.下列有关钠及钠的化合物的说法中,正确的是A.一小块钠置于空气中足够时间,最终会变成Na2O 2B.在饱和Na2CO3溶液中通入足量CO2有沉淀析出C.用洁净的铂丝蘸取溶液放置于酒精灯火焰上灼烧,焰色为黄色;该溶液为钠盐溶液D.7.8gNa2O2和6.2gNa2O分别溶于100g水中,得到溶液的质量分数前者更大10.下列化学事实,不能说明钠的活动性比铁强的是( ) A.钠在常温下与水剧烈反应,铁只能在高温下与水蒸气反应B.钠与氯气反应有白烟产生,铁与氯气反应有棕黄色烟产生C.与相同浓度的盐酸分别反应时,钠比铁要剧烈得多D.钠在空气中很快被氧化为氧化钠,铁在空气中能稳定存在11.我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl的反应原理制备纯碱.下面是在实验室进行模拟实验的生产流程示意图:则下列叙述错误的是()A.A气体是NH3,B气体是CO2B.把纯碱及第Ⅲ步得到的晶体与某些固体酸性物质(如酒石酸)混合可制得发酵粉C.纯碱可广泛地用于玻璃、制皂、造纸、纺织等工业中D.第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶12.下图模拟“侯氏制碱法”制取NaHCO3的部分装置。
【2022新高考化学一轮复习】钠及其重要化合物含答案

钠及其重要化合物一、基础选择题(每小题只有一个选项符合题意)1.下列做法中观察到的现象说明钠的密度比水小的是()A.用小刀切开金属钠B.将钠放在坩埚中加热C.把钠保存在煤油中D.将钠放入盛水的烧杯中2.盐在生产、生活中有广泛应用。
下列盐的性质与用途具有对应关系的是() A.NaClO有氧化性,可用于消毒杀菌B.NaHSO3有还原性,可用于漂白纸浆C.NaCl易溶于水,可用于工业电解制备钠D.NaHCO3受热易分解,可用于制抗酸药物3.用下图所示实验装置进行相关实验探究,其中装置不合理的是()A.鉴别纯碱与小苏打B.证明Na2O2与水反应放热C.证明Cl2能与烧碱溶液反应D.探究钠与Cl2反应4.下列说法正确的是()A.金属钠着火,可用干燥沙土盖灭B.1 L生理盐水(0.9% NaCl溶液)中含有9 mol Na+C.浓硫酸溅到皮肤上,应立即用Na2CO3溶液冲洗D.NaOH浓溶液溅入眼中,应立即用大量水冲洗,再用稀盐酸冲洗5.(2021·合肥模拟)将一定量的碳酸氢钠(含少量氯化钠)固体加热一段时间,再加入足量的盐酸完全反应。
有关叙述正确的是()A.原固体中碳酸氢钠含量越多,钠元素的含量也越多B.若原固体加热质量减少3.1 g,固体中碳酸氢钠质量为8.4 gC.若反应后溶液中含0.1 mol Na+,原固体的质量可能为8.0 gD.原固体分解越完全,消耗盐酸的量越少6.(2020·武汉模拟)将金属钠放入盛有下列溶液的小烧杯中,既有气体,又有白色沉淀产生的是()①MgSO4溶液;②Na2SO4稀溶液;③饱和澄清石灰水;④Ca(HCO3)2溶液;⑤CuSO4溶液;⑥饱和NaCl溶液A.①④⑤⑥B.③④⑤⑥C.②④⑤⑥D.①③④⑥7.下列关于Na2O2的说法正确的是()A.SO2和CO2都是酸性氧化物,SO2与Na2O2反应生成Na2SO3和O2B.84 g NaHCO3受热分解,将生成的气体通过足量的Na2O2,固体质量增加31 g C.将Na2O2投入到酚酞溶液中,溶液变红D.Na2O2与水的反应中,Na2O2既是氧化剂,又是还原剂8.(2020·衡水模拟)倒置的坩埚盖子上放入硫粉,在硫粉中央放一小块钠,按图示搭建装置,用胶头滴管向金属钠中滴加一滴水,立即倒扣上大烧杯,发现坩埚盖子内火星四溅,烧杯内出现大量白烟,下列说法错误的是()A.水是钠与硫反应的催化剂B.酚酞的水溶液变红色C.钠与硫的反应是放热反应D.滤纸逐渐变黑二、综合选择题9.NaCl可制备一系列物质(如图)。
(通用版)19版高考化学微一轮复习第8讲钠及其重要的化

第三章
第1讲
钠及其重要的化合物
2.钠与水、酸、盐溶液的反应 (1)钠与水、酸的反应实质上均是和 H+反应 钠与稀硫酸、盐酸等非氧化性酸反应时,首先是钠直接跟酸反应,过量的钠再与水反 应,而不能认为是钠先跟水反应,生成的 NaOH 再跟酸中和。 钠投入足量盐酸中反应的化学方程式: 2Na+2HCl===2NaCl+H2↑ 离子方程式:2Na+2H ===2Na +H2↑ (2)钠与盐溶液的反应 先考虑 Na 与水反应生成 NaOH,再考虑 NaOH 是否与盐发生复分解反应
(2)b
第三章
第1讲
钠及其重要的化合物
考向三
焰色反应
4.(2018· 安徽十校联考)用光洁的铂丝蘸取某无色溶液在无色火焰上灼烧,直接观察 到火焰呈黄色,下列各判断正确的是( A.只含有 Na+ C.既含有 Na+,又含有 K+ ) B.一定含有 Na+,可能含有 K+ D.可能含有 Na+,可能还含有 K+
化
学
ቤተ መጻሕፍቲ ባይዱ
高三总复习
第三章
金属及其化合物
第三章
第1讲
钠及其重要的化合物
第1讲
考纲要求
钠及其重要的化合物
1.掌握钠的主要性质及其应用。 2.掌握钠的重要化合物主要性质及其应用。
第三章
第1讲
钠及其重要的化合物
考点一
钠的主要性质及其应用
第三章
第1讲
钠及其重要的化合物
1.物理性质 颜色 银白色 2.化学性质 (1)与非金属单质(如 O2、Cl2)的反应 与O2 常温下:化学方程式为4Na+O2===2Na2O。 △ 反应 加热时:化学方程式为2Na+O2=====Na2O2。 熔点 低 硬度 小 密度 导电导热性 良好
2024届高三化学高考备考一轮复习:钠及其化合物课件

(6)1 mol Na2O与Na2O2的混合物中阴离子数为6.02×1023。( ) (7)Na、Na2O2投入FeCl3溶液中均有红褐色沉淀和气体生成。( ) [答案] (1)× (2)√ (3)× (4)× (5)√ (6)√ (7)√
钠及其氧化物的性质与应用 1.把一小块金属钠放入下列溶液中,说法正确的是( C ) A.放入饱和NaOH溶液中:有氢气放出,恢复至原温度后溶液的 pH增大 B.放入稀CuSO4溶液中:有氢气放出,有紫红色铜析出 C.放入MgCl2溶液中:有氢气放出,有白色沉淀生成 D.放入NH4NO3溶液中:有无色无味气体放出
[答案] (1)NaHCO3+CH3COOH===CH3COONa+CO2↑+H2O (2)小苏打水具有碱性,能与酸性物质反应,减小酸性 (3)若服用 小苏打药品,胃中的酸与小苏打反应生成CO2气体,加重胃溃疡
Na2CO3与NaHCO3的性质及应用 1 . 有 关 NaHCO3 和 Na2CO3 与 盐 酸 的 反 应 , 以 下 叙 述 错 误 的 是 (C )
①与非金属反应O2常 加温 热: :4_N_2_Na_+a_+_O_O_2=_2=_==_=△2_=N_=_=a_2N_Oa_2_O__2 ______ Cl2:2Na+Cl2==△===2NaCl
②与 H2O 反应:_2_N_a_+__2_H__2O__=_=_=_2_N__a_O_H__+__H_2_↑__。
2.纯碱和小苏打是厨房中两种常见的物品,它们都是白色固体, 下列区分这两种物质的方法中正确的是 ( C ) A.分别用砂锅加热两种样品,全部分解挥发没有残留物的是小苏 打 B.用洁净铁丝蘸取两种样品在煤气火焰上灼烧,使火焰颜色发生 明显变化的是小苏打 C.用两只小玻璃杯,分别加入少量的两种样品,再加入等量的食 醋,产生气泡快的是小苏打 D.先将两种样品配成溶液,分别加入澄清石灰水,无白色沉淀生 成的是小苏打
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题08 钠及其重要化合物1.下列实验中,实验操作和现象,以及得出的结论均正确的是【答案】B【解析】A.久置的Na2O2粉末,接触空气中的水和二氧化碳最终变质为碳酸钠,向其中滴加过量的盐酸,过氧化钠和碳酸钠均能与盐酸反应生成无色气体,A项错误;B.乙酸乙酯与NaOH溶液共热、搅拌,完全水解生成的乙酸钠与乙醇均溶于水,液体不再分层,B项正确;C.向黄色的Fe(NO3)3溶液中滴加氢碘酸酸化后,得到强氧化剂稀HNO3,无法证明I2是I−被Fe3+氧化所得,C项错误;D. NaHCO3的水解吸热,微热滴加了酚酞的NaHCO3溶液,使水解平衡正向移动,溶液碱性增强,红色加深。
微热达不到NaHCO3分解所需温度,D 项错误。
2.某同学用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)。
下列分析推理正确的是( )A.盐酸的物质的量浓度为6.0 mol/LB.当混合物质量为9.2 g时,50 mL盐酸恰好完全反应C.混合物中NaHCO3、KHCO3的物质的量之比为1∶1D.根据表中数据不能计算出混合物中NaHCO3的质量分数【答案】C【解析】A.据后两组数据可知,加入15.7 g固体混合物时,盐酸已完全反应。
NaHCO3和KHCO3与HCl反应实质相同:HCO+H+=CO2↑+H2O,生成的CO2物质的量为3.36L÷22.4L/mol=0.15mol,则该盐酸中HCl的物质的量为0.15 mol,其物质的量浓度为=3.0 mol/L,A项错误;B.对比第一组和第二组数据可以看出,加入9.2 g固体时盐酸过量,即两种碳酸氢盐完全反应,B项错误;C.据第一组数据列式可得:①n(NaHCO3)+n(KHCO3)=2.24L÷22.4L/mol=0.1 mol;②n(NaHCO3)×84 g/mol+n(KHCO3)×100 g/mol=9.2 g,解之得n(NaHCO3)=n(KHCO3)=0.05 mol,混合物中NaHCO3、KHCO3的物质的量之比为1∶1,C项正确;D.根据C项的解析可知,混合物中NaHCO3的质量分数为×100%=45.7%,D项错误。
3.以CO2和Na2O2为原料,制取纯净干燥的O2,实验装置如下:下列说法不正确...的是A.装置②中试剂可以是NaOH溶液B.装置③的作用是干燥O2C.收集氧气应选择装置aD.装置②、③之间应增加盛澄清石灰水的洗气瓶【答案】C【解析】A.装置②中试剂可以是NaOH溶液,用来除掉二氧化碳气体,故不选A;B. 装置③中盛有浓硫酸,作用是干燥O2,故不选B;C. 由于氧气密度大于空气,选择装置b,故选C;D. 装置②、③之间应增加盛澄清石灰水的洗气瓶,验证二氧化碳是否除尽,故不选D。
4.某探究活动小组根据侯德榜制碱原理,按下面设计的方案制备碳酸氢钠。
实验装置如下图所示(图中夹持、固定用的仪器未画出)。
下列说法正确的是A.乙装置中盛放的是饱和食盐水B.丙装置中的溶液变浑浊,因有碳酸氢钠晶体析出C.丁装置中倒扣的漏斗主要作用是防止产生的气体污染空气D.实验结束后,分离碳酸氢钠的操作是蒸发结晶【答案】B【解析】A. 利用盐酸制取二氧化碳时,因盐酸易挥发,所以,二氧化碳中常会含有氯化氢气体,碳酸氢钠能与盐酸反应不与二氧化碳反应,所以通过碳酸氢钠的溶液是可以除掉二氧化碳气体中的氯化氢气体,因此乙装置中盛放的是饱和碳酸氢钠溶液,故A错误;B. 碳酸氢钠的溶解度比碳酸钠小,丙装置中的溶液变浑浊,因有碳酸氢钠晶体析出,故B正确;C. 实验过程中氨气可能有剩余,而稀硫酸能与氨气反应,所以稀硫酸的作用是吸收末反应的NH3,氨气极易溶于水,丁装置中倒扣的漏斗主要是防止倒吸,故C错误;D. 分离出NaHCO3晶体的操作是分离固体与液体,常采用的实验操作是过滤操作,故D错误。
5.下列有关物质性质与用途具有对应关系的是A.NaHCO3能与碱反应,因此食品工业上可用作焙制糕点的膨松剂B.Na2O2与CO2可以发生反应,常用作潜水艇中的供氧剂C.N2性质稳定,工业生产金属镁时,为防止其氧化,可以用N2作保护气D.次氯酸有酸性,可用于自来水的杀菌消毒【答案】B【解析】A、NaHCO3在食品工业上可用作焙制糕点的膨松剂,是因为NaHCO3受热放出二氧化碳气体,且与酸反应也放出二氧化碳,故A错误;B、Na2O2可与潜水艇中人呼出的CO2发生反应:2Na2O2+2CO22Na2CO3+O2,因此Na2O2可用作供氧剂,故B正确;C、镁可以在氮气中燃烧生成氮化镁,故C错误;D、次氯酸具有强氧化性,可用于自来水的杀菌和消毒,与次氯酸的酸性无关,故D错误。
6.“侯氏制碱法”是我国化工专家候德榜为世界制碱工业作出的突出贡献。
某实验小组模拟“侯氏制碱法”的工艺流程及实验装置(部分夹持装置省略)如下:下列叙述错误的是A.实验时先点燃装置①的酒精灯,过一段时间后再打开装置③中分液漏斗的旋塞B.装置②的干燥管中可盛放蘸稀硫酸的脱脂棉,作用是吸收多余的NH3C.向步骤Ⅰ所得滤液中通入氨气,加入细小的食盐颗粒并降温,可析出NH4ClD.用装置④加热碳酸氢钠可实现步骤Ⅱ的转化,所得CO2可循环使用【答案】D【解析】A. 因为氨气极易溶于水,而二氧化碳在水中溶解度非常小,所以应该先通入氨气,故不选A;B. 过量氨气扩散到空气中会造成污染,所以要进行尾气吸收,2NH3+H2SO4=(NH4)2SO4,故不选B;C.过滤碳酸氢钠晶体后,母液中含有氯化铵,在母液中通入氨气可以增大溶液中铵根离子的浓度,使NH4Cl以晶体的形式析出,故不选C;D.固体加热不可用烧杯,也实现不了二氧化碳循环利用,故选D。
7.化学在生活中有着广泛的应用,下列对应关系....正确的个数是()①Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂②ClO2具有还原性,可用于自来水的杀菌消毒③SiO2硬度大,用于制造光导纤维④NH3易溶于水,可用作制冷剂⑤次氯酸盐具有氧化性,因而能漂白织物⑥二氧化硅是酸性氧化物,它不溶于任何酸⑦SO2具有还原性,可用于漂白纸浆⑧晶体硅是半导体材料,可做晶体管A.1 B.2 C.3 D.4【答案】C【解析】①过氧化钠与二氧化碳、水蒸气反应都产生氧气,常用作供氧剂,可以用作呼吸面具中的氧气来源,故正确;②ClO2具有强氧化性,可用于自来水的杀菌消毒,故错误;③光导纤维的主要成分是二氧化硅,光导纤维是利用光的全反射原理,与二氧化硅的硬度大小无关,故错误;④氨气易液化,变为气体时吸收热量导致周围环境温度降低,所以氨气常作制冷剂,与氨气易溶于水无关,故错误;⑤次氯酸盐具有强氧化性和漂白性,可用于漂白,故正确;⑥二氧化硅是酸性氧化物,能和氢氟酸反应,故错误;⑦SO2具有漂白性,可用于漂白纸浆,故错误;⑧晶体硅是半导体材料,可以用硅制造集成电路、晶体管等半导体器件,故正确。
8.向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol·L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是A.OA段所发生反应的离子方程式:H+ + OH-= H2OB.产生的CO2体积(标准状况下)为0.056 LC.原NaOH溶液的物质的量浓度为0.75 mol·L-1D.NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1【答案】A【解析】NaOH与CO2反应,反应后溶液中溶质可能为NaOH和Na2CO3、Na2CO3、Na2CO3和NaHCO3、NaHCO3,与盐酸反应先后:NaOH、Na2CO3、NaHCO3,发生反应:NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+CO2↑+H2O,根据图像,OA段消耗盐酸的体积大于AB段,推出NaOH与CO2反应后溶液中的溶质为NaOH和Na2CO3,A、根据上述分析,OA段发生离子反应是OH-+H+=H2O、CO32-+H+=HCO3-,故A说法错误;B、AB段发生反应HCO3-+H+=H2O+CO2↑,n(CO2)=(75-50)×10-3L×0.1mol·L-1=2.5×10-3mol,标准状况下CO2的体积为2.5×10-3L×22.4L·mol-1=0.056L,故B说法正确;C、B点溶质为NaCl,根据元素守恒,n(NaOH)=n(NaCl)=n(HCl)=75×10-3L×0.1mol·L-1=7.5×10-3mol,其浓度为7.5×10-3mol/(10×10-3)mL=0.75mol·L-1,原溶液中NaOH浓度为0.75mol·L-1,故C说法正确;D、根据A、B选项分析,n(Na2CO3)=n(NaHCO3)=n(CO2)=2.5×10-3mol,依据A选项分析,n(NaOH)=[50-(75-50)]×10-3L×0.1mol·L -1=2.5×10-3mol,物质的量之比等于物质的量浓度之比,即c(NaOH):c(NaCO3)=1:1,故D说法正确。
29.下列有关钠及钠的化合物的说法中,正确的是A.一小块钠置于空气中足够时间,最终会变成Na2O2B.在饱和Na2CO3溶液中通入足量CO2有沉淀析出C.用洁净的铂丝蘸取溶液放置于酒精灯火焰上灼烧,焰色为黄色;该溶液为钠盐溶液D.7.8gNa2O2和6.2gNa2O分别溶于100g水中,得到溶液的质量分数前者更大【答案】B【解析】A.切开金属钠置于空气中,切口开始呈银白色(钠的真面目)→变暗(生成Na2O)→变白色固体(生成NaOH)→成液(NaOH潮解)→结块(吸收CO2成Na2CO3?10H2O)→最后变成Na2CO3粉末(风化),故A错误;B.由Na2CO3+H2O+CO2=2NaHCO3可知,此反应消耗水,且Na2CO3转化为NaHCO3后溶质质量增加,又因NaHCO3溶解度较小,所以会有晶体析出,故B正确;C.用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中一定含Na+,可能为钠盐或氢氧化钠溶液,故C错误;D.6.2gNa2O与水反应生成氢氧化钠,溶液中的溶质是氢氧化钠,根据化学式Na2O→NaOH知,生成氢氧化钠的质量为8g,溶液的质量=氧化钠和水的质量=6.2g+100g=106.2g,所以该溶液的质量分数为7.5%;7.8gNa2O2与水反应生成氢氧化钠和氧气,所以溶液中的溶质是氢氧化钠,根据化学式Na2O2→NaOH知,生成氢氧化钠的质量为8g,溶液的质量=过氧化钠+水的质量-氧气的质量=7.8g+100g-1.6g=106.2g,所以该溶液的质量分数为7.5%,故D错误。
