有关氮族元素及其化合物的化学方程式(答案)
专题01 氮元素拓展之实验大题-【微专题 大素养】备战2022年高考化学核心突破(元素拓展综合题)

专题01 氮族元素拓展之实验大题知识点一氮的氢化物之拓展1)联氨N2H4:二元弱碱N2H4+H2O==N2H5++OH-N2H5++H20==N2H62++OH-不稳定易分解:N2H4===N2+H2以还原剂为主,作为火箭推进剂。
2)羟胺NH2OH:一元弱碱:NH2OH+H20==NH3OH++OH-不稳定易分解:3NH2OH===NH3↑+3H20+N2↑3)叠氮酸HN3:撞击容易分解氮气加氢气。
所以其叠氮化物作为汽车安全气囊的成分。
【立即见效】1.NH2OH (羟胺)是一种无色针状结晶,羟胺及其盐类常用作有机合成的还原剂,回答下列问题:(1)NH2OH的电子式为_______。
(2)室温时,NH2OH会发生分解反应,分解产生的无色气体遇浓盐酸产生白烟,与空气接触变为红棕色;且其分解产物会使无水CuSO4变蓝色,则NH2OH分解反应的化学方程式_______,NH2OH水溶液显碱性,其电离方式类似于氨水的电离,写出其电离方程式:_______【答案】5NH2OH=3NH3↑+2NO↑+3H2O +-223NH OH+H O NH OH+OH2.叠氮酸(HN3)常温下是一种无色液体,其水溶液具有酸性,可与NaOH溶液反应得到叠氮化钠(NaN3)。
某些汽车安全气囊中装有叠氮化钠。
(1)叠氮酸在水溶液中解离出H+和___________(填化学符号),N的化合价为___________。
(2)盐酸和氢氧化钠的反应方程式为___________,类比叠氮酸与NaOH溶液的反应属于___________(填反应类型)。
(3)叠氮化钠受热分解时产生两种单质,该反应的化学方程式为___________。
【答案】(1)N -1 3(2)HCl+NaOH=NaCl+H2O 中和反应或复分解反应(3)2NaN3∆3N2↑+2Na3.联氨(又称联肼,24N H,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:(1)联氨分子的电子式为_______,其中氮的化合价为_______(2)联氨为二元弱碱,第一步电离:24225N H H ON H OH +-++该步平衡常数的值为_______(已知:2425N H H N H +++的714K 8.710kw 1.010-=⨯=⨯) (3)联氨是一种常用的还原剂。
高三总复习 氮族元素及其化合物

NH3的化学性质
1.溶于水、与水的反应
NH3+H2O 2.与酸的反应 3.与氧化剂反应 (大部分)
喷泉实验 NH3· 2O H NH4++OH
-
(小部分) NH4Cl
NH3+HCl 催化剂
(白烟)
4NH3+ 5O2 2NH3+3Cl2
2NH3+3CuO
4NO+6H2O (氨氧化法制硝酸)
N2+6HCl (NH3不足)
制NO2:Cu和浓硝酸
与实验室制氢气、二氧化碳 装置相同 收集: NO----排水法
NO2----向下排空气法 多余气体----碱液吸收
• 知识网络
ቤተ መጻሕፍቲ ባይዱ
氨和铵盐
分子结构:氨分子为三角锥形的分子 物理性质:无色、具有刺激性气味的气体,极易溶于水,易液化
易溶于水— —氨水
化 学 性 质
氨
与H+
铵盐
1.弱电解质NH3+H2O NH4++OH— 2.可溶性——一元弱碱(具有碱的通性) 3.易挥发,不稳定,易分解(保存方法) 1.离子化合物易溶于水 2.受热易分解 3.与碱共热产生氨气 4. NH4+检验方法
(1)与不活泼金属反应(Pt、Au除外) Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀) (2)与活泼金属反应 Fe、Al遇浓硝酸钝化,加热则反应(一般生成NO2)
3Cu(NO3)2+2NO↑+2H2O
Mg、Zn常温下可以与任何浓度的硝酸反应(还原 产物可以是NO2、NO、N2、NH4NO3等。)
NO是一种无色还原性较强的气体,易被氧气氧化 为NO2 ,
NO2是一种红棕色的易溶于水与水反应的气体,氧 化性强,能氧化SO2,能使湿润的KI淀粉试纸变蓝。
高三化学一轮复习必备精品第八章《氮族元素》

证对市爱幕阳光实验学校第八章 氮族元素一、知识体系2.氮的循环:3.氮及其化合物的衍变关系:NH 3 ←N 2 →NO →NO 2→HNO 3→NH 4NO 3→NH 3 NH 3·H 2O NH 4+、OH -4.氮氧化物①各种价态氮氧化物:1N +〔N 2O 〕、2N +〔NO 〕、3N +〔N 2O 3〕、4N +〔NO 2、N 2O 4〕、5N +〔N 2O 5〕,其中N 2O 3和N 2O 5分别是HNO 2和HNO 3的酸酐。
气态的氮氧化物几乎都是剧毒性物质,在太阳辐射下还会与碳氢化物反形成光化学烟雾②NO 和NO 2性质比拟NO :一种无色气体,难溶于水,不成盐氧化物。
常温下,极易被氧化为NO 2:2NO+O 2=2NO 2NO 2:一种有刺激性气味的红棕色气体,溶于水后与水反:3NO 2+H 2O==2HNO 3+NO③氮氧化物溶于水计算方法涉及的可能相关化学反方程式分别为:3NO 2+H 2O=2HNO 3+NO 、4NO+3O 2+2H 2O=4HNO 3、4NO 2+O 2+2H 2O=4HNO 3、NO 2+NO+O 2+H 2O=2HNO 3。
NO 与NO 2混合气体溶于水:反最后得到的气体是NO ,其体积=V 〔NO 〕+1/3V 〔NO 2〕NO 与O 2的混合气体溶于水:假设V 〔NO 〕∶V〔O 2〕=4∶3,那么容器内无气体剩余,水可充满容器。
假设V 〔NO 〕∶V〔O 2〕>4∶3,那么容器内剩余气体为过量的NO 。
假设V 〔NO 〕∶V〔O 2〕<4∶3,那么容器内剩余气体为过量的O 2。
NO 2与O 2的混合气体溶于水:假设V 〔NO 2〕∶V〔O 2〕=4∶1,那么容器内无气体剩余,水可充满容器。
假设V 〔NO 2〕∶V〔O 2〕>4∶1,那么NO 2过量,容器内剩余气体为的NO ,体积为过量的NO 2的1/3。
假设V 〔NO 2〕∶V〔O 2〕<4∶1,那么O 2过量,容器内剩余气体为过量的O 2。
高考复习-氮及其化合物

氮气的用途:
(1) 是合成氨、制硝酸的重要原料 (2) 保护气:焊接金属;灯泡的填充气体;
保存粮食、罐头、水果
(3) 医学上,用液氮作冷冻剂。
在常压下,液氮温度为-196℃,液氮(常写为LN2)
(4) 高科技领域中用液氮制造低温环境。
N2制备:
工业上: 空气
空气
降温加压
液态
N2
蒸发
N2 O2
C,△
)
A
氨气的物理性质
无色、有剌激性气味的气体
比空气轻 极易溶于水(1:700) 易液化(可作致冷剂)
熔沸点高(氢键)
氨气的结构和性质
氨气的电子式: 氨气和酸反应的实质是什么?
H + H+ [ ]+
NH3分子有孤对电子,易通过配位键与H+结合 形成NH4+。 据反应实质,解释氨水为什么是碱性的?
大部分
铵盐
铵盐是NH4+和酸根离子组成的化合物。
1.物理性质 铵盐都是晶体,易溶于水。
小结铵盐: 硫酸铵【(NH4)2SO4 ,俗称硫铵】 氯化铵【NH4Cl,俗称氯铵】 硝酸铵【NH4NO3,俗称硝铵、炸药】 碳酸氢铵【NH4HCO3,俗称碳铵】铵盐属于铵态 氮肥。 常用氮肥有铵态氮肥和尿素【 CO(NH2)2 】
请写出氨气的电子式:
氨气的结构和性质
孤对电子
氨气的熔沸点比PH3高还是低,为什么?列出氮族元素 氢化物熔沸点高低顺序。 比PH3高,氨气分子之间能形成氢键。 氨气在水中的溶解度如何?在CCl4或苯中呢? 1:700 氨气极易溶于水,难溶于CCl4或苯。可用来防倒吸 氨气容易发生液化吗?为什么极易液化?利用这个性质 ,液氨可以用作那种用途? 氨气易液化,液氨气化时吸收大量热,可用作制冷剂。
氮族元素方程式

姓名班级姓名班级
氮族元素方程式(能写出离子方程式的写离子方程式)1、氮气与氢气2、氮气与氧气
3、氮气与镁
4、氮化镁与水
5、氨气催化氧化
6、氨气与一氧化氮反应
7、氨气与二氧化氮反应
8、氨气与氧化铜反应
9、氨气与氯气
10、二氧化氮溶于水
11、一氧化氮和氧气的混合气体溶于水
12、二氧化氮和氧气的混合气体溶于水
13、用氢氧化钠溶液吸收二氧化氮
14、用氢氧化钠溶液吸收二氧化氮和一氧化氮混合气体
15、铜与浓硝酸反应
16、少量铁与稀硝酸反应
17、足量铁与稀硝酸反应
18、向氯化钡和稀硝酸混合溶液中通入二氧化硫
19、向氯化亚铁溶液加入稀硝酸无气体产生
20、实验室制溴化氢
氮族元素方程式(能写出离子方程式的写离子方程式)1、氮气与氢气2、氮气与氧气
3、氮气与镁
4、氮化镁与水
5、氨气催化氧化
6、氨气与一氧化氮反应
7、氨气与二氧化氮反应
8、氨气与氧化铜反应
9、氨气与氯气
10、二氧化氮溶于水
11、一氧化氮和氧气的混合气体溶于水
12、二氧化氮和氧气的混合气体溶于水
13、用氢氧化钠溶液吸收二氧化氮
14、用氢氧化钠溶液吸收二氧化氮和一氧化氮混合气体
15、铜与浓硝酸反应
16、少量铁与稀硝酸反应
17、足量铁与稀硝酸反应
18、向氯化钡和稀硝酸混合溶液中通入二氧化硫
19、向氯化亚铁溶液加入稀硝酸无气体产生
20、实验室制溴化氢。
无机课后习题答案12-17、20

3Cu+8HNO3(稀)==3Cu(NO3)2+2NO+4H2O (4)实验室制备 NO2 的反应为: Cu+4HNO3==Cu(NO3)2+2NO2+2H2O
12.3 解:N2 分子中氮氮三键键能很大,不易参加反应;而 NH3 分子中的 N—H 键则键能较小,易 断裂参加反应,故常作为制备含氮化合物的原料。
市售硝酸的百分比浓度为:68%;密度为:1.4g/cm-3;;体积摩尔浓度为:15.1mol/cm-3。市售 磷酸的百分比浓度为:85%密度为 1.6g/cm-3; 体积摩尔浓度为:13.9mol/cm-3。 12.25 解:向 SbCl5 溶液中通入 H2S 时,伴随 Sb2S5 的生成,溶液的酸度提高,Sb5+氧化能力提高而 与 H2S 发生氧化还原反应,有 Sb2S3 和 S 沉淀生成。 2Sb5++5H2S==Sb2S5+10H+ 2Sb5++5H2S==Sb2S3+2S+10H+ 若制较纯的 Sb2S5,应在碱性条件下先得到 SbS43-,再小心加入稀酸即可。 2Sb5++5S2-==Sb2S5 Sb2S5+3S2-==2SbS432SbS43-+6H+==Sb2S5+3H2S 12.26 解:Sb2S3 是两性氧化物,故可以和碱性氧化物反应。反应方程式为: 3Na2S+Sb2S3==2Na3SbS5 而 Bi2S3 没有酸性,不溶于碱金属硫化物中。 Sb2S3 具有还原性,它们可以和具有氧化性的多硫化物反应生成硫代锑酸盐,方程式为: Sb2S3+(NH4)2S2==(NH4)2SbS4 由于 Bi2S3 中 Bi(III)的还原性极若,故不和多硫化物反应。 12.27 解:并不矛盾。碱性条件下:E(AsO43-/AsO2-)=-0.68V,E(I2/I-)=0.5355V,故碘单质可以
4.2.4氮族元素

4NH3 + 3O2
△
2N2 + 6H2O
催化剂(Pt网)作用下,氧化为NO 4NH3 + 5O2
Pt, 1073K
4NO + 6H2O (工业合成硝酸的基础)
氯和溴能在气态或溶液中将NH3氧化成N2,并进一步反应 2NH3 + 3Cl2 N2 + 6HCl NH4Cl(s)(工业上检查Cl2管道是否漏气)
氮族元素形成-3氧化值的趋势从N到Bi减弱,Bi不能形成稳 定的-3氧化值化合物,如NH3稳定, BiH3室温下自动分解
氮族元素氧化物的酸性随原子序数的递增而递减,对于+3 价氧化物,N2O3、P2O3酸性,As2O3两性偏酸,Sb2O3两性, Bi2O3碱性
2013-7-31
4
氮族元素的分布
∶N-N=N∶
H
N2H4+HNO2=HN3+2H2O
NaOH Zn
撞击 N2↑ +H2↑
NaN3
Zn(N3)2+H2↑
AgN3、Cu(N3) 2 、Pb(N3)2 、Hg(N3) 2作为雷管引爆剂; NaN3、KNO3、SiO2为主要成分用于汽车安全气囊,在汽车 受到撞击的一刹那,由于剧烈碰撞,NaN3分解,气袋迅速膨 胀弹出,从而保护司乘人员。
2013-7-31
21
2013-7-31
22
氮氧化物是大气污染物之一,可以引起光化学烟雾,破环臭氧层。 N2O + O = N2 + O2 N2 + O2 = 2NO NO + O3 = NO2 + O2 NO2 + O = NO + O2 总反应式 O3 + O = 2O2 NO 气体还具有治疗哮喘和关节炎,抵御肿瘤,杀死感性细 菌、真菌和寄生虫的能力。Ferid Murad、Louis J. IgnH4)2SO4
无机化学 第15章 氮族元素习题解答 20120319
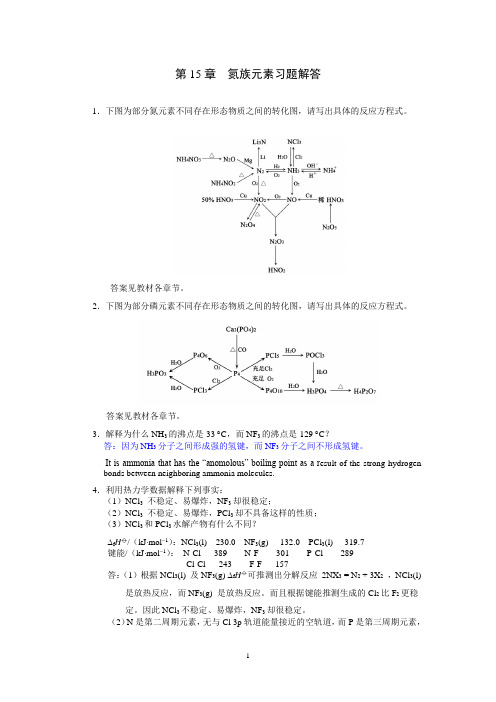
第15章氮族元素习题解答1.下图为部分氮元素不同存在形态物质之间的转化图,请写出具体的反应方程式。
答案见教材各章节。
2.下图为部分磷元素不同存在形态物质之间的转化图,请写出具体的反应方程式。
答案见教材各章节。
3.解释为什么NH3的沸点是-33 ︒C,而NF3的沸点是-129 ︒C?答:因为NH3分子之间形成强的氢键,而NF3分子之间不形成氢键。
It is ammonia that has the “anomolous” boiling point as a r esult of the strong hydrogen bonds between neighboring ammonia molecules.4.利用热力学数据解释下列事实:(1)NCl3不稳定、易爆炸,NF3却很稳定;(2)NCl3不稳定、易爆炸,PCl3却不具备这样的性质;(3)NCl3和PCl3水解产物有什么不同?∆f H/(kJ⋅mol-1):NCl3(l) 230.0 NF3(g) -132.0 PCl3(l) -319.7键能/(kJ⋅mol-1):N-Cl 389 N-F 301 P-Cl 289Cl-Cl 243 F-F 157答:(1)根据NCl3(l) 及NF3(g) ∆f H可推测出分解反应2NX3 = N2 + 3X2,NCl3(l) 是放热反应,而NF3(g) 是放热反应。
而且根据键能推测生成的Cl2比F2更稳定。
因此NCl3不稳定、易爆炸,NF3却很稳定。
(2)N是第二周期元素,无与Cl 3p轨道能量接近的空轨道,而P是第三周期元素,最低空轨道是3d轨道,与Cl的3p轨道能量接近,形成的PCl3中的P-Cl键除σ键以外,还有p-d 反馈π键,使P-Cl 键键级大于1,相对稳定。
所以NCl3不稳定、易爆炸,PCl3却不具备这样的性质。
(3)NCl3水解是亲电水解,产物是NH3和HOCl;PCl3水解是亲电加亲核水解,产物H3PO3和HCl。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有关氮族元素及其化合物的化学方程式 1. 氮气和氢气反应 N 2 + 3H 2 2NH 3
2. 氮气和氧气反应 N 2 + O 2 ===== 2NO
3. 镁在氮气中点燃 3Mg +N 2 ===== Mg 3N 2
4. 氮化镁和水反应 Mg 3N 2 + 6H 2O ==== 3Mg(OH)2↓+ 2NH 3
5. 一氧化氮被氧气氧化 2NO + O 2 ==== 2NO 2
6. 二氧化氮和水反应 3NO 2 +2H 2O ==== 2HNO 3 +NO
7. 一氧化氮氧气的混合气溶于水 4NO +3O 2 +2H 2O ==== 4HNO 3
8. 二氧化氮氧气的混合气溶于水 4NO 2 +O 2 +2H 2O ==== 4HNO 3
9. 二氧化氮和氢氧化钠溶液反应 2NO 2 +2NaOH ==== NaNO 3 +NaNO 2 +H 2O
10. 给盛二氧化氮的密闭容器加压 2NO 2 N 2O 4
11. 磷在氧气中燃烧 4P + 5O 2 ===== 2P 2O 5
12. 磷和氯气反应 2P + 3Cl 2 ==== 2P Cl 3 2P + 5Cl 2 ==== 2P Cl 5 13. 五氧化二磷与热水反应 P 2O 5 + 3H 2O (热)==== 2H 3PO 4
14. 制取银氨溶液 2NH 3 + Ag + === [Ag(NH 3)2]+
15. 氨气溶于水并电离 NH 3 +H 2O NH 3·H 2O NH 4+ + OH —
16. 氨水中通入过量的二氧化碳 NH 3·H 2O + CO 2 ===== NH 4HCO 3
17. 氨与氯化氢反应 NH 3 + HCl ==== NH 4Cl
18. 氨的催化氧化 4NH 3 + 5O 2 ====== 4NO + 6H 2O 19. 氯化铵受热分解 NH 4Cl ===== NH 3↑ + HCl↑
20. 碳酸氢铵受热分解 NH 4HCO 3 ==== NH 3 ↑+ CO 2 ↑+ H 2O
21. 硫酸铵和氢氧化钠加热 (NH 4)2SO 4 + 2NaOH === Na 2SO 4 +2 NH 3↑+2H 2O
22. 实验室制取氨的反应原理2NH 4Cl + Ca(OH)2 ===== CaCl 2 + 2NH 3↑ + 2H 2O
23. 浓硝酸的分解 4HNO 3 =========== 4NO 2↑ + O 2 ↑+ 2H 2O 高温 高压
催化剂 放电
点燃
△
催化剂
△ △ △ △ 微热或光照 点燃 点燃 点燃
24. 铜和稀硝酸的反应 3Cu + 8HNO 3 (稀) ==== 3Cu (NO 3)2 + 2NO ↑+4H 2O
25. 铜和浓硝酸的反应 Cu + 4HNO 3(浓)==== Cu (NO 3)2 + 2NO 2 ↑+2H 2O
26. 不足的铁和稀硝酸反应 Fe + 4HNO 3 (稀) === Fe(NO 3)3 + NO↑+ 2H 2O
27. 足量的铁和稀硝酸反应 3Fe + 8HNO 3(稀) === 3Fe(NO 3)2 +2NO ↑+ 4H 2O
28. 浓硝酸和碳反应 C + 4HNO 3(浓)==== CO 2↑ + 4NO 2↑ + 2H 2O
29. 稀硝酸和银反应 3Ag+ 4HNO3 (稀) ==== 3AgNO 3+ NO↑+ 2H 2O
30. 氢硫酸和稀硝酸反应 3H 2S + 2HNO 3 (稀)==== 3S↓+ 2NO↑+ 4H 2O
31. 亚硫酸钠和稀硝酸反应3Na 2SO 3+2HNO 3(稀) ===3Na 2SO 4 + 2NO↑ + H 2O
32. 苯和硝酸反应
33. 甲苯和硝酸反应
34. 乙醇和硝酸反应C 2H 5OH+HONO 2
C 2H 5ONO 2+H 2O
35. 硝酸和甘油反应
36. 硝化纤维的制取
37. 氨气在纯氧中燃烧 2NH 3 +3O 2 ===== 2N 2 +6H 2O
38. 氨气与灼热的氧化铜反应 2NH 3 +3CuO ===== 3Cu + N 2 ↑+3H 2O
39. 氨气与过量的氯气反应 2NH 3 +3Cl 2 ==== 6HCl +N 2↑
40. 过量的氨气和氯气反应8NH 3 +3Cl 2 === 6NH 4Cl +N 2↑ 点燃 △ △
△。
