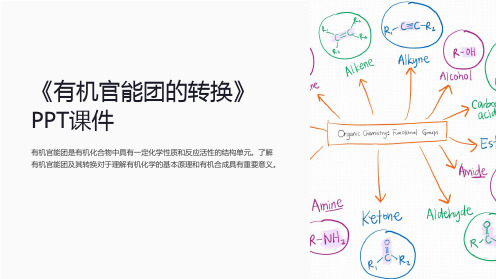
《有机官能团的转换》PPT课件
合集下载
《有机官能团的转换》课件
有机官能团的种类繁多,包括羟基、羰基、氨基、酯基、醚基等。
有机官能团的常见种类
1 羟基
在有机化合物中常见的官能团,具有亲水性 和参与酸碱反应的性质。
2 羰基
包括醛基和酮基,是有机化合物中常见的官 能团,具有亲电性和参与加成反应的性质。
3 氨基
含有氮原子的官能团,可以参与酸碱反应和 亲电取代反应。
4 酯基
它在医药、农业、材料科学等领域具有重要的应用价值。
总结和展望
通过对有机官能团的转换和应用的学习,我们能够深入理解有机化学的基本原理和有机合成的方法。 未来,在有机官能团转化领域的研究和应用将进一步拓展我们对功能有机物的认识和应用。
由羧酸和醇缩合得到的官能团,具有亲电性 和参与酯交换反应的性质。
有官能团的转换
有机官能团的转换指的是通过化学反应将一个有机官能团转化为另一个有机官能团。 这种转换可以通过选择合适的试剂和反应条件来实现,从而实现有机化合物的功能扩展和结构改变。
常见的有机官能团转化反应
1
醇的氧化
通过氧化剂将醇氧化成醛、酮或羧酸。
《有机官能团的转换》 PPT课件
有机官能团是有机化合物中具有一定化学性质和反应活性的结构单元。了解 有机官能团及其转换对于理解有机化学的基本原理和有机合成具有重要意义。
什么是有机官能团
有机官能团是有机分子中特定的原子或原子团,决定了分子的化学性质和反 应活性。
它们可以通过共价键与其他原子或原子团发生化学反应,从而参与有机化学 反应的进行。
2
烷烃的卤代反应
通过卤素化试剂与烷烃反应得到卤代烃。
3
烯烃的加成反应
通过加成试剂将烯烃与其他化合物反应,生成环烷化产物或加成产物。
4
醛的还原
有机官能团的常见种类
1 羟基
在有机化合物中常见的官能团,具有亲水性 和参与酸碱反应的性质。
2 羰基
包括醛基和酮基,是有机化合物中常见的官 能团,具有亲电性和参与加成反应的性质。
3 氨基
含有氮原子的官能团,可以参与酸碱反应和 亲电取代反应。
4 酯基
它在医药、农业、材料科学等领域具有重要的应用价值。
总结和展望
通过对有机官能团的转换和应用的学习,我们能够深入理解有机化学的基本原理和有机合成的方法。 未来,在有机官能团转化领域的研究和应用将进一步拓展我们对功能有机物的认识和应用。
由羧酸和醇缩合得到的官能团,具有亲电性 和参与酯交换反应的性质。
有官能团的转换
有机官能团的转换指的是通过化学反应将一个有机官能团转化为另一个有机官能团。 这种转换可以通过选择合适的试剂和反应条件来实现,从而实现有机化合物的功能扩展和结构改变。
常见的有机官能团转化反应
1
醇的氧化
通过氧化剂将醇氧化成醛、酮或羧酸。
《有机官能团的转换》 PPT课件
有机官能团是有机化合物中具有一定化学性质和反应活性的结构单元。了解 有机官能团及其转换对于理解有机化学的基本原理和有机合成具有重要意义。
什么是有机官能团
有机官能团是有机分子中特定的原子或原子团,决定了分子的化学性质和反 应活性。
它们可以通过共价键与其他原子或原子团发生化学反应,从而参与有机化学 反应的进行。
2
烷烃的卤代反应
通过卤素化试剂与烷烃反应得到卤代烃。
3
烯烃的加成反应
通过加成试剂将烯烃与其他化合物反应,生成环烷化产物或加成产物。
4
醛的还原
有机合成——官能团的引入转化消除及保护课件高二化学人教版选择性必修3

氧化
CH3-CHO
CH3-COOH
五、官能团的转化(种类、数目和位置的变化)
2、官能团数目变化
原创:WJ化学研究院
CH3CH2-OH 消去
CH2=CH2
加Br2
水解 CH2Br-CH2Br
HO-CH2CH2-OH
3、官能团位置变化
消去
CH3CH2CH2-Br
CH3CH=CH2
加HBr CH3CH-CH3 Br
卤素原子 烯烃(炔烃)的加成 烷烃(苯及苯的同系物)的取代 醇(酚)的取代
羟基 烯烃与水的加成 酯的水解 卤代烃的水解 醛、酮的加氢
醛基 炔烃水化 烯烃氧化 伯醇的催化氧化 糖类水解
羧基 烯炔烃、苯的同系物、醛、醇的氧化 酯、酰胺、R-CN的水解
酯基
酯化反应、酰氯醇解
八、练习
原创:WJ化学研究院
1.由苯酚制取
①醇的催化氧化引入碳氧双键
2RCH2OH+O2
催化剂 △
2RCHO+2H2O
2RCH(OH)R'+O2 催化△ 剂2R—C—R+2H2O
O
②某些烯烃被氧化
2CH2=CH2+O2 一定条件 2CH3CHO
①O3
②Zn/H2O OHCCH2CH2CH2CH2CHO
三、引入官能团--碳氧双键
2、引入碳氧双键
4、醛基的保护
醛基可被弱氧化剂氧化,为避免在反应过程中受到影响,保护一般是把 醛基制成缩醛,最后再将缩醛水解得到醛基(常用乙二醇)
缩醛 也可以先生成醇,然后再氧化恢复
四、官能团的保护--氨基的保护
5、氨基(-NH2)的保护
胺基易被O2、O3、H2O2等氧化,一般采用下列方法保护
有机物官能团的转化

选择性控制
通过选择合适的金属有机试剂和反应条件,可实现官能团转化的选 择性控制。
其他新兴技术
光催化法
利用光催化剂吸收光能并转化为 化学能,驱动官能团的转化,如 光催化氧化、光催化还原等。
电化学法
通过电化学手段实现官能团的氧 化或还原,具有高效、环保等优 点,如电化学合成、电化学降解 等。
微波辅助法
进展
近年来,动力学研究方法在有机物官能团转化反应机理研究中取得了重要进展。例如,微观动力学模 拟方法的出现,使得研究人员可以在原子水平上模拟反应过程,进而揭示反应的详细机理。此外,一 些新的实验技术,如超快光谱学、飞秒化学等,也为动力学研究提供了有力支持。
计算化学在官能团转化中应用
计算化学方法
计算化学方法在有机物官能团转化反应机理 研究中发挥着越来越重要的作用。常用的计 算化学方法包括量子化学计算、分子动力学 模拟、蒙特卡罗模拟等。这些方法可以模拟 和预测反应的详细过程,揭示反应的微观机 制。
官能团转化优化药物性质
通过官能团的转化可以改善药物的溶解性、稳定 性以及吸收等性质,从而提高药物的生物利用度 。
天然产物全合成中应用
官能团转化构建复杂结构
天然产物往往具有复杂的分子结构,通过官能团的转化可以构建这些复杂结构,如多环体 系、手性中心等。
官能团转化实现立体选择性合成
在天然产物的全合成中,需要实现高立体选择性的合成,官能团的转化可以提供有效的手 段来控制分子的立体构型。
温和条件
酶催化反应通常在温和的条件下进行,如常温常压,有利于节约 能源和保护环境。
生物兼容性
酶作为生物催化剂,具有良好的生物兼容性,可用于生物医药和 食品工业等领域。
金属有机法
金属有机试剂的多样性
通过选择合适的金属有机试剂和反应条件,可实现官能团转化的选 择性控制。
其他新兴技术
光催化法
利用光催化剂吸收光能并转化为 化学能,驱动官能团的转化,如 光催化氧化、光催化还原等。
电化学法
通过电化学手段实现官能团的氧 化或还原,具有高效、环保等优 点,如电化学合成、电化学降解 等。
微波辅助法
进展
近年来,动力学研究方法在有机物官能团转化反应机理研究中取得了重要进展。例如,微观动力学模 拟方法的出现,使得研究人员可以在原子水平上模拟反应过程,进而揭示反应的详细机理。此外,一 些新的实验技术,如超快光谱学、飞秒化学等,也为动力学研究提供了有力支持。
计算化学在官能团转化中应用
计算化学方法
计算化学方法在有机物官能团转化反应机理 研究中发挥着越来越重要的作用。常用的计 算化学方法包括量子化学计算、分子动力学 模拟、蒙特卡罗模拟等。这些方法可以模拟 和预测反应的详细过程,揭示反应的微观机 制。
官能团转化优化药物性质
通过官能团的转化可以改善药物的溶解性、稳定 性以及吸收等性质,从而提高药物的生物利用度 。
天然产物全合成中应用
官能团转化构建复杂结构
天然产物往往具有复杂的分子结构,通过官能团的转化可以构建这些复杂结构,如多环体 系、手性中心等。
官能团转化实现立体选择性合成
在天然产物的全合成中,需要实现高立体选择性的合成,官能团的转化可以提供有效的手 段来控制分子的立体构型。
温和条件
酶催化反应通常在温和的条件下进行,如常温常压,有利于节约 能源和保护环境。
生物兼容性
酶作为生物催化剂,具有良好的生物兼容性,可用于生物医药和 食品工业等领域。
金属有机法
金属有机试剂的多样性
人教课标版 有机官能团的衍变PPT

NaOH溶液
D
稀硫酸
E
X 稀硫酸 C6H11O2Br △
B (C3H8O)
浓硫酸/ △
F 六元环
4、教学必须从学习者已有的经验开始。——杜威 5、构成我们学习最大障碍的是已知的东西,而不是未知的东西。——贝尔纳 6、学习要注意到细处,不是粗枝大叶的,这样可以逐步学习摸索,找到客观规律。——徐特立 7、学习文学而懒于记诵是不成的,特别是诗。一个高中文科的学生,与其囫囵吞枣或走马观花地读十部诗集,不如仔仔细细地背诵三百首诗。——朱自清 8、一般青年的任务,尤其是共产主义青年团及其他一切组织的任务,可以用一句话来表示,就是要学习。——列宁 9、学习和研究好比爬梯子,要一步一步地往上爬,企图一脚跨上四五步,平地登天,那就必须会摔跤了。——华罗庚 10、儿童的心灵是敏感的,它是为着接受一切好的东西而敞开的。如果教师诱导儿童学习好榜样,鼓励仿效一切好的行为,那末,儿童身上的所有缺点就会没有痛苦和创伤地不觉得难受地逐渐消失。——苏霍姆林斯基 11、学会学习的人,是非常幸福的人。——米南德 12、你们要学习思考,然后再来写作。——布瓦罗14、许多年轻人在学习音乐时学会了爱。——莱杰 15、学习是劳动,是充满思想的劳动。——乌申斯基 16、我们一定要给自己提出这样的任务:第一,学习,第二是学习,第三还是学习。——列宁 17、学习的敌人是自己的满足,要认真学习一点东西,必须从不自满开始。对自己,“学而不厌”,对人家,“诲人不倦”,我们应取这种态度。——毛泽东 18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫· 托尔斯泰 20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰· 贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚52、若不给自己设限,则人生中就没有限制你发挥的藩篱。 53、希望是厄运的忠实的姐妹。 54、辛勤的蜜蜂永没有时间悲哀。 55、领导的速度决定团队的效率。 56、成功与不成功之间有时距离很短只要后者再向前几步。 57、任何的限制,都是从自己的内心开始的。 58、伟人所达到并保持着的高处,并不是一飞就到的,而是他们在同伴誉就很难挽回。 59、不要说你不会做!你是个人你就会做! 60、生活本没有导演,但我们每个人都像演员一样,为了合乎剧情而认真地表演着。 61、所谓英雄,其实是指那些无论在什么环境下都能够生存下去的人。 62、一切的一切,都是自己咎由自取。原来爱的太深,心有坠落的感觉。 63、命运不是一个机遇的问题,而是一个选择问题;它不是我们要等待的东西,而是我们要实现的东西。 64、每一个发奋努力的背后,必有加倍的赏赐。 65、再冷的石头,坐上三年也会暖。 66、淡了,散了,累了,原来的那个你呢? 67、我们的目的是什么?是胜利!不惜一切代价争取胜利! 68、一遇挫折就灰心丧气的人,永远是个失败者。而一向努力奋斗,坚韧不拔的人会走向成功。 69、在真实的生命里,每桩伟业都由信心开始,并由信心跨出第一步。 70、平凡的脚步也可以走完伟大的行程。 71、胜利,是属于最坚韧的人。 72、因害怕失败而不敢放手一搏,永远不会成功。 73、只要路是对的,就不怕路远。 74、驾驭命运的舵是奋斗。不抱有一丝幻想,不放弃一点机会,不停止一日努力。3、上帝助自助者。 24、凡事要三思,但比三思更重要的是三思而行。 25、如果你希望成功,以恒心为良友,以经验为参谋,以小心为兄弟,以希望为哨兵。 26、没有退路的时候,正是潜力发挥最大的时候。 27、没有糟糕的事情,只有糟糕的心情。 28、不为外撼,不以物移,而后可以任天下之大事。 29、打开你的手机,收到我的祝福,忘掉所有烦恼,你会幸福每秒,对着镜子笑笑,从此开心到老,想想明天美好,相信自己最好。 30、不屈不挠的奋斗是取得胜利的唯一道路。 31、生活中若没有朋友,就像生活中没有阳光一样。 32、任何业绩的质变,都来自于量变的积累。 33、空想会想出很多绝妙的主意,但却办不成任何事情。 34、不大可能的事也许今天实现,根本不可能的事也许明天会实现。 35、再长的路,一步步也能走完,再短的路,不迈开双脚也无法到达。 36、失败者任其失败,成功者创造成功。 37、世上没有绝望的处境,只有对处境绝望的人。 38、天助自助者,你要你就能。 39、我自信,故我成功;我行,我一定能行。 40、每个人都有潜在的能量,只是很容易:被习惯所掩盖,被时间所迷离,被惰性所消磨。 41、从现在开始,不要未语泪先流。 75、自己选择的路,跪着也要走完。
3.5.2有机合成——官能团转化及合成分析 课件 高二下学期化学人教版(2019)选择性必修3

示例分析:由乙烯合成二乙酸乙二酯
逆合成分析法
⑤
目标化合物
H2C OH
②
H2C OH CH3COOH ④
H2C
Cl
①
H2C Cl
CH2 CH2
C2H5OH ③
中间体
CH2 CH2
基础原料
同学们,如何合成二乙酸乙二酯?
路线一 CH2=CH2
加成 直接氧化
酯化
路线二
CH2=CH2
O2 催化剂,△
H2O 加压,△
官能团的保护 醇羟基的保护
可先将羟基转化为醚键,使醇转化为在一般反应条件下比较稳 定的醚。待相关合成反应结束后,再在一定条件下脱除起保护作 用的基团(保护基),恢复羟基。
【任务】
以HOCH2-CH=CH-CH2OH为原料合成HOOC-CH=CH-COOH的路线为
HOCH2-CH=CH-CH2OH
A HOCH2-CHCl-CH2-CH2OH B
CH3C OH NH4Cl
⑤苯的同系物氧化反应
R CH
R′
KMnO4 H+
COOH
二、官能团的引入
【小结1】常见官能团的引入
官能团
引入方法
碳碳双键 ①卤代烃的消去 ②醇的消去 ③炔烃的不完全加成
①醇(酚)的取代 ②烯烃(炔烃)的加成 碳卤键
③烷烃(苯及苯的同系物)的取代
羟基 ①烯烃与水的加成 ②卤代烃的水解 ③醛的还原 ④酯的水解
C=C +HX
—C—C—
NaOH/醇 △
XH
C=C
C=C +H2O
—C—C— OH H
浓硫酸 △
C=C
四、官能团的转化
官能团的保护
第五章 官能团转换(1)

反应实例:McCloskey, A. L.; Fonken, G. S.; Kluiber, R. W.; Johns on, W. S. Org. Synth., Coll. Vol. IV 1963, 261.
H SO Me M 2 4 Me Me HO OH OO Me M Et O, rt O O Me Me 2 O O
5.3 由烯合成醇
12
由烯烃生成醇的反应,一般在酸性条件下进行,且符合Markovni kov规则。但在强酸条件下,对很多基团不稳定,所以实验室一 般采用以下方法合成醇。
5.3.1 硼氢化氧化(反马氏规则)
反应实例:Kono, H.; Hooz, J. Org. Synth., Coll. Vol. VI 1988, 919.
13
C H NaOH 6 13 B O H C H H 2 2 6 13 C 6 13 aq
q N a O H OR a B D ROOR
Me
OH
A: 通过一个四元环电子移动进行硼氢化反应。B: 过氧化氢负离
子进攻硼烷形成一个硼酸盐。C: 烷基迁移生成硼酸酯。D: 水解
生成末端醇。
14
5.3.2 羟汞化脱汞(符合马氏规则)
机理?
机理解答:
M e M e OO M e B HO OH M e M e OO M e HO
7
M e M e
H A
+ H
OH
M e M e OO M e O OH
M eO
OM e
M e M e O M e M e O
A: 异丁烯质子化形成一个稳定的叔碳离子。B: 羧酸的孤对电子 进攻碳正离子形成单酯,然后继续反应生成二酯。
H SO Me M 2 4 Me Me HO OH OO Me M Et O, rt O O Me Me 2 O O
5.3 由烯合成醇
12
由烯烃生成醇的反应,一般在酸性条件下进行,且符合Markovni kov规则。但在强酸条件下,对很多基团不稳定,所以实验室一 般采用以下方法合成醇。
5.3.1 硼氢化氧化(反马氏规则)
反应实例:Kono, H.; Hooz, J. Org. Synth., Coll. Vol. VI 1988, 919.
13
C H NaOH 6 13 B O H C H H 2 2 6 13 C 6 13 aq
q N a O H OR a B D ROOR
Me
OH
A: 通过一个四元环电子移动进行硼氢化反应。B: 过氧化氢负离
子进攻硼烷形成一个硼酸盐。C: 烷基迁移生成硼酸酯。D: 水解
生成末端醇。
14
5.3.2 羟汞化脱汞(符合马氏规则)
机理?
机理解答:
M e M e OO M e B HO OH M e M e OO M e HO
7
M e M e
H A
+ H
OH
M e M e OO M e O OH
M eO
OM e
M e M e O M e M e O
A: 异丁烯质子化形成一个稳定的叔碳离子。B: 羧酸的孤对电子 进攻碳正离子形成单酯,然后继续反应生成二酯。
有机官能团转化规律

NO2
1
官能团转化与引入关系图
1. CH3—CH2 OH ( 消去反应
浓硫酸 170℃
) CH2=CH2
(加成反应)
CH2—CH2 Cl Cl
(水解或取代)
CH2—CH2 OH OH
(氧化反应 )
酯化
H—C—C—OH O O
(氧化 )
缩聚
HO—C—C—OH O O
生物发酵
葡萄糖 2. CH3—CH2 Cl
光合作用
[CH2—CH2—O]n CO2+H2O ) CH2=CH2 (加成反应 )
(加聚反应)
CH2—O—C=O
CH2—CH2 O ) CH2=CH Cl
OO HOCH2CH2-O-C-C-OH [OCH2CH2OCOCO]n
CH2—O—C=O
(消去反应
CH2—CH2 Cl Cl
(消去反应
(加成反应 )
CH2—CH—Cl Cl Cl
(加成反应 ) (水解或取代) CH2—CH—Br Br Cl 3. CH2=CH2 5. CH≡CH
3 分子成环 硝化取代 —NO2 加成 HCN
(水解或取代) CH2—CH OH O
加成 HCN
氧化
CH2—C—OH OH O CH2 = CH COOH
4. CH3—CH2 CN
CH3—COOH
CH2=CH—Cl
[CH2—CHCl]n
油 脂
动 植 物
蛋 白 质
CH3
H2 Ni 浓 H2SO4 HNO3 Cl —OH OH 浓 H2SO4 HNO3 CH3 浓 H2SO4 HNO3 O2N— —NO2 NO2 O2N— —NO2 —NO2 Fe 稀盐酸 —NH2
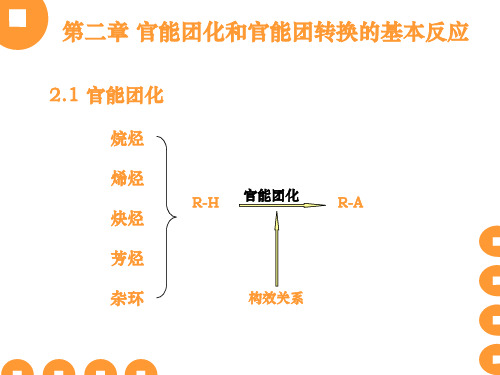
第二章官能团化和官能团转化的基本反应
硼氢化 RCOOH ~0oC
C C
Na, NH3 LiAlH4 (THF)
C C
(82%)
C C
4 芳烃的官能团化
以苯为例;大家自己从苯的结构来分析,苯环上能发
生哪些反应? 苯环上有双键,容易发生亲电加成反应吗? 苯环上典型的反应是什么?能否用电子中间体加以说明 取代苯衍生物的官能团化,环上已有官能团对引入的官 能团位置有何影响?
这种异构现象称为酮醇互变异构。
Hg2+, H2SO4
C =C H O 酮 式(稳定)
O [H C CH O-H ] CH 3-C H H
HC ≡ CH
H2O
~100℃
这一反应是库切洛夫在1881年发现的,故称为库切洛夫反应。
其他炔烃水化时,则变成酮。例如:丙炔得丙酮,苯乙炔 得苯乙酮。
CH 3C ≡ CH + H 2O
炔烃的硼氢化反应:
C H3(C H2)5C CH
R2B H / 醚
C H3(C H2)5C
H2O2, H 2O NaOH
CH BR2
重排
C H3(C H2)5C H C H H O
C2H5 C2H5C CC2H5
B2H6 / 醚 。 0C
C H3(C H2)5C H2C HO
C2H5 H C =C C2H5 H
为什么简单杂环化合物的亲电取代反应一般发生在α位?
+
进攻2位
E X H E
+
E X E H X H
+ X
E H
X
+ E
+
进攻3位
H X
+
2、加成-加H2
X H2/Ni X X= O 、S、NH (THF是良好的溶剂,b.p65℃)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
离子,特别是一些含O、N的负离子.能通过氢键发生 溶剂化,这样可使负电荷分散,负离子稳定,而有利于 离去基团的离解,从而有利于SNl反应的进行。例如,一 些在醇中按SN2机理进行的反应,在甲酸作溶剂时则可 能按SNl机理进行。
在质子溶剂中,由于亲核试剂被溶剂分子所包围,
必须破坏溶剂层才能使试剂接触中心碳而反应。因此, 质子溶剂对SN2反应不利。偶极非质子溶剂由于偶极正 端包含于分子内部,对负离子的溶剂化作用很小,故亲
可在不同位置发生反应,生成不同的产物。例如,N02同伯卤代烷作用,生成硝基烷,同仲或叔卤代烷作用则 生成亚硝酸酯:
CN—、SCN—等也属于两可性亲核试剂,利用CN—的 这一特性,可分别制得腈和异腈产物:
SN反应大多是在溶液中进行的。溶剂不同,不仅可 使反应速度不同,有时甚至可以使反应机理也不相同。 溶剂在反应中的作用称为溶剂效应。在质子溶剂中,10 负
核试剂一般可不受溶剂层的包围而呈所调“裸露”状态, 从而表现出很强的亲核活性,有利于SN2反应的进行。 溶剂极性对SN反应的影响还同过渡态的电荷状态有关。 中性的作用物发生SNl反应时,过渡态的电荷发生分离, 即过渡态的极性增大,这时极性较高的溶剂比较低的溶
剂更能降低过渡态的能量和增加反应速度。相反,正11 离
第三章、有机官能团的转换
官能团是决定有机分子主要反应性能的关键部位,
也是进行有机反应的场所和根据。一般说来,大多数
合成总是通过官能团之间的相互作用而实现的。因此,
有机化合物的官能团之间的相互转变的规律,是有机
合成的基础和工具。本章将对有机官能团转换的如下 几方面进行讨论:
(1)有机分子中原子或基团被取代的反应; (2)氧化值发生改变的氧化、还原反应; (3)生成不饱和键的消除反应; (4)不饱和链上的加成反应; (5)形成多官能团化合物的反应。
第一节、取代反应
1
一、 饱和碳上的亲核取代反应
1.反应机理及影响因素 在卤代烷或其它脂肪族化合物分子中,饱和碳上 的原子或基团,连同一对电子被亲核试剂所置换的反 应,称为饱和碳上的亲核取代反应(SN),反应的一般 式为:
式中RX代表作用物,Nu代表亲核试剂,X为离去基团。 作用物中发生反应的原子称为中心原子。反应随作用物、 试剂和反应条件的不同,可按不同的机理进行,其中最 典型的是SN2和SNl机理。
同SN2反应相反,作用物的空间效应对SNl反应是一 种有利因素。这是由于中心碳上的取代基越多,所形成 的碳正离子越稳定,同时形成碳正离子后,基团之间的 键角由109.5度增至120度,其空间拥挤程度可部分得 到改善之故。这种作用被称为“空间加速”或“空助效 应”。故对于SNl反应,作用物烷基的结构影响为:
在SN1反应中,决定速度步骤不含试剂,故试剂对 SN1反应影响很小。与SN1反应不同,试剂包括在SN2反 应的决定速度步骤内,故试剂的浓度、性质对SN2反应 是重要的,一般试剂的亲核性愈强,SN2反应的活性愈 高。
一些亲核试剂,如亚硝酸根负离子-O—N=0,其分 子中的0和N均可作为亲核中心同中心碳反应,这类试 剂称为两可性亲核试剂。在不同条件下,两可性亲核9 试
5
作用物电离一步是决定反应速度的步骤。由于决定 速度步骤只涉及一种分子,故称为单分子亲核取代反应, 其动力学式符合一级速度表示式:
由于SNl反应经碳正离子中间体而实现,后者为平面构型, 亲核试剂可从平面的两边进入,从而使产物发生消旋化。 但在SNl反应的溶液中,生成的碳正离于中间体并不是完 全自由的,它很可能与离去基团组成离子对,使其溶剂 化,而不完全对称,从而有可能使试剂从离子对背面进 攻占优势,结果使部分产物构型发生反转。例如,(R)— (一)—2—溴辛烷在SNl条件下水解,产物2—辛醇中,仅 34%是外消旋体,83%[66%十1/2(34%)是反转的产物。
在SN2和SN1反应中,都涉及离去基团从中心碳上的 脱离问题,故容易离去的基团,对SN2和SN1反应都是有 利的。基团脱离作用物的难易与其碱性相关。离去基团 的碱性愈弱,形成的负离于愈稳定,就愈容易脱离作8 用
物。具有这种性质的离去基团常见的有硫酸根、取代苯 磺酸基以及碘、溴、氯离子等。它们在SN反应中的相对 速度大小顺序如下:
反应进程的协同性,必然导致立体化学的专一性,
在SN2反应中,产物构型发生反转,这一现象称为瓦尔
登反转(Walden inversion)。例如:
3
4
在SN2反应中,决定速度的步骤(即过渡态的形成) 涉及进攻试剂和作用物,故称为双分于反应,其动力 学式符合二级速度表示式:
SNl反应是分步进行的。作用物首先离解为碳正离 子,然后亲电性很强的碳正离子迅速同溶液中的亲核 试剂结合成产物。
SN2 机理包括一个由作用物与试剂分子形成的过渡 态,反应按协同方式进行。即试剂从离去基团相反的方 向上进攻中心碳原于,试剂同中心碳之间键的形成,2 与
离去基团与中心碳之间键的断裂是同时进行的。在过渡 态中,进攻试剂、中心碳原子和离去基团大约处于同一 直线位置。而中心碳上的其余三个原子或基团则位于同 该直线垂直的平面上。这时,进攻试剂与离去基团分别 处于平面的两边。随着新键的逐渐形成,离去基团与中 心碳之间的键逐渐削弱,最后完全脱离中心碳,而完成 反应。
作用物进行SNl反应时,其过渡态的电荷比基态分散,这 时极性较小的溶剂更为有利。同样的规律也适合SN2反应, 因为SN2反应的过渡态电荷也较基态分散,增加溶剂极性, 只会使电荷较集中的亲核试剂溶剂化,而不利于SN2过渡 态的形成。
至于非极性溶剂,由于较难溶解SN反应中极性的作 用物和试剂,其反应性能较低,故很少使用。
6
Байду номын сангаас
实际上,纯粹SN2与SNl反应仅仅是亲核取代的两种 极限情况。大多数情况下,两种机理并存.并表现为竞
争反应。作用物结构、试剂以及反应条件将对反应产生 很大的影响。
作用物中心碳原子的空间效应对SN2反应影响很大。 中心碳上取代基增多,试剂进攻中心碳受阻,SN2反应7
的相对速度便减小。不同结构的作用物进行SN2反应的活 性顺序是:
