硼
硼的概述

硼的概述*导读:硼是人体的一种非金属矿物元素,大多数人并不缺硼,但老年人有必要适当注意摄取。
……硼的简介.hzh {display: none; } 硼,非金属元素,原子序数5,原子量10.811。
硼为黑色或银灰色固体。
晶体硼为黑色,熔点约2300°C,沸点2550°C,密度2.34克/立方厘米,硬度仅次于金刚石,较脆。
天然硼有2种同位素:硼10和硼11,其中硼10最重要。
硼普遍存在于蔬果中,是维持骨的健康和钙、磷、镁正常代谢所需要的微量元素之一。
对停经后妇女防止钙质流失、预防骨质疏松症具有功效,硼的缺乏会加重维生素D的缺乏;另一方面,硼也有助于提高男性睾丸甾酮分泌量,强化肌肉,是运动员不可缺少的营养素。
硼还有改善脑功能,提高反应能力的作用。
虽然大多数人并不缺硼,但老年人有必要适当注意摄取。
硼的发现约公元前200年,古埃及、罗马、巴比伦曾用硼沙制造玻璃和焊接黄金。
1808年法国化学家盖·吕萨克和泰纳尔分别用金属钾还原硼酸制得单质硼。
直至1981年,人们才认识到硼不仅是植物,而且是动物合人类所必须的元素。
当时报道的一项早期研究结果提示了硼的必要性,在这项研究中发现,给雏鸡喂饲维生素D不足但并不完全缺乏的饲料时,硼能够改善其骨骼钙化。
食物来源黄豆、葡萄干、杏仁、花生、榛子、枣、葡萄酒、蜂密,酒类,例如苹果酒和啤酒。
代谢吸收有关硼的吸收代谢目前还未充分了解,膳食中很容易吸收,并大部分由尿排出,在血液中是与氧结合,为B(OH)3,和B(OH)4,硼酸与有机化合物的羟基形成酯化物。
动物与人的血液中硼的含量很低,并与膳食中镁的摄入有关,镁摄入低时,血液中硼的含量就增加。
硼可在骨中蓄积,但尚不清楚是何种形式。
生理功能硼的生理功能还未确定,目前有两种假说解释硼缺乏时出现的明显而不同的反应,以及已知硼的生化特性。
一种假说是,硼是一种代谢调节因子,通过竞争性抑制一些关键酶的反应,来控制许多代谢途径。
硼

元素序号:5元素符号:B元素名称:硼元素原子量:10.81元素类型:非金属发现人:戴维、盖吕萨克、泰纳发现年代:1808年发现过程:1808年,英国的戴维和法国的盖吕萨克、泰纳,用钾还原硼酸而制得硼。
元素描述:它是最外层少于4个电子的仅有的非金属元素。
其单质有无定形和结晶形两种。
前者呈棕黑色到黑色的粉末。
后者呈乌黑色到银灰色,并有金属光泽。
硬度与金刚石相近。
无定形的硼密度2.3克/厘米3,(25-27℃);晶形的硼密度2.31克/厘米3,熔点2300℃,沸点2550℃,化合价3。
在室温下无定形硼在空气中缓慢氧化,在800℃左右能自燃。
硼与盐酸或氢氟酸,即使长期煮沸,也不起作用。
它能被热浓硝酸和重铬酸钠与硫酸的混合物缓慢侵蚀和氧化。
过氧化氢和过硫酸铵也能缓慢氧化结晶硼。
上述试剂与无定形硼作用激烈。
与碱金属碳酸盐和氢氧化物混合物共熔时,所有各种形态的硼都被完全氧化。
氯、溴、氟与硼作用而形成相应的卤化硼。
约在600℃硼与硫激烈反应形成一种硫化硼的混合物。
硼在氮或氨气中加热到1000℃以上则形成氮化硼,温度在1800-2000℃是硼和氢仍不发生反应,硼和硅在2000℃以上反应生成硼化硅。
在高温时硼能与许多金属和金属氧化物反应,生成金属硼化物。
元素来源:制备方法有:硼的氧化物用活泼金属热还原;用氢还原硼的卤化物;用碳热还硼砂;电解熔融硼酸盐或其他含硼化合物;热分解硼的氢化合物上述方法所得初产品均应真空除气或控制卤化,才可制得高纯度的硼。
元素用途:由于硼在高温时特别活泼,因此被用来作冶金除气剂、锻铁的热处理、增加合金钢高温强固性,硼还用于原子反应堆和高温技术中。
棒状和条状硼钢在原子反应堆中广泛用作控制棒。
由于硼具有低密度、高强度和高熔点的性质,可用来制作导弹的火箭中所用的某些结构材料。
硼的化合物在农业、医药、玻璃工业等方面用途很广。
元素辅助资料:天然含硼的化合物硼砂(Na2B4O7·10H2O)早为古代医药学家所知悉。
硼族元素及其化合物

硼族元素及其化合物
一、硼的性质
硼(Boron)是一种族IIIb的元素,在化学元素周期表中第五位,原子序数为5,原子质量为10.81、硼元素是一种半金属元素,具有金属质地,保持着类似硅的结构。
硼具有极强的抗氧化、加热稳定性、腐蚀性,使其有着优良的电性能,适用于电子设备中的导电成份,还拥有稳定的介电性能,是线路板制作的上佳材料。
二、硼的化合物
(1)氢氧化硼
氢氧化硼(H₂BO₃)是硼元素的最常见的化合物。
它是一种无色粉末状的晶体,熔点为350℃,有特殊的稀酸味,非常溶于水,但在碳酸钠、碳酸氢钠水溶液中极难溶解。
氢氧化硼是一种电解质,是用作电缆、电池和电磁浮动的主要材料。
(2)硼酸
硼酸(HBO₂)是硼的重要的化合物之一,其有机半氧化物的形式为
H₃BO₃,通常以白色粉末的形式存在,溶于水,不溶于二氯甲烷,拥有特殊的稀酸性味道。
硼酸有着广泛的应用,主要用作农药、洗涤剂、轻工业中制作消光剂、染料、防腐剂和焊条等。
(3)硼酸钠
硼酸钠(Na₂B₂O₄·2H₂O)是一种水溶性的硼酸盐,主要用作染料、洗涤剂、消光剂、增塑剂、绝缘剂、涂料等。
硼及其化合物

硼族元素及其化合物约公元前200年,古埃及、罗马、巴比伦曾用硼沙制造玻璃和焊接黄金。
法国化学家盖·吕萨克用金属钾还原硼酸制得单质硼。
硼在地壳中的含量为0.001%。
硼为黑色或银灰色固体。
晶体硼为黑色,硬度仅次于金刚石,质地较脆。
硼还由于其缺电子性造成其氢化物中硼原子拥有异常高的配位数,使之成为所有元素氢化物中结构最复杂的。
单质硼为黑色或深棕色粉末,熔点2076℃。
沸点3927℃。
单质硼有多种同素异形体,无定形硼为棕色粉末,晶体硼呈灰黑色。
晶态硼较惰性,无定形硼则比较活泼。
单质硼的硬度近似于金刚石,有很高的电阻,但它的导电率却随着温度的升高而增大,高温时为良导体。
硼共有14种同位素,其中只有两个是稳定的。
室温时为弱导电体;高温时则为良导体。
在自然界中主要以硼酸和硼酸盐的形式存在。
晶体结构晶态单质硼有多种变体,它们都以B12正二十面体为基本的结构单元。
这个二十面体由12个B原子组成,20个接近等边三角形的棱面相交成30条棱边和12个角顶,每个角顶为一个B原子所占据。
由于B12二十面体的连接方式不同,键也不同,形成的硼晶体类型也不同。
其中最普通的一种为α-菱形硼。
α-菱形硼是由B12单元组成的层状结构,α-菱形硼晶体中既有普通的σ键,又有三中心两电子键。
许多B原子的成键电子在相当大的程度上是离域的,这样的晶体属于原子晶体,因此晶态单质硼的硬度大,熔点高,化学性质也不活泼。
在α-菱形硼晶格中,每个二十面体通过处在腰部的6个B原子以三中心两电子键与在同一平面内的相邻的6个二十面体连接起来(其中虚线三角形表示三中心两电子键,键距203pm)。
这种二十面体组成的片层,层面结合靠的是二十面体的上下各3 个B原子以6个正常的B-B共价键(即两中心两电子键,键长171pm)同上下两层的6个附近的二十面体相连接,3个在上一层,3个在下一层。
在硼的二十面体结构单元中,B12的36个电子是如下分配的:在二十面体内有13个分子轨道,用去26个电子;每个二十面体同上下相邻的6个二十面体形成6个两中心两电子共价键,用去了6个电子;在二十面体腰部的6个B原子与同平面上周围相邻的6个三中心两电子键,用去了6×2/3=4个电子,结果总电子数是26+6+4=36。
硼
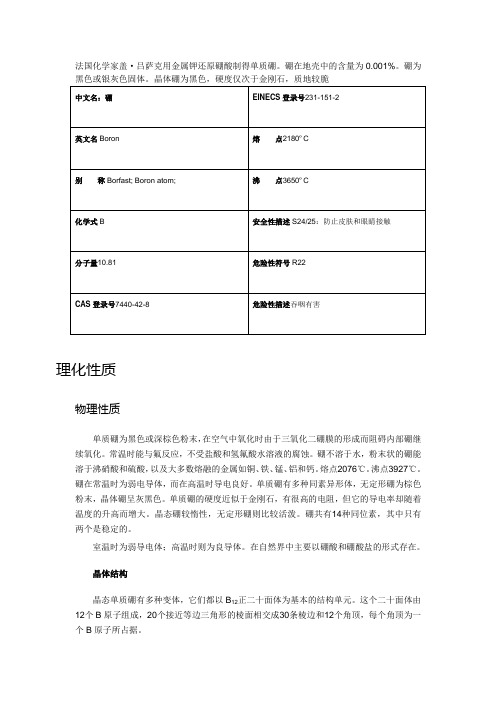
理化性质物理性质单质硼为黑色或深棕色粉末,在空气中氧化时由于三氧化二硼膜的形成而阻碍内部硼继续氧化。
常温时能与氟反应,不受盐酸和氢氟酸水溶液的腐蚀。
硼不溶于水,粉末状的硼能溶于沸硝酸和硫酸,以及大多数熔融的金属如铜、铁、锰、铝和钙。
熔点2076℃。
沸点3927℃。
硼在常温时为弱电导体,而在高温时导电良好。
单质硼有多种同素异形体,无定形硼为棕色粉末,晶体硼呈灰黑色。
单质硼的硬度近似于金刚石,有很高的电阻,但它的导电率却随着温度的升高而增大。
晶态硼较惰性,无定形硼则比较活泼。
硼共有14种同位素,其中只有两个是稳定的。
室温时为弱导电体;高温时则为良导体。
在自然界中主要以硼酸和硼酸盐的形式存在。
晶体结构晶态单质硼有多种变体,它们都以B12正二十面体为基本的结构单元。
这个二十面体由12个B原子组成,20个接近等边三角形的棱面相交成30条棱边和12个角顶,每个角顶为一个B原子所占据。
由于B12二十面体的连接方式不同,键也不同,形成的硼晶体类型也不同。
其中最普通的一种为α-菱形硼。
α-菱形硼是由B12单元组成的层状结构,α-菱形硼晶体中既有普通的σ键,又有三中心两电子键。
许多B原子的成键电子在相当大的程度上是离域的,这样的晶体属于原子晶体,因此晶态单质硼的硬度大,熔点高,化学性质也不活泼。
在α-菱形硼晶格中,每个二十面体通过处在腰部的6个B原子以三中心两电子键与在同一平面内的相邻的6个二十面体连接起来(其中虚线三角形表示三中心两电子键,键距203pm)。
这种二十面体组成的片层,层面结合靠的是二十面体的上下各3 个B原子以6个正常的B-B共价键(即两中心两电子键,键长171pm)同上下两层的6个附近的二十面体相连接,3个在上一层,3个在下一层。
在硼的二十面体结构单元中,B12的36个电子是如下分配的:在二十面体内有13个分子轨道,用去26个电子;每个二十面体同上下相邻的6个二十面体形成6个两中心两电子共价键,用去了6个电子;在二十面体腰部的6个B原子与同平面上周围相邻的6个三中心两电子键,用去了6×2/3=4个电子,结果总电子数是26+6+4=36。
元素化学——硼族

为什么不用铝来还原制备单质硼?
高温生成的 Al2O3难溶于酸,难以除去; Al 与 B 可以形成黑色的 AlB12 ,难以除去。
30
氧化物
硼是亲氧元素,硼氧化物具有很高的稳定性。 通过 B 与 O2 反应或 H3BO3 加热脱水可得到氧化物。加热脱 水红热时得玻璃态 B2O3 ,减压历时二周逐渐加热到 670 K 得 晶体状 B2O3。
1
盐溶解的热力学解释
溶解过程:G=H-TS,通常H较大,因而可以近似忽略TS,
H包括两部分:破坏晶格能吸热、离子水合过程放热
晶格能
水合焓
U f1 ( H 水合 1 ) rM rX -
rM rX 时, 对U有利 rM rX 或 rM rX 时, 对H 水合 有利
18
物理性质
铝
银白色金属,有良好的延展性和导电性;用于制造合金并广 泛应用于航空航天领域,另外可以作为还原剂用于制备其它 金属;
镓、铟、铊
镓为较软的金属,熔点为 302.78K,人 的体温就能使之熔化,沸点为2343K, 熔沸点相差非常大,可以用于制造高温 温度计;
19
物理性质
镓、铟、铊及其化合物如 GaAs、InP均为性能优异的半
通性
键 键能 389 / kJmol-1 某些键的键能 B-H C-H Si-H B-O C-O Si-O B-B 411 318 561 358 452 293 C-C 346 Si-Si 222
• 本族元素有三个价电子,可以形成三条共价键,最外层为6
电子,尚缺两个电子达到稳定结构,因而本族 +3 氧化态的
1 1 f 2 ( ) f3 ( ) rM rX -
如 LiF 阴阳离子半径较接近, 溶解度小;而 LiI、CsF 离子半径 相差比较大,溶解度也比较大。
硼性质总结
硼性质总结1. 硼的基本信息硼(符号为B)是一个位于元素周期表中第13组第2周期的金属loid元素。
它的原子序数为5,原子量为10.81。
硼是一种非金属元素,其形成块状物质时呈现蓝黑色。
硼在自然界中主要以硼酸盐的形式存在。
2. 硼的物理性质密度和熔点硼的密度为2.34克/立方厘米,属于较轻的金属loid元素之一。
硼的熔点较高,约为2075摄氏度,因此其在高温环境下具有良好的热稳定性。
硬度和脆性硼具有很高的硬度,其莫氏硬度约为9.5。
这使得硼成为一种常用的磨料材料。
然而,硼也是一种脆性材料,容易在受到外力作用时发生断裂。
磁性硼是一种非磁性材料,不受磁场的影响。
这使得硼在一些特定的应用领域,如电子器件制造,具有优势。
3. 硼的化学性质氧化性硼是一种具有较高氧化性的元素。
硼与氧气反应能够产生硼酸盐,如硼酸。
惰性硼具有较高的惰性,对大多数化学物质不产生反应。
这使得硼可以用作一种良好的阻隔材料。
溶解性硼在水中的溶解度较低,但在某些有机溶剂中可以溶解。
硼酸盐可以在水中溶解并形成酸性溶液。
4. 硼的应用玻璃加工硼的高熔点和耐热性使其成为玻璃加工中的重要材料。
硼可以增加玻璃的抗热冲击能力,并使玻璃具有较低的热膨胀系数。
电子器件制造硼在电子器件制造中具有广泛的应用。
其高硬度和热稳定性使其成为半导体材料、硬盘表面涂层材料和显示屏玻璃的组成部分。
医疗应用硼中的硼中子捕获截面较大,使其在肿瘤治疗中发挥重要作用。
硼中子俘获疗法利用硼对中子的高吸收能力,通过将含硼的化合物注入肿瘤细胞,然后用中子束照射,来实现对肿瘤的治疗。
核工业硼中的硼中子截面在核工业中具有重要意义。
硼可以用于控制核反应中的中子流量,从而调节核反应的速率。
5. 结论硼是一种具有特殊物理和化学性质的元素。
它具有较高的硬度、脆性和热稳定性。
硼的化学性质惰性较高,但在氧气等一些物质的作用下仍能发生反应。
硼在玻璃加工、电子器件制造、医疗应用和核工业等领域具有广泛的应用。
知识点——硼元素
一、元素介绍中文名称:硼英文别名:Boron,amorphous元素符号:B发现人:盖吕萨克相对原子质量:10.811密度:2.34g/cm³熔点:2300.0℃沸点:3658℃储存:密封保存。
原子体积:(立方厘米/摩尔)4.6元素在海水中的含量:(ppm)4.41元素在太阳中的含量:(ppm) 0.002地壳中含量:(ppm)950莫氏硬度:9.3晶体结构:晶胞为三斜晶胞。
核内质子数:5核外电子数:5中子数:6核电荷数:5原子核亏损质量:0.28017u质子质量:8.365E-27质子相对质量:5.035所属周期:2所属族数:IIIA摩尔质量:11(g/mol)热导率:W/(m·K)27.4声音在其中的传播速率:(m/S)16200 外围电子排布:[He] 2s2 2p1核外电子排布:2、3核电荷数:5电子层:K-L颜色和状态:固体原子半径:1.17常见化合价:+3二、性状特点1702年法国医生霍姆贝格首先从硼砂制得硼酸,称为salsedativum,即镇静盐。
1741年法国化学家帕特指出,硼砂与硫酸作用除生成硼酸外,还得到硫酸钠。
1789年拉瓦锡把硼酸基列入元素表。
1808年英国化学家戴维和法国化学家盖吕萨克、泰纳各自获得单质硼。
硼的拉丁名称为boracium,元素符号为B。
这一词来自borax(硼砂)。
硼在室温下比较稳定,即使在盐酸或氢氟酸中长期煮沸也不起作用。
硼能和卤族元素直接化合,形成卤化硼。
硼在600~1000℃可与硫、锡、磷、砷反应;在1000~1400℃与氮、碳、硅作用,高温下硼还与许多金属和金属氧化物反应,形成金属硼化物。
这些化合物通常是高硬度、耐熔、高电导率和化学惰性的物质,常具有特殊的性质。
它是最外层少于4个电子的仅有的非金属元素。
其单质有无定形和结晶形两种。
前者呈棕黑色到黑色的粉末。
后者呈乌黑色到银灰色,并有金属光泽。
硬度与金刚石相近。
无定形的硼密度2.3克/厘米3,(25-27℃);晶形的硼密度2.31克/厘米3,熔点2300℃,沸点2550℃,。
化学元素 硼
化学元素硼
硼(Boron)是化学元素周期表中的第五号元素,原子序数为5,原子量为10.81。
硼是一种金属样的非金属元素,具有多种同素异形体,常见的有无定形硼和晶体硼。
晶体硼有几种不同的同素异形体,包括无色或棕黑色的透明晶体和无定形棕色粉末。
硼的硬度很高,仅次于金刚石,但它的质地较脆。
硼的化学性质不活泼,它在室温下对酸和碱相对稳定,不会与它们发生反应。
然而,硼能够与卤素直接反应形成卤化硼,如氯化硼(BCl3)和氟化硼(BF3)。
此外,硼还能与金属反应形成金属硼化物,这些化合物通常具有高硬度和耐熔性。
硼在自然界中以化合物的形式存在,最常见的硼矿是硼砂(Na2B4O7·10H2O)和白硼钙石(CaB2O4)。
硼砂是一种重要的工业原料,广泛用于玻璃、陶瓷、洗涤剂和化肥等行业。
硼酸(H3BO3)也是一种常见的硼化合物,它曾用作食品防腐剂,但由于其潜在的健康风险,现在这种用途已经减少。
硼的用途非常广泛,它被用于制作玻璃和陶瓷的耐热剂,洗涤剂中的防腐剂,农业上的微量元素肥料,以及许多其他化学产品的添加剂。
在电子工业中,硼化物被用作半导体材
料的掺杂剂,因为它们能够提供所需的导电性能。
在科学研究中,硼的化合物也用于各种实验室分析和合成反应。
硼化合物在医学和生物化学领域也有应用,例如,硼酸用于治疗皮肤病和作为防腐剂,而硼化合物在药物递送系统中也有潜在的应用。
总的来说,硼是一个多用途的元素,它在工业、农业、医药和科学研究等领域都有着重要的作用。
硼的化学符号
硼的化学符号
硼是元素周期表中的一种化学元素,其化学符号为B。
硼是一种
非金属元素,在大自然中主要存在于硼酸盐、硼砂矿等矿物中,同时
也可通过人工合成获得纯度较高的硼材料。
下面,我们将分步骤阐述
硼的化学符号及相关知识。
1. 硼的基本信息
硼在元素周期表中的原子序数为5,原子量为10.81,属于第三周期,
第13族元素。
硼的原子结构为1s2 2s2 2p1,其中,2s和2p轨道处
于半满状态,使其成为一种不稳定的元素。
2. 硼的物理和化学性质
硼在标准状态下为黑色固体,其最高熔点为2300℃,热导率和电导率
都很高。
硼具有良好的抗磨、耐酸碱等性质,被广泛应用于硼纤维、
高硬度陶瓷材料、半导体材料等领域。
3. 硼的化学反应
硼与氧反应生成三种氧化物:二氧化硼、亚硼酸和硼酸。
其中,二氧
化硼是硼与氧化钙或氧化铝反应时产生的副产物,是一种白色固体,
广泛应用于陶瓷、玻璃、纸张等行业。
4. 硼的应用
硼具有广泛的应用领域,被应用于半导体材料、核能技术、冶金工业、红外光学材料等多个领域。
特别是硼纤维,由于其高强度、高模量等
特点,被应用于航空航天、高速列车、制动器等高科技领域。
总之,硼是一种十分重要的化学元素,其符号为B。
硼具有很多
独特的物理和化学性质,被广泛应用于各个领域。
在今后的发展中,
我们相信硼这种化学元素将有更广泛的应用场景。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硼是一种典型的非金属元素。
硼在自然界中只以化合物形式存在,但在地壳中分散状态的硼却分布广泛,而且是地表水、地下水、岩浆喷气、矿泉水和所有岩层的气液包裹体中所具有的元素。
硼也是非常分散的、典型的亲石元素,广泛分布于各种成因、不同类型的岩石中。
硼矿物几乎在地质旋回的所有阶段都可以形成,从岩浆作用到表生作用,在内生条件和外生条件下均可以形成工业富集。
硼矿是一种用途广泛的化工原料矿物。
它主要用于生产硼砂和硼酸以及元素硼。
硼在玻璃、冶金、医药、搪瓷、油漆、日用化工、农业以及国防尖端工业等部门都是不可缺少的。
因此,硼资源的开发、利用,对于现代工业的发展,具有越来越重要的作用。
一、矿物原料特点
世界上含硼矿物很多,根据含硼矿物的化学组成,可将其分为三类:硼硅酸盐矿物、硼铝硅酸盐矿物和硼酸盐矿物。
其中,硼硅酸盐矿物主要是硅钙硼石和赛黄晶;硼铝硅酸盐矿物主要有电气石和斧石。
这两类硼矿物中,除了硅钙硼石尚具有工业价值外,其他或是难以加工,或因未大量聚集成工业矿床而意义不大。
目前,作为硼工业原料的主要是第三类——硼酸盐矿物。
这类矿物有100多种,但作为工业硼资源开发利用的仅有10余种,如天然硼砂、遂安石、硼镁石、硬硼钙石、天然硼酸、钠硼解石、柱硼镁石等。
在中国,硼镁石、遂安石、硼镁铁矿、硼砂、钠硼解石、柱硼镁石等均可形成大、中型矿床。
下面分别简介一下几种主要硼酸盐矿物的物理、化学性能。
硼镁石Mg2[B2O4(OH)](OH):B2O3的理论含量为41.38%;呈纤维状、板状、柱状晶形;具有丝绢光泽;颜色有白、灰、浅黄色;密度为2.62~2.75 g/cm3,莫氏硬度3~4,不溶于水。
硼镁铁矿(Mg·Fe)3 Fe[BO3]O2:B2O3的理论含量17.83% ;形态有针状、柱状、纤维状、短柱状-粒状集合体等多种晶形;具有珍珠、金刚光泽;颜色有黑色和黑绿色;密度为3.6~4.7 g/cm3;莫氏硬度5.5~6;不溶于水。
天然硼砂Na2B4O5(OH)4·8H2O:B2O3的理论含量是36.51% ;形态为晶体或致密块状、土状集合体;颜色有白色、浅灰色和浅黄色;密度为1.69~1.72 g/cm3;莫氏硬度2.0~2.5;可溶于水。
遂安石Mg2(B2O5):B2O3的理论含量46.34%;形态有板柱状、楔状、竹叶状、针状、纤维状等多种晶形;呈玻璃油脂光泽;有白色或淡褐色;密度为2.91~2.93 g/cm3;莫氏硬度5.9;不溶于水。
钠硼解石NaCa(H2O)6[B3B2O7(OH)4]:B2O3的理论含量42.95% ;晶形有纤维状、针状集合体两种;呈玻璃、丝绢光泽;无色或白色;密度1.65~1.95 g/cm3;莫氏硬度2.5;难溶于水。
硬硼钙石Ca(H2O)[B2BO4(OH)3]:B2O3的理论含量50.81% ;形态为等粒状、放射状、致密状集合体;有玻璃、金刚光泽;白色或无色;密度2.41~2.44 g/cm3;莫氏硬度4.5~5;不溶于水。
柱硼镁石Mg[B2O(OH)3]:B2O3的理论含量42.46% ;有柱状、短柱状和纤维状3种晶形;玻璃光泽;颜色有白色、灰白色或无色;密度2.3 g/ cm3;莫氏硬度3.5。
二、用途与技术经济指标
(一)硼矿物的主要用途
上文已经提过,硼是重要的化工原料。
硼矿的主要用途是用来生产硼砂、硼酸、元素硼以及硼的其他化合物,这些硼化物广泛应用于国民经济的许多部门。
1.建材工业
玻璃行业是硼砂的最大用户。
玻璃生产中加入一定量的硼砂可以增强玻璃的热稳定性,增大紫外线的透射率,提高玻璃的透明度和抗冲击的机械性能。
近年来,硼酸还大量用于玻璃纤维的制造,而玻璃纤维不仅是生产玻璃钢的重要原料,而且也是建筑、机械和制萘工业等的新型材料。
在陶瓷行业中可用硼砂作催化剂。
硼砂也是防腐剂、高温坩埚、油漆等生产的添加剂。
2.轻工工业
硼砂是生产搪瓷制品的重要原料,它能增强搪瓷制品的牢固度和光泽度,提高瓷釉的耐热性,并大大增大其膨胀系数。
在印染行业中,硼砂是常用的煮炼剂,用来去除天然棉纤维中所含的油、蜡及色素等,并对原布具有漂白作用利于染色。
在造纸业中硼化物是一种新型的造纸涂料,它可以增加纸的光泽和防火性能,并用作造纸工业中含汞污水的处理剂等。
硼的某些化合物还可以做成防火剂、防火涂料、油漆干燥剂、防锈漆等。
3.冶金工业
在冶金工业中加入硼化物可制成硼钢等特种钢,这类钢具有很高的强度和耐腐蚀及耐热等优良性能,是制造喷气发动机等主要部件的优质钢材。
在铝、钼、镍等金属中加入少许硼,可以改善这些金属的机械性能。
硼也是铸造镁及其合金时的防氧化剂。
铁、硼、硅非晶态金属是一种高新技术材料,用它作变压器铁心,代替硅钢片,可节电3/4。
4.机械工业
在机械工业中硼被用作硬质合金、宝石等硬质材料的磨削、研磨、钻孔及抛光等。
“渗硼”是机械加工行业中一种新工艺,它能提高零件表面的硬度和耐磨、抗氧化性能。
5.化学工业
硼砂、硼酸可作为肥皂、洗涤剂等日用化工产品的添加剂。
含硼洗涤剂具有保护头发、去污力强、无污染等性能。
某些硼化物还可制成良好的还原剂、催化剂、溴化剂等。
6.电子工业
在硼系列化合物中,某些硼化物是绝缘材料,而有些硼化物则是良好的导电材料,具有半导体的特性,又有电子放射等性能,可用来制造各种电子元、器件,用作引燃管的引燃极、
电讯器材、电容器、半导体的掺合料、高压高频电及等离子弧的绝缘体、雷达的传递窗等。
7.原子能工业和国防工业
硼具有显著的吸收中子的作用,可用作原子反应堆中的控制棒及原子反应堆的结构材料。
碳化硼具有高熔点、抗压强度大、防辐射和防化学腐蚀性能,因此,它是航空和装甲的理想防护材料。
硼的某些化合物是制造火箭喷嘴、燃烧室内件及喷气发动机的部件。
硼的氢化物是液体火箭推进剂中常用的燃烧剂等。
8.农业
硼在农业上用作生产硼肥、杀虫剂等。
(二)中国对硼矿物的一般工业要求
1.对硼镁石矿的要求
边界品位:B2O3 3%;
工业品位:B2O3 5%;
可采厚度:1~2 m;
夹石剔除厚度:1~2 m;
矿石品级划分Ⅰ级品(富矿):B2O3>11%;不需选矿,直接加工;
Ⅱ级品(贫矿):B2O3 5%~11%;需经选矿或配矿。
2.对盐湖硼矿的要
(1)对固体硼矿层的要求
边界品位:B2O3 1.5%
工业品位:B2O3 2%;
可采厚度:≥0.3 m;
夹石剔除厚度:≥0.6 m。
(2)对液体硼矿(含硼卤水及晶间卤水)的要求
边界品位:B2O3 400mg/L;
工业品位:B2O3 1 000mg/L。
