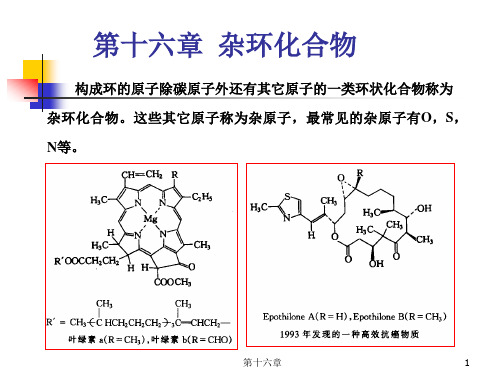
第十六章 杂环化合物
第十六 章杂环化合物

P2S5
Δ
CH3
S
CH3
五、卟啉化合物
CH CH3 N Fe CH3 N N CH3 CH2CH2COOH CH2CH2COOH N CH2 CH3 CH CH2
血红素
1853年分离得到晶体,1929年Fischer人工合成。
31
CH CH3 N
CH2
R CH2CH3 N
Mg N CH3 CH2 C O CH2 N CH3
(3)、磺化:
+ -
N
SO3
N H
+ -
N H
N SO 3
SO3H
O
H 2SO4 , 25℃
O
SO 3H
S
S
SO3H
18
(4)酰化:
N H
+ (CH3 CO)2 O
150 ~ 200℃
N H
BF3 -10 ℃
H 3PO4
COCH3
O
+ (CH3CO)2O
O
COCH3
S
+ (CH 3CO) 2O
S
O
CHO
3-甲基吡啶
2-呋喃甲醛
5
含有两种以上杂原子时:
则依照O,S,N 次序编号,编号时杂原子的位次之和应最小 。
4 3 4 2 5 3 4 2 5 3
N
5
N O
1
口恶 唑
N
2
S
1
N1 H 咪唑
噻唑
有些稠杂环化合物的原子编号是固定的。
5 6 7 8 1 4 3
1 6 5
N2 异喹啉
N N
3 4
CH3 CH3 CH2CONH 2 CH2CH2CONH 2 NC N Co +
第十六章 杂环化合物、生物碱

第十六章杂环化合物、生物碱第十六章杂环化合物、生物碱杂环化合物的定义:在环状有机化合物中,构成环的原子除了碳原子外还含有其他原子,这环状种化合物就叫做杂环化合物(heterocyclic compound)。
除碳以外的其他原子叫做杂原子。
常见的杂原子有:氮、氧、硫。
第一节杂环化合物的分类和命名一、分类按照环的大小和环的数目可分为:五元环单杂环OSN六元环H杂环N苯环与单杂环的稠合杂环(苯并杂环)稠杂环N两个或两个以上单杂环的稠合杂环NNNNH二、命名1、音译法:根据外文译音,选用同音汉字,加“口”字旁表示杂环。
ONS呋喃噻吩furanpyrrole吡咯HthiopheneN吡啶N咪N啶NHpyridinepyrimidineindole吲哚?取代杂环的命名:①杂环的编号从杂原子起依次1,2,3 ……(或:α,β,γ……)。
②如环上不止一个杂原子时,则从O、S、N的顺序依次编号。
③有两个相同杂原子的,应从连有H原子或取代基的开始编号。
④编号时注意杂原子或取代基的位次之和最小。
⑤稠杂环是特定的母体和固定的编号。
4CH354463CH3N3N512NH12C5N32H5S213-甲基吡啶4-甲基咪唑5-乙基噻唑2、根据结构命名:1即根据相应于杂环的碳环来命名,把杂环看作是相应的碳环中的碳原子被杂原子置换而形成的。
例如,吡啶可看作是苯环上一个碳原子被氮原子置换而成的,所以叫做氮杂苯。
NHO 茂(环戊二烯)氮茂S氧茂硫茂NNN苯氮苯1,3-二氮苯第二节一杂五元杂环化合物含有一个杂原子的典型五元杂环是呋喃、噻吩、吡咯。
OSNH一、呋喃、噻吩、吡咯的结构1、据现代物理方法证明:①呋喃、噻吩、吡咯都是一个平面的五元环结构,即成环的四个C原子和一个杂原子都是以SP2杂化轨道成键的。
②环上每个碳原子的P轨道有一个电子,杂原子P轨道上有两个电子。
③ P轨道垂直于五元环的平面,互相侧面重叠而形成一个与苯环相似的闭合共轭体系。
第十六章杂环化合物
第十六章
20
呋喃在镍催化下,加氢可得四氢呋喃。四氢呋喃沸点65.5℃,
是良好的溶剂,也是有机合成的原料。从四氢呋喃可得到己二酸和
己二胺,它们是制造尼龙—66的原料。
第十六章
21
尽管呋喃在温和条件下容易发生亲电取代反应,但由于它的芳
香性较弱,呋喃及其衍生物可以容易地进行Diels—Alder反应和一般
合物。最常见的和最稳定的杂环化合物可分为五元杂环和六元杂环 两大类,在每一类中又根据杂原子种类、数目、单环或稠环等再分 类。
第十六章
4
第十六章
5
第十六章
6
杂环化合物的命名采用英文名称的音译,一般在同音汉字的左
边加一“口”旁。对于含一个杂原子的杂环也可把靠近杂原子的位
置叫做α位,其次为β位和γ位。
沸点162℃。糠醛在醋酸存在下遇苯胺呈亮红色,可用来定性检验 糠醛。糠醛可由农副产品如燕麦壳、玉米芯、棉子壳等原料来制取。 这些原料中含有戊醛糖的高聚物 (戊聚糖)。戊聚糖用盐酸处理后, 先解聚变为戊醛糖,然后再失水而成糠醛。
第十六章
19
糠醛是一个很好的溶剂,也是有机合成的原料。糠醛的化学性
质同苯甲醛类似,例如糠醛与约50%氢氧化钠水溶液作用可生成糠
第十六章
7
16.1.2 结构和芳香性
呋喃、噻吩和吡咯是含一个杂原子的五元杂环化合物,组成环
的五个原子位于同一平面上,彼此以 σ键相连接,每个碳原子还有
一个电子在p轨道上,杂原子的未共用电子对也在p轨道上,这五个 p轨道都垂直于环所在的平面。
第十六章
8
呋喃、吡咯和噻吩的离域能分别为67 kJ· mol-1、88 kJ· mol-1和
第十六章--杂环化合物

HOOC
N CO
CH3 CH3
S
CH NH C R O
R = CH2
为青霉素 G
R = CH2 O
为青霉素 V 常用青霉素
R = CH CH CH2 S CH3 为青霉素 O
青霉素具有强酸性(pKa≈2.7),在游离状 态下不稳定(青霉素O例外),故常将它们变成 钠盐、钾盐或有机碱盐用于临床。
0
0
0
0
0
0
- 0.02
- 0.03
O
+ 0.1
- 0.04
- 0.06
S
+ 0.20
- 0.06
- 0.10
N H
+ 0.32
五元杂环具有芳香性,但其芳香性不如 苯环,因环上旳π电子云密度比苯环大,且 分布不匀,它们在亲电取代反应中旳速率也 比要苯快得多。
亲电取代反应旳活性为:
吡咯 > 呋喃 > 噻吩 > 苯,主要进入α-位。
四、 呋喃、噻吩、吡咯旳制备
试验室制备 1、帕尔-诺尔(Paal, C.-Knorr, L.)合成法
t-Bu
Bu-t
OO
H2SO4-H2O, HAc TsOH, 甲苯, △
t-Bu
Bu-t
OH O
t-Bu
P2S5, 170℃
H
OH -H2O
t-Bu
O Bu-t
O
t-Bu
Bu-t (~40 %)
S
Bu-t
五元杂环 六元杂环
呋喃
O N
噁唑
杂环化合物

吡咯 —无色液体,b.p. 130~131℃,有弱的苯胺气味 —松木片反应:遇盐酸浸湿的松木片呈红色
二、吡啶的物理性质
▪ 吡啶为具有特殊臭味的无色液体, b.p. 115.5℃, 密度 0.982, 可与水、乙醇、乙醚任意混合
▪ 化学性质稳定 可作溶剂(碱性)
三、五员杂环化合物的化学性质
1.亲电取代反应 反应活性顺序:吡咯>呋喃>噻吩>苯
(1) 卤化 呋喃、噻吩在温和条件下(如溶剂稀释及低温)反应 可得一卤代产物;
Br2, 0℃
O Br O O
Cl2
O
-40℃
+ O Cl Cl O Cl
80%
吡咯卤化常得四卤化物,唯有2-氯吡咯可直接卤化制
得。
Br
Br
Br N Br H
Br2, 0℃
AcONO2
O
-5~-30℃
HNO3/(CH3CO)2O
N H
H O NO2
N NO2 H
AcOPyridine
S
H
H
AcO O NO2
O NO2 35%
混酸
S NO2
(3)磺化
呋喃、噻吩和吡咯常用较温和的磺化试剂-吡 啶与三氧化硫加合物进行反应
SO3, CH2Cl2
N
r. t.
综上所述,五元、六元杂环化合物虽然都具有芳香性,
但其环上的电子云的密度是不同的,其电子云密度由高到 低的顺序是:
S
N
O
N
H
§16-4 杂环化合物的性质
一、呋喃、噻吩、吡咯的物理性质
▪ 呋喃 ▪ —无色液体,b.p. 31.36℃,有氯仿气味 —松木片反应:遇盐酸浸湿松木片呈绿色
有机化学第十六章杂环

按照英文字母顺序排列取代基,并按照取代基的数目和位置进行编 号。
编号顺序
按照取代基的编号顺序进行编号,取代基的编号越小,优先级越高。
分类方法
1
根据杂环母核的环状结构分类:分为单环、双环 和多环杂环化合物。
2
根据杂环母核中杂原子的种类分类:分为含氧、 含氮、含硫和含磷等杂环化合物。
3
根据杂环母核中碳原子和杂原子的成键情况分类: 分为碳-碳键和碳-杂原子键杂环化合物。
杂环化合物的特点
01
02
03
稳定性
杂环化合物通常比相应的 碳环化合物更加稳定,因 为杂原子可以提供额外的 电子,增加环的稳定性。
芳香性
有些杂环化合物具有芳香 性,其特点是具有特殊的 电子分布和化学性质。
反应性
杂环化合物的反应性取决 于其结构和取代基的性质, 有些杂环化合物容易进行 亲电或亲核反应。
THANKS
感谢观看
随着科学技术的发展,杂环化合物在 未来的应用将更加广泛和深入。
同时,随着人们对环境保护和可持续 发展的重视,开发环境友好型的杂环 化合物合成方法和技术也将成为未来 的重要研究方向。
未来发展的方向包括开发新的杂环化 合物合成方法、研究杂环化合物的生 物活性与作用机制、探索杂环化合物 在其他领域的应用等。
杂环化合物的取代反应机理通常涉及亲核和亲电取代反应。
详细描述
杂环化合物的取代反应机理通常涉及亲核和亲电取代反应。在亲核取代反应中,亲核试剂进攻杂环上 的碳原子,形成负离子中间体;在亲电取代反应中,亲电试剂进攻杂环上的碳原子,形成正离子中间 体。这些中间体可以进一步发生重排或水解,最终形成取代产物。
05
在材料科学中的应用
杂环化合物在材料科学中也有广泛的应用,如高分子材料、功能材料和复合材料等。
第十六章 杂环化合物2009级新
N
H
H2, Pt, AcOH, 40℃
H +
N
N H H
N H H
反十氢喹啉
顺十氢喹啉
杂环的合成
1. 吡咯环的合成 ——Knorr(L)合成法 2. 呋喃环和噻吩环的合成 ——Paal-Knorr合成法 汪秋安编, 重要有机化学反应 及机理速查手册, 中国纺织出版社
3. 吡啶环的合成
——Hantzsch(A)合成法 4. 喹啉和异喹啉环的合成
(2) 亲核取代反应
N
N
(3) 氧化反应
喹啉和异喹啉与绝大多数氧化剂不发生反应;与高锰酸钾能 发生反应:
KMnO4 水溶液
HOOC HOOC N
N
100℃
喹啉与异喹啉在过酸的作用下均可形成N-氧化物。
RC O3H
N
N O
RC O3H
N
N
O
(4) 还原反应
H2 / Ni
N
N H
Hg(OAc)2, 130℃ or I2
第十六章
·
N
· ·
· ·
五 中 心 六 电 子
·
· ·
N—H 体系中π 电子数: 4+2=6
吡咯
· ·
·
·
· ·
O 呋喃
· ·
O · ·
· ·
S 噻吩
富 电 子 环
)
(
· · ·
·
S ·
· ·
符合休克 尔4n+2 规则,故 三个杂环 均具有芳 香性
吡咯、呋喃、噻吩小结
具体反应式:P.427/435/436 化学性质:
糠醛的化学性质——无α-H的芳醛。
① 催化加氢 -CHO O ② 氧化 -CHO O
、有机化学:杂环化合物(H)
SO3H 2-吡咯磺酸
N H
SO3H 2-呋喃磺酸
O
H2SO4
H2O
r.t S
SO3H S
S
2-噻吩磺酸:易 溶于水,该性质 可用来鉴别苯与
噻吩。
该反应常用来除去 粗苯中的噻吩,也可用 来提纯噻吩。
付-克反应
Ac2O
COCH3
N 150~200C N
H
H
2-乙酰基吡咯
Ac2O, BF3
COCH3
粱杆、棉子壳等为原料,用稀酸加热蒸煮制取。
玉米芯等 3~5%H2SO4 HOCH CHOH 3~5%H2SO4
农副产品
CH2 CHCHO
CHO + 3H2O O
HO OH
戊醛糖
糠醛
1.2 化学性质
氧化还原反应
CHO O
H2, CuO-Cr2O3 T.P
H2, RaneyNi T.P
CH2OH O
吡咯碘化镁
N-甲基吡咯
四、重要的五元杂环化合物的衍生物
1、糠醛(α- 呋喃甲醛) 糖醛最初是由米糠制得,故而得名之。它为无
色透明具有苦杏仁气味的油状液体,b.p162 ℃,略 溶于水,能和乙醇、乙醚等有机溶剂混溶。在空气 中,糠醛易被氧化而变色(黄色~棕褐色)。
其鉴别方法:
糠醛
苯胺 醋酸
呈鲜红色
1.1 制备 由农副产品如甘蔗渣、玉米芯、花生壳、高
NO2 +
N H
N H
2-硝基吡咯 3-硝基吡咯
(51%)
(13%)
CH3CO2NO2
O
Ac2O, -5~30C
O NO2 2-硝基呋喃(35%)
CH3CO2NO2
第十六章 杂环化合物
教材:高鸿宾 主编 高等教育出版社
第十六章 杂环化合物
制作: 陈 锋
东北大学理学院化学系
第十六章
杂环化合物
杂环化合物:参与成环的原子除碳原子外,还有其它 元素的原子,这类环状化合物叫做杂环化合物 •一般把除碳以外的成环原子叫杂原子,常见的杂原子 有氧、硫和氮:
发 烟 HNO ;H SO 3 2 4 300℃ ; 24h. ; 5%
NO 2 N
N
发 烟2 H SO /HgSO 4 4 220℃ ; 70%
SO H 3 N
-Br N
Br2,300℃ N
比苯难,发生在β位。
(五)亲核取代反应
①与强亲核试剂NaNH2
+ NaNH2
发生在α位
N
N
-NH2
②当吡啶的α位联-Cl时,易进行亲核取代,与
-
3
O
- Br
2 -溴呋喃 α-溴呋喃
N
4 -甲基吡啶 γ-甲基吡啶
⑵当环上有两个或两个以上的杂原子时,应使杂原子所在的位次 数字最小;当环上有不同杂原子时,按O→S→N的次序编号。
H 3C 5 N 1 H 4 N 3 2
4
4-甲基咪唑
N S 1
3 2
H 3C
5
5-甲基噻吩
⑶环上连有不同取代基时,编号时遵守次序规则及最低系列原则
烟碱 Nicotine(尼古丁)
三. 衍生物
(二)4-甲基吡啶
CH 3
O
COOH
H2N-NH 2
N
O C NH-NH N
2
N
H2SO 4
4-甲基吡啶
4-吡啶甲酸(异烟酸) 异烟肼 Rimifon(雷米封)
第十六章-杂环化合物
1、
2、
3、
4、
请推测此生物碱的构造式,并解释这些反应。
解 A及B的构造式如下:
罂粟碱
罂粟酮
A
4CH3I,表明A中有4个CH3O-。
B 进一步氧化,在C=O两边断裂得1与4等,1再进一步氧化,苯环破裂得3, 吡啶环破裂得2,等等。
三十五、罂粟碱已用下列步骤合成,请写出每一步反应所得产物的构造式。
14、
15、
16、
解 1、
2、
3、
4、
5、
6、
7、
8、
9、
10、
11、
甲酯
二羰基化合物
12、
13、
14、
15、
16、
五、完成下列反应机制。 1、写出 2、写出 3、写出 在酸作用下与苯肼反应生成吡唑的反应机制。 在 在 催化作用下形成噁唑的反应机制。 及 中形成咪唑的反应机制。
解 1、
2、
二、下列化合物发生硝化反应,请用箭头表示主要产物的位置。
解
三、从指定的原料及必要的试剂合成化合物。 1. 2. 3. 从庚二酸二乙酯及 从环戊酮及 合成 合成
从乙酰乙酸乙酯、苯、丙酮合成
解
1、
2、
3、
四、完成下列反应,写出主要产物。
1、
2、
3、
4、
5、
6、
7、
8、
9、
10、
11、
12、
13、
3、 3 、
三十一、一含氧杂环的衍生物(A),它与强酸水溶液加热,反应得到的化合物 (B)C6H10O2。(B)与苯肼呈正反应,与土伦,菲林试剂呈负反应。(B)的 IR谱在1751cm-1有强吸收,NMR谱在δ H:2.6及2.8有两个峰,这两个单峰面积 之比为2:3 。请写出(A),(B)的构造式。 解 含氧杂环衍生物(A)的构造式为 。它与强酸水溶液加热反应得
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
N N pyrazine 吡嗪
5 6 7 8
4 3 6 7 2
5
4 3
4
6 3 2 1N 2
N
N2
8 1
5 6
5
7 8
1
7
quinoline 喹啉
isoquinoline 异喹啉
N1 H indole 吲哚
N 4 N9 H 3 purine 嘌呤
杂环化合物分类:
第一类:无芳香性的杂环化合物:
O 例: O 四氢呋喃 O 丁二酸酐 O N H 四氢吡咯 N H 六氢吡啶
CO2Et H2C COCH3 Et2NH CO2Et C COCH3
H2 C O
+
CH2
第二步:发生迈克加成
CH2
CO2Et C COCH3
+
H2 C
CO2Et COCH3
Et2NH
EtO2C H3C OO
CO2Et CH3
第三步:关环,生成二氢吡啶环
EtO2C H3 C OO
CO2Et CH3
KNO3 , H2SO4(SO3) N 300℃ Br N N
NO2 3-硝基吡啶
Br2 , HOAc N NH2 20℃
NH2
E N
E
H N
E
H N
E
H N
E N
E H E N N E H or N+
16.1.4 吡啶环上亲核取代反应 亲核取代是吡啶环特有的反应,苯系化合物没有类似的反应。 吡啶环 2, 4, 6 位上的卤素容易被亲核试剂取代。
N2
2
thiazole
oxazole
2 六元杂环
N N pyridine 吡啶 N pyrimidine 嘧啶 N pyridazine 哒嗪 N N N pyrazine 吡嗪
3 稠杂环
5 6 7 8 4 3 6 7 8 1 2 5 4 3 4 6 3 2 1N 2
N
N2 isoquinoline 异喹啉
5 6
5
7 8
1
quinoline 喹啉
N1 7 H indole 吲哚
N 4 N9 H 3 purine 嘌呤
§16.1 吡啶
16.1.1 结构和物理性质 氮上有一对电子未参与共轭,易接受质子,具有碱性,五 个碳原子和一个氮原子在同一个平面,极性分子。 碱性:脂肪胺>吡啶>芳香胺 吡啶是一个无色有恶臭的液体,对人体神经系统有损害, 与水及许多有机溶剂,如乙醇、乙醚等混溶,是良好的溶 剂。
CH2 CH CH2 OH OH OH H2SO4 CH CH CH2 OH OH HC O CH2 CH2 OH H2SO4 HC O CH CH2
②.苯胺与丙烯醛发生迈克加成
O
+
NH2
CH2
CHCHO
HC N H
CH2 CH2
③.质子化的醛对苯环进行亲电取代反应
O HC N H CH2 CH2 H OH HC N H H OH C OH HC N H OH C N H
N
吡啶共振结构为:
N:sp 杂化
2
N
N
N
N
N
与苯环相比,吡啶环是缺点子的芳环 吡啶环上原子的编号与π-电子密度:
4γ 3β N 1 2α
0.87 1.01 N 1.43 0.84
16.1.2 吡啶的化学性质
亲电取代 芳环 亲核取代 氮上未成键电子对 亲核性 碱性
吡啶环上氮的碱性及亲核性
NH3 , ZnCl2 N Br Br N NH3 , H2O Cl
220℃
N NH2
NH2
Br N
160℃
NaOMe CH3OH N Cl N OMe
除吡啶环 2, 4, 6 位上的卤素容易被亲核试剂取代 外,吡啶环2位上的负氢离子也能被取代。
+
N H NaNH2 N NHNa
+
H2
+
N NHNa
30%H2O2 CH3COOH 70℃, 24h. O CH3COOH N N O N O
COOH NH 3 N
CNH2
N
尼古丁(烟碱)
CH3 N
尼古丁酰胺(烟酰胺)
CH3
16.1.8 吡啶环合成 Hantzsch(汉栖)合成法:原料:β-酮酸酯、醛和氨缩合。 第一步: β-酮酸酯和醛发生羟醛缩合
罂粟花
婴粟碱 papaverine
16.2.2.7 喹啉及其衍生物的合成 Skraup合成法:将芳香族伯胺与甘油同硫酸和一种氧化剂 (如:硝基苯、五氧化二砷、氧化铁等)一起加热,即可得 喹啉及其衍生物。
+
NH2 CH2 CH CH2 OH OH OH 浓H2SO4 As2O5 N
反应过程: ①.甘油在浓硫酸(或磷酸)作用下脱水生成丙烯醛,也可直 接用α,β-不饱和醛或酮
CH2 ቤተ መጻሕፍቲ ባይዱH2
CH2 CH2
H H
CH2 H CH 2 N H
CH2 CH2
H2O N H
④.1, 2-二氢喹啉氧化
NO2
N H
+
N NH2
Cl 例: NH2
甘油 , H2SO4
Cl NO2
Cl N (85-88%)
+
NH2
CH2
O CH C CH3
CH3 FeCl3 , ZnCl2 或 H2SO4
+
N
HCl
N H
Cl
N N
Cl Pt Cl
N N
+ N
RCOX
N COR
X
X N COR
-HX + HNu +HX N R C O Nu
O RC-Nu + N
+ N
PhCH2Cl
N CH2Ph
Cl
吡啶与酰氯、磺酰氯或酐迅速生成季铵盐,与酰氯相比是更 有效的酰化剂,因吡啶是芳环,与卤离子相比,是更好的离 去基团。
NO2
N (73%)
CH2CH2NH2 Ac2O
CH2 O
C CH3
CH2 NH
P2O5 205℃
CH2
C CH3
CH2 N
Pd 190℃ N CH3 (83%)
§16.3 嘧啶(1,3-二嗪)
结构与物理性质 嘧啶是含有二个氮原子的六元杂环化合物,,较难发生 亲代取代反应,它本身在自然界并不存在,但它的衍生物 在自然界很多,如核酸、Vitamin B1等,它们在生理和药 理上都有着非常重要的作用。此外,含嘧啶环结构的药物 也非常多,如维生素类、磺胺类、巴比妥类以及抗癌药物。
16.2.2 化学反应:多数反应与吡啶相似,碱性与吡啶也相近,N 原子上的亲电加成与吡啶相似。 16.2.2.1 碳原子上的亲电取代反应亲电取代反应主要发生在碳 环的5位和8位,较吡啶容易。 NO
2
HNO3 , H2SO4 N 0℃ NO2 N
+
N 5-硝基喹啉(52%)
8-硝基喹啉(48%)
HNO3 , H2SO4 N 0℃ NO2 10%
1 五元杂环
β4 α5 3β
O
1
2α
S thiophene 噻吩
N H pyrrole 吡咯
furan 呋喃
五元环中含两个或两个(至少有一个氮原子)以上的杂原 子的体系称唑。
4 5
N3
2
4 5
3
4 5
N3 S1 噻唑
2
4 5
N3 O1
噁唑
N1 H imidazole 咪唑
N1 H pyrazole 吡唑
quinoline 喹啉
16.2.1
结构与物理性质
喹啉、异喹啉的性质与吡啶相似,分子中所有的原子都在同一 个平面,为杂芳环,具有弱碱性。常压下,喹啉为液体,沸点 为238℃,难溶于冷水,易溶于热水及有机溶剂,采用水蒸气蒸 馏可以得到喹啉;异喹啉为低熔点固体,熔点为26℃,沸点为 243℃,微溶于水,易溶于有机溶剂
H2 / Ni N 25℃, 3 atm. Sn , HCl N 或Na ,EtOH N H 六氢吡啶(哌啶) N H
16.1.6 羟基吡啶和氨基吡啶
2-吡啶酮 N OH OH N H O 4-吡啶酮 N OH N N+ H HNO2 N NH N N N H2O N OH N H O N H ON H O O
第二类:具有一定程度的芳香性的杂环化合物:
β4 α5 3β
O
1
2α
S thiophene 噻吩
N H pyrrole 吡咯
furan 呋喃
N
吡啶
2p轨道
sp2杂化轨道
分类和命名 芳杂环的数目很多,可根据环大小、杂原子的多少以及单 环和稠环来分类。 常见的杂环为五元、六元的单杂环及稠杂环。 稠杂环是由苯环及一个或多个单杂环绸合而成。 命名:复杂,杂环母环采取外文音译方法,用带“口”字旁 的同音汉字表示。
NH3, EtOH
EtO2C H3 C N H
CO2Et CH3
第四步:二氢吡啶环脱氢,生成吡啶衍生物
EtO2C H 3C N H
CO2Et CH3
HNO3, H2SO4
EtO2C H3C N
CO2Et CH3
§16.2 喹啉、异喹啉
5 6 7 8 4 3 2 5 6 7 8 1 4 3
N
1
N2 isoquinoline 异喹啉
NO2 N
+
N 90%
16.2.2.2 亲核加成 喹啉和异喹啉与吡啶的显著差异是更容易在1,2位加成
