水质分析试验
水质简分析主要试验步骤及计算
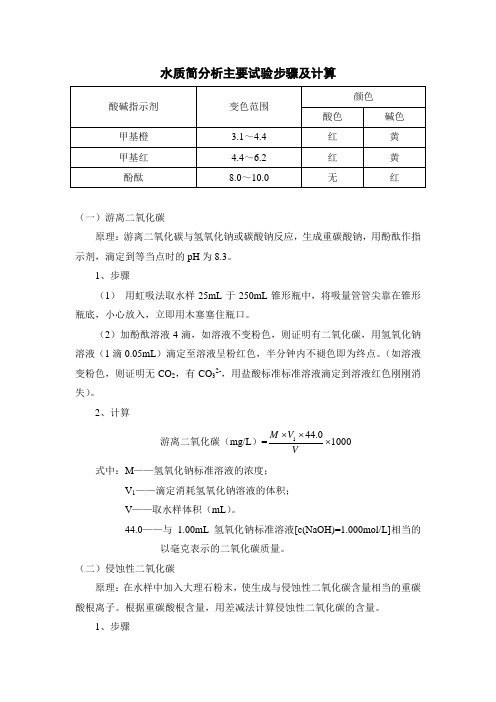
水质简分析主要试验步骤及计算(一)游离二氧化碳原理:游离二氧化碳与氢氧化钠或碳酸钠反应,生成重碳酸钠,用酚酞作指示剂,滴定到等当点时的pH 为8.3。
1、步骤(1) 用虹吸法取水样25mL 于250mL 锥形瓶中,将吸量管管尖靠在锥形瓶底,小心放入,立即用木塞塞住瓶口。
(2)加酚酞溶液4滴,如溶液不变粉色,则证明有二氧化碳,用氢氧化钠溶液(1滴0.05mL )滴定至溶液呈粉红色,半分钟内不褪色即为终点。
(如溶液变粉色,则证明无CO 2,有CO 32-,用盐酸标准标准溶液滴定到溶液红色刚刚消失)。
2、计算游离二氧化碳(mg/L )=10000.441⨯⨯⨯V V M 式中:M ——氢氧化钠标准溶液的浓度;V 1——滴定消耗氢氧化钠溶液的体积;V ——取水样体积(mL )。
44.0——与1.00mL 氢氧化钠标准溶液[c(NaOH)=1.000mol/L]相当的以毫克表示的二氧化碳质量。
(二)侵蚀性二氧化碳原理:在水样中加入大理石粉末,使生成与侵蚀性二氧化碳含量相当的重碳酸根离子。
根据重碳酸根含量,用差减法计算侵蚀性二氧化碳的含量。
1、步骤(1)吸取未加大理石粉末的水样25mL 于150mL 三角瓶中,加入甲基橙溶液4滴,用盐酸标准溶液滴定到黄色突变为橙色,消耗的盐酸标准溶液的体积为V 1(mL );(2)另取加大理石粉末的水样25mL 于三角瓶中,按(1)的步骤进行测定,消耗的盐酸标准溶液的体积为V 2(mL )。
2、计算侵蚀性二氧化碳(mg/L )=10000.22)(12⨯⨯-VV V c 式中:c ——盐酸标准溶液的浓度,mol/L ;V 2——加大理石粉末的水样所消耗的盐酸标准溶液的体积,mL ; V 1——未加大理石粉末的水样所消耗的盐酸标准溶液的体积,mL ; V ——所取水样的体积,mL ;22.0——与1.00mL 盐酸标准溶液[c(HCl)=1.000mol/L]相当的以毫克表示的二氧化碳质量。
水质参数测定实验报告

水质参数测定实验报告1. 引言水是人类赖以生存的重要资源,而水质的好坏与人类的生产生活密切相关。
为了保证水质的安全,需要测定一系列的水质参数,如pH值、溶解氧、浊度等。
本实验旨在通过实际操作和测量,了解水质参数的测定方法和测定结果的意义,以提高对水质问题的认识。
2. 实验目的- 学习和掌握测定水质参数的方法;- 掌握使用实验仪器的技巧;- 分析实验结果,评估水质。
3. 实验仪器和试剂3.1 仪器- pH计- 溶解氧仪- 浊度计3.2 试剂- pH标准缓冲液- 溶解氧标准溶液- 水样4. 实验步骤4.1 pH值的测定1. 校准pH计:使用pH标准缓冲液,按照说明书进行校准。
2. 取不同水样,并使用pH计测定其pH值。
3. 记录测得的pH值。
4.2 溶解氧的测定1. 校准溶解氧仪:使用溶解氧标准溶液,按照说明书进行校准。
2. 将溶解氧仪的电极浸入水样中,等待一段时间使测量稳定。
3. 读取溶解氧仪的显示结果,并记录其数值。
4.3 浊度的测定1. 校准浊度计:按照说明书进行校准。
2. 取不同水样,用浊度计进行测定。
3. 记录测得的浊度数值。
5. 数据处理与分析5.1 pH值的分析根据测得的pH值,判断水样的酸碱性,pH值越低表示越酸,越高表示越碱。
5.2 溶解氧的分析溶解氧是水中溶解的氧气的含量,对维持水生生物的生存起着重要作用。
根据测得的溶解氧数值,评估水样中的溶解氧含量。
过低的溶解氧含量会危害水生生物的生存。
5.3 浊度的分析浊度是水中杂质的含量,一定程度上反映了水的清洁程度。
根据测得的浊度数值,评估水质的清洁程度。
高浊度的水质可能含有较多的悬浮颗粒和微生物。
6. 结论通过测定水样的pH值、溶解氧和浊度等参数,我们可以获得对水质状况的初步了解。
根据实验结果,我们可以评估水质的好坏,并采取相应的措施进行水质的改善或治理。
通过本实验,我们可以更好地了解水质参数的测定方法,并提高对水质的认识。
7. 实验心得通过本次实验,不仅学习了测定水质参数的方法和使用实验仪器的技巧,还对水质的测定结果有了更深入的认识。
水质分析与监测实验

水质分析与监测实验指导书实验一试剂配制一、目的和要求规范操作,掌握基本技能(万分之一天平,移液管,称量,定容,取NaOH,浓H2SO4,酸碱滴定管,标签,定容后盐酸入广口玻璃试剂瓶,定容后NaOH入广口聚乙烯瓶)二、试剂配制1.0.0100mol/l碳酸钠标准溶液溶解1.060g预先在105~110℃干燥至恒重的基准无水碳酸钠(N a C O,优23级纯,粉末),并转入1000m L容量瓶中,用无二氧化碳的水(即煮沸后的冷却水,下同)稀释至刻度。
2.甲基橙(0.1%)甲基橙(C15H15O2N3)1.0g,用500ml水溶解。
转至棕色瓶中。
3.HCL标准溶液(0.02mol/l)取8.3ml浓HCL至1000ml,得到0.1mol/l储存液。
取此溶液200ml用无水CO2水稀释至1000ml。
取稀释液入滴定管,取N a C O标准液10~25ml,加甲基橙233滴,用HCL标定由黄变红,计用量,换算得其精确浓度C HCL(待测HCL入酸式管,N a C O标准液入三角瓶)234. 0.02mol/lNaOH标液称取约8gNaOH于1000ml定容,取10ml于100ml定容。
取已标定HCL10~25ml入三角瓶,加酚酞2滴,用稀释的待测NaOH滴定,由无色至出现红色,且30s不褪色,计用量。
5.酚酞取0.5g酚溶于95%的乙醇定容至100ml。
6.1200mg/lCOD溶解0.5101g邻苯二钾酸氢钾(H O O C C H C O O K,晶体)(105~110烘干2小64时)于重蒸馏水中,转入500m L容量瓶,用重蒸馏水稀释至标线,使之成为1200 mg L的COD标准溶液,用时新配。
用邻苯二钾酸氢钾标准溶液检查试剂的质量和操作技术时,由于每克邻苯二钾酸氢钾的理论C O D为1.176g。
C r7.催化剂25ml移液管准确取专用催化剂25ml于250ml容量瓶中,用浓硫酸定容至标线,摇匀,备用。
工程勘察水质分析试验

12
CO2 பைடு நூலகம்剂的标定
标定方法:吸取(20±0.05)ml碳酸钠溶液于250ml 三角瓶中,用水稀释至100ml,加入二滴甲基橙指 示剂,以硫酸标准溶液滴定至橙红色为终点。硫 酸标准溶液的浓度按下列公式计算:
C1——硫酸标准溶液浓度的数值; C2——碳酸钠标准溶液浓度的数值; V1——硫酸标准溶液消耗的体积的数值; V2——碳酸钠标准溶液取用体积的数值。
对地下水需掌握?
岩土工程勘察要根据工程要求,需掌握下列水文地质 条件: 1、地下水的类型和赋存状态; 2、主要含水层的分布规律; 3、是否存在对地下水和地表水的污染源及可能的污染; 4、对高层建筑或重大工程,当水文地质条件对地基评价 、基础抗浮和工程降水有重大影响时,宜进行专门的水文 地质勘察。
4
7
试验前的检查
由试验人员完成
试验准备: 1、对所用的仪器进行检查(检定证书、必要的期间 核查,例如标准试剂曲线与之前的比对等) 2、对所用试剂、指示剂进行检查(试剂有无过期、 有无沉淀物如硝酸银溶液需每个星期需重新标定) 3、对水样的包装、色度、浑浊度、悬浮等物理性装 进行描述记录。
8
工程勘察水样主要检测项目:
水样取好后立即送试验室(不得超过1天),并 标明取样地点及时间;
送样单填写:取样地点、取样深度、钻孔编号、 检测项目。(必要时标出现场位置草图)
6
取水样的要求
由现场地质人员完成
《岩土工程勘察规程》第7.1.5款规定水试样的采取 和试验应符合下列规定: 1、水试样应能代表天然条件下的水质情况; 2、水试样的采取和试验项目应符合本规范的规定; 3、水试样应及时试验,清洁水放置时间不宜超过 72小时,稍受污染的水不宜超过48小时,受污染的 水不宜超过12小时。
水质全分析试验方法

水质全分析试验方法水质全分析时,应做好分析前的准备工作。
根据试验的要求和测定项目,选择适当的分析方法,准备分析用的仪器和试剂,然后再分析测定。
测定时应注意下列事项:1.开启水样瓶封口前,应先观察并记录水样的颜色,透明程度和沉淀的数量及其它特征。
2.透明的水样在开瓶后应先辩别气味,并且立即测定温度、PH、氨、化学耗氧量、碱度、电导率和钠等易变项目;然后测定全固体、溶解固体和悬浮固体;接着测定硅、铁铝氧化物、钙、镁、硬度、磷酸盐、硝酸盐、硫酸盐、氯化物等项目。
3.浑浊的水样应取其中经澄清的一瓶,并立即测定PH、氨、温度、酚酞碱度等易变项目;过滤后测定全碱度、硬度、磷酸盐、硝酸盐、硫酸盐、氯化物等项目。
将另一瓶水样混匀后,立即测定化学耗氧量,并测定全固体、悬浮固体、溶解固体、硅、铁铝氧化物以及钙、镁等项目。
4.水质全分析结果,必须进行审核,当时对误差超过《SQ方法》中的相应规定时,应查找原因后重新测定,直到符合要求。
全固体的测定1.概要1.1全固体为悬浮固体与溶解固体的总和。
1.2全固体测定有三种方法:第一法适用于一般水样;第二法适用于酚酞碱度高的水样,如炉水;第三法适用于有大量吸湿性很强的固体物质,如氯化钙、氯化镁、硝酸镁等的苦咸水。
2.仪器2.1水溶锅或400ml烧杯(蒸干操作时水浴锅内水面不能与蒸发皿接触,以免沾污蒸发皿而引起误差)。
2.2瓷蒸发皿或石英蒸发皿:(若为精密分析应使用铂蒸发皿)。
3.试剂3.1碳酸钠标准溶液(1ml含10mgNa2CO3)。
3.2 0.1硫酸标准溶液。
4.测定方法4.1第一法的测定步骤:a 取一定量充分摇匀的水样,次注入已经烘干至恒重的蒸发皿中,在水浴锅上蒸干。
b 将已蒸干的样品连同蒸发皿移入105-110℃的烘箱中烘2小时。
c 取出蒸发皿放在干燥器内冷却至室温,迅速称量。
d 在相同条件下烘半小时,冷却后称量,如此反复操作至恒重。
全固体(QG)含量(mg/l)按式(1)计算:QG =(G1-G2)/V×1000 (1)式中G1-蒸干残留物与蒸发皿的总重量, mgG2-蒸发皿的重量,mgV-水样的体积, ml4.2第二法的测定步骤取一定量充分摇匀的水样,加入与其酚酞碱度相当量的硫酸标准溶液,使水样中和至PH=8.3左右。
水质分析监测实验报告

水质分析监测实验报告前言水质分析是对水体中各种成分的含量和性质进行测定和评价的过程,对保护水资源和人类健康具有重要意义。
本次实验旨在通过对水样的分析监测,了解水质状况及其中存在的污染物,以及对水质进行评价。
实验目的1. 了解常见水质参数的测定方法;2. 掌握水质分析的基本实验步骤和操作技巧;3. 进行水质监测实验,评价水质情况;4. 提供水质改善的参考意见。
实验装置和试剂实验装置:1. 水样采集器;2. 试剂瓶、量筒和滴定管;3. 水质分析仪器(如PH计、离子色谱仪等);4. 加热设备。
试剂:1. pH标准缓冲液;2. 氯化物指示剂;3. 高锰酸钾溶液;4. 硝酸银溶液等。
实验步骤1. 水样采集在实验前应选择具有代表性的不同水源,采集样品,并分别记录采样点、时间、日期和天气情况。
2. 温度和pH值测定使用温度计和pH计测定样品的温度和pH值,并记录。
3. 总溶解固体(TDS)测定取一定量的水样,通过蒸发法或便携式TDS仪器测定水样中总溶解固体的含量。
4. 氧化还原电位(ORP)测定使用氧化还原电位仪测定水样的氧化还原电位,并记录结果。
5. 悬浮物测定将水样放置一定时间后,观察悬浮物的颜色、透明度和颗粒大小,并记录观察结果。
6. 重金属离子测定采用离子色谱仪等方法,测定水样中重金属离子(如铅、汞等)的含量,并与国家标准进行比较。
7. 溶解氧(DO)测定使用溶解氧仪测定水样中的溶解氧含量,并记录结果。
8. 有机物质测定通过紫外分光光度计等设备对水样中的有机物质进行测定,并与标准值进行对比。
9. 细菌总数测定采用培养基培养法,测定水样中细菌总数,并记录结果。
实验结果与讨论根据实验步骤所得结果,可以对水质进行评价和分析。
比如,pH值在范围内的水样可认为是中性的,而超出范围可能表示存在酸性或碱性污染。
溶解氧含量过低可能导致水体富营养化和水生生物死亡,高浓度重金属离子可能对人体健康产生潜在的风险等。
结论通过本实验的水质分析监测,我们得出了以下结论:1. 样品A的pH值偏酸性,可考虑采取中性化措施;2. 样品B的溶解氧含量低于标准值,水体需要增加氧气供应;3. 样品C的重金属离子浓度超标,需要加强废水处理和源头控制;4. 样品D的有机物质浓度较高,需进行有机物质排放的治理。
工程勘察水质分析试验

9
侵蚀二氧化碳测定
原理: 水中侵蚀二氧化碳与碳酸钙反应,生成与
侵蚀二氧化碳含量相当的重碳酸根离子。分 别测定原水样中和加入碳酸钙后水样中的重 碳酸根离子的含量,根据其差值计算出水中 侵蚀性二氧化碳的含量。
钠,溶于少量水中,转入500mL容量瓶,用水稀释至刻度 ,摇匀。
11
CO2
试剂
硫酸标准溶液:c(H2SO4)=0.05 mol/L, 吸取 1.40ml硫酸(p=1.84)于1L盛有少量水的容量瓶 中,冷却至室温后,用水稀释至刻度,摇匀。
硫酸标准溶液:c(H2SO4)=0.05 mol/L, 吸取 1.40ml硫酸(p=1.84)于1L盛有少量水的容量瓶 中,冷却至室温后,用水稀释至刻度,摇匀。
2
水在地球理化作用中的影响?
在沉积岩中
水的溶蚀性: 水对碳酸盐类岩石的溶解能力,主要取决于水中侵蚀性
CO2的含量。 水中侵蚀性CO2的含量越多,水的溶蚀能力也 越强。 水的流动性 :
水的流动性反映了水在可溶岩层中的循环交替程度。 只 有水循环交替条件好,水的流动速度快,才能将溶解物质带 走,同时又促使含有大量CO2的水,源源不断地得到补充, 则岩溶发育速度就快,反之岩溶发育就慢,甚至处于停滞状 态。
31
氯离子含量、硫酸根含量 硫酸根测定
原理:
在盐酸溶液中,硫酸盐与加入的氯化钡反应形成硫酸钡沉 淀。沉淀反应在微沸的温度下进行,陈化一段时间之后过滤 ,用水洗到无氯离子,在500℃灼烧沉淀,称硫酸钡的质量 。
从理论讲,硫酸钡的溶度积常数很低,约为0.87 × 10-10 ,当溶液中的硫酸根离子和钡离子的乘积达到了其溶度积常 数后,就产生沉淀,如果达不到就会溶解在溶液中,不产生 沉淀。
水质分析报告

水质分析报告1. 引言水质是指水中所含的物质和微生物的状态和性质。
对水质进行分析可以了解水的污染程度,帮助决策者采取适当的措施来保护和改善水资源。
本报告对某水体的水质进行分析,并对分析结果进行解读。
2. 实验方法本次水质分析实验采用以下方法:1.水质采样:从目标水体中采集水样,并尽量避免受外界污染影响。
2.pH测定:利用pH测试仪测量水样的酸碱性。
3.溶解氧测定:利用溶解氧仪测量水样中的溶解氧含量。
4.总悬浮固体(TSS)测定:采用过滤法,将水样中的悬浮物集中在滤纸上,并称量滤纸的质量。
5.氨氮测定:使用氨氮试剂盒,根据反应原理测定水样中的氨氮浓度。
3. 实验结果根据以上实验方法,得到了以下水质分析结果:参数测定值单位pH值7.2 -溶解氧含量8.5 mg/LTSS 25.6 mg/L氨氮浓度0.8 mg/L4. 数据分析与讨论4.1 pH值水样的pH值是衡量水体酸碱性的重要指标。
根据国家标准,水体pH值应在6.5-8.5之间。
实验结果显示,本次测试的水样pH值为7.2,处于理想的范围内,表明水体整体酸碱性较为中性,不会对生态环境造成明显的影响。
4.2 溶解氧含量水中的溶解氧对水生生物的生存至关重要。
通常情况下,水体中的溶解氧含量应大于5.0 mg/L。
本次实验测得的溶解氧含量为8.5 mg/L,说明水样中溶解氧含量较高,水体中的生态系统相对较为健康。
4.3 TSS总悬浮固体(Total Suspended Solids,简称TSS)指水体中悬浮物质的总量。
根据水质标准,TSS的浓度应小于30 mg/L。
本次实验测得的TSS浓度为25.6mg/L,说明水体中的悬浮物质处于可接受范围内,未出现明显的污染现象。
4.4 氨氮浓度氨氮是指水体中以氨(NH3)和氨根离子(NH4+)形式存在的氮化合物。
过高的氨氮浓度会对水生生物造成毒害。
根据国家标准,水体中的氨氮浓度应小于1.0 mg/L。
本次实验测得的氨氮浓度为0.8 mg/L,处于合理范围内,不会对水生生物造成明显的危害。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
五、教材大綱: 單元主題
內容綱要
1. 水樣採取 1.水樣採取概說。
2.水樣採取的意義。
3.水樣的種類。
4.水樣的採取方法。
5.水樣的保存方法。
2. 水中 PH 值 1.PH 值的定義。
測定
2.指示劑法。
3.指示劑法的操作及計算。
4.PH 計的原理及構造。
5.PH 計的校正及操作。
3.溶氧量(DO) 1.溶氧量的定義。
測定
2.溶氧量的測定原理
3.溶氧量的檢驗步驟
4.DO 的計算方法
5.DO 計的原理及構造。
6.DO 計的校正及操作。
4. 生化需氧 1.生化需氧量的定義及單位。 量(BOD)測定 2.生化需氧量的操作。
3.生化需氧量的計算。
分配節數
備註
3
1.可用指示劑與 PH 計.兩者做比 3較
化工群 化工科訂定校訂參考科目
水質分析實驗科目大要
科 目 名 稱 水質分析實驗
Chemical Engineering Equipments
科 目 屬 性 □一般科目 專業科目 實習科目 □實務科目 □實驗科目
科 目 來 源 自行研發 依現有課程進行調整 □其他
研訂本科目之必 本科目目標在協助學生水質分析的基本原理及操作。
其
他
備註:1.若無規劃模組課程,則免填。 2.若無「其他」,則免填。
(二) 水質分析
表 2-1 水質分析科目大要
學分數:3 (3/0)
建議開課學期:第三學年第一學期
本科目目標在協助學生瞭解水質分析的基本原理及操作。主要內容包含:水樣採
取、水中 PH 值測定、溶氧量(DO)測定 、生化需氧量(BOD)測定 、 化學需氧量
7. 懸浮物質(S 1. 懸浮物質(S S) 的單位。
S)
2. S S 的計算。
8. 水的硬度 1.水硬度的原理。 2.水硬度的操作。 3.水硬度的計算。
9. 水 中 餘 氯 1.水中餘氯的定義。
測定
2.滴定操作。
3.餘氯的計算。
10. 水中油脂 1.油脂的檢驗原理。 的檢驗 2.吸引過濾裝置。 3.蒸餾裝置。 4.油脂的計算。
14. 重金屬測 1.原子吸收光譜儀之原理及操作。
定
2.波長的選擇。
3 標準減量線的製得。
4.未知物的操作及定量。
15. 簡易重金 1.酸鹼度對金屬離子的影響。
屬之處理 2.處理分析實驗的陽離子。
1. 包 含 藥 品 的 配
製
3 2. 滴 定 的 操 作 及 顏色的判別
3.兩者做比較
1.含標準值的較
2.教學方法 (1)教師教學前,應編寫教學計畫。 (2)教師教學時,應以學生的舊經驗為基礎,引發其學習動機,導出若干有 關問題,然後採取解決問題的步驟。 (3)教師教學時,應以和日常生活有關的事務做為教材。 (4)教學完畢後,應根據實際教學效果修訂教學計畫,以期改進教學方法。
11. 水中亞硝 1.分光光度計的原理及操作。 酸鹽的測定 2.標準減量線的製得。 3.未知物的計算。
12 水中有機磷 1.氣相層析儀之原理及操作。 的測定 2.氣相層析儀定量及定性分析 3.未知物之操作及定量。
13.酚的測定 1.分光光度計的原理及操作。 2.標準減量線的製得。
3.未知物吸收度的測得及計算。
十、水中油脂的測定
二、水中 PH 值測定
十一、水中亞硝酸鹽的測定
三、溶氧量(DO)測定
十二、水中有機磷的測定
四、生化需氧量(BOD)測定 十三、酚的測定
科
目
大
要
五、化學需氧量(COD)測定
六、濁度測定
*
十四、重金屬之測定 十五、簡易重金屬之處理
七、懸浮務物質(S S)測定
八、水的硬度測定
九、水中餘氯的測定
要性(摘要說明)
適用科別、模組
化工科別 模組
染整科別 模組
科別 模組
科別 模組
建議開課年級/學 期
三年級 1 學期
三年級 1 學期
年級 學期
年級 學期
建議學分數
3 學分
3 學分
學分
學分
建議開課節數
3節
3節
節
節
科別 模組 年級 學期 學分
節
教 學 目 標 認識水質分析的基本原理、操作及處理。
一、水樣採取
1.Winkler 法與
DO 計. 兩者做比
較
3
2.溫度對溶氧的
影響
1.包含稀釋水的 配置
3 2.水樣之事前處 理 3.DO 值的測定
5 化學需氧量 1.化學需氧量的原理及單位。 (COD) 測定 2.化學需氧量的滴定操作。
3.化學需氧量的計算。 4.化學需氧量的儀器操作。
6. 濁度測定 1.濁度的單位。 2.儀器的的原理。 3.濁度計的操作。
(COD)測定、 濁度測定、 懸浮務物質(S S)測定、 水的硬度測定、水中餘氯的
測定 、水中油脂的測定、水中亞硝酸鹽的測定、水中有機磷的測定、酚的測定、
重金屬之測定、簡易重金屬之處理。教學上應重視實作與理論的配合
表、5.2 化工群 化工科/水質分析實驗 教學綱要
一、科目名稱: 水質分析實驗 二、學分數:3 (3/0) 三、先修科目:分析實驗 四、教學目標:
3正1. 採 用 Nhomakorabea 璃 纖 維
3
濾紙過濾法
1.酸鹼度對滴定
3 的影響
2.EDTA 的特性
1.藥品的配製
3 2.空白滴定
1.過濾操作 3
1.藥品的配製 6
1.找出磷的滯流 6 時間
1.藥品的配製 6 2.蒸餾出酚的裝
置
3
3
過濾裝置
六、教學要點: 有*號的內容可依教學狀況取捨。
1.教材編選 (1)教材之選擇應顧及社區與學生之需要並配合科技之發展,使課程內容儘 量與生活相結合,以引發學生興趣,增進學生之理解,使學生不但能應 用所學知能於實際生活中,且能洞察實際生活之各種問題,思謀解決之 道,以改進目前生活。 (2)教材之選擇應顧及學生之學習經驗並配合學生身心發展歷程,一方面基 於前一層級學校的學習經驗,一方面須考慮與下一層級學校的課程銜接。 (3)教材之選擇須注意「縱」的銜接,同一科目各單元間及相關科目彼此間 須加以適當的組織,使其內容與活動能由簡而繁,由易而難,由具體而 抽象,務使新的學習經驗均能建立於舊經驗之上,逐漸加廣加深,以減 少學習困擾,提高學習效率。 (4)教材之選擇須重視「橫」的聯繫,同科目各單元間及相關科目彼此間須 加以適當的組織,使其內容與活動能統合或聯貫,俾使學生能獲得統整 之知能,以聯合運用於實際工作中,並有利於將來之自我發展。 (5)教材之選擇須具啟發性與創造性,課程內容及活動須能提供學生觀察、 探索、討論與創作的學習機會,使學生具有創造思考、獨立判斷、適應 變遷及自我發展之能力。
