二氧化碳的性质(基础) 知识讲解
大自然中的二氧化碳知识梳理

第四节大自然中的二氧化碳一.二氧化碳对环境的影响1.大气中二氧化碳的来源和消耗:(1)二氧化碳的主要来源:煤、石油、天然气等化石燃料的燃烧;人、动植物的呼吸作用;动植物尸体腐烂。
(2)二氧化碳的消耗途径:植物的光合作用。
2.二氧化碳与温室效应(1)导致温室效应的气体主要是二氧化碳,其它还有甲烷等(2)温室效应的危害:导致全球气候变暖;极地等冰川融化,使海平面上升;土地沙漠化,农业减产等(3)如何防止温室效应:减少煤、石油、天然气等化石燃料的燃烧;更多使用太阳能、风能、地热能、氢能等清洁能源的使用;大量植树造林,严禁乱砍乱伐。
二.二氧化碳的制取1.药品:石灰石(或大理石)和稀盐酸(一般不用硫酸)2.原理:CaCO3+2HCl CaCl2+CO2↑+H2O3.实验装置:(1)发生装置:实验室用双氧水在二氧化锰催化作用下制取氧气的装置(固+液)(2)收集方法:因为CO2密度比空气大,所以可用向上排空气法收集。
又由于CO2溶于水,所以不能用排水法收集。
4.验满的方法:将燃着的木条靠近集气瓶口,如果木条的火焰熄灭,则证明已集满CO2。
5.检验的方法:将气体通入澄清石灰水,若石灰水变浑浊,则该气体是CO2。
6.制取二氧化碳的简易装置:7.有关药品选择(1)不用碳酸氢钠的原因是反应太快,不利于实验控制和气体收集;(2)不用稀硫酸与块状的大理石(或石灰石)反应原因是:反应生成的硫酸钙微溶于水,会形成沉淀,覆盖在大理石(或石灰石)表面,阻碍反应进一步进行。
但是,可以用稀硫酸与大理石(或石灰石)粉末反应来制取二氧化碳。
(3)不用浓盐酸与大理石(或石灰石)反应是因为浓盐酸易挥发,生成的二氧化碳气体中含有HCl气体而不纯。
三.二氧化碳的性质1.物理性质:通常状态下,二氧化碳无色无味的气体,密度比空气大,能溶于水,固体CO2俗称干冰。
干冰升华吸热,常用作人工降雨,制造舞台云雾效果,和用做制冷剂。
2.化学性质:(1)不能燃烧,也不支持燃烧,不能供给呼吸,无毒。
二氧化碳常考知识点归纳

二氧化碳常考知识点归纳一、二氧化碳的物理性质。
1. 颜色、气味、状态。
- 二氧化碳是一种无色、无味的气体。
2. 密度。
- 二氧化碳的密度比空气大。
可以通过倾倒二氧化碳熄灭蜡烛实验来证明,将二氧化碳气体慢慢倒入放有高低不同蜡烛的烧杯中,下层蜡烛先熄灭,上层蜡烛后熄灭,说明二氧化碳密度比空气大且不支持燃烧。
3. 溶解性。
- 二氧化碳能溶于水。
通常情况下,1体积水大约能溶解1体积二氧化碳。
可以通过汽水等碳酸饮料来理解,瓶内压强大,二氧化碳溶解得多,打开瓶盖后压强减小,二氧化碳逸出。
二、二氧化碳的化学性质。
1. 不燃烧也不支持燃烧。
- 如上述倾倒二氧化碳熄灭蜡烛实验,这一性质可用于灭火。
二氧化碳灭火器就是利用二氧化碳不燃烧也不支持燃烧且密度比空气大的性质来灭火的,它可以扑灭图书、档案、贵重设备、精密仪器等火灾。
2. 与水反应。
- 二氧化碳与水反应生成碳酸,化学方程式为CO_2 + H_2O=H_2CO_3。
碳酸能使紫色石蕊试液变红。
但碳酸不稳定,受热易分解,化学方程式为H_2CO_3 =H_2O+CO_2↑。
可以通过将二氧化碳通入紫色石蕊试液中,试液变红,然后加热变红的溶液,溶液又变回紫色来验证这两个反应。
3. 与碱反应。
- 与氢氧化钠反应:CO_2+2NaOH = Na_2CO_3 + H_2O。
如果二氧化碳过量,还会继续反应Na_2CO_3+CO_2 + H_2O=2NaHCO_3。
利用氢氧化钠溶液能吸收二氧化碳的性质,可以用氢氧化钠溶液来除去混合气体中的二氧化碳。
- 与氢氧化钙反应:CO_2 + Ca(OH)_2=CaCO_3↓+H_2O。
这个反应常用于检验二氧化碳,澄清石灰水变浑浊证明有二氧化碳存在。
如果继续通入二氧化碳,浑浊的石灰水又会变澄清,因为CaCO_3+CO_2 + H_2O = Ca(HCO_3)_2。
三、二氧化碳的制取。
1. 工业制取。
- 工业上制取二氧化碳的方法是高温煅烧石灰石,化学方程式为CaCO_3[]{高温}CaO + CO_2↑。
二氧化碳资料

知识整合:二氧化碳的性质、用途及制法1.二氧化碳的性质(1)物理性质:无色,无味的气体,密度比空气大,能溶于水,固态:白色,俗称“干冰”(2)化学性质①一般情况下不能燃烧,也不支持燃烧,不能供给呼吸②与水反应生成碳酸:CO2+H2O一→ H2CO3 生成的碳酸能使紫色的石蕊试液变红H2CO3一→ H2O+ CO2碳酸不稳定,易分解③能使澄清的石灰水变浑浊:CO2+Ca(OH)2一→CaCO3 +H2O 本反应用于检验二氧化碳。
2.二氧化碳的用途:①灭火(利用性质:二氧化碳密度大于空气,不可燃,不助燃)阶梯蜡烛实验现象:蜡烛自下而上依次熄灭。
②干冰用于人工降雨、制冷剂、舞台云雾效果③温室肥料④制碳酸饮料3.二氧化碳对环境的影响:过多排放加剧温室效应。
4.二氧化碳的制法(1)实验室制取气体的思路:(原理、装置、检验)(2)二氧化碳的实验室制法:①原理:石灰石(大理石)和稀盐酸反应:CaCO3+ HCl一→ CaCl2+ H2O+ CO2不用碳酸钙粉末的原因:反应速率过快,不易控制与收集气体不用稀硫酸:反应生成的微溶于水的硫酸钙覆盖在大理石表面,阻止反应的进一步发生不用浓盐酸:浓盐酸有强挥发性,使收集的二氧化碳中混有氯化氢气体而不纯②发生装置:固液不加热型③收集方法:向上排空气法④验满方法:将点燃的木条放在集气瓶口,木条熄灭。
证明已集满二氧化碳气体。
检验方法:将制得的气体通入澄清的石灰水,若变浑浊,则是二氧化碳。
5.气体制取装置优缺点利用分液漏斗:可以控制反应速率。
长颈漏斗加止水夹:控制反应的发生和停止多功能瓶:(排空气法)密度大的长导管进气,密度小的短导管进气。
(排水法)短导管进气。
二氧化碳的物理性质(共7张PPT)

的碳,通过微生物的分解作用也成为二氧化碳而 一、研究制取气体的原料、原理
1、原料:大理石或石灰石(主要成分是CaCO3)和稀盐酸(主要成分是HCl) 2、根据该气体的密度和溶解性确定收集装置。
最终排入大气。大气中的二氧化碳这样循环一次 植物和动物的呼吸作用把摄入体内的一部分碳转化为二氧化碳释放入大气,另一部分则构成生物的机体或在机体内贮存。
二氧化碳的物理性质
二氧化碳是无色、无味的 气体,密度比空气大(可以从 一个容器倒入另一个容器), 可溶于水,固态二氧化碳叫做 “干冰”,易升华.
二氧化碳的化学性质
1、二氧化碳不能燃烧,也不能支持燃烧。 2、二氧化碳可与水反应
CO2+H2O=H2CO3 (碳酸,碳酸具有酸性,能使紫色
石蕊溶液变红)
3、二氧化碳可与氢氧化钙反应(石灰水的主要成分是 氢氧化钙)
二、制二氧化碳的装置
1、发生装置:固-液不加热型装置
注意: ⑴ 导管刚过橡胶塞为宜。 ⑵长
颈漏斗的末端必须伸到液面以下(防止气体从长
颈漏斗排出) 2、收集装置:只能用向上排空气法收集。(因 CO2+Ca(OH)2=CaCO3 +H2O
1、原料:大理石或石灰石(主要成分是CaCO3)和稀盐酸(主要成分是HCl) 2、检验二氧化碳是否收集满:将燃烧的木条放在瓶口,木条熄灭,说明二氧化碳已收集满。
一、研究制取气体的原料、原理
1、检验是否为二氧化碳气体:用澄清石灰 1、根据反应物的状态和反应条件确定发生装置。
1、二氧化碳不能燃烧,也不能支持燃烧。 2、检验二氧化碳是否收集满:将燃烧的木条放在瓶口,木条熄灭,说明二氧化碳已收集满。
水,看是否变浑浊。 1、根据反应物的状态和反应条件确定发生装置。
沪教版九年级化学 5.1 二氧化碳的性质与用途(学习、上课课件)

知2-讲
1. 将汽水中的二氧化碳气体导出通入滴有紫色石蕊溶液的
水中。
(1)实验现象为石蕊溶液由紫色变成红色。
(2)产生此现象的原因为二氧化碳与水反应,生成能使紫
色石蕊溶液变红色的酸性物质碳酸。
(3)该反应为:CO2+H2O
H2CO3。
感悟新知
知2-讲
2. 把二氧化碳慢慢倒入放有两支高度不同的燃着的蜡 烛的烧杯中。
感悟新知
知2-练
误区警示: 检验二氧化碳只能用澄清石灰水,不能用紫色石蕊
溶液或燃着的木条,因为其他气体也能使紫色石蕊溶液 变红(如HCl),能使燃着的木条熄灭( 如N2)。
感悟新知
知识点 3 二氧化碳的用途
知3-讲
用途 生产汽水等碳酸饮料
灭火
性质 能溶于水
不支持燃烧,不能燃烧, 密度比空气大
气态肥料
CaCO3 ↓ +H2O。
感悟新知
知2-讲
5. 煅烧石灰石可以得到生石灰,生石灰与水反应可以
转化为熟石灰 [主要成分是氢氧化钙Ca(OH)2],氢氧 化钙又可以吸收二氧化碳最终转化为碳酸钙。相关的
化学方程式如下:
CaCO3 高温 CaO+CO2 ↑
CaO+H2O
Ca(OH)2
CO2+Ca(OH)2
水和二氧化碳(常温下也能分解,反应速率慢一些)。 (3)该反应为:H2CO3 △ H2O+CO2 ↑。
感悟新知
知2-讲
4. 将二氧化碳气体通入足量的澄清石灰水中:
(1)实验现象为:澄清石灰水变浑浊。
(2)产生此现象的原因为:澄清石灰水中的氢氧化钙与二
氧化碳反应,生成不溶于水的白色固体碳酸钙。
二氧化碳的性质与用途(共19张PPT)
二、CO2的化学性质
1、一般情况下,CO2不能燃烧,不能支持燃烧。
2、CO2不能供呼吸。
3、CO2跟水反应。
CO2
CO2
CO2+H2O = H2CO3
醋酸
石蕊固体
石蕊溶液
一、CO2的物理性质
1、通常情况下是无色、无气味的气体。
2、能溶于水(1:1)
3、标态下, CO2=1.977 克 /升, 比空气的密度大。
H2CO3 = CO2↑ +H2O
4、CO2与石灰水[Ca(OH)2]反应。
CO2+ Ca(OH)2 = H2O +CaCO3 ↓
一、CO2的物理性质
1、通常情况下是无色、无气味的气体。
2、能溶于水(1:1)
3、标态下, CO2=1.977 克 /升, 比空气的密度大。
二、CO2的化学性质
1、一般情况下,CO2不能燃烧,不能支持燃烧。 2、CO2不能供呼吸。
1、通常情况下是无色、无气味的气体。
2、能溶于水(1:1)
3、标态下, CO2=1.977 克 /升, 比空气的密度大。
二、CO2的化学性质
1、一般情况下,CO2不能燃烧,不能支持燃烧。
2、CO2不能供呼吸。
一、CO2的物理性质
1、通常情况下是无色、无气味的气体。
2、能溶于水(1:1)
3、标态下, CO2=1.977 克 /升, 比空气的密度大。
最简便且可行的方法是
A、用燃着的木条分别伸入集气瓶中
B、分别加入石灰水并振荡 C、分别滴入紫色石蕊试液
D、分别加入水并振荡
A
B
C
D
结束
2、CO2能使紫色石蕊试液变红是因为 A、密度比空气大
二氧化碳的性质和用途(上课用)

• 英国科学家普利斯特曾做过一个实验:如右图所 示在甲和乙两个密封玻璃容器内,甲中放一只小 白鼠,乙内放一只小白鼠和一盆绿色植物,放于 向阳处,发现小白鼠在乙中的存活时间比甲长了 许多。 • (1)此实验说明了 _____________________________________ • (2)如果用黑布将乙容器完全罩住,则乙内小白 鼠存活时间比没罩时短,这是因为: • _____________________________________
7、下列关于二氧化碳的说中,正确的是( D) A、二氧化碳由一个碳原子和两个氧原子构成 B、二氧化碳和水混合是一个物理变化 C、二氧化碳可以使紫色石蕊试液变无色 D、二氧化碳是由碳元素和氧元素组成的 8、下列说法中,正确的是( A ) A、 CO2能溶于水,可用于制汽水 B、能使燃着的木条熄灭的气体一定是CO2 C、因为CO2可与水反应生成H2CO3,所以 H2CO3很稳定,不易分解。 D、干冰用于人工降雨和致冷剂,是利用了它 的化学性质
二氧化碳的性质和 用途总结
书写下列化学方程式
1、实验室制取二氧化碳的原理 2、二氧化碳使澄清石灰水变浑浊 3、二氧化碳和水生成碳酸
小组归纳
1、CO2的物理性质
(1)通常状况下是无色、无 气味的气体 大 (2)密度比空气的密度
(3)能溶于水(1:1)
二 氧 化 碳 的 化 学 性 质
1、 二氧化碳不能燃烧也不支持燃烧。 2、与水的反应。 CO2 + H2O = H2CO3 (碳酸不稳定易分解) H2CO3 = H2O + CO2↑ 3、与石灰水反应生成白色沉淀CaCO3。 CO2 + Ca(OH)2 = CaCO3 ↓+ H2O 白色沉淀
二氧化碳的性质

二氧化碳的性质二氧化碳在常温常压下为无色无味气体,溶于水和烃类等多数有机溶剂。
二氧化碳一般可由高温煅烧石灰石或由石灰石和稀盐酸反应制得,主要应用于冷藏易腐败的食品(固态)、作致冷剂(液态)、制造碳化软饮料(气态)和作均相反应的溶剂(超临界状态)等。
关于其毒性,研究表明:低浓度的二氧化碳没有毒性,高浓度的二氧化碳则会使动物中毒。
二氧化碳就是碳氧化合物之一,就是一种无机物,不易燃,通常不积极支持冷却,低浓度时无毒性。
它也就是碳酸的酸酐,属酸性氧化物,具备酸性氧化物的通性,其中碳元素的化合价为+4价,处在碳元素的最高价态,故二氧化碳具备水解性而并无还原性,但水解性不弱。
3二氧化碳产生途径二氧化碳气体就是大气共同组成的一部分(占到大气总体积的0.03%-0.04%),在自然界中含量多样,其产生途径主要存有以下几种:①有机物(包括动植物)在分解、发酵、腐烂、变质的过程中都可释放出二氧化碳。
②石油、石腊、煤炭、天然气冷却过程中,也必须放出二氧化碳。
③石油、煤炭在生产化工产品过程中,也会释放出二氧化碳。
④所有粪便、腐植酸在蒸煮,内膛的过程中也能够放出二氧化碳。
⑤所有动物在呼吸过程中,都要吸氧气吐出二氧化碳可以中毒吗吸入浓度过高的二氧化碳会中毒,主要是指长期处在低氧和高二氧化碳的环境中,或者突然进入高浓度的二氧化碳环境中,都会引起中毒,一般会引起恶心、呕吐、头晕、头痛,会出现注意力不集中,引起记忆力减退。
比较严重的情况下还会引起昏迷,出现呼吸中枢的麻痹,而影响患者的生命。
如果怀疑二氧化碳中毒,需要立刻离开这种环境,需要及时吸氧或者吸新鲜的空气,症状比较严重的需要把患者及时送去医院,接受检查和救治。
一般需要抽血化验做血气分析,还需要做x线检查,症状比较严重的需要用高压氧舱治疗。
人二氧化碳的中毒怎么办?1、一氧化碳中毒人一氧化碳中毒时会最初感觉为头痛、头昏、恶心、咳嗽、软弱无力,当他意识到中毒时,常绝望下床进门、开窗,但通常仅有少数人能打开门,大部分病人快速出现扣痉、昏迷不醒,两颊、前胸皮肤及口唇呈圆形樱桃红色,例如抢救不及时,可以很快体温遏制而丧生。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二氧化碳的性质(基础)
责编:熊亚军
【学习目标】
1.掌握二氧化碳的性质,了解二氧化碳的用途。
2.了解化合反应和分解反应,能区别化合反应和分解反应。
3.了解并关注温室效应。
【要点梳理】
要点一、二氧化碳的性质和用途
1.二氧化碳的物理性质:
(1)通常状况下,二氧化碳是一种无色无味的气体。
(2)标准状况下,二氧化碳的密度为1.977g/L,比空气大。
(3)二氧化碳能溶于水,1体积水中能溶解1体积的二氧化碳气体。
(4)固态CO2又叫干冰。
二氧化碳的三态变化:
2.二氧化碳的化学性质:(高清课堂《二氧化碳和一氧化碳》)
(1)二氧化碳既不能燃烧,也不支持燃烧。
如图所示实验中:下层的蜡烛先熄灭,上层的蜡烛后熄灭。
通过分析该实验的现象,可以说明二氧化碳两点性质:①二氧化碳不燃烧,也不支持燃烧;②二氧化碳的密度比空气大。
(2)CO2与水反应生成碳酸。
碳酸能使紫色石蕊试液变成红色。
CO2+H2O=H2CO3
碳酸很不稳定,容易分解生成二氧化碳和水。
H2CO3=H2O+CO2↑
讨论:观察课本实验6-6(如下图所示)并分析。
现象与分析:A纸花变红说明酸能使紫色石蕊变红;B、C纸花不变色,说明水和二氧化碳都不能使紫色石蕊变色D纸花变红说明二氧化碳和水反应生成碳酸,碳酸具有酸性。
四组实验的对比说明了水和二氧化碳不使紫色石蕊变色,水和二氧化碳反应生成的酸使紫色石蕊变红,酸能使紫色石蕊变红。
D纸花变红后加热,又变成了原来的紫色,说明碳酸不稳定,又分解了。
(3)CO2与石灰水反应生成白色的碳酸钙沉淀。
常利用此性质,来检验二氧化碳气体。
Ca(OH)2+CO2=CaCO3↓+H2O(清变浊)
3.二氧化碳的用途:
(1)气体二氧化碳可用于灭火、制汽水、作气体肥料、化工产品的原料等。
(2)固态二氧化碳又叫干冰,可用作①制冷剂,②形成人工云雾(舞台上),③人工降雨。
【要点诠释】
1.二氧化碳不能支持一般可燃物的燃烧,但不是所有物质,有些物质如金属镁能在二氧化碳中燃烧。
2.把CO2通入紫色石蕊试液时,会观察到紫色石蕊试液变成红色。
使紫色石蕊试液变红的不是二氧化碳,而是二氧化碳与水反应后生成的碳酸。
盐酸、稀硫酸等也能使紫色石蕊试液变红。
3.二氧化碳能溶于水和与水发生化学反应两者在本质上是不同的,前者是二氧化碳的物理性质,后者是二氧化碳的化学性质。
4.实验室久置的石灰水瓶内壁,会有一层白色物质,白色物质是CaCO3(石灰水吸收空气中的CO2,发生如下反应:Ca(OH)2+CO2=CaCO3↓+H2O)。
要点二、二氧化碳对生活和环境的影响
1.二氧化碳无毒,但在二氧化碳过多的地方,人们会感到窒息。
通常空气里含0.03%体积的二氧化碳,当含量达到1%的时候,对人体就有害处;达到4%~5%的时候,会使人感到气喘、头痛、眩晕;达到10%的时候,能使人不省人事,呼吸逐渐停止,以致死亡。
2.温室效应的形成、危害及对策:
(1)温室效应形成的主要原因:随着工农业生产的发展和人类生活水平的提高,煤、石油、天然气等化石燃料的需求不断增大,它们燃烧后放出大量的二氧化碳等温室气体;而由于一些天灾和乱砍滥伐,能吸收二氧化碳的大片森林和草原绿地却在不断消失,从而导致碳氧循环不平衡,致使大气中二氧化碳等温室气体增多,地球表面温度上升。
(2)温室效应的危害:①气温上升,导致冰川融化,海平面上升,沿海城市会被淹没;②地球表面的水分蒸发,使土地沙漠化,农业减产等。
(3)防治措施:①减少煤、石油等含碳矿物燃料的使用,更多利用清洁能源如太阳能、风能、水能、地热能、潮汐能等。
②大力植树造林,禁止乱砍滥伐,提倡种草种花增加绿化面积等。
【要点诠释】
1.空气中CO2含量过高会引起“温室效应”,但不能说CO2是空气污染物,一般空气中CO2的体积分数大约在0.03%左右。
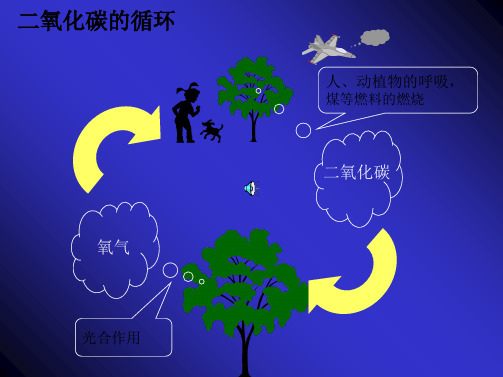
2.植物的光合作用在大气循环中起着重要作用,它是消耗二氧化碳的主要途径,对大气中氧气和二氧化碳含量保持不变及人类的生存、生活有着重大的影响。
3.大气中二氧化碳的产生途径有:人和动植物的呼吸、矿物燃料的燃烧、动植物体腐烂等。
大气中二氧化碳的消耗途径有:植物的光合作用等。
4.二氧化碳不能供给呼吸,并不是说二氧化碳有毒。
当空气中的二氧化碳超过正常含量时,对人体会产生有害影响。
要点三、化合反应和分解反应
特点多变一一变多
举例
磷﹢氧气五氧化二磷过氧化氢水+氧气
【典型例题】
类型一、考查二氧化碳的性质
1.(2015•山东中考)通过实验探究可获得较多的化学知识,对如图所示的实验分析错误的是()
A.两支蜡烛自下而上依次熄灭
B.二氧化碳不能燃烧
C.二氧化碳的密度比空气大
D.二氧化碳支持燃烧
【思路点拨】根据实验现象,下层的蜡烛先熄灭,上层的蜡烛后熄灭,结合二氧化碳的物理性质与化学性质,进行分析判断。
【答案】D
【解析】如图所示的实验,可观察到两支蜡烛自下而上依次熄灭,故A选项说法正确;蜡烛熄灭,说明了二氧化碳不能燃烧,故B选项说法正确;两支蜡烛自下而上依次熄灭,说明二氧化碳的密度比空气大,故C 选项说法正确;蜡烛熄灭,说明了二氧化碳不能支持燃烧,故D选项说法错误。
【总结升华】本题难度不大,掌握二氧化碳的化学性质、物理性质是正确解答本题的关键。
2.干冰是固态的,在常温下易升华。
干冰升华时_________(填“吸收”或“放出”)大量热,因此可作致冷剂或用于人工降雨。
【思路点拨】固体CO2叫做“干冰”,其升华时会吸收大量的热,因而具有很多重要的用途;而“冰”是水的固体,二者要注意区分。
【答案】二氧化碳吸收
【解析】干冰升华是由固体直接变成气体,需要吸收热量。
【总结升华】本题考查了CO2的用途及相关性质的掌握情况。
建议大家按“性质决定用途,用途反映性质”的规律梳理并识记CO2的用途。
3.下列有关鉴别二氧化碳、氧气的方法错误的是()
A.观察气体颜色
B.用澄清石灰水
C.用带火星的木条
D.用紫色石蕊试液
【思路点拨】物质的鉴别要选择两种物质的典型性质的差异来进行。
CO2和O2都是无色无味的气体,通过观察颜色不能将两者区别开来。
【答案】A
【解析】二氧化碳能使澄清的石灰水变浑浊,氧气不能使澄清的石灰水变浑浊;氧气能使带火星的小木条复燃,二氧化碳不能使带火星的小木条复燃;二氧化碳能使紫色石蕊试液变红,氧气不能使紫色石蕊试液变红。
故BCD都是正确的。
【总结升华】二氧化碳、氧气的性质、用途和制法是中考的重要考点,可采用对比的方法理解和记忆。
举一反三:
【变式1】2009年12月在哥本哈根召开了世界气候大会,各国共同协商对策,以减少温室气体排放量。
下列气体中大家关注的温室气体是()
A.氮气
B.氧气
C.氢气
D.二氧化碳
【答案】D
【变式2】(2014·山东中考)氧循环和碳循环密不可分。
其中属于二氧化碳转化为氧气的变化是()A.海水吸收二氧化碳B.动植物的呼吸作用
C.绿色植物的光合作用D.化石燃料的燃烧
【答案】C
【解析】绿色植物在光照和叶绿素的作用下可将二氧化碳和水转化成有机物,并释放出氧气。
类型二、考查分解反应和化合反应
4.下列化学变化中,属于化合反应的是________。
A.硫+氧气二氧化硫
B.铁+氧气四氧化三铁
C.酒精+氧气二氧化碳+水
D.氢气+氧气水
【思路点拨】深刻理解化合反应、分解反应的概念,抓住其特点,即可解决问题。
【答案】A、B、D
【解析】由两种或两种以上物质生成另一种物质的反应叫化合反应。
【总结升华】化合反应的特点是“多变一”。
举一反三:
【变式】下列反应中,属于化合反应的是。
①高锰酸钾锰酸钾+二氧化锰+氧气
②铁+氧气四氧化三铁
③碳+氧气二氧化碳
④过氧化氢水+氧气
【答案】②③。
