铝和铝的氧化物
铝和铝的化合物
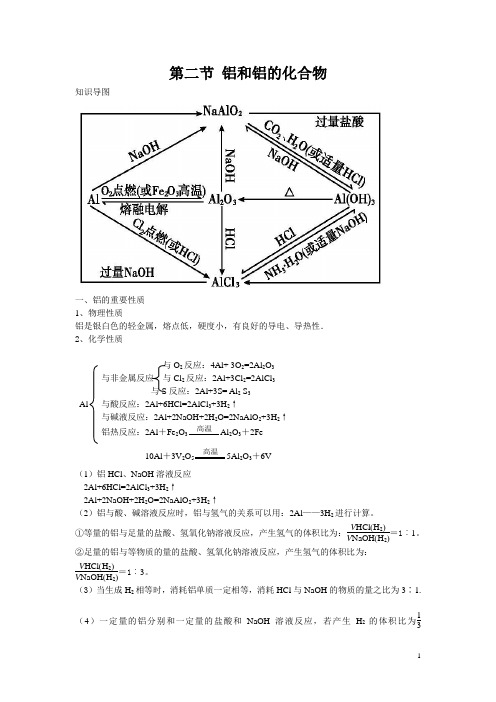
第二节 铝和铝的化合物知识导图一、铝的重要性质1、物理性质铝是银白色的轻金属,熔点低,硬度小,有良好的导电、导热性.2、化学性质与O 2反应:4Al+ 3O 2=2Al 2O 3与非金属反应 与Cl 2反应:2Al+3Cl 2=2AlCl 3与S 反应:2Al+3S= Al 2 S 3Al 与酸反应:2Al+6HCl=2AlCl 3+3H 2↑与碱液反应:2Al+2NaOH+2H 2O=2NaAlO 2+3H 2↑铝热反应:2Al +Fe 2O 3 高温 Al 2O 3+2Fe10Al +3V 2O 5 高温 5Al 2O 3+6V (1)铝HCl 、NaOH 溶液反应2Al+6HCl=2AlCl 3+3H 2↑2Al+2NaOH+2H 2O=2NaAlO 2+3H 2↑(2)铝与酸、碱溶液反应时,铝与氢气的关系可以用:2Al ——3H 2进行计算。
①等量的铝与足量的盐酸、氢氧化钠溶液反应,产生氢气的体积比为:V HCl (H 2)V NaOH (H 2)=1︰1。
②足量的铝与等物质的量的盐酸、氢氧化钠溶液反应,产生氢气的体积比为:V HCl (H 2)V NaOH (H 2)=1︰3。
(3)当生成H 2相等时,消耗铝单质一定相等,消耗HCl 与NaOH 的物质的量之比为3∶1.(4)一定量的铝分别和一定量的盐酸和NaOH 溶液反应,若产生H 2的体积比为13<V HCl (H 2)V NaOH (H 2)<11,则必定是:Al 与HCl 反应时,Al 过量而HCl 不足;Al 与NaOH 溶液反应时,Al 不足而NaOH 溶液过量.二、铝的氧化物(Al 2O 3)1、化学性质与酸反应:Al 2O 3+6HCl=2AlCl 3+3H 2O与碱反应:Al 2O 3+2NaOH=2NaAlO 2+H 2O2、用途:熔点很高,是一种很好的耐火材料(Al 2O 3,MgO ),红宝石,蓝宝石的主要成分是氧化铝。
铝及铝的化合物知识点总结

铝及铝的化合物知识点总结1。
铝的氧化物中,最稳定的是Al2O3,最活泼的是Al3O4。
铝能与热浓HCl反应生成氢气和氯化铝;也能与过量的NaOH反应,生成偏铝酸钠。
2。
一水合铝离子是最常见的无机离子。
3。
一水合铝离子与水反应时,没有明显的催化剂作用,它是在水溶液中反应的。
当加热至高温时,会发生分解,产生偏铝酸和氢气。
4。
在常温下,硫酸铝是一种无色、透明的晶体;但当温度升高到约327 ℃时,它变为淡黄色,在热的浓硫酸中则为黄绿色。
在干燥空气中风化。
3。
铝是轻金属之一,在自然界中不存在游离态的铝单质,铝的重要化合物有氧化铝、氯化铝等,如高温下煅烧氧化铝生成偏铝酸钠,熔融时生成氧化铝等,可用来制备铝盐,也可作干燥剂等。
4。
铝的化学性质很活泼,极易与其他元素化合,形成多种合金。
如铝镁合金、铝铜合金等。
铝镁合金是以镁为主要合金元素,铝为强化元素的轻金属合金。
这类合金的共同特点是:密度小、比强度和比刚度高,但耐蚀性较差,铸造性能好。
如飞机结构件、铆钉、锻件、粉末冶金制品、铝基复合材料等。
5。
铝是银白色轻金属,密度较小,具有延展性。
它能和水发生反应,放出氢气,在加热或加压下能和大部分非金属元素反应,生成多种化合物,如氢氧化铝、碱式碳酸铝、偏铝酸钠、三氯化铝等。
此外,铝还能与酸反应,在干燥空气中能风化。
6。
铝有两种同素异构体: a)顺式异构体,与水作用,放出氢气; b)反式异构体,与水作用,吸收氢气。
7。
氢氧化铝与氢氧化钠、硫酸铝溶液混合,受热会产生胶状沉淀。
8。
三氧化二铝易溶于水,通过加热分解而得到一水合氧化铝,可用于净水,也可用做食品添加剂。
9。
铝的熔点为660 ℃,沸点为861 ℃,凝固点为660 ℃。
10。
铝粉的表面覆盖着氧化膜,并形成一层致密的氧化铝薄膜,使铝表面对红外线、紫外线及电离辐射的反射率达80%,故铝是优良的光反射材料。
11。
铝片在空气中加热至660 ℃,开始氧化,生成四氧化三铁。
铝及其氧化物的化学与物理性质

铝及其氧化物的化学与物理性质铝是一种重要的金属元素,具有许多独特的化学和物理性质。
铝的
氧化物也具有独特的性质,本文将探讨铝及其氧化物的化学与物理性质。
1. 铝的化学性质
铝是一种化学性质活泼的金属,具有很强的还原性。
它可以和很多
元素发生反应,例如氧、硅、氮等。
铝和氧的反应是最为常见的,当
铝暴露在空气中时会生成一层氧化铝的保护膜。
这层氧化铝薄而致密,能够有效防止铝继续氧化,保护了铝的表面。
2. 铝的物理性质
铝是一种轻便、坚固的金属,密度较小,但具有较高的强度。
这使
得铝成为制造飞机、汽车等产品的理想材料。
铝具有良好的导电性和
导热性,因此也被广泛用于制造电线、散热器等产品。
3. 氧化铝的化学性质
氧化铝是一种无机化合物,化学性质稳定。
它可以与酸、碱发生反应,但通常是惰性的,不容易与其他物质发生化学变化。
氧化铝的晶
体结构稳定,硬度较高,对外部环境有很好的耐腐蚀性。
4. 氧化铝的物理性质
氧化铝是一种白色、无定形的粉末状固体。
它有很好的隔热性和绝缘性能,常用于制造耐火材料、陶瓷等产品。
氧化铝的熔点较高,能够在高温环境下保持稳定性。
总结
铝及其氧化物具有独特的化学和物理性质,广泛应用于工业生产和科学研究中。
了解铝和氧化铝的性质,有助于我们更好地利用这些材料,推动科技进步和社会发展。
希望本文对读者有所启发,增进对铝及其氧化物性质的了解。
三氧化二铝 矿石品位

三氧化二铝矿石品位三氧化二铝是一种重要的矿石,也被称为氧化铝或铝石。
它的化学式为Al2O3,是铝的氧化物。
三氧化二铝具有广泛的应用领域,包括冶金、陶瓷、化工、电子等多个行业。
本文将从矿石品位的角度来介绍三氧化二铝。
矿石品位是指矿石中所含有的有用成分的质量百分比。
对于三氧化二铝矿石而言,其品位主要指的是铝的含量。
一般来说,三氧化二铝矿石中铝的含量越高,品位就越高,其价值也就越大。
三氧化二铝矿石的品位与其产地、矿石类型、矿石成分等因素密切相关。
在不同的产地和矿石类型中,三氧化二铝矿石的品位会有所差异。
常见的三氧化二铝矿石有赤铁矿、莫来石、矾土等。
这些矿石中的铝含量不同,因此其品位也各不相同。
矿石品位的高低直接影响到三氧化二铝的提取效率和成本。
当矿石品位较高时,提取过程中的损耗较小,提取效率较高,生产成本相对较低。
相反,当矿石品位较低时,提取过程中的损耗较大,提取效率较低,生产成本相对较高。
为了提高三氧化二铝矿石的品位,人们采取了一系列的选矿技术和处理方法。
选矿技术是通过对矿石进行物理或化学处理,去除其中的杂质,提高铝的含量。
常用的选矿方法包括重选、浮选、磁选、化学浸出等。
通过这些方法,可以有效地提高三氧化二铝矿石的品位。
除了选矿技术,还有其他一些方法可以提高三氧化二铝矿石的品位。
例如,改变矿石的破碎、磨矿和烧结工艺,优化工艺参数,提高提取效率。
此外,还可以通过添加助剂、改变反应条件等方式来提高提取过程中的效果。
三氧化二铝矿石的品位不仅影响到其提取效率和成本,也影响到其市场价值。
高品位的三氧化二铝矿石在市场上供不应求,价格较高。
而低品位的三氧化二铝矿石则需经过更多的处理和提取过程,成本较高。
因此,矿石品位的高低对于生产厂家和购买方来说都具有重要意义。
三氧化二铝矿石的品位是指其中铝的含量。
矿石品位的高低直接影响到三氧化二铝的提取效率、生产成本和市场价值。
为了提高矿石品位,人们采取了一系列的选矿技术和处理方法。
为什么铝不容易生锈

为什么铝不容易生锈铝是一种常见而且重要的金属,它是地球上第三个最常见的元素,仅次于氧和硅。
作为一个轻质、导电、导热性能优良的金属,铝在许多重要的工业和制造领域都有广泛的应用。
然而,这种金属的优良性能可能因为其对氧气和水的反应而受到损害。
那么,为什么铝不容易生锈呢?下面将从原理、化学反应、表面保护以及应用等方面来解释这个问题。
一、铝的氧化物保护膜铝在空气中容易形成铝氧化物(Al2O3),这种氧化物可以形成一层保护膜,这种膜是一种致密的、茶色的、不透明的,可以有效防止后续氧气和水的侵蚀,从而保护铝的本体性能不受损害。
二、铝的特殊化学反应铝的氧化物保护膜存在的情况下,铝在大多数常见的环境条件下都不会产生大量的化学反应。
例如,铝和水并不容易产生明显的气体反应,并且当氧化剂(例如金属氧化物)与铝反应时,氧化剂一般会优先与氧化物保护膜发生反应,而不是与铝本身发生反应。
三、表面保护尽管铝的氧化物保护膜能够很好地保护铝的本体性能,但有时仍需要采取一些特殊措施来防止铝的损伤和腐蚀。
对于大部分应用来说,常见的表面保护方法包括表面涂层(例如油漆、粉末涂层和阳极氧化)和金属合金化。
四、应用铝的易于加工性和稳定性使它可以用于广泛的应用领域。
例如,建筑和工业用途中常用的铝合金材料可以制作航空器、汽车、城市道路标志和照明设施等产品。
铝制电线和杆塔用于输电和电网装备。
在生物医疗和食品加工领域,铝的材料性质和表面质量要求极高,可以制成高品质的食品罐、饮料包装和药品包装等。
总之,铝不容易生锈的主要原因是由于铝的氧化物保护膜的存在以及特殊的化学反应。
为了进一步保护铝的表面和性能,采取一些特殊的表面保护方法可以提高铝的性能和寿命。
虽然铝有时会受到腐蚀和损伤,但在许多应用中,它仍然是一种可靠和优秀的材料。
五、铝与氧化与水反应铝是一种活泼的金属,它能够与氧气、水和酸等反应,但由于铝在空气中能够产生一层致密的氧化物层,铝具备了一定的抗腐蚀能力。
铝热反应的应用

铝热反应的应用
铝热反应(也称为铝与氧化物之间的燃烧反应)是指铝粉与氧化物反应生成金属铝和相应的金属氧化物的化学反应。
铝热反应具有以下一些应用:
1. 焊接:铝热反应可以用于金属的焊接,尤其是对于铝和铝合金的焊接。
通过在焊接接头处引入铝粉,可以产生高温和熔融的金属铝,以将焊接材料连接在一起。
2. 燃料:铝热反应可以用作高能燃料。
铝热反应释放的高温和燃烧产物(氧化铝)具有高能量密度,可用作推动剂、火箭燃料和导弹发动机。
3. 防火材料:铝热反应可以用于制备防火材料。
由于铝粉燃烧时生成的氧化铝具有良好的隔热性能和抗火性能,可以用于制备耐火砖、隔热材料和耐火涂料等防火材料。
4. 热源:铝热反应可以作为热源用于加热或熔炼其他物质。
通过控制铝与氧化物的反应条件,可以产生高温和高热量的燃烧产物,用于工业加热、金属熔炼和高温实验等领域。
总之,铝热反应由于其高温、高能量和防火特性,在焊接、燃料、防火材料和热源等方面有着广泛的应用。
高中化学,铝及铝的氧化物

一、铝在自然界中的存在铝元素在地壳中含量丰富,仅次于氧和硅。
自然界中的铝全部以化合态存在;铝土矿的主要成分是氧化铝。
二、铝单质(一)物理性质银白色有金属光泽的固体,有良好的导电性、导热性和延展性,是质地较软的轻金属。
(二)化学性质1、与非金属单质反应(1)与O2反应:常温下,铝表面可形成致密的氧化膜保护层,故金属铝有一定的抗腐蚀性。
点燃或加热时与O2反应的化学方程式为:4Al+3O2 2Al2O3。
(2)在点燃或加热的条件下与Cl2、S反应,化学反应方程式分别为:2Al+3Cl2 2AlCl3,2Al+3S Al2S3。
2、与酸反应(1)常温下铝遇浓HNO3、浓H2SO4能够发生钝化。
(2)与盐酸反应的化学方程式为:2Al+6HCl=2AlCl3+3H2↑。
3、与强碱(如NaOH)溶液反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
4、与某些盐(如CuCl2)溶液反应的化学方程式为:2Al+3CuCl2=2AlCl3+3Cu。
5、与金属氧化物(如Fe2O3)反应(铝热反应)的化学方程式为:2Al+Fe2O3 Al2O3+2Fe。
三、从铝土矿中提铝(一)工艺流程铝土矿(主要成分Al2O3) NaAlO2溶液Al(OH)3沉淀Al2O3 Al。
(二)各步反应的化学方程式:①2NaOH+Al2O3=2NaAlO2+H2O;②NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓;③2Al(OH)3 Al2O3+3H2O;④2Al2O3 4Al+3O2↑。
【思考感悟】仍以铝土矿为原料,设计另一套可行的提取铝的方案。
可按以下流程提取铝:铝土矿AlCl3溶液Al(OH)3 Al2O3 Al。
【基础训练】1、铝在一种重要的金属。
(1)铝在元素周期表中的位置是第3周期,ⅢA族。
(2)生产中曾用铝热反应焊接钢轨,铝与氧化铁发生反应的化学方程式为2Al+Fe2O3 Al2O3+2Fe。
工业冶炼铝的原理

工业冶炼铝的原理铝是一种轻质、耐腐蚀、导电、导热性能良好的金属,广泛应用于航空、汽车、建筑等领域。
工业冶炼铝是通过将铝的氧化物还原为金属铝的过程。
本文将详细介绍工业冶炼铝的基本原理。
1. 铝的氧化物铝主要存在于自然界中的氧化物形式,最常见的是氧化铝(Al2O3),也被称为赤铁矾。
氧化铝是一种白色固体,具有较高的熔点和硬度。
2. 工业冶炼铝的过程工业冶炼铝的过程主要包括以下几个步骤:制取氧化铝、制取金属铝、电解精炼。
2.1 制取氧化铝制取氧化铝的方法有多种,其中最常用的是巴氏法和贝耳法。
2.1.1 巴氏法巴氏法是通过将氧化铝矿石与氢氟酸反应制取氟铝酸盐,再将氟铝酸盐加热分解得到氧化铝。
具体步骤如下:1.破碎矿石:将氧化铝矿石经过破碎、磨粉等工艺处理,使其达到一定颗粒度要求。
2.酸浸:将破碎后的矿石与稀盐酸反应,使氧化铝与盐酸生成氯铝酸盐溶液。
3.沉淀:在氯铝酸盐溶液中加入氟化氢,生成氟铝酸盐沉淀。
4.分解:将氟铝酸盐沉淀加热分解,得到氧化铝。
2.1.2 贝耳法贝耳法是通过将氧化铝矿石与碳素反应制取金属铝和一氧化碳。
具体步骤如下:1.破碎矿石:将氧化铝矿石经过破碎、磨粉等工艺处理,使其达到一定颗粒度要求。
2.还原:将破碎后的矿石与焦炭(含有高纯度的碳素)一起放入电炉中进行高温还原反应,生成金属铝和一氧化碳。
3.分离:通过物理方法,将金属铝和一氧化碳分离。
2.2 制取金属铝制取金属铝的方法有多种,其中最常用的是电解法。
2.2.1 电解法电解法是通过在电解槽中加入氧化铝溶液,通过电解反应将氧化铝还原为金属铝。
具体步骤如下:1.准备电解槽:将电解槽分为阳极和阴极两个区域,阳极由碳素材料制成,阴极由金属铝制成。
2.加入电解质:在电解槽中加入氟化铝等电解质,以提高电解液的导电性。
3.加热电解液:将电解槽中的电解液加热至高温,以提高电解反应的速率。
4.通电:将电解槽连接到直流电源,使阳极和阴极之间形成电流。
通过电解反应,氧化铝被还原为金属铝,在阴极上沉积。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 氧化铝:
– 与酸:Al2O3 + 6HCl = 2AlCl3 + 3H2O – 与碱:Al2O3 + 2NaOH = 2NaAlO2+H2O
AL
AL
O
O
O
整理ppt
13
氧化铝和酸、碱反应
• 氧化铝属于两性氧化物,既能与酸反应,也能与强碱反应: • 和酸反应: • Al₂O₃ + 6HCl = 2AlCl₃ + 3H₂O • Al₂O₃ + 6H+ = 2Al3+ + 3H₂O • 和熔融的碱反应: • Al₂O₃ + 2NaOH(熔融) = 2NaAlO₂+ H₂O • 和碱溶液反应: • Al₂O₃ + 2NaOH +3H₂O = 2NaAl(OH)4(四羟基合铝酸钠) • Al2O3+2OH- = 2AlO2-+H2O
铝粉的反应。
整理ppt
铝和水反应
• 与水反应 • 2Al+6H2O=2Al(OH)3+3H2↑ • 根据铝的还原性可推断铝可以与水反应,但实验发现,铝与沸水几乎
没有反应现象,不过铝在加热条件下就可以与水蒸汽发生明显反应, 但反应一开始就与水中的氧气生成致密氧化膜阻止反应进一步进行。
整理ppt
10
第一课时
铝和铝的氧化物
整理ppt
1
金属铝的简介
• 史前时代,人类已经使用含铝化合物的黏土(Al2O3·2SiO2·2H2O) 制成陶器。铝在地壳中的含量仅次于氧和硅,位列第三。
• 铝为银白色轻金属。有延展性。商品常制成柱状、棒状、片状、箔状、 粉状、带状和丝状。
• 在潮湿空气中能形成一层防止金属腐蚀的氧化膜。 • 用酸处理过的铝粉在空气中加热能猛烈燃烧,并发出眩目的白色火焰。 • 易溶于稀硫酸、稀硝酸、盐酸、氢氧化钠和氢氧化钾溶液,不溶于水,
但可以和热水缓慢地反应生成氢氧化铝。 • 相对密度2.70,熔点660℃。沸点2327℃。以其轻、良好的导电和导
热性能、高反射性和耐氧化而被广泛使用。
整理ppt
2
复习金属的化学性质
• 金属容易失去最外层电子,变成金属阳离 子,表现出还原性。
• 不同的金属,有不同的结构,在化学反应 中表现出的还原性各有不同。
整理ppt
14
• 氧化铝和氧化镁的比较
整理ppt
15
两性氧化物
• 两性氧化物是指既可以与酸反应生成盐和水又可以与碱反应生成盐和水的氧 化物。
• 两性氧化物难溶于水。弱酸的酸式盐或弱酸弱碱盐虽然既能与酸反应,又能 与碱反应,但不能生成“盐和水 ”,因而不是两性化合物。
• 与酸反应只生成盐与水的氧化物是碱性氧化物,同理,与碱反应只生成盐与 水的氧化物成为酸性氧化物。与两者都能发生上述反映的为两性氧化物。
铝和酸和强碱的反应
• AL与酸反应
• 2Al +6HCl ==== 2AlCl₃+ 3H₂↑ 2Al + 3H₂SO₄(稀)==== Al₂(SO₄)₃+ 3H₂↑ Al + 6HNO₃(浓)====Al(NO₃)₃+ 3NO₂↑+ 3H₂O(加热) Al + 4HNO₃(稀)==== Al(NO₃)₃+ NO↑+ 2H₂O 8Al + 30HNO₃(较稀)====8Al(NO₃)₃+ 3N₂O↑+ 15H₂O 8Al + 30HNO₃(极稀)====8Al(NO₃)₃+ 3NH₄NO₃+ 9H₂O
• 氧化铅
– 与酸:PbO + 2HCl = PbCl2 + H2O – 与碱:PbO + Ca(OH)2 +H2O = Ca[Pb(OH)4]
• 氧化锌
– 与酸:ZnO + 2HCl = ZnCl2 + H2O – 与碱:ZnO + 2NaOH +H2O = Na2[Zn(OH)4]
整理ppt
3
思考
• 指出铝在元素周期表中的位置。 • 画出铝元素的原子结构示意图。 • 预测铝所表现的化学性质。
整理ppt
4
铝在元素周期表中的位置
整理ppt
5
铝元素原子结构示意图
• AL
• 铝元素原子核外共有 3 个电子层,最 外层电子数是 3 .
整理ppt
6
预测铝的化学性质
• 铝元素的原子在化学反应中易(填“得”或 “失”) 失 电子,形成 阳 离子,带 3 个单位的 正 电荷.铝离子符号表示 为 AL3+。
• 6CH₃COOH+2Al=2Al(CH₃COO)₃+3H₂↑
• 注意,铝在常温下遇到浓硫酸、浓硝酸会发生钝化现象,且无氢气生成。
• AL与强碱碱反应
• 铝先与水反应 2Al+6H2O=2Al(OH)3+3H2↑ 氢氧化铝两性,与强碱反应: Al(OH)3+NaOH=NaAlO2+2H2O 将上述两个反应叠加,得到: 2 Al+2NaOH+2H2O=2NaAlO2+3H2↑
整理ppt
11
思考
• 铝是活泼金属,为什么很多铝制品有很强的抗腐 蚀性?
• 氧化铝,化学式Al₂O₃,在矿业、制陶业和材料科 学上又被称为矾土。是一种高硬度的化合物,难 溶于水,熔点为2054℃,沸点为2980℃,在高温 下可电离的离子晶体,常用于制造耐火材料。
整理ppt
12
氧化铝的化学性质
• 氧化铝的结构式
•
铝与硫需在干糙条件下才能反应,因为生成硫化铝易水解。
整理ppt
8
铝热反应及铝和水的反应
• 铝热反应 • 2Al + Fe₂O₃==点燃== Al₂O₃+2Fe(铝热
反应)
• 8Al + 3Fe3O4==高温== 4Al₂O₃+9Fe
• 铝热法是一种利用铝的还原性获得高熔 点金属单质的方法。 可简单认为是铝 与某些金属氧化物(如三氧化二铁、三 氧化二铬、二氧化锰等)在高热条件下 发生的反应。铝热反应常用于冶炼高熔 点的金属,并且它是一个放热反应其中 镁条为引燃剂,氯酸钾为助燃剂。镁条 在空气中可以燃烧,氧气是氧化剂。但 插入混合物中的部分镁条燃烧时,氯酸 钾则是氧化剂,以保证镁条的继续燃烧, 同时放出足够的热量引发金属氧化物和
• 铝与非金属单质反应 • 铝与水反应 • 铝与酸反应
整理ppt
7
铝与非金属反应
• 铝与非金属反应,表现还原性
• 1、4Al+3O2=2Al2O3 (点燃)
现象:耀眼的白光,放热
• 2、2Al+3Cl₂=2AlCl₃ (点燃)
铝箔或者铝粉可以在氯气中燃烧,产生白烟 。
• 3、2Al+3S=Al₂S₃ (加热)
