中国医疗器械产品标准
无菌医疗器械产品检验相关标准(附件)

无菌医疗器械质量检验相关标准(一)医疗器械生物相容性试验GB/T 16886。
3 医疗器械生物学评价第3部分:遗传毒性、致癌性和生殖毒性试验GB/T 16886.4 医疗器械生物学评价第4部分:与血液相互作用试验选择GB/T 16886.5 医疗器械生物学评价第5部分:体外细胞毒性试验GB/T 16886。
6 医疗器械生物学评价第6部分:植入后局部反应试验GB/T 16886。
7 医疗器械生物学评价第7部分:环氧乙烷灭菌残留量GB/T 16886.8 医疗器械生物学评价第8部分:生物学试验参照样品的选择和定性GB/T 16886.10 医疗器械生物学评价第10部分:刺激与致敏试验GB/T 16886。
11 医疗器械生物学评价第11部分:全身毒性试验GB/T 16886。
12医疗器械生物学评价第12部分:样品制备和参照样品GB/T 16886.13 医疗器械生物学评价第13部分:聚合物医疗器械降解产物的定性与定量GB/T 16886。
14 医疗器械生物学评价第14部分:陶瓷降解产物的定性与定量分析GB/T 16886。
15 医疗器械生物学评价第15部分:金属与合金降解产物的定性与定量GB/T 16886.16 医疗器械生物学评价第16部分:降解产物与可溶出物的毒代动力学研究设计)GB/T 16886.17 医疗器械生物学评价第17部分:根据健康风险评价确定可溶出物允许极限的方法GB/T 16886。
18 医疗器械生物学评价第18部分:材料化学定性GB/T 16886.19 医疗器械生物学评价第19部分:材料理化、机械和形态定性GB/T 16886。
20 医疗器械生物学评价第20部分:医疗器械免疫毒理学试验原理和方法GB/T16175医用有机硅材料生物学评价试验方法GB/T 16886。
9医疗器械生物学评价第9部分:潜在降解产物的定性与定量总则YY/T 0473外科植入物聚交酯共聚物和共混物体外降解试验YY/T 0474外科植入物用聚L—丙交酯树脂及制品体外降解试验YY/T XXXX 一次性使用橡胶手套生物学评价要求与试验方法GB /TXXXX 医疗器械微生物法第3部分:细菌内毒素试验方法用于常规监测和跳批检验YY/T 0567。
医疗器械产品标准2018.6.1资料

2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2017年1月1日 2017年1月1日 2017年1月1日 2017年1月1日 2017年1月1日 2017年1月1日 2017年1月1日 2017年1月1日 2017年1月1日 2017年1月1日 2017年1月1日 2017年1月1日 2017年1月1日 2017年1月1日 2014年10月1日 2014年10月1日 2014年10月1日 2014年10月1日 2014年10月1日
2016 2016 2016 2016 2016 2016 2016 2016 2016 2016 2016
YY 0989.6 YY 1057 YY 1468 YY 1475 YY0572 YY0598 YY0599 YY0603 YY0605.9 YY0831.2 YY0832.2 YY0945.2 YY0948 YY0950 YY0951 YY0952 YY0953 YY0954 YY0006 YY0045 YY0091 YY0092 YY0109
2016 2016 2016 2015 2015 血液透析及相关治疗用浓缩物 2015 激光治疗设备 准分子激光角膜屈光治疗机
心血管植入物及人工器官 心脏手术硬壳
眼科仪器裂隙灯显微镜 关节置换植入物髋关节假体 医用超声耦合剂 钛及钛合金牙种植体 关节置换植入物膝关节假体 眼科仪器角膜曲率计 高强度聚焦超声(HIFU)治疗系统 外科植入物金属材料第12部分:锻造钴-铬-钼合金 牙科学匹配性试验第1部分:金属-陶瓷体系 牙科学根管器械第3部分加压器 手术植入物有源植入医疗器械第 6 部分:治疗快速性心律失常的有源植入医疗器械 (包括植入式除颤器)的专用要求 医用脚踏开关通用技术条件 用于医用气体管道系统的氧气浓缩器供气系统 激光治疗设备 Q开关掺钕钇铝石榴石激光治疗机 血液透析及相关治疗用水
医疗器械产品标准
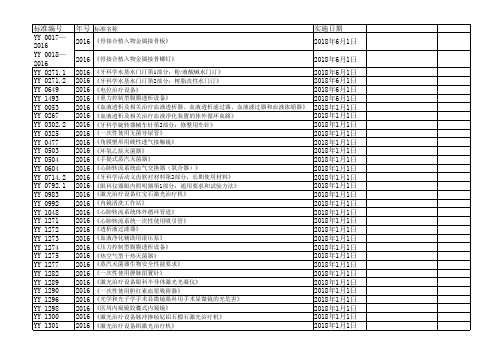
2013 子宫颈活体取样钳 2013 医用超声雾化器 2013 压力蒸汽灭菌设备用弹簧式安全阀 2013 一次性使用无菌阴道扩张器 2013 医用电气设备 第2部分:手术台安全专用要求 2013 医用电气设备 第2部分:医院电动床安全专用要求 2013 医用呼吸机 基本安全和主要性能专用要求 第4部分 人工复苏器 2013 吸入式麻醉系统 第1部分:麻醉呼吸系统 2013 医用电气设备 放射治疗计划系统的安全要求 2013 直线型吻合器及组件 2013 直线型切割吻合器及组件 2013 荷包缝合针 2013 一次性使用植入式给药装置专用针 2013 医用电气设备 第2部分:动态心电图系统安全和基本性能专用要求 2013 医用气体混合器 独立气体混合器 2013 医用电气设备第2部分:肌电及诱发反应设备安全专用要求 2013 耳鼻喉射频消融设备 2013 毫米波治疗设备 2013 医用微波设备附件的通用要求 2013 减重步行训练台 2013 紫外治疗设备 2013 接触式远红外理疗设备 2013 脑电生物反馈仪 2013 电池供电骨组织手术设备 2013 含动物源材料的一次性使用医疗器械的灭菌液体灭菌剂灭菌的确认与常规控制 2013 子宫颈钳 2013 输卵管提取钩 2013 心电诊断设备 2012 医用电气设备第1-2部分:安全通用要求-并列标准:电磁兼容-要求和试验 2011 牙科学 基托聚合物 第1部分:义齿基托聚合物 2011 牙科学 基托聚合物 第2部分:正畸基托聚合物 2011 连续波掺钕钇铝石榴石激光治疗机 2011 植入式给药装置 2011 外科植入物 金属骨针 第1部分 材料和力学性能要求 2011 医用电气设备 第2部分:婴儿辐射保暖台安全专用要求
2018年6月1日 2018年6月1日 2018年6月1日 2018年6月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日 2018年1月1日
医疗器械不合格品判定标准(收藏)

医疗器械不合格品判定标准(收藏)一、概述医疗器械不合格品判定标准是评价医疗器械质量的重要依据,也是保障患者使用安全的关键环节。
为了加强医疗器械生产、经营企业和使用单位对不合格品的识别和管理,提高医疗器械质量,我国制定了严格的医疗器械不合格品判定标准。
本文将对医疗器械不合格品判定标准进行详细解读,以供相关企业和单位参考。
二、医疗器械不合格品的定义医疗器械不合格品是指在生产、经营、使用过程中,不符合国家有关法律、法规、规章、标准和规定要求的医疗器械产品。
医疗器械不合格品可能存在安全隐患,对患者健康造成威胁。
因此,对医疗器械不合格品的判定和管理至关重要。
三、医疗器械不合格品的判定依据1. 法律法规:医疗器械不合格品的判定依据主要包括《中华人民共和国药品管理法》、《医疗器械监督管理条例》等法律法规。
2. 国家标准和行业标准:医疗器械不合格品的判定依据还包括国家和行业发布的医疗器械相关标准,如GB/T 14233《医用输液、输血、注射器具检验方法》等。
3. 企业标准:医疗器械生产企业制定的产品标准,也是判定医疗器械不合格品的依据之一。
4. 注册申报资料:医疗器械注册申报时提交的技术文件、临床试验报告等资料,可作为判定不合格品的依据。
四、医疗器械不合格品的判定标准1. 产品质量标准:医疗器械不合格品的质量标准主要参照国家和行业标准,包括产品的外观、结构、性能、安全性等方面。
如产品外观有破损、变形、污染等情况,或产品性能不符合标准要求,均可判定为不合格品。
2. 标识和说明书:医疗器械不合格品的标识和说明书应真实、准确、完整,包括产品名称、规格、型号、生产日期、有效期、生产企业等信息。
如标识和说明书内容不全、错误或模糊不清,可判定为不合格品。
3. 包装和储存条件:医疗器械不合格品的包装应牢固、密封、防潮、防晒,以确保产品在运输和储存过程中的安全。
如包装破损、密封不良、受潮、变形等,可判定为不合格品。
4. 安全性和有效性:医疗器械不合格品的安全性和有效性应符合国家有关要求。
医疗器械产品适用强制性标准清单(2024年修订版)-20240614

01-10其他手术设备
03电动吻合器
01-10-03下适用产品均适用
YY 0875-2023外科器械直线型吻合器及组件(实施日期:2026-9-15)
02-01手术器械-刀
01手术刀
手术刀片、一次性使用无菌手术刀片、一次性使用无菌取皮刀
GB 8662-2006手术刀片和手术刀柄的配合尺寸
YY 1650-2019 X射线图像引导放射治疗设备 性能和试验方法
04伽玛射束远距离治疗机
钴-60远距离治疗机
YY 0096-2019钴-60远距离治疗机
GB 9706.211-2020医用电气设备 第2-11部分:γ射束治疗设备的基本安全和基本性能专用要求
YY 0637-2013医用电气设备 放射治疗计划系统的安全要求(有放射治疗计划系统的适用)
02-13手术器械-吻(缝)合器械及材料
01吻合器(带钉)
吻合器、切割吻合器
YY 0875-2023外科器械直线型吻合器及组件(实施日期:2026-9-15)
02-13手术器械-吻(缝)合器械及材料
02吻合器(不带钉)
吻合器(不带钉)、切割吻合器(不带钉)
YY 0875-2023外科器械直线型吻合器及组件(实施日期:2026-9-15)
03-13神经和心血管手术器械-心血管介入器械
26微导管
微导管、外周介入微导管、输送微导管、漂浮微导管、一次性使用微导管
YY 0285.1-2017血管内导管一次性使用无菌导管第1部分:通用要求
05-01放射治疗设备
01医用电子加速器
医用电子直线加速器、医用电子回旋加速器、螺旋断层放射治疗系统、X射线立体定向放射外科治疗系统、移动式电子束术中放射治疗系统
医疗器械注册产品标准

添加标题
收集国内外相关法规、 标准和文献资料
添加标题
制定标准草案,包括 技术要求、试验方法、 检验规则等
添加标题
征求相关部门、企业 和专家的意见和建议
添加标题
修改和完善标准草案, 形成征求意见稿
添加标题
提交相关部门进行审 查和批准
添加标题
发布实施,并定期进 行修订和更新
征求意见阶段
制定草案: 起草产品标 准草案,明 确标准内容、 适用范围等
02
品标准的内容
产品技术要求
产品结构组成:包括产品 的组成、结构、材料等
产品检验方法:包括产品 的检验方法、检验标准等
产品包装和标签:包括产 品的包装、标签、说明书
等
产品性能指标:包括产 品的安全性、有效性、
可靠性等
产品生产工艺:包括产 品的生产工艺、生产流
程等
产品使用说明书:包括 产品的使用方法、注意
技术审查:对 医疗器械注册 产品标准的技 术内容进行审 查,确保其符 合相关法规和
标准要求。
法规审查:对 医疗器械注册 产品标准的法 规内容进行审 查,确保其符 合相关法规和
政策要求。
专家审查:组 织专家对医疗 器械注册产品 标准进行审查, 确保其科学性
和可行性。
公示和征求意 见:将医疗器 械注册产品标 准草案向社会 公示,征求社 会各界的意见
标准的制定机构和流程
制定机构:国家 食品药品监督管 理总局(CFDA)
制定依据:《医 疗器械监督管理 条例》、《医疗 器械注册管理办 法》等法律法规
制定流程:包括 立项、起草、征 求意见、审查、 批准、发布等环 节
标准内容:包括 产品分类、技术 要求、检验方法、 标签和说明书等 要求
nmpa标准

NMPA,即国家药品监督管理局(National Medical Products Administration),是中国负责药品、医疗器械、化妆品安全监管的最高行政机构。
在提及NMPA标准时,通常是指由该机构制定并发布的关于药品、医疗器械等相关产品的技术要求、质量管理、检验方法等一系列指导原则和规定。
以下是对NMPA涉及的不同方面标准的简要分析:1.药品标准:o NMPA发布的《药品标准管理办法》旨在规范药品研发、生产、流通全过程中的质量控制,确保药品的安全、有效和质量可控。
这些标准涵盖原料药、辅料、制剂的质量标准,以及药品生产质量管理规范(GMP)、药品注册分类及审评要求等。
2.医疗器械标准:o NMPA对医疗器械的标准涵盖了从产品研发、设计、生产到上市后监督的各个环节,制定了严格的注册与备案制度。
其中包括但不限于医疗器械分类规则、产品技术要求、检测评价方法、风险管理、临床试验要求、质量管理体系等标准。
o根据医疗器械的风险程度,NMPA将其分为不同的管理类别,并针对各类别制定相应的审批流程和技术标准,比如上文提到的“YY0042—2018《高频喷射呼吸机》”等医疗器械行业标准。
3.信息化标准:o NMPA还发布了关于药品信息化管理的标准,例如《药品追溯码标识规范》和《药品追溯消费者查询结果显示规范》,以推进药品供应链全程可追溯体系的建设,确保药品信息透明,便于药品质量安全事件的应急处理和责任追踪。
4.国际接轨与融合:o在制定标准的过程中,NMPA积极借鉴国际先进经验和做法,如与CE(欧洲合格标志)、FDA(美国食品药品监督管理局)等国际标准对比和对接,力求使中国标准与国际同步或接轨,提升国内医药产业的国际竞争力。
综上所述,NMPA标准体系是全方位覆盖药品与医疗器械行业的法规和技术要求,对于保障公众用药用械安全、推动医药行业健康发展具有重要意义。
通过不断更新和完善标准体系,NMPA努力实现药品和医疗器械全生命周期的有效监管。
医疗器械产品 严苛的标标准与要求

医疗器械产品严苛的标准与要求一、引言医疗器械产品是医疗行业的重要组成部分,它对人类的健康和生命安全起着至关重要的作用。
医疗器械产品的质量安全和性能可靠性是医疗器械行业的重中之重。
为了保障人民群众的身体健康和生命安全,在不断发展变化的医疗器械市场中,如何确保医疗器械产品的质量安全和性能可靠性,成为了医疗器械行业的重要课题。
二、医疗器械产品的标准与要求在不同国家和地区,医疗器械产品的标准与要求可能会有所不同。
然而,无论是国际标准还是国家标准,医疗器械产品的标准与要求都是严苛的。
以下是医疗器械产品严苛的标准与要求的几个方面:1. 安全性标准与要求医疗器械产品的安全性是首要考虑的因素。
在设计和生产医疗器械产品时,必须遵循相应的安全标准与要求,保证产品在正常使用情况下不对患者造成伤害。
这需要对医疗器械产品的材料、结构、性能等方面进行严格的检测和评估,确保产品符合安全标准与要求。
2. 效能标准与要求医疗器械产品的效能是衡量产品性能的重要指标之一。
医疗器械产品必须在设计和生产阶段考虑到其预期的治疗效果,以及在实际使用中的安全可靠性和稳定性。
在制定医疗器械产品的标准与要求时,必须对其治疗效果、功能性能等进行严格的评估和验证,确保产品符合效能标准与要求。
3. 环境适应性标准与要求医疗器械产品通常需要在特定的环境条件下进行使用,其环境适应性也是需要考虑的重要因素。
医疗器械产品的标准与要求中通常会包括产品在不同环境条件下的适应性考量,以确保产品在特定环境条件下能够正常工作并达到预期的治疗效果。
4. 注册与监管要求在许多国家和地区,医疗器械产品的注册与监管要求也是非常严格的。
医疗器械生产企业必须对产品进行严格的质量管理,并依法申请产品注册,以取得产品上市销售的资格。
政府监管部门还会对医疗器械产品进行定期的检查和监管,以确保产品符合相关的标准与要求。
三、医疗器械产品的质量管理与控制为了确保医疗器械产品符合严苛的标准与要求,医疗器械生产企业必须建立健全的质量管理体系,并对产品的生产过程进行严格控制。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
YZB 医疗器械注册产品标准
YZB/苏(常)XXXX-200X
标准名称
标准英文名称(进口产品)
200X-XX-XX 发布200X-XX-XX 实施
X X X X (企业)发布
YZB/苏(常)XXXX-200X
前言
XXX(产品名称)目前尚无国家标准和行业标准,根据《医疗器械标准管理办法》,特制定本标准,作为企业生产、监督的依据。
本标准的编写符合GB/T1.1-2000、GB/T1.2-2002和《医疗器械注册产品标准编写规范》的有关要求。
本标准的附录X是规范性附录;
本标准的附录X是资料性附录。
本标准由XXXXXXXXX(企业名称)提出。
本标准由XXXXXXXXX(企业名称)负责起草。
本标准主要起草人:XXX、XXX。
本标准首次发布时间:200X年X月。
YZB/苏(常)XXXX-200X
XXXXXXXXX(标准名称)
1 范围
本标准规定了XXXXX的分类和标识、要求、试验方法、标志、使用说明书、包装、运输、储存的要求。
本标准适用于XXXXX(以下简称XXX)。
该产品用于XXXXXXXXXXXXXXXXXXXXXXXX。
2 规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。
凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
GB XXXX-XXXX XXXXXXX
YY XXXX-XXXX XXXXXXX
ISO XXXXX-X:XXXXX XXXXX
3 分类和标记
3.1 分类
(产品的组成、结构、型式,结构、型式可用图表示、规格尺寸可列表表示)
3.2 标记
(为符合标准要求的产品(系列)建立一个分类、型号、产品代码)
4 要求
4.1外观
4.2尺寸
4.3 物理(或机械)性能
如强度、硬度、弹性、耐热性、耐磨性等。
4.4 使用性能
4.5 化学性能
如还原物质(易氧化物)、金属离子、酸碱度、蒸发残渣、紫外吸光度、环氧乙烷残留量等。
4.6 生物性能
如无菌、热原、溶血、刺激、致敏等(按GB/T16886.1)
4.7 安全性能
GB 9706医用电气设备通用安全要求系列标准;
GB/T16886医疗器械生物学评价系列标准;
YY/T口腔材料生物学评价系列标准;
及其他安全要求。
4.8 其他方面的要求
5 试验方法
5.1 外观
5.2 尺寸
YZB/苏(常)XXXX-200X 5.3
(试验方法应与要求相对应。
试验方法一般应采用已颁布的标准试验方法。
如果没有现行的试验方法可采用时,规定的试验方法应具有可操作性和可再现性。
试验中使用的测试仪器、设备、工具及标准样品等一般应有规定的精度等级)
6 检验规则
6.1 XXX经制造厂质量部门进行检验,合格后附合格证方可出厂。
6.2 XXX应成批(或逐件、逐台)提交检查,检查分逐批检查(出厂检验)和周期检查(型式检验)。
6.3 组批规则(针对逐批检查)
6.4 逐批检查(出厂检验)
6.4.1 逐批检查应按GB/T2828.1-2003有关规定进行。
6.4.2 抽样方案采用一次抽样,抽样方案的严格性从正常检查抽样方案开始,其不合格分类、不合格分类组、检查项目、检查水平和接收质量限(AQL)按表X的规定。
6.5 周期检查(型式检验)
6.5.1 周期检查前应进行逐批检查,从逐批检查合格批中抽取样本进行周期检查。
6.5.2 在下列情况下应进行周期检查:
a)新产品投产前(包括老产品转厂生产)
b)连续生产中的产品,每年不少于一次;
c)间隔半年再进行生产时;
d)在设计、工艺或材料有重大改动时。
6.5.3 周期检查应按GB/T2829-2002的规定进行。
6.5.4 周期检查采用一次抽样方案,其不合格分类、试验组、检查项目、判别水平、不合格质量水平(RQL)和抽样方案按表X规定。
7 标志、使用说明书
7.1 标志
YZB/苏(常)XXXX-200X
XXX的包装上的标志应清晰,并应包括下列内容:(可能分小、中、大包装或内、外包装)
a)产品名称、型号、规格;
b)生产企业名称、注册地址、生产地址、联系方式;
c)医疗器械注册证书编号;
d)产品标准编号;
e)生产日期或批(编)号;
f)电源连接条件、输入功率;
g)限期使用的产品,应当标明有效期限;
h)依据产品特性应当标注的图形、符号以及其他相关内容。
(局令第10号)
7.2 使用说明书
使用说明书一般应当包括以下内容:
a)产品名称、型号、规格;
b)生产企业名称、注册地址、生产地址、联系方式及售后服务单位;
c)《医疗器械生产企业许可证》编号(第一类医疗器械除外)、医疗器械注册证书编号;
d)产品标准编号;
e)产品的性能、主要结构、适用范围;
f)禁忌症、注意事项以及其他需要警示或者提示的内容;
g)医疗器械标签所用的图形、符号、缩写等内容的解释;
h)安装和使用说明或者图示;
i)产品维护和保养方法,特殊储存条件、方法;
j)限期使用的产品,应当标明有效期限;
k)产品标准中规定的应当在说明书中标明的其他内容。
8、包装、运输、储存
编制说明一、产品概述
二、与人体接触材料安全性、可靠性证明
三、引用的相关标准和资料
四、管理类别的确定依据
五、主要技术条款的确定依据
六、产品自测报告。
