PT项目性能验证方案模板
6kVⅧ段Ⅸ段母线PT全部检验报告
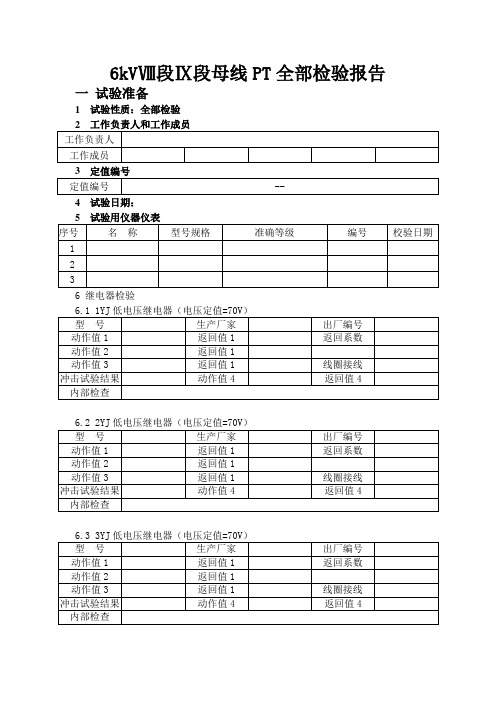
返回系数
动作值2
返回值1
动作值3
返回值1
线圈接线
冲击试验结果
动作值4
返回值4
内部检查
6.3 3YJ低电压继电器(电压定值=70V)
型 号
生产厂家
出厂编号
动作值1
返回值1
返回系数
动作值2
返回值1
动作值3
返回值1
线圈接线
冲击试验结果
动作值4
返回值4
内部检查
6.4 XJJ接地继电器(电压定值=15V)
动作值2
返回值1
动作值3
返回值1
线圈接线
冲击试验结果
动作值4
返回值4
内部检查
6.2 2YJ低电压继电器(电压定值=70V)
型 号
生产厂家
出厂编号
动作值1
返回值1
返回系数
动作值2
返回值1
动作值3
返回值1
线圈接线
冲击试验结果
动作值4
返回值4
内部检查
6.3 3YJ低电压继电器(电压定值=70V)
型 号
生产厂家
型 号
生产厂家
出厂编号
线圈电阻
动作值
返回值
内部检查
7 绝缘检查
序号
项 目
结 果
1
交流电压回路对地
2
直流回路对地
8 结论:
9 报告审核
审核人
审核日期
年 月 日
6kV Ⅸ段母线PT全部检验报告
一 试验准备
1试验性质:全部检验
2工作负责人和工作成员
工作负责人
工作成员
3定值编号
定值编号
--
pt方案范文

pt方案PT方案简介PT方案是一种高效的项目管理方法,通过将项目分解为一系列可完成的小任务,以便更好地组织和监控项目进展。
PT方案有助于提高团队的协作效率,加快项目交付速度,并确保项目按时交付。
核心概念项目在PT方案中,项目是指拥有明确目标和截止日期的特定工作。
项目可以根据其性质和复杂性分为多个阶段,并分配给不同的团队成员负责。
任务任务是项目工作的最小单元,每个任务都有明确的描述、截止日期和责任人。
任务可以是具体的操作、问题解决或决策等。
PT板PT板是用于可视化项目任务和进展的工具。
它通常分为多个列,每个列代表任务的当前状态,如“待办”、“进行中”和“已完成”。
团队成员可以在PT板上移动任务卡片来表示任务的进展情况。
PT方案的实施步骤步骤1:项目分解将项目分解为具体可行的小任务。
这些任务应该能够在较短时间内完成,并且有明确的截止日期和责任人。
合理的分解任务有助于团队成员更好地理解项目目标,并能够更好地协作和监控进展。
步骤2:任务排列使用PT板或类似的工具,将任务排列在不同的列中,根据任务的状态分为“待办”、“进行中”和“已完成”。
这样的分列有助于团队成员清晰地了解任务的当前状态,并能够更好地协作和沟通。
步骤3:任务分配将任务分配给适当的团队成员。
根据每个成员的工作负荷和专长,合理地分配任务可以提高工作效率和质量。
确保每个任务都有明确的责任人,并设置适当的截止日期。
步骤4:任务执行和监控团队成员应按照任务要求和截止日期执行任务。
在任务执行过程中,及时沟通并解决可能遇到的问题。
使用PT板来监控任务的进展,并确保项目保持在预期的时间范围内。
步骤5:任务评估和总结一旦任务完成,团队应该进行任务评估和总结。
通过评估任务的实施过程和结果,团队可以识别问题和取得的进展,并为下一阶段的工作做好准备。
PT方案的优势- 提高团队的协作效率:通过明确的任务分配和透明的任务状态,团队成员可以更好地协作和沟通。
- 加快项目交付速度:将项目拆分为小任务,可以减少等待时间,并加快项目的整体交付速度。
临床免疫学检验的定性项目性能验证方案

临床免疫学检验的定性项目性能验证方案检验程序性能验证是临床实验室质量管理的关键技术要求,是保证实验室检测结果准确的前提。
根据中国合格评定国家认可委员会(CNAS)发布的《CNAS-GL038:临床免疫学定性检验程序性能验证指南》,要求申请认可或已获认可的医学实验室对临床免疫学(定性)检验程序,在新检验程序常规应用前、检验程序分析性能受影响后(如仪器主部件故障、仪器搬迁、环境失控等)、检验程序的任一要素(仪器、试剂、校准品等)变更等,都要对检验程序的性能进行验证或重新验证,通过验证结果来分析评估该检验程序是否符合实验室的质量管理要求并满足临床的诊断需要。
性能验证指标的选择应满足该项目检测的预期用途,临床免疫学定性检验程序的分析性能参数一般包括:符合率、精密度(重复性)、检出限、临界值、抗干扰能力、血清与血浆结果一致性等。
下面将对临床免疫学定性检验程序的符合率、精密度(重复性)、检出限和临界值这4个性能指标的验证方案进行介绍解释。
1符合率验证符合率验证的目的是评估该检验程序所检测结果的正确度,有两种验证方案,一是诊断符合率,采用国家标准血清盘或临床明确诊断的阴阳性样品进行比对;二是方法符合率,即与其他分析方法进行比对,包括用候选方法评估已知能力验证或室间质评的样本以及不同方法学或/和相同方法学在不同实验室之间的比对。
1.1诊断符合率验证选取国家标准血清盘或临床明确诊断的阴性样本20份(包含至少10份其他标志物阳性的样本)、阳性样本20份(包含至少10份浓度在cut-off值和2-4倍cut-off值之间的弱阳性样本,1份极高值阳性样本),随机分组分批检测样本,以国家标准血清盘或临床明确诊断的样本结果为金标准,计算候选检验程序所检测结果的诊断符合率,如表1,表1诊断符合率验证金标准合计+-候选检验程序+a b a+b -c d c+d合计n1n2n 诊断符合率计算:诊断灵敏度=[a/n1]×100%诊断特异性=[d/n2]×100%诊断符合率=[(a+d)/n]×100%验证通过标准:要求计算得出的诊断灵敏度、诊断特异性和诊断符合率不低于厂商检验方法声明。
验证方案模板

验证方案模板
1. 验证目的。
首先,我们需要明确验证的目的是什么。
验证的目的通常包括验证产品的功能、性能、可靠性、兼容性等方面。
在设计验证方案时,需要明确每个验证目的,并确保验证方案可以有效地满足这些目的。
2. 验证方法。
接下来,我们需要确定验证的方法。
验证方法通常包括实验验证、仿真验证、
测试验证等。
在选择验证方法时,需要考虑到验证的目的和产品的特性,以及验证的成本和时间。
在设计验证方案时,需要明确每个验证方法,并确保验证方法可以有效地实现验证的目的。
3. 验证步骤。
然后,我们需要确定验证的步骤。
验证步骤通常包括准备工作、实施验证、数
据分析等。
在设计验证方案时,需要明确每个验证步骤,并确保验证步骤可以有效地完成验证的方法。
4. 验证标准。
最后,我们需要确定验证的标准。
验证标准通常包括产品规格、行业标准、客
户需求等。
在设计验证方案时,需要明确每个验证标准,并确保验证标准可以有效地评估验证的结果。
综上所述,一个完善的验证方案需要明确验证的目的、方法、步骤和标准。
在
设计验证方案时,需要充分考虑产品的特性和需求,以及验证的目的和方法。
通过一个完善的验证方案,可以有效地保证产品的质量和性能,提高产品的可靠性和稳定性。
希望以上内容能够对您在设计验证方案时提供一些帮助和参考。
PTS性能测试方案-标准化模板

XXXX公司线上容量性能测试方案文档编号:文档名称:编写:审核:批准:批准日期:修改历史目录1.项目背景 (1)2.项目目标 (1)3.项目范围 (1)4.环境 (2)4.1. 生产环境系统架构图 (2)4.2. 测试环境系统架构图 (2)4.3. 生产环境硬件配置 (2)4.4. 测试环境硬件配置 (3)4.5. 生产环境与测试环境软件配置 (3)4.6. 测试环境与生产环境差异分析 (3)5.模型 (3)5.1. 业务模型 (3)5.1.1. 业务模型分析 (3)5.1.2. 业务模型1 (4)5.1.3. 业务模型2 (4)5.1.4. 业务模型3 (5)5.2. 业务指标 (6)5.3. 测试模型 (6)6.测试策略 (6)6.1.测试发起策略 (6)6.2.测试执行策略 (6)6.3.测试监控策略 (6)7.测试内容 (7)7.1.混合场景容量测试 (7)7.2.业务突变测试 (7)7.3.自动投标和满标复审对混合交易影响 (7)7.4.稳定性测试 (7)8.测试实施准备 (8)8.1.测试工具准备 (8)8.2.测试挡板准备 (8)8.3.测试数据准备 (8)8.4.测试脚本准备 (8)9.测试组织结构 (8)10.测试输出 (9)10.1.过程性输出 (9)10.2.结果输出 (9)11.项目计划 (9)12.项目风险分析 (10)1.项目背景随着XXXX公司业务发展,现有系统的系统架构不足以满足性能需求,为了配合新系统架构的改造,对原有系统架构性能容量进行基线测试,测试出当前线上系统的容量。
2.项目目标本次项目目标如下:测试当前系统的最大容量测试批量时间窗口和速率测试批量对联机交易的影响考察线上系统的稳定性3.项目范围本次项目范围只对当前应用系统的容量进行测试,不涉及到第三方系统、操作系统、中间件、数据库等自身系统的容量。
4.环境4.1.生产环境系统架构图IIS IIS4.2.测试环境系统架构图与生产环境架构一致4.3.生产环境硬件配置4.4.测试环境硬件配置跟生产环境相同4.5.生产环境与测试环境软件配置4.6.测试环境与生产环境差异分析5.模型5.1.业务模型5.1.1.业务模型分析生产上访问量统计如附件所示:访问量统计-高峰小时.xlsx通过这个访问量统计可知,大部分时间段业务种类和业务占比基本相似,作为正常情况下业务模型;其中某些天业务6、业务3、业务12将会进行突变,作为突变业务模型;另外在业务13批处理将会对数据库产生极大影响,因此需要考虑这两笔业务对系统性能影响,作为批量对联机交易的影响业务模型。
验证方案模版(新)

IQ/OQ/PQ验证方案模版使用说明:针对此模版使用者XX验证方案2013此模版应用于系统/设备确认验证方案的起草,规定了方案格式和通用内容。
因此系统/设备确认验证方案的产生形成过程必须以此模版给出的格式为指南并且要严格符合验证组织和实施sop(xxxxx)的要求。
此模版作为一个指导,由一些必须在实际操作中执行章节组成. 这些章节/ 内容项目以蓝色标明。
在完成这些蓝色标注的项目后必须用黑色字体的文字部分来代替,删除或覆盖掉。
而与本次验证不相关的部分/项目以黑字内容可直接从模版中删除。
方案批准:批准意味着该确认方案已经被审核并且是完整和可接收的。
目录(列出本文件的主要标题及相应的页码)1.目的 (3)2.范围 (3)3. 职责 (3)1. 目的此验证方案收集的资料源于对系统的检查和附表中测试的数据,以此提供书面文件证明系统/设备安装和连续运行过程中必须达到的目的、方法及具体操作,并以此确认系统的安装/运行完全符合用户需求、设计标准和GMP法规(中国GMP/美国现行GMP/ 欧盟GMP)的要求,或任何明确的基于GMP风险分析而提出的要求。
2. 范围本确认方案将会在公司XXXX系统/设备上实施。
本文件描述了系统/设备检查、测试程序及可接受标准、文件和参考文件,这些可以用来确定系统/设备的安装/操作符合设计标准及生产工艺的要求。
本确认文件提供了有关验证人员职责的描述、有效的批准签名、支持文件和其他包含于文件包中的因素,完成后所有的支持数据和文件将附于本验证文件之后。
3. 验证小组职责和验证计划3.1 验证小组职责3.1.1 验证小组组长职责●保证IQ方案及IQ检查表的起草。
●保证在执行前完成对IQ方案及IQ检查表的审核和批准。
●确保在执行前DQ已完成,且DQ检查结果及最终报告都已经通过审核和批准。
●负责对验证小组成员进行本方案的培训。
●保证完全按照IQ方案实施。
●确保能及时发现偏差,并按照已经达成一致偏差处理方法对其进行记录、纠正、调查和最终确认。
PTM01T02-Certification and Test Plan测试与验证计划模板
XXX Certification and Test Plan XXX测试与验证计划Prepared by拟制Date日期yyyy-mm-ddReviewed by 评审人Date日期yyyy-mm-ddApproved by批准Date日期yyyy-mm-ddAuthorized by签发Date日期yyyy-mm-ddCoship Technologies Co., Ltd.同洲有限公司All rights reserved版权所有侵权必究(PTM01T02 V2.0/ IPD-PTM V2.0 / for internal use only) (PTM01T02 V2.0/ IPD-PTM V2.0 / 仅供内部使用)Revision Record 修订记录Distribution List 分发记录Table of Contents 目录Table of Contents 目录 (3)1 I ntroduction 简介 (5)1.1 P urpose 目的 (5)1.2 S cope 范围 (5)1.3 R eferences 参考资料 (5)2 S chedule Development 测试进度计划 (5)2.1 T est Restriction & Key Milestone 测试约束与关键里程碑 (5)2.2 E stimated size 规模 (5)2.3 E stimated effort 工作量 (5)2.4 E stimated schedule 进度 (6)2.5 T est Resource Required 资源需求 (7)2.5.1 Staffing 人员需求计划 (7)2.5.2 Training Plan 人员培训计划 (7)2.5.3 Structure of Organization 测试组结构 (7)2.5.4 Equipment/Tools Requirement 设备/工具需求计划 (8)3 D eliverables 交付件 (9)4 Q uality Plan 质量计划 (9)4.1 Q uality Targets 质量目标 (9)4.2 P lan to achieve the Quality Targets 质量计划 (11)4.3 Q uality Control Activities 质量控制活动 (11)5 R isk Management Plan 风险管理计划 (12)6 C ommunication Plan 沟通计划 (12)6.1 D ependencies 依赖关系 (12)6.2 A ssumptions 假定 (12)6.3 T est Stockholder 产品测试干系人 (12)6.4 M anagement Reports 管理报告 (12)6.5 P roject Team Meeting 测试组会议 (13)6.6 T est Folder 测试文件夹 (13)7 A ppendix 附录 (13)XXX Certification and Test PlanXXX测试与验证计划Keywords 关键词:Abstract 摘要:List of abbreviations 缩略语清单:1Introduction 简介1.1Purpose 目的举例:本计划所应达到的目标如下:For example: The plan should be meeting the following objectives:·确定所有计划、开发和验证阶段的测试活动;Specify all the test activities in plan phase develop phase, qualify phase;·明确各测试活动的任务、方法、标准、输入输出、资源需求、风险、角色和职责等;Confirm Task, method, standard, inputs/out, resource requirement, risk, role and responsibility of the test activities;1.2Scope 范围本计划适用于什么产品,什么阶段,什么对象, 以及被测产品所包含的范围等The plan is applied in what product, what phase, what object, and the scope of the product under test, etc.1.3References 参考资料2Schedule Development 测试进度计划2.1Test Restriction & Key Milestone 测试约束与关键里程碑简要描述产品测试的主要约束条件,如产品关键里程碑约束、产品版本规划约束等,目的在于通过分析各类测试约束条件,制定符合实际情况的测试进度。
设备验证(IQ、OQ、PQ)文件模板
设备验证文件(安装IQ、运行OQ、性能PQ)设备名称:XXXXXXXX设备型号:XXXXXXXX验证文件名称验证文件编码XXXXX设备(IOPQ)验证方案XXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXX公司XXX年目录1.验证方案审批 (2)2. 概述 (3)3. 目的 (3)4. 范围 (3)5.职责 (3)7.安装确认(IQ) (4)8.运行确认(OQ) (5)9.性能确认(PQ) (7)10验证结果的评审与验证结论 (9)11文件修订变更历史 (9)12.附件: (9)12.1培训记录 (10)12.2安装确认记录 (10)12.3运行确认记录 (15)12.4性能确认记录 (22)1.验证方案审批起草签名日期起草部门年月日工程设备部审核签名日期审核部门质量管理部年月日生产技术部年月日设备总监年月日批准批准人签名日期质量受权人年月日2. 概述2.1设备基本信息设备名称型号设备编号生产厂家设备生产日期购入日期安装位置2.2设备系统描述设备结构:主要由XXX部分、XXX部分组成。
设备特点:XXXXXX。
2.3主要技术参数XXXXXXXX3. 目的通过验证,保证设备名称安装并运行后,工作性能符合生产工艺和生产规模的要求,标准操作程序符合生产操作要求。
4. 范围本方案适用于公司XXXX车间设备名称安装、运行和性能确认的验证。
5.职责工程设备部:负责起草验证方案和报告,并负责本方案的实施。
负责跟踪所有偏差缺陷均已整改。
生产技术部:负责该方案和报告审核。
负责配合设备的安装调试过程,主要参与性能确认验证。
质量管理部:负责验证方案、验证报告的审核,负责对验证过程的监控和检验,负责对偏差作出处理意见。
设备总监:审核验证方案和验证报告。
质量受权人:质量受权人负责方案、偏差和报告的最后批准。
6.培训在本方案实施前,应对方案实施过程中涉及人员进行培训,以保证方案顺利实施,并做好培训记录,培训记录见附表6.1。
PT项目性能验证方案模板
PT检测方法学性能验证评价报告验证内容:正确度、重复精密度、中间精密度及参考区间的确认验证人员:一检测系统信息项目:PT仪器名称:STA-R全自动凝血分析仪仪器型号:STA COMPACT试剂:厂商:STAGO检测方法:凝固法厂商提供的相关参数三验证过程1正确度1.1目的:评价仪器测试结果与接受参考值之间的一致程度。
通过实验室检测数据的偏倚从而评价和验证实验室检测结果的准确性。
1.2评价方法:参加卫生部临检中心的室间质评,本组参加室间质评的项目一律用回报结果作为评价标准,最近一次参加卫生部室间质评卫生部质控值。
1.3结果判断方式:<1/2 CLIA ' 88正确度验证试验数据记录表2精密度2.1重复精密度2.1.1目的:考察仪器检测方法的随机误差2.1.2原理:在检测系统处于优良的条件下,连续测定20个结果,判断这20个独立结果间的一致程度2.1.3方法:选择二个水平的质控血浆,测量前先定标,再做质控,质控结果在控制范围内,连续重复测定20次,计算SD,CV,得到重复性精密度。
2.1.4标本来源:二个水平的质控血浆为LEVEL1,LEVEL2。
2.1.5 结果判断方式:V1/4CLIA' 883.75%重复性精密度验证试验数据记录表2.2中间精密度:2.2.1目的:考察目前实验室检测方法中间精密度。
222原理:在检测系统处于优良的条件下,连续测定20天,取得20个结果,判断这20个独立结果间的一致程度。
2.2.3方法:取一个月的室内质控值(高值、低值)计算CV、SD,得到批间精密度。
2.2.4 结果判断方式:<1/3 CLIA' 88 5%3干扰物质干扰物质对本项目的影响大小沿用厂商参数,详细内容见本项目SOP。
4 参考区间(Referenee intervals ):4.1目的:选择20份体检合格的健康人标本,在检测系统上进行测定,对结果进行统计并与仪器说明书提供的参考区间进行比较。
项目管理验证计划模版
项目管理验证计划模版1. 项目概述
- 项目名称
- 项目背景和目的
- 项目范围
- 项目里程碑和关键日期
2. 验证目标
- 列出需要验证的主要功能和要求
- 确定验证活动的目标和期望结果
3. 验证策略
- 确定验证类型(单元测试、集成测试、系统测试等) - 确定验证环境和工具
- 确定测试用例设计方法
- 确定缺陷管理流程
4. 验证活动
- 列出验证活动及其描述
- 为每个活动确定入口/出口条件
- 确定所需资源(人员、设备等)
- 制定活动时间表
5. 验证测试
- 确定测试用例和测试数据
- 制定测试执行计划
- 确定测试覆盖率目标
6. 验证交付物
- 列出预期的验证交付成果
- 确定交付物审阅和批准流程
7. 风险和缓解措施
- 识别可能影响验证活动的风险 - 提出风险缓解措施
8. 沟通计划
- 确定利益相关者
- 确定沟通内容、频率和方式
9. 验证度量
- 确定验证度量指标
- 确定度量数据收集和报告方式
10. 审批和签署
- 列出审批人员
- 包含签名和日期部分。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
PT 检测方法学性能验证评价报告
验证内容:正确度、重复精密度、中间精密度及参考区间的确认
验证人员:
一检测系统信息
项目:PT
仪器名称: STA-R全自动凝血分析仪
仪器型号:STA COMPACT
试剂:
厂商:STAGO
检测方法:凝固法
二厂商提供的相关参数
三验证过程
1 正确度
1.1 目的:评价仪器测试结果与接受参考值之间的一致程度。
通过实验室检测数据的偏倚从而评价和验证实验室检测结果的准确性。
1.2 评价方法:参加卫生部临检中心的室间质评,本组参加室间质评的项目一律用回报结果作为评价标准,最近一次参加卫生部室间质评卫生部质控值。
1.3 结果判断方式:<1/2 CLIA’88
正确度验证试验数据记录表
2 精密度
2.1 重复精密度
2.1.1 目的:考察仪器检测方法的随机误差
2.1.2 原理:在检测系统处于优良的条件下,连续测定20个结果,判断这20个独立结果间
的一致程度
2.1.3 方法:选择二个水平的质控血浆,测量前先定标,再做质控,质控结果在控制范围内,
连续重复测定20次,计算SD,CV,得到重复性精密度。
2.1.4 标本来源:二个水平的质控血浆为LEVEL1,LEVEL2。
2.1.5 结果判断方式:<1/4C LIA’ 88
3.75%
重复性精密度验证试验数据记录表
2.2 中间精密度:
2.2.1 目的:考察目前实验室检测方法中间精密度。
2.2.2 原理:在检测系统处于优良的条件下,连续测定20天,取得20个结果,判断这20个
独立结果间的一致程度。
2.2.3 方法:取一个月的室内质控值(高值、低值)计算CV、SD,得到批间精密度。
2.2.4 结果判断方式:<1/3 CLIA’ 88 5%
中间精密度验证试验数据记录表
3 干扰物质
干扰物质对本项目的影响大小沿用厂商参数,详细内容见本项目SOP。
4 参考区间(Reference intervals):
4.1 目的:选择20份体检合格的健康人标本,在检测系统上进行测定,对结果进行统计并与仪器说明书提供的参考区间进行比较。
4.2 原理:收集20 例正常健康人血清标本及时检测,要求其年龄,性别等均匀分布,对参考范围进行验证,只允许10%的数据超过所验证的参考范围,否则需建立参考范围。
验证范围:11.0-15.0s
4.3 标本的要求
1) 体检合格健康的筛选者
2) 脂血、溶血均勿用
4.4 结果判断方式:R= ≥90%即合格
生物参考区间数据及验证记录表
4.5 结论:
若本实验室所检测的20个标本其检测结果19个均在验证区间11.0-15.0s内,故本实验室参考区间验证通过。
5 PT正常值及PT INR计算公式的建立
5.1 实验方案:参照NCCLS的H21-A4文件,先收集20位未服药的健康人标本进行pt项目
检测,要求其男女性别各一半,年龄在2.5-65岁之间,然后统计其平均值即为PT的正常值。
再根据公式INR=(P/N)ISI建立PT和PT INR换算关系。
其中P为病人的PT时间,N为正常人的PT时间。
PT正常值及PT INR计算公式的建立记录表
5.2 结论:由实验数据知,根据体检标本得出的MEAN PT值10.64s。
根据试剂批号LOT:的试剂说明书,可知其国际敏感指数ISI为1.0.即可建立PT和PT INR换算关系:INR=(P/N)ISI
四总结(Summary)
STA-R PT试剂盒在STA COMPACT全自动凝血分析仪检测系统的精密度、正确度、生物参考区间通过验证。
通过以上各项性能验证室验的结论,STA COMPACT全自动凝血分析仪检测系统达到检测要求,保证检验结果准确可靠,可以满足临床需求。
