乙酸乙酯反应器设计
年产10万吨乙酸乙酯毕业设计说明书
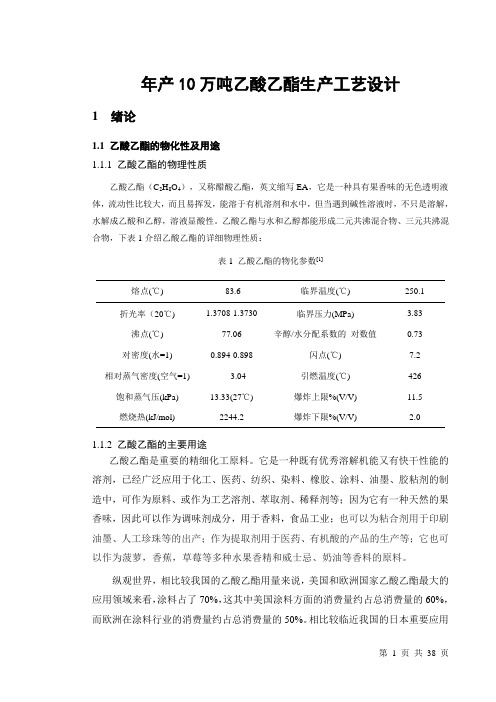
年产10万吨乙酸乙酯生产工艺设计1 绪论1.1 乙酸乙酯的物化性及用途1.1.1 乙酸乙酯的物理性质乙酸乙酯(C2H8O4),又称醋酸乙酯,英文缩写EA,它是一种具有果香味的无色透明液体,流动性比较大,而且易挥发,能溶于有机溶剂和水中,但当遇到碱性溶液时,不只是溶解,水解成乙酸和乙醇,溶液显酸性。
乙酸乙酯与水和乙醇都能形成二元共沸混合物、三元共沸混合物,下表1介绍乙酸乙酯的详细物理性质:表1 乙酸乙酯的物化参数[1]熔点(℃) -83.6 临界温度(℃) 250.1 折光率(20℃) 1.3708-1.3730 临界压力(MPa) 3.83 沸点(℃) 77.06 辛醇/水分配系数的对数值0.73 对密度(水=1) 0.894-0.898 闪点(℃) 7.2 相对蒸气密度(空气=1) 3.04 引燃温度(℃) 426 饱和蒸气压(kPa) 13.33(27℃) 爆炸上限%(V/V) 11.5燃烧热(kJ/mol) 2244.2 爆炸下限%(V/V) 2.01.1.2 乙酸乙酯的主要用途乙酸乙酯是重要的精细化工原料。
它是一种既有优秀溶解机能又有快干性能的溶剂,已经广泛应用于化工、医药、纺织、染料、橡胶、涂料、油墨、胶粘剂的制造中,可作为原料、或作为工艺溶剂、萃取剂、稀释剂等;因为它有一种天然的果香味,因此可以作为调味剂成分,用于香料,食品工业;也可以为粘合剂用于印刷油墨、人工珍珠等的出产;作为提取剂用于医药、有机酸的产品的生产等;它也可以作为菠萝,香蕉,草莓等多种水果香精和威士忌、奶油等香料的原料。
纵观世界,相比较我国的乙酸乙酯用量来说,美国和欧洲国家乙酸乙酯最大的应用领域来看,涂料占了70%,这其中美国涂料方面的消费量约占总消费量的60%,而欧洲在涂料行业的消费量约占总消费量的50%。
相比较临近我国的日本重要应用在涂料,油墨两方面,分别约占总消费量的40%和30%。
我国主要应用于涂料,粘合剂和制药等领域[3]。
年产3万吨乙酸乙酯_毕业设计说明书

1 绪论1。
1 乙酸乙酯概述1。
1。
1 乙酸乙酯的简介乙酸乙酯(EA),又名醋酸乙酯,英文名称:Ethyl acetate.分子式为:C2H8O4。
它是一种无色透明具有流动性并且是易挥发的可燃性液体[1],呈强烈清凉菠萝香气和葡萄酒香味。
乙酸乙酯能很好的溶于乙醇、氯仿、乙醚、甘油、丙二醇、和大多数非挥发性油等有机溶剂中,稍溶于水(25℃时,1mL乙酸乙酯可溶于10mL水中),而且在碱性溶液中易水解成乙酸和乙醇。
水分能使其缓慢分解而呈酸性。
乙酸乙酯与水和乙醇皆能形成二元共沸混合物,与水形成的共沸混合物沸点为70.4℃,其中含水量为6。
1%(质量分数)。
与乙醇形成的共沸混合物的沸点为71.8℃。
还与7.8%的水和9.0%的乙醇形成三元共沸混合物,其沸点为70。
2℃。
下表为乙酸乙酯的一些物化参数。
表1.1 乙酸乙酯的物化参数[2]熔点(℃)-83。
6 临界温度(℃)250.1折光率(20℃) 1.3708—1。
3730临界压力(MPa) 3.83沸点(℃)77。
06 辛醇/水分配系数的对数值0.73 对密度(水=1) 0.894-0.898 闪点(℃) 7.2 相对蒸气密度(空气=1) 3。
04 引燃温度(℃)426 饱和蒸气压(kPa)13.33(27℃)爆炸上限%(V/V) 11。
5燃烧热(kJ/mol) 2244.2 爆炸下限%(V/V) 2.0 室温下的分子偶极距 6.555×10—301。
1。
2 乙酸乙酯的用途乙酸乙酯是重要的精细化工原料.它是一种具有优异溶解性能和快干性能的溶剂,已广泛应用于化工、医药、纺织、染料、橡胶、涂料、油墨、胶粘剂的生产中,或作为原料、或作为工艺溶剂、萃取剂、稀释剂等等;由于它具有天然水果香味,因此还可作为调香剂组分,应用于香料、食品工业中;也可作为粘合剂用于印刷油墨、人造珍珠等的生产;作为提取剂用于医药、有机酸的产品的生产等;此外还可用作生产菠萝、香蕉、草莓等水果香精和威士忌、奶油等香料的原料。
年产30万吨乙酸乙酯的工艺设计

乙酸乙酯(ethyl acetate,简称EA)是一种常用的有机化工原料,广泛用于溶剂、涂料、胶粘剂、香精等行业中。
本文将为您介绍年产30万吨乙酸乙酯的工艺设计。
1.原料准备本工艺设计中所需原料包括乙酸、乙醇和催化剂等。
乙酸和乙醇的纯度应达到工业级标准,催化剂选择的是硫酸。
原料的准备包括弃水、脱硫等处理。
2.乙酸乙酯的制备反应乙酸乙酯的制备反应是乙酸和乙醇发生酯化反应生成乙酸乙酯。
反应的条件包括温度、压力和催化剂的选择。
在本工艺设计中,酯化反应采用连续流程进行。
首先,将经处理的乙酸和乙醇以一定的摩尔比例混合后进入反应器。
根据经验,酯化反应的摩尔比一般为2:1、然后,在适当的温度下(一般为50-60℃)加入适量的硫酸催化剂,促进反应的进行。
反应器中的乙酸乙酯生成后,通过蒸汽加热或外部加热方式升温。
随着温度的升高,乙酸乙酯以气态形式蒸发出反应器。
3.乙酸乙酯的分离净化乙酸乙酯的分离净化主要包括提纯和脱色两个过程。
提纯过程中,需将乙酸乙酯的气态产物进入一个冷凝器进行冷凝,将其转化为液态,然后通过过滤去除其中的悬浮物。
脱色过程中,将提纯后的液态乙酸乙酯通过活性炭等脱色剂进行脱色,以提高乙酸乙酯的纯度。
脱色后的乙酸乙酯经过过滤,得到清澈的乙酸乙酯产物。
4.乙酸乙酯的回收利用在乙酸乙酯制备反应过程中,有部分乙酸乙酯会以气体的形式带出反应器,在分离净化过程中被捕集并回收利用。
在回收过程中,将乙酸乙酯的气态产物与乙酸乙酯的液态产物进行冷凝,将其转化为液态,然后通过分离装置进行分离,将回收的乙酸乙酯重新加入到反应器中。
5.产品质量控制在乙酸乙酯的制备过程中,需要对产品质量进行严密的控制。
主要的质量指标包括乙酸乙酯的纯度、含水量和酸度等。
为了确保产品质量,需要定期对反应器和分离净化设备进行清洗和维护,以避免杂质的积累影响产品质量。
以上就是年产30万吨乙酸乙酯的工艺设计。
通过合理的反应控制和分离净化过程,可以高效地制备乙酸乙酯产品,并确保产品质量。
间歇式反应釜设计说明书

反应工程课程设计反应釜设计任务书一、设计题目:5×103T/Y乙酸乙酯反应釜设计1、用间歇反应器进行乙酸和乙醇的酯化反应,年生产量为5000吨,2、反应式为()()()()3253252CH COOH A C H OH B CH COOC H R H O S +=+3、原料中反应组分的质量比为:::1:2:1.35A B S =4、反应液的密度为31020/kg m ,并假设在反应过程中不变 5、每批装料、卸料及清洗等辅助操作时间为1小时678二、摘要摘要:本选题为年产量为5×103T 的间歇釜式反应器的设计。
通过物料衡算、热量衡算,反应器体积为319.77m 、换热量为62.8710KJ 。
设备设计结果表明,反应器的特征尺寸为高2973.3mm ,直径3000mm ,还对塔体等进行了辅助设备设计,换热则是通过夹套与内冷管共同作用完成。
搅拌器的形式为圆盘桨式搅拌器,搅拌轴直径80mm ,搅拌轴长度3601mm 。
在此基础上绘制了设备条件图。
本设计为间歇釜式反应器的工业设计提供较为详尽的数据与图纸。
关键字:间歇釜式反应器; 物料衡算; 热量衡算; 壁厚设计;Abstract: The batch reactor for five million T a year is to be designed. Through the material, heat balance reactor volume, heat transfer. Equipment design results show that the characteristic dimensions for high reactor is 2973.3 mm, diameter is 3000mm, height is 3180mm , the auxiliary equipment also is to be designed , heat is finished through the clip with the common cold tube inside. The mixer for disk paddle type mixer, stirring shaft diameter and length of stirring shaft is 3601mm , diameter is 80mm. Based on the condition of equipment drawing. This design for batch reactor industrial design provides a detailed data and drawings. Key words : batch reactor, Material, Heat balance, Thick wall design,目录第一章反应釜物料衡算 (1)1.1 反应釜反应时间、反应体积的确定 (1)第二章反应釜公称直径、公称压力的确定 (2)2.1 反应釜公称直径的确定 (2)2.2 反应釜PN的确定 (2)第三章反应釜体设计 (3)3.1 反应釜筒体壁厚的确定 (3)3.1.1 设计参数的确定 (3)3.2 筒体壁厚设计 (4)3.3 釜体封头设计 (4)3.3.1 封头的选型 (4)3.3.2 封头壁厚设计 (4)3.3 筒体长度H设计 (5)3.4 反应釜的压力校核 (6)3.4.1 釜体的水压试验 (6)3.4.2 液压试验的强度校核 (6)3.5 釜体的气压试验 (7)3.5.1 气压试验压力的确定 (7)第四章反应釜夹套的设计 (8)4.1 夹套公称直径、公称压力的确定 (8)4.1.1 夹套DN的确定 (8)4.1.2 夹套PN的确定 (8)4.2 夹套筒体的设计 (8)4.2.1 夹套筒体壁厚的设计 (8)4.2.2 夹套筒体长度H的确定 (8)4.3 夹套封头的设计 (9)4.3.1 封头的选型 (9)4.3.2 椭圆型封头结构尺寸的确定 (9)4.4 夹套的液压试验 (9)4.4.1 液压试验压力的确定 (9)4.4.2 液压试验的强度校核 (10)第五章外压壁厚的设计 (10)5.1 圆筒的临界压力计算 (10)5.2 外压封头壁厚设计 (11)第六章热量衡算 (11)6.1 热量衡算基本数据 (11)6.2 原料带入的热量Q1的计算 (12)6.3 反应热的计算 (13)6.4 夹套给热量的计算 (14)6.5 内冷管移热量的计算 (14)第七章反应釜附件的选型及尺寸设计 (15)7.1 釜体法兰连接结构的设计 (15)7.2 密封面形式的选型 (15)7.3 工艺接管的设计 (15)7.3.1 原料液进口管 (15)7.3.2 物料出口管 (16)7.3.3 催化剂进口设计 (16)7.3.4 温度计接口 (16)7.3.5 视镜 (17)第八章搅拌装置设计 (17)8.1 凸缘法兰选择 (17)8.2 临界转速的计算 (17)8.3 搅拌装置的选型与尺寸设计 (19)8.3.1 搅拌轴直径的初步计算 (19)8.3.2 搅拌轴临界转速校核计算 (20)8.4 搅拌轴的结构及尺寸设计 (20)8.4.1 搅拌轴长度的设计 (20)8.4.2 搅拌桨的尺寸设计 (21)第九章支座 (21)结论 (21)设计结果一览表 (22)参考文献 (23)第一章 反应釜物料衡算1.1 反应釜反应时间、反应体积的确定原料处理量0Q ,根据乙酸乙酯的产量,每小时的一算用量为:500020.77/Kmol h=原料1BO SO AO AO c c b c c K ⎛⎫=-++ ⎪⎝⎭11c K =-得反应时间[1]212 1Af Af XAAO A Ab X adXtk c a bX cX++ ==++⎰10.23.908a=()10.217.591 5.153.908 3.908 2.92b⎛⎫=-++=-⎪⨯⎝⎭110.65752.92c=-=查到反应釜的2800DN mm=2.2 反应釜PN的确定[2]由lg s Bp A t C =-+得一下数据在100℃下,各物质的饱和蒸汽压为下列图表()()()()3253252CH COOH A C H OH B CH COOC H R H O S +=+3.1.1 设计参数的确定设计压力p :()1.05~1.1W p P =,取1.1 1.10.350.385W p P Mpa ==⨯= 液体静压忽略不计 计算压力c p :0.385c L p p p P Mpa=+==设计温度t :110t =℃焊缝系数Φ:1φ=(双面对接焊,100%无损探伤)[3]许用应力[]t σ:根据材料001910Cr Ni ,设计温度为110℃,该材料的[]118tMpaσ=[4]钢板负偏差1C :10.6C mm=腐蚀裕量2C :22C mm=(双面腐蚀)3.2 筒体壁厚设计C n S 制造较难,中、低压小设备不宜采用;蝶形封头的深度可通过过渡半径加以调节,但由于蝶形封头母线曲率不连续,存在局部应力,故受力不如椭圆形封头;保准椭圆形封头制造比较简单,受力状况比蝶形封头好,故该反应釜采用椭圆形封头。
乙酸乙酯反应器设计

乙酸乙酯反应器设计-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN青海大学《化工过程设备设计Ⅱ》设计说明书设计题目:年产×103t乙酸乙酯反应器设计班级:2013级化工2班姓名:邬天贵学号:30前言乙酸乙酯,又称醋酸乙酯,分子式C4H8O2。
它是一种无色透明易挥发的可燃性液体,呈强烈清凉菠萝香气和葡萄酒香味。
乙酸乙酯能很好的溶于乙醇、氯仿、乙醚、甘油、丙二醇和大多数非挥发性油等有机溶剂中,稍溶于水,25℃时,1ml乙酸乙酯可溶于10ml 水中,而且在碱性溶液中易分解成乙酸和乙醇。
水能使其缓慢分解而呈酸性。
乙酸乙酯与水和乙醇都能形成二元共沸混合物,与水形成的共沸物沸点为℃,其中含水量为%(质量分数)。
与乙醇形成的共沸物沸点为℃。
还与%的水和%的乙醇形成三元共沸物,其沸点为℃。
乙酸乙酯应用最广泛的脂肪酸酯之一,具有优良的溶解性能,是一种较好的工业溶剂,已经被广泛应用于醋酸纤维、乙基纤维、氯化橡胶、乙醛纤维树脂、合成橡胶等的生产,也可用于生产复印机用液体硝基纤维墨水,在纺织工业中用作清洗剂,在食品工业中用作特殊改性酒精的香味萃取剂,在香料工业中是最重要的香味添加剂,可作为调香剂的组分,乙酸乙酯也可用作黏合剂的溶剂,油漆的稀释剂以及作为制造药物、染料等的原料。
目前,国内外市场需求不断增加。
在人类不断注重环保的今天,在涂料油墨生产中采用高档溶剂是大势所趋。
作为高档溶剂,乙酸乙酯在国内外的应用在持续稳定的增长,在建筑、汽车等行业的迅速发展,也会带动对乙酸乙酯类溶剂的需求。
工业生产技术目前全球乙酸乙酯工业生产方法主要有醋酸酯化法、乙醛缩合法、乙醇脱氢法和乙烯加成法等。
传统的醋酸酯化法工艺在国外被逐步淘汰,而大规模生产装置主要采用后三种方法,其中新建装置多采用乙烯加成法。
本设计采用醋酸酯化法。
醋酸酯化法在硫酸催化剂作用下,醋酸和乙醇直接酯化生成乙酸乙酯。
该工艺方法技术成熟,投资少,操作简单,但缺点是生产成本高、硫酸对设备腐蚀性强、副反应多、产品处理困难、环境污染严重。
乙酸乙酯反应器设计说明书(河南城建)

乙酸乙酯反应器设计说明书专业:化学工程与工艺姓名:xxx学号:*******指导教师:***化学与材料工程学院2014年5月主要符号一览表V——反应釜的体积t——反应时间c——反应物A的起始浓度Af——反应器的填充系数D——反应釜的内径iH——反应器筒体的高度P——操作压力P c——设计压力φ——取焊缝系数[σ]t——钢板的许用应力C1——钢板的负偏差C2——钢板的腐蚀裕量S——筒壁的计算厚度S——筒壁的设计厚度dS——筒壁的名义厚度nH——反应器夹套筒体的高度jv——封头的体积P——水压试验压力TD——夹套的内径j目 录绪论 ..................................................................................................... 错误!未定义书签。
第1章 设计方案 ....................................................................................................................... 3 第二章 物料计算及方案选择 (3)2.1间歇进料的计算 ................................................................................................................. 3 2.2连续性进料的计算 ............................................................................................................. 4 2.3方案选择 ............................................................................................................................. 6 第3章 热量核算 .. (7)3.1热量衡算总式 (7)3.2每摩尔各种物值在不同条件下的,p mc 值 (8)3.3各种气象物质的参数如下表 ............................................................................................. 9 3.4每摩尔物质在100℃下的焓值 .......................................................................................... 9 3.5总能量衡算 ....................................................................................................................... 10 3.6换热设计 ........................................................................................................................... 11 第4章 反应釜釜体设计 (15)4.1反应器的直径和高度 ....................................................................................................... 15 4.2筒体壁厚的设计 ............................................................................................................... 16 4.3釜体封头厚 ....................................................................................................................... 16 第5章 反应釜夹套的设计 .. (18)5.1夹套DN 、PN 的确定 ...................................................................................................... 18 5.2夹套筒体的壁厚 ............................................................................................................... 18 5.3夹套筒体的高度 ............................................................................................................... 19 5.4夹套的封头 ....................................................................................................................... 19 5.5传热面积校核 ................................................................................................................... 19 第6章 反应釜釜体及夹套的压力试验 (20)6.1釜体的水压试验 ............................................................................................................... 20 6.2夹套的液压试验 ............................................................................................................... 21 第7章 搅拌器的选型 . (22)7.1搅拌桨的尺寸及安装位置 ............................................................................................... 22 7.2搅拌功率的计算 ............................................................................................................... 22 7.3搅拌轴的的初步计算 ....................................................................................................... 21 7.4夹套式反应釜附属装置的确定 ....................................................................................... 21 总结 24 致谢 25 参考书目 26绪论反应工程课程设计是《化工设备机械基础》和《反应工程》课程教学中综合性和实践性较强的教学环节,是理论联系实际的桥梁,是学生体察工程实际问题复杂性,学习初次尝试反应釜机械设计。
乙酸乙酯制备实验的改进设计

乙酸乙酯制备实验的改进设计
摘要
以乙醇与乙酸钠反应制备乙酸乙酯被广泛用于各种工业制备合成中,
但乙酸乙酯的物化性质和合成手段不同,影响着其制备的实验设计。
因此,本文就乙酸乙酯制备实验的改进设计进行了讨论。
首先,本文详细分析了
乙酸乙酯的物化性质,诱导出实验设计的要点,包括:使用更大的反应容器,运用恒温水浴应变调恒,运用自动搅拌制备,采用混合溶剂降低反应
温度,增加反应物浓度以降低反应时间,使用催化剂,采用自制的反应器,改变乙酸钠的质量比,运用分子筛等改进措施。
最后,本文运用平板法,
对上述改进措施进行了评价,得出最佳改进方案:使用更大的反应容器,
运用恒温水浴应变调恒,运用自动搅拌制备,采用混合溶剂,增加反应物
浓度,使用催化剂,改变乙酸钠的质量比,运用分子筛等改进措施。
关键词:乙酸乙酯,改进措施,实验设计,反应容器
1.引言
乙酸乙酯是乙醇和乙酸钠反应合成的有机化合物,乙酸乙酯是一种重
要的有机化合物,它的性质决定了它在医药,农药及香料等领域的广泛应用。
乙酸乙酯反应器设计.

乙酸乙酯反应器设计.乙酸乙酯(ethyl acetate)是一种广泛应用于化学、医药、塑料、香料和溶剂等领域的有机化合物。
乙酸乙酯的生产过程是通过将乙酸和乙醇加热反应得到。
本文将介绍乙酸乙酯反应器的设计,包括工艺流程、反应器类型、反应条件和反应器尺寸等。
1. 工艺流程乙酸乙酯的生产工艺一般采用酯化反应,即将乙酸和乙醇在反应器内加热反应。
反应得到的产物为乙酸乙酯和水。
下图展示了乙酸乙酯的生产工艺流程。
2. 反应器类型针对乙酸乙酯的生产要求,反应器应选择高效、可控、稳定的反应器。
常见的反应器类型包括:① 塔式反应器:采用连续生产方式,反应器内有不同的分层板,可以控制反应速率和产物质量。
③ 固定床反应器:适用于反应速率较慢的酯化反应,其中反应物固定在反应器内某一位置,反应产物从另一端流出。
3. 反应条件酯化反应是一个放热反应,需要在加反应物的同时控制温度。
反应器的温度应在65-85℃之间,反应物在反应器内的停留时间一般为2-3小时。
反应物的摩尔比例为1:1,反应剂浓度一般为10-15 mol/L。
另外,为了促进反应的进行,反应器内应操作低压条件,一般为1.1-1.5 MPa。
反应器的尺寸应根据生产量和反应条件来确定。
反应器的体积一般为1-3 m3,高宽比应在2:1-4:1范围内。
同时,应选择合适的搅拌器和换热器,以保证反应物的均匀混合和温度控制。
5. 总结本文介绍了乙酸乙酯的生产过程和反应器设计,包括工艺流程、反应器类型、反应条件和反应器尺寸等。
希望对相关领域的从业人员和科研工作者提供参考和指导。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
青海大学《化工过程设备设计Ⅱ》设计说明书设计题目:年产2.76×103t乙酸乙酯反应器设计班级:2013级化工2班******学号:**********前言乙酸乙酯,又称醋酸乙酯,分子式C4H8O2。
它是一种无色透明易挥发的可燃性液体,呈强烈清凉菠萝香气和葡萄酒香味。
乙酸乙酯能很好的溶于乙醇、氯仿、乙醚、甘油、丙二醇和大多数非挥发性油等有机溶剂中,稍溶于水,25℃时,1ml乙酸乙酯可溶于10ml水中,而且在碱性溶液中易分解成乙酸和乙醇。
水能使其缓慢分解而呈酸性。
乙酸乙酯与水和乙醇都能形成二元共沸混合物,与水形成的共沸物沸点为70.4℃,其中含水量为6.1%(质量分数)。
与乙醇形成的共沸物沸点为71.8℃。
还与7.8%的水和9.0%的乙醇形成三元共沸物,其沸点为70.2℃。
乙酸乙酯应用最广泛的脂肪酸酯之一,具有优良的溶解性能,是一种较好的工业溶剂,已经被广泛应用于醋酸纤维、乙基纤维、氯化橡胶、乙醛纤维树脂、合成橡胶等的生产,也可用于生产复印机用液体硝基纤维墨水,在纺织工业中用作清洗剂,在食品工业中用作特殊改性酒精的香味萃取剂,在香料工业中是最重要的香味添加剂,可作为调香剂的组分,乙酸乙酯也可用作黏合剂的溶剂,油漆的稀释剂以及作为制造药物、染料等的原料。
目前,国内外市场需求不断增加。
在人类不断注重环保的今天,在涂料油墨生产中采用高档溶剂是大势所趋。
作为高档溶剂,乙酸乙酯在国内外的应用在持续稳定的增长,在建筑、汽车等行业的迅速发展,也会带动对乙酸乙酯类溶剂的需求。
工业生产技术目前全球乙酸乙酯工业生产方法主要有醋酸酯化法、乙醛缩合法、乙醇脱氢法和乙烯加成法等。
传统的醋酸酯化法工艺在国外被逐步淘汰,而大规模生产装置主要采用后三种方法,其中新建装置多采用乙烯加成法。
本设计采用醋酸酯化法。
醋酸酯化法在硫酸催化剂作用下,醋酸和乙醇直接酯化生成乙酸乙酯。
该工艺方法技术成熟,投资少,操作简单,但缺点是生产成本高、硫酸对设备腐蚀性强、副反应多、产品处理困难、环境污染严重。
目前我国大多数企业仍采用醋酸酯化法生产乙酸乙酯。
目录一、工艺设计 (1)1.1原料液的处理量 (1)1.2原料液的起始浓度 (1)1.3反应时间与反应体积 (1)二、物料衡算 (2)三、热量衡算 (3)3.1标准反应热 (3)3.2热量衡算 (3)3.3换热计算 (5)四、反应釜釜体设计 (5)4.1反应器的直径与高度 (5)4.2筒体的壁厚 (7)4.3反应釜封头厚度 (8)五、反应釜夹套设计 (8)5.1夹套DN、PN的确定 (8)5.2夹套筒体的壁厚 (9)5.3夹套筒体的高度 (10)5.4夹套的封头 (10)5.5换热面积校核 (10)六、反应釜釜体及夹套压力试验 (10)6.1釜体的水压试验 (11)6.2夹套的液压试验 (11)七、搅拌器 (12)7.1搅拌桨的尺寸与安装位置 (13)7.2搅拌功率的计算 (14)7.3搅拌轴直径设计 (15)八、反应釜附件的选型与尺寸设计 (17)8.1原料液进料管 (17)8.2人孔与手孔 (17)8.3支座 (17)8.4传动装置 (17)8.5机架 (18)九、设计结果一览表 (18)十、设计心得.......................................................20 参考文献. (21)一、工艺设计1.1原料液的处理量根据乙酸乙酯的产量可计算出每小时乙酸用量为Q=2.76×103×10388×7200×0.386 =11.285kmol/h由于原料液的组分质量比为1:2:1.35所以单位时间处理量为Q 0=11.285×60×4.351020=2.888m 3/h 1.2原料液的起始浓度C A0=11.2852.888 =3.908mol/L有质量比可得乙醇和水的起始浓度C B0=3.908×60×246=10.195mol/LC S0=3.908×60×1.3518=17.586mol/L 1.3反应时间与反应体积将速率方程转换成转化率的函数C A =C A0(1-X A ) C B =C B0-C A0X A C R =C A0X A C S =C S0+C A0X AR A =k 1(a+bX A +cX A 2)C A02=k 1[K -1K X A 2-(1+C A0C B0 +C S0C A0K )X A +C B0C A0 ]C A02 由上式可得a=C B0C A0=2.609 b=-(1+C A0C B0 +C S0C A0K )=-5.15 c=K -1K =0.658所以:∆=2b 2-4ac =4.434则:t=1k 1C A0 X 0dX A a+bX A +cX A 2 =143.8min所以:V R =Q 0(t+t 0)=2.888×(143.8+50)60=9.328m 3 实际体积V t =V R f =9.3280.6 =15.547m 3 (对于沸腾或鼓泡的液体物料,f可取0.4~0.6 《化学反应工程》)二、物料衡算乙酸每小时进料量为11.285kmol/h ,根据乙酸的转化率和反应物的初始质量比计算出各物料的进料和出料量。
进料:乙醇:Q 0=11.285×60×246=29.439kmol/h 乙酸乙酯:Q 0=0kmol/h水:Q 0=11.285×60×1.3518=50.783kmol/h 出料:乙酸:Q=11.285-11.285×0.386=6.929kmol/h乙醇:Q=29.439-11.285×0.386=25.083kmol/h乙酸乙酯:Q=11.285×0.386=4.356kmol/h水:Q=50.783+11.285×0.386=55.139kmol/h列表如下:三、热量衡算3.1标准反应热以第一基准为计算基准反应方程式:CH 3COOH+C 2H 5OH →CH 3COOC 2H 5+H 2O∆H=n∆H r 0μ +∑输出n i H i -∑输入n i H i各物质的∆H f 0及∆H V (蒸发焓)查得如下:(由《化工工艺设计手册》第四版上册查得)乙酸:∆H f0=-487.0KJ/mol乙醇:∆H f0=-277.6KJ/mol ∆H V=39.33KJ/mol乙酸乙酯:∆H f0=-463.3KJ/mol ∆H V=32.24KJ/mol水:∆H f0=-285.9KJ/mol ∆H V=40.63KJ/mol∆H r0=∑输出μi∆H f0-∑输入μi∆H f0=-(463.3+285.9)+(487.0+277.6)=15.4KJ/mol3.2热量衡算从《化工工艺设计手册》第四版上册查出各组分在各温度段的C P值,经拟合呈线性关系,所以可用内插法求得各物质在反应温度段下的平均C P值。
拟合结果如下:乙酸:y=0.1015X+131.25 k2=0.9961得C P=137.803J/(mol·k)乙醇:y液=0.4845X+98.9 k2=0.9942得C P液=124.678J/(mol·k)y气=0.1558X+61.593 k2=0.9998得C P气=75.390J/(mol·k)乙酸乙酯:y液=0.225X+164.8 k2=0.9681得C P液=177.038J/(mol·k)y气=0.272X+104.12 k2=0.9995得C P气=128.028J/(mol·k)水:y=0.0002X2-0.0136X+75.453 k2=0.9968得C P=75.672J/(mol·k)因为进料温度为25℃,所以∑输入n i H i=0,将上述C P值带入计算各组分输出焓值。
乙酸:∆H1=n⎰10025Cp液dt=7.161×104KJ/h乙醇:∆H2=n[⎰7825pC液dt+∆H V+⎰10078p C气dt]=1.194×106KJ/h乙酸乙酯:∆H3=n[⎰7725pC液dt+∆H V+⎰10077p C气dt]=1.934×105KJ/h 水:∆H4=n(⎰10025Cp液dt+∆H V)=2.553×106KJ/h∑输出n i H i=4.012×106KJ/h∆H总=4.356×15.4×103+4.012×106-0=4.079×106KJ/h∆H总>0,所以外界应向系统提供能量。
3.3换热计算换热采用夹套加热,设夹套内的过热水蒸气由130℃降到110℃。
温差为20℃,忽略热损失,则计算水蒸气的用量如下:水蒸气的比热容C P0:C p0=a+(b×10-2)T+(c×10-5)T2+(d×10-9)T3其中a=7.7,b=0.0459,c=0.252,d=-0.859 (由《化工计算》查得)T1=130℃,T2=110℃,T=T1+T22=120℃计算得C p0=7.7+0.180+0.389-0.052=8.217cal/(mol·k)由Q=m0C p0(T1-T2)得m 0=Q C p0(T 1-T 2) =4.079×106×188.217×4.184×20 =1.068×105kg/h 四、反应釜釜体设计4.1反应器的直径和高度在已知搅拌器的操作容积后,首先要选择罐体适宜的高径比(H/D i )以确定罐体的直径和高度。
选择罐体高径比主要考虑以下两方面因素:1、高径比对搅拌功率的影响:在转速不变的情况下,PαD i 3,其中搅拌功率P 随釜体直径D i 的增大,而增加很多,减小高径比只能无畏的消耗一些搅拌功率。
因此一般情况下,高径比应选择大一些。
2、高径比对传热的影响:当容积一定时,H/D i 越大,越有利于传热。
高径比的确定通常采用经验值假设高径比H D i=1.3 先忽略罐底容积 V t ≈π4 D i 2H≈π4 D i 3H D i15.547=π4 D i 3×1.3D i =2.48m取标准D i =2.5m=2500mm标准椭球形封头设计参数由《化工制图》查得筒体的高度H=(V -v)4D i 2π =2.711m=2710mm釜体高径比的复核 H D i =H+h D i =2710+402500 =1.1所以,该设计满足要求。
