高中化学选修4 溶液酸碱性
人教版高中化学选修4第三章第二节 水的电离和溶液的酸碱性 课件(共21张PPT)

知识小结:溶液稀释的PH计算有关规律
1、强酸(碱)每稀释10倍,pH值向7靠拢 一个单位。
2、弱酸(碱)每稀释10倍,pH值向7靠拢 不到一个单位 3、 pH=6或8时,不可忽略水的电离,只能 接近7; 酸碱溶液无限稀释,pH只能接近7:酸不 能等于或大于 7;碱不能等于或小于7。 4.酸(碱)溶液稀释时,OH-(H+)的物 质的量浓度将增大。
方法二:用pH计测定
三、pH的计算 酸性溶液,直接求pH 碱性溶液,先求pOH(或c(H+)),再求pH 混合溶液,先判断酸碱性, 再根据以上方法求 无限稀释接近7
➢pH计算1—— 强酸的稀释
例题:在25℃时,pH值等于3的盐酸溶液稀释到原来的 100倍,pH 值等于多少?
解: [H+]=
=1.0 ×10-5mol/L
➢pH计算4—— 强酸与强酸混合
例题:在25℃时,pH值等于1的盐酸溶液和pH值等于4 的硫酸溶液等体积混合pH值等于多少?
解:pH=-lg[H+] =-lg(1×10—1+1×10—4)/(1+1) =-lg5×10—2 =2-lg5 =1.3
关键:抓住氢离子进行计算!
➢pH计算5—— 强碱与强碱混合
关键:碱过量抓住氢氧根离子进行计算!
pH计算8 弱酸强碱或强酸弱碱混合
(1)PH为12 的NaOH溶液和PH为2的醋酸溶液等体积相 混合,则混合液呈__酸___性
(2)PH为12的氨水和PH为2的盐酸等体积相混合,则混 合液呈 __碱____性
(3)PH为2的盐酸和PH为12的某碱等体积相混合,则混 合液PH_大__于__等__于__7
√ 6、pH值相同的强酸和弱酸中[H+] 物质的量的浓
溶液的酸碱性

溶液的酸碱性溶液的酸碱性是指溶液中的氢离子(H+)和羟离子(OH-)的相对浓度。
酸性溶液中,氢离子的浓度高于羟离子的浓度;碱性溶液中,羟离子的浓度高于氢离子的浓度;中性溶液中,氢离子和羟离子的浓度相等。
溶液的酸碱性对生物体的生理功能、工业生产和环境保护等领域都有着重要影响。
酸碱性的度量常利用pH值来表示。
pH的定义是pH=-log[H+],其中[H+]为溶液中氢离子的浓度。
pH值在0~14之间,数值越小表示酸性越强,0为最酸;数值越大表示碱性越强,14为最碱性。
中性溶液的pH值为7。
pH值的改变可能会造成化学反应、腐蚀、酶活性的改变等。
溶液酸碱性的调节与酸碱反应有关。
酸碱反应是发生在酸和碱之间的反应,其中酸和碱相互中和生成盐和水。
常见的酸碱反应有酸与碱反应、酸与金属反应、碱与金属反应等。
这些反应会导致令人感觉到的酸味、碱味和气味。
许多生物体利用酸碱反应进行生命活动。
比如,我们的胃酸能够帮助消化食物,维持胃内的酸性环境,抑制有害细菌的生长。
酸碱解离平衡是溶液酸碱性的重要因素。
酸和碱在水溶液中会发生解离,生成氢离子和羟离子。
酸的解离产生氢离子,而碱的解离产生羟离子。
强酸和弱酸的解离程度不同,会影响到溶液的酸碱性。
溶液中出现氢离子浓度的变化,会进一步影响pH值。
溶液酸碱性对生物体的影响很大。
细胞内的酸碱平衡对维持细胞的正常功能至关重要。
细胞内外的pH差异能够影响酶的活性,进而影响细胞的代谢功能。
酸碱平衡失调会导致酸中毒或碱中毒,严重时会危及生命。
在工业生产中,酸碱性也起到重要的作用。
许多化学反应需要在特定的酸碱条件下进行。
工业废水的酸碱性对环境保护也非常重要。
酸性废水对水体的生态环境会产生严重破坏,而碱性废水可能会引起水体的浑浊和大规模无菌。
为了调节溶液的酸碱性,人们常常采取一些方法。
最常用的方法是加入酸或碱物质来调节pH值。
例如,当溶液变得过酸性时,可以加入一些碱物质如氢氧化钠来中和溶液,提高pH值。
高中化学人教版选修4 3.2水的电离和溶液的酸碱性--2ph计算 课件

C(H+) =
=
=1 ×10-4mol/L =1 ×10-10mol/L
pH=-lgC(H+) =10
关键:抓住氢氧根离子进行计算!
练习
溶液的稀释
pH=3的稀盐酸加水稀释100倍 pH=2的稀硫酸加水稀释100倍
稀释后 溶液pH
5 4
pH=11的NaOH溶液加水稀释100倍
9
pH=12的Ba(OH)2溶液加水稀释100倍
pH=7 (25℃)
碱性溶液: c(H+)<c(OH—)
pH>7 (25℃)
(一般不特别说明均指常温25℃)
2、pH=-lgC(H+)
相关计算:稀释不变性、酸以氢、碱以氢氧根、酸碱
比谁狠。
3、pH的测定
pH计算9 pH= 2的盐酸和pH= 13的氢氧化钠混合,
(1)若使混合后的溶液呈中性,则V酸/V碱=? (2)混合后溶液的pH=3 V酸/V碱=? (3)混合后溶液的pH=11 V酸/V碱=?
同pH的酸稀释相同的倍数,强酸和弱酸变化幅度大的是?
练习 A
常温下溶液的pH
0
酸性增强 碱性增强
1
2
3
4
5
中性
6 7
8
9
10
11
12
13
14
C(H+) C(OH-)
100 10-1 10-2 10-3 10-4
10-14 结论:
10-13 10-12
1.强酸(或强碱)每稀释10倍,
10-11 10-10
练习
1、有相同pH的三种酸HX、HY、HZ的溶液,稀释相同倍数后,pH
的 变 化值 依 次 增 大 , 则 HX、 HY、 HZ的 酸 性 由 强 到弱 的 顺 序 是
高中化学3.2《水的电离和溶液的酸碱性》学案新人教版选修4

3.2《水的电离和溶液的酸碱性》学案(新人教版选修4)(第一课时)复习目标1、使学生了解水的电离和水的离子积,2、了解溶液的酸碱性与pH 的关系,3、学会计算酸碱的pH 值以及氢离子浓度和pH 值的互算,4、掌握pH 相同的强酸与弱酸的几个规律,5、了解指示剂的变色范围,学会用pH 试纸测定溶液的pH 值 一、水的电离与溶液的PH 值 1.水的电离 H 2O + H 2OH 3O + + OH —简写为:H 2OH + + OH—实验测定:25℃纯水中 C(H +)=C(OH -)=1710-⨯mol/L100℃ C(H +)=C(OH -) = 1610-⨯ mol/L2.水的离子积常数 k w = C(H +)·C(OH -常温下: k w = 3.影响Kw 大小的因素是:注意:任何物质的水溶液中,在常温时,K W = ,K W 与溶液的酸碱性无关,只与: 有关。
提问:当温度升高时,K w 如何变化?(电离过程是吸热过程)1000C 时,K w = c (H +)·c (OH —)=1×10-12影响因素:温度越高,Kw 越大,水的电离程度越大。
对于中性水,尽管Kw 、电离度增大,但仍是中性水,[H +]=[OH -].(注:温度升高时K w 增大,所以说K w 时要强调温度。
)例1:某温度下,纯水中的c (H +)=2.0×10-7mol/L ,则此时溶液中c (OH -)为 ;若温度不变,滴入稀硫酸使c (H +)=5.0×10-6mol/L ,则c (OH -)为 。
〖针对性训练〗1.某温度时,测得纯水中的C(H +)=2.4×10-7mol/L ,则C(OH -)为( )A .2.4×10-7mol/L B .0.1×10-7mol/L C .714104.2100.1--⨯⨯ mol/L D .C(OH -)无法确定2.水的电离过程为H 2O H ++OH -,不同温度下其离子积常数为k w (25℃)=1.0×10-14,k w (35℃)=2.1×10-14。
3.2.2《溶液pH的计算》教学设计(含解析)人教版高中化学选修4

(人教版选修4)第三章《水溶液中的离子平衡》教学设计第二节水的电离和溶液的酸碱性(第二课时溶液pH的计算)【答案】 B【解析】 pH 计算方法为:酸按酸,碱按碱,酸碱混合看过量,无限稀释7为限。
稀释后A 项pH ≈7;B 项pH =9;C 项pH ≈9.7;D 项pH ≈7。
【板书】活动二、酸、碱溶液混合后pH 的计算方法【问题探究1】(1常温下,pH =2的盐酸与pH =4的盐酸,若按1∶10的体积比混合后,求混合溶液的c (H +)及pH 。
【交流】c (H +)=[1×10-2mol ·L -1+10×10-4mol ·L -1]/(1+10)L =1.0×10-3mol ·L -1,故溶液的pH =3。
【问题探究2】(2)常温下,将200 mL 5×10-3mol ·L -1NaOH 溶液与100 mL 2×10-2mol ·L-1NaOH 溶液混合后,求溶液的c (OH -)、c (H +)及pH 。
【交流】c (OH -)=1.0×10-2mol ·L -1,c (H +)=1.0×10-12mol ·L -1,pH =12。
【问题探究3】(3)常温下,pH =12的NaOH 溶液与pH =2的硫酸,若等体积混合后,求溶液的pH 为多少?若按9∶11的体积比混合后,溶液的pH 又为多少?【交流】先判断酸、碱谁过量,若酸过量,直接求c (H +)和pH ,若碱过量,则先求c (OH -),再求c (H +)和pH 。
可得前者酸碱恰好完全反应,则pH =7,后者酸过量pH =3。
【方法探究】强酸碱混合后溶液pH 的计算基本思路是什么?【交流1】(1)强酸与强酸混合:c (H +)混=c 1H +·V 1+c 2H +·V 2V 1+V 2,然后再求pH 。
优秀课件苏教版高中化学选修四 3.2溶液的酸碱性 (共14张PPT)

引言
溶液的酸碱性对生产生活有十分重要的影响。
许多化工产品的生产需要在一定pH的溶液中进行;
人体体液的pH必须保持在一定的范围内才能保证人
体健康,如血液的pH必须保持在7.35~7.45,超出这 个范围就会导致生理功能失调,甚至发生疾病;植 物的生长也需要适宜的pH范围。因此,准确的测定 和控制溶液的酸碱度就显得十分必要。
pH= -lg c(H+)
依据三:溶液的pH值
中性 常温下,当pH= 7时溶液呈___ 常温下,当pH<7 时溶液呈___ 酸性 常温下,当pH> 7时溶液呈___ 碱性
Hale Waihona Puke 问题解决C (H+) /mol.L-1 C (OH-) /mol.L-1 溶液1 溶液2 溶液3 1×10-5 1×10-7 1×10-10 pH
经过研究得知:在一定温度下,水溶液中C (H+) ×C (OH-) =Kw(常数) 当T=25℃(常温下)Kw=1 ×10-14
依据二:常温下C H+
中性 当C (H+) = 1 ×10-7 mol.L-1溶液呈___ 酸性 当C (H+) > 1 ×10-7 mol.L-1溶液呈___ 碱性 当C (H+) < 1 ×10-7 mol.L-1溶液呈___
人体某些体液的pH范围
血液 pH:7.3~7.5 pH :6.6~7.1 pH :0.8~1.5 健康的体质应该呈弱碱性!
唾液
胃液
溶液酸碱性的定量分析
溶液酸碱性的定量分析
请用手头的实验仪器分析你手上农夫山泉是不是真的呈 弱碱性? 红色 5.0 紫色 8.0 蓝色 1、酸碱指示剂:石蕊 酚酞 无色 8.2 粉红 10.0 红色
【高中化学】高中化学选修四高效课堂教学设计:3.3.2盐溶液的酸碱性
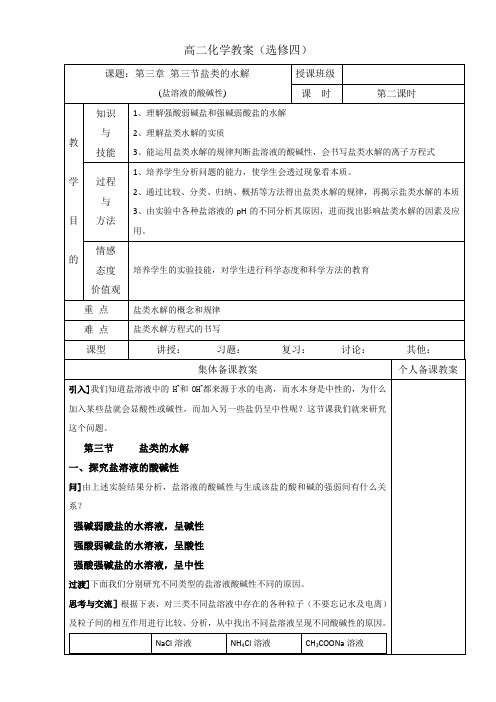
高二化学教案(选修四)C(H+)和C(OH-)相对大小C(H+)=C(OH-)C(H+)>C(OH-)C(H+)<C(OH-)溶液中的粒子Na+、Cl-、H+、OH-、H2O NH4+、Cl-、H+、NH3·H2O、OH-、H2OCH3COO H-、Na+、H+、OH-、H2O、CH3COOH有无弱电解质生成无有有相关化学方程式H2O H++OH-NaCl =Na+ + Cl-H2O H++OH-NH4++ OH-NH3·H2OH2O H++OH-CH3COO- + H+CH3COOH二、盐溶液呈现不同酸碱性的原因讲]CH3COONa溶于水之后,完全电离。
(因为CH3COONa是强电解质。
)投影]CH3COONa ═ CH3COO- + Na+………⑴问]把CH3COONa溶于水之后,溶液中存在哪些电离平衡?投影] H2O H+ + OH-………⑵讲]我们知道,CH3COOH是一种弱酸,在溶液中部分电离,溶液中既然存在CH3COO-和H+,根据,可逆反应,反应物和生成物同时共存,那么就一定有CH3COOH。
投影]CH3COO- + H+ CH3COOH………⑶讲]把⑴⑵⑶式联立,可得到投影]水解方程式:CH3COONa + H2O CH3COOH + NaOH讲]这说明CH3COONa溶于水后,反应有NaOH生成,所以溶液显碱性。
把上述化学方程式改写成离子方程式。
投影]CH3COO- + H2O CH3COOH + OH-讲]随着CH3COONa的加入,对水的电离有什么影响呢?促进了水的电离,可以看作是使水分解了。
醋酸钠与水反应的实质是:醋酸钠电离出的醋酸根离子和水电离出的氢离子结合生成弱电解质醋酸的过程。
投影]1、弱酸强碱盐,水解显碱性 CH3COONa = CH3COO−+ Na+投影]2、强酸弱碱盐,水解显酸性 NH4Cl = NH4+ + Cl−投影]3、强酸强碱盐:不水解4、弱酸弱碱盐:双水解,水解程度增大。
2022届高中化学苏教版选修4知识点复习 第三章 物质在水溶液中的行为 Word版

第三章物质在水溶液中的行为(一)水溶液1、水的电离和水的离子积水是一种极弱的电解质,存在以下电离平衡2H2O H3O++OH-,ΔH>0 简写为:H2O H++OH-;ΔH>0。
25℃时,c(H+)=c(OH-)=10-7mol·L-1水的电离程度: 1.8×10-7%水的离子积:K W=c(H+)·c(OH-)=10-14(25℃ )理解K W时要留意:(1)K W与温度有关,由于水的电离过程是吸热过程,所以温度上升,有利于水的电离,K W增大。
如100℃时,K W =10-12。
(2)K W 不仅适用于纯水,还适用于酸性或碱性的稀溶液。
不管哪种溶液均有如酸性溶液中{c(H+)酸+}·=K W碱性溶液中:{c(OH-)碱+} ·=K W(3)K W与c(H+)及c(OH-)的计算对于水溶液,要精确求算c(OH-)、c(H+)的大小,可依靠K W来计算。
对于中性溶液(或纯水),c(H+)=c(OH-)=。
而酸性溶液,若已知c(H+)、c(OH-)其中之一,另一种离子的浓度即可代入关系:K W=c(H+)c(OH-)求出。
应留意的是:在酸、碱性很弱的溶液中c(H+)和c(OH-)都很小,这时由水电离生成的c(H+)和c(OH-)与酸或碱供应的c(H+)或OH-的浓度较接近,因而不行忽视由水电离生成的c(H+)和c(OH-),应考虑水电离出来的c(H+)和OH-的浓度、并将总的离子浓度代入水的离子积常数关系式中进行求解。
(4)影响水电离平衡的外界因素:(1)酸、碱:抑制水的电离(pH之和为14的酸和碱的水溶液中水的电离被同等的抑制)(2)温度:促进水的电离(水的电离是吸热的)(3)易水解的盐:促进水的电离(pH之和为14两种水解盐溶液中水的电离被同等的促进)2、溶液的酸碱性和pH(1)溶液的酸碱性取决于溶液中c(H+)与c(OH-)的相对大小。
(2)pH:①水溶液里的H+浓度的负对数叫做pH,即pH=-lgc(H+)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
巩固练习
25℃时, 1×10-4mol/L的氢氧化 钠溶液的pH为多少?
解:c(H+)=KW/ c(OH-) =1×10-10
pH=-lg c(H+) =-lg1×10-10 =10
11
表3-6溶液的pH与氢离子、氢氧根离子浓度(25℃)
溶液1 溶液2
c(H+) mol·L-1
c(OH-) mol·L-
20
反馈应用
下列溶液肯定是酸性的是: D
A.含有H+的溶液 B.酚酞显无色的溶液 C.pH<7的溶液 D.c(OH-)<c(H+)
21
反馈应用
某溶液中,25℃时由水电离产生的 c(H+)=1×10-11 mol/L,则溶液的
PH可能为
( ) AB
A.11 B.3 C.9 D.7
温馨提示:根据水的离子积 , c(H+)水= c(OH- )水=1×10-11 mol/L < 1×10-7mol/L ( 25℃ ),显然,此溶液中水的电
1
pH
c(H+)与 c(OH-)比较
酸碱 性
1×10-5 1×10-9 5 c(H+)>c(OH-酸) 性
1×10-7 1×10-7 7 c(H+)=c(OH-中) 性
溶液3 1×10-10 1×10-4 10 c(H+)<c(OH-碱) 性
12
➢25℃时,溶液的pH与c(H+)的关系:
0 100
17
18
各抒己见
从化学实验合理性、规范性的角度 看,请你谈谈对该广告的看法。 用pH试纸测定溶液pH的规范方法:
1.用镊子夹取一小片pH试纸放在干燥洁净的表面皿 (或玻璃片)上; 2.用干燥洁净的玻璃棒蘸取待测液点于pH试纸中部; 3.半分钟内与标准比色卡对照,读出pH。
19
pH计又叫酸度计,是一种用来精确测量溶液pH的 仪器,测量时可以从仪器上直接读出溶液的pH。
常见食物的酸碱性:
强酸性:蛋黄、奶酪、白糖、西点、柿子、乌鱼子、柴鱼等。
离受到抑制,则该溶液可能为酸,也可能为碱,应分两种
情况。
22
反馈应用
下列溶液在常温下酸性最强的是( C)
A.pH=4的溶液 B.1L溶液里溶有22.4ml(标况)HCl的溶
液 C.c(OH_)=10-12 mol/L的溶液 D.c(H+)=10-3 mol/L的溶液
23
归纳小结
一.溶液酸碱性的判断
× 若加水稀释至原体积的10000倍后, pH=?8
≈ 7√
14
三、溶液酸碱性的测定方法
酸碱指示剂法
pH试纸法
pH计法
15
广范pH试纸
精密pH试纸
16
• 将pH试纸湿润之后测pH,误差与真实 值关系是什么?
• 【思考·提示】 若pH试纸湿润后,相当 于将溶液稀释,因此会使溶液pH发生变化。 若测酸性溶液,则会使pH变大,若测碱性 溶液,则pH变小,而若测的是中性溶液, 则溶液pH不发生变化。
1 10—1
酸 性 越 强
2 10—2 3 10—3 4 10—4 5 10—5 6 10—6
7 10—7
碱
ห้องสมุดไป่ตู้8 10—8
性 越 强
9 10—9 10 10—10 11 10—11 12 10—12
13 10—13
14 1310—14
思考讨论
25℃时:
pH=4的盐酸加水稀释10倍后,pH为多少?5 继续加水稀释原体积的100倍后,pH=?6
• 2.水的离子积表达式:Kw=_c_(_H_+_) _·_c_(O__H_-)_ 在25℃时其值是_1_×__10_-_14___
• 3. 分别计算室温下0.01mol/L的盐酸、氯化 钠和氢氧化钠溶液中 c(H+)及c(OH-)分别是 多少?
4
溶液的酸碱性与溶液中的c(H+) 、c(OH-) 的大小有什么关系?
——溶液中c(H+)、c(OH-)的相对大小
二.溶液酸碱性的表示方法——pH的简单计算 pH=-lg c(H+)
三.溶液酸碱性 的测定方法
酸碱指示剂 pH试纸
pH计
24
把健康带回家
25
关注健康 珍爱生命
26
酸性食物与碱性食物
营养学上划分食物酸碱性的标准,不是根据食物的口味,而是根据食物在 人体内分解最终代谢产物的酸碱性来划分的,凡是在体内分解的最终代谢产物 是酸性的,就称为酸性食物,反之就是碱性食物 。
10-2
10-7
10-12
5
请大家计算0.01mol·L-1的下列溶液中c(H+) 和c(OH-)
c(H+)/ mol·L-1
c(OH-)/ mol·L-1
盐酸 NaCl溶液 NaOH溶液
1×10-2 1×10-7 1×10-12
1×10-12 1×10-7 1×10-2
注:水的离子积 Kw = c(H+) ·c(OH-) = 1×10-14(25℃)
8
二、溶液酸碱性的表示方法
能否使用一种简单的方法表示溶 液的酸碱性? pH与c(H+)之间又是怎样一种关系呢?
pH=-lg c(H+)
9
例题讲解
已知某弱酸HA的电离度为10%, 求0.1mol/L该酸溶液的pH。
解:该0.1mol/L HA溶液中
c(H+) = c(HA)·α = 0.1mol/L×10%= 0.01 mol/L pH= -lg c(H+) = - lg 0.01 = 2
专题三 溶液中的离子反应
溶液的酸碱性
1
课标定位
• 课标要求 • 1.了解溶液的酸碱性和pH的关系。 • 2.有关pH的简单计算。 • 学习重点 • 1.有关pH的简单计算。 • 2.酸碱中和反应曲线的测定方法。
2
3
温故知新
• 1.请写出水的电离方程式: ____H_2_O____H_+_+__O_H_- _______
碱性溶液 c(H+)<__c(OH-) c(H+) <__1×10-7 mol·L-1
c(OH-)越 _大___ ,溶液碱性越_强___ 。
7
思考讨论
某溶液中c(H+) >1×10-7 mol·L-1,则该 溶液一定显酸性?
不一定。 说明:溶液酸碱性的判断依据是c(H+) 和c(OH-)的相对大小。 c(H+) >1×10-7 mol·L-1呈酸性只是25℃时的一种特殊情况。
6
一、溶液的酸碱性的判断
➢溶液的酸碱性与c(H+)和c(OH- )的关系:
T=25℃ 酸性溶液 c(H+) >__c(OH-) c(H+) >__1×10-7 mol·L-1
c(H+)越 _大___ ,溶液酸性越_强___ 。 = = 中性溶液 c(H+) __c(OH-) c(H+) __1×10-7 mol·L-1
