线栓法大鼠脑缺血再灌注模型改良与评价
线栓法大鼠大脑中动脉阻断实验(MCAO模型)的经验

线栓法大鼠大脑中动脉阻断实验(MCAO模型)的经验本人现在正在做线栓法大鼠大脑中动脉阻断实验(MCAO模型),这方面的资料我查了一些,这个实验我也作了一段时间,不敢说很专业了,不过现在基本上我能在15min左右完成手术,而且手术过程中不出一滴血,造模后缺血程度基本一致。
虽然前面有很多前辈发了很多MCAO的很专业的贴子,不过我觉得比较凌乱,现在我把我的心得体会和以前的贴子的精华部分奉献给大家,希望这会对将要做这个实验的朋友有一丝的帮助。
虽然做实验总会有郁闷的时候,不过风雨之后总会见到彩虹的,这可以也是我的心得体会。
衷心祝福大家能把实验做的成功、完美!实验前准备麻醉剂:水合氯醛(应较好的控制大鼠体温)保温:60W白炙灯高度为37cm直接照射能使肛温保持在 37℃栓线的制备:1.取熔点为56℃的固体石蜡一块,在瓷杯中加热熔化。
直径为0.24mm、长5cm的鱼线一端5mm长的一段,垂直在熔化的石蜡中迅速浸入并提起,立即凝固的一薄层石蜡可牢固地粘附在鱼线一端的表面,其直径为0.26mm。
就这样,普通的鱼线即可变成规相一致头端光滑圆钝的栓线。
2.在鱼线18mm的位置用涂改液标记一个白色点。
TTC的配制:用0.2mol/L磷酸缓冲液(PBS)配成2%TTC溶液(pH7.5),避光保存体重与栓线直径:线栓直径0.24mm采用的SD大鼠,体重250-300g。
实验方法:动物用10%水合氯醛(35mg/kg)腹腔注射麻醉。
仰卧位固定,颈正中线切口,沿胸锁乳突肌内缘分离肌肉和筋膜,分离左侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA),在CCA远心端和近心端与ECA处挂线备用。
用微动脉夹暂时夹闭ICA,然后近心端结扎CCA、ECA。
然后在距CCA分叉部4mm处剪一小口,将拴线插入到ICA,这时用绕在CCA远心端的细线轻轻系牢拴线。
(不可过紧,否则进线困难,但松了又会出血。
)用眼科镊轻推拴线,从血管分叉处开始算距离,当插入深度在18 mm时(一定要将血管放松至原来状态, 且保证标记点在分叉处,由于标记的是白色的所以很容易看的),紧紧系牢CCA远心端的细线,此时的关键是动作轻柔,不要使ICA有任何的牵拉,否则栓线会脱出ACA,可能会造成缺血失败。
大鼠线栓(MCAO)模型+灌注取脑+TTC染色
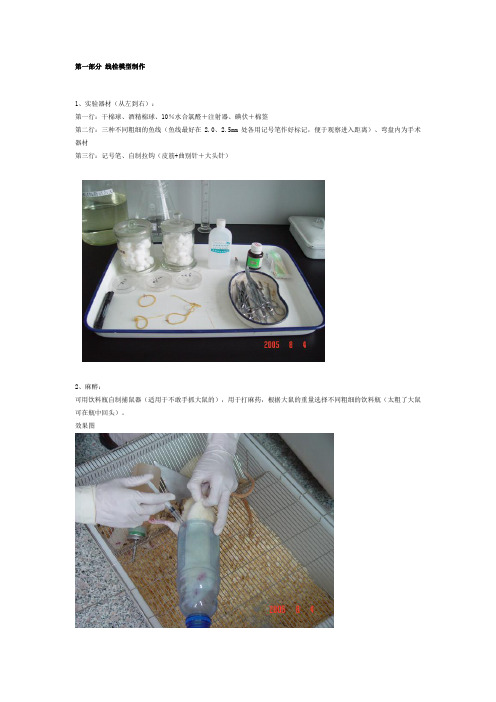
第一部分 线栓模型制作1、实验器材(从左到右):第一行:干棉球、酒精棉球、10%水合氯醛+注射器、碘伏+棉签第二行:三种不同粗细的鱼线(鱼线最好在2.0、2.5mm处各用记号笔作好标记,便于观察进入距离)、弯盘内为手术器材第三行:记号笔、自制拉钩(皮筋+曲别针+大头针)2、麻醉:可用饮料瓶自制捕鼠器(适用于不敢手抓大鼠的),用于打麻药,根据大鼠的重量选择不同粗细的饮料瓶(太粗了大鼠可在瓶中回头)。
效果图3、麻倒后绑在手术台上。
4、剪去颈前的鼠毛,碘伏消毒。
5、沿经部正中切开皮肤。
说明:切开皮肤前最好将结扎动脉的线事先剪好(后面会用到)。
6、钝性分离皮下组织。
如图:大鼠腹侧可见事先剪好的结扎线。
7、分离到气管前肌后,沿右侧胸锁乳突肌腱向下分离,见到颈动脉鞘后可上拉钩。
8、分离动脉鞘。
如图:分离好后见光滑的颈总动脉。
9、分离出颈总、颈外、颈内动脉,结扎颈总、颈外动脉,注意中间那根线不要系紧,用来插鱼线时防止出血的。
10、夹闭颈内动脉,用眼科剪将颈总动脉剪一小口。
11、插入鱼线,鱼线进入颈内动脉后按图中注释方法插(成功率在90%以上)。
说明:(1)这一步鱼线选择是关键,根据大鼠重量(作的多了后根据动脉粗细就可选择了)选鱼线。
我们的经验是:250g以下的选0.26mm的线,250-300g的选0.26mm蘸腊的或0.28的都可以。
(2)如果遇到鱼线怎么也查不进去的情况,可让大鼠休息一会,换细点的鱼线再试,这种情况不一定都是进到翼腭动脉了,我曾解剖过4例这种情况的大鼠,有三例都是在如颅的地方卡住了,可惜我们手里没有0.24mm的鱼线。
(3)通过实践,我们认为结扎或夹闭翼腭动脉没有必要,按我们的方法,熟练的话,从切开到缝合完毕也就是15分钟,算上准备工作(如麻醉、消毒等)半小时也可以搞定了,这样一上午两人作10只大鼠不成问题。
(4)我们体会最好用蘸腊的鱼线作模型,好处是进线深度控制的好,不容易出现蛛网膜下腔出血。
大鼠线栓(MCAO)模型+灌注取脑+TTC染色

第一部分 线栓模型制作1、实验器材(从左到右):第一行:干棉球、酒精棉球、10%水合氯醛+注射器、碘伏+棉签第二行:三种不同粗细的鱼线(鱼线最好在2.0、2.5mm处各用记号笔作好标记,便于观察进入距离)、弯盘内为手术器材第三行:记号笔、自制拉钩(皮筋+曲别针+大头针)2、麻醉:可用饮料瓶自制捕鼠器(适用于不敢手抓大鼠的),用于打麻药,根据大鼠的重量选择不同粗细的饮料瓶(太粗了大鼠可在瓶中回头)。
效果图3、麻倒后绑在手术台上。
4、剪去颈前的鼠毛,碘伏消毒。
5、沿经部正中切开皮肤。
说明:切开皮肤前最好将结扎动脉的线事先剪好(后面会用到)。
6、钝性分离皮下组织。
如图:大鼠腹侧可见事先剪好的结扎线。
7、分离到气管前肌后,沿右侧胸锁乳突肌腱向下分离,见到颈动脉鞘后可上拉钩。
8、分离动脉鞘。
如图:分离好后见光滑的颈总动脉。
9、分离出颈总、颈外、颈内动脉,结扎颈总、颈外动脉,注意中间那根线不要系紧,用来插鱼线时防止出血的。
10、夹闭颈内动脉,用眼科剪将颈总动脉剪一小口。
11、插入鱼线,鱼线进入颈内动脉后按图中注释方法插(成功率在90%以上)。
说明:(1)这一步鱼线选择是关键,根据大鼠重量(作的多了后根据动脉粗细就可选择了)选鱼线。
我们的经验是:250g以下的选0.26mm的线,250-300g的选0.26mm蘸腊的或0.28的都可以。
(2)如果遇到鱼线怎么也查不进去的情况,可让大鼠休息一会,换细点的鱼线再试,这种情况不一定都是进到翼腭动脉了,我曾解剖过4例这种情况的大鼠,有三例都是在如颅的地方卡住了,可惜我们手里没有0.24mm的鱼线。
(3)通过实践,我们认为结扎或夹闭翼腭动脉没有必要,按我们的方法,熟练的话,从切开到缝合完毕也就是15分钟,算上准备工作(如麻醉、消毒等)半小时也可以搞定了,这样一上午两人作10只大鼠不成问题。
(4)我们体会最好用蘸腊的鱼线作模型,好处是进线深度控制的好,不容易出现蛛网膜下腔出血。
全脑缺血再灌注动物模型建立方法

全脑缺血再灌注动物模型建立方法引言全脑缺血再灌注是一种临床上常见的危重症,常见于心脏骤停、溺水等情况下,出现全脑缺血缺氧,随后通过复苏措施进行再灌注。
建立全脑缺血再灌注动物模型对于深入研究相关疾病的发病机制,评估治疗方法具有重要意义。
本文将介绍一种常用的全脑缺血再灌注动物模型的建立方法。
动物模型选择建立全脑缺血再灌注模型时,主要选择小鼠或大鼠作为实验动物。
一般情况下,小鼠更为常用,因其易于操作、成本较低,且其脑血管结构与人类相似,因此具有较高的可比性。
对于大鼠,其相对较大的体积能够更好地模拟人体情况,但操作相对较为复杂。
手术操作准备在进行全脑缺血再灌注动物模型的建立前,需要进行手术操作的准备工作。
首先需要进行动物的麻醉和固定,确保手术操作的安全性。
其次需要准备全脑缺血再灌注模型所需的仪器和设备,包括导管、监测仪器等。
在手术操作前,还需要对实验动物进行术前处理,包括禁食、定时给予抗生素等。
手术操作步骤1. 麻醉和固定:将实验动物置于麻醉箱内,使用合适的麻醉药物使其达到麻醉状态。
随后将其固定在手术台上,以确保手术操作的稳定性。
2. 手术部位暴露:在麻醉状态下,对实验动物进行皮肤消毒,随后进行手术部位的切开,暴露出颅骨表面。
3. 血管结扎:通过显微外科手术操作,对实验动物的颅骨表面的动脉和静脉进行结扎,以模拟全脑缺血的状态。
4. 缺血时间控制:根据实验设计的需要,控制全脑缺血的时间,一般为15至20分钟。
5. 再灌注:在全脑缺血一定时间后,通过解开血管结扎,使血液重新灌注至大脑。
6. 术后处理:对实验动物进行术后处理,包括给予液体、保暖、饲养等。
检测指标和评价方法建立全脑缺血再灌注模型后,需要对实验动物进行一系列的检测和评价,以评估其神经功能恢复情况。
常用的评价指标包括神经行为学评分、脑组织病理学检测、神经元凋亡检测、脑组织炎症因子检测等。
通过对这些指标的检测和评价,可以全面地评估全脑缺血再灌注模型的建立效果,为后续的实验研究提供可靠的依据。
线栓法制作大鼠局灶性脑缺血再灌注模型的研究及体会

Re s e a r c h a n d Ex p e r i e n c e o n Ma k i n g Ra t Mo d e l o f Mi d d l e Ce r e br a l Ar t e r y Oc c l u s i o n / Re p e r f u s i o n b y t h e Th r e a d Oc c l u s i o n Me t h o d Zh a n g
( 5) : 1 2—1 4 ( 收稿 日期 : 2 0 1 3— 0 8—2 0 ) ( 修 回 日期 : 2 0 1 3— 0 9—0 3 )
9
冯 天艳 ,方 荣 , 邓 改 改 ,等 .根 皮 苷 对 小 鼠 C C 1 急 性 肝 损 伤 的保 护作 用 [ J ] .中 药药 理 临床 , 2 0 1 0 , 2 6 ( 5 ) : 4 7— 4 9
鼠随机分为两组 , 组1 体重控 制为 2 3 0~ 2 4 9 g ; 组2 体 重控制为 2 5 0一 , 2 6 9 g , 每组 1 0只 。 以 改 良的 L o n g a 法 使 用 特 定 型 号 栓 线 制 作
大 鼠大 脑 中动 脉 闭 塞 模 型 , 缺血 2 h后 拔 出线 栓 实 现 再 灌 注 , 并 评 估 两组 大 鼠 的 神 经 功 能 缺 损 情 况 , 再 灌注 2 4 h时取 脑行 2 , 3 , 5一 氯 化 三 苯 基 四氮 唑 染 色 , 计 算 并 比较 两 组 大 鼠的 死 亡 率 , 神经功能评分和相对脑梗 死体积。结果 两 组 大 鼠的 死 亡 率 均 为 1 0 %,
5 9 7
1 1 曹 丹 ,薛 冰 洁 ,黄 文 峰 ,等 .湖北 海 棠 总 黄 酮 对 去 势 大 鼠骨 质 疏 松的影响 [ J ] .中药 药 理 与 临 床 , 2 0 1 1 , 2 7 ( 5 ) : 5 6—5 北 海 棠 总 黄 酮 对 成 骨 细 胞 增 殖 分
线栓法大鼠脑缺血再灌注模型的制备

线栓法制备大鼠脑缺血再灌注模型的方法研究马贤德1孙宏伟1 柴纪严1 赵金茹1(1 辽宁中医药大学,辽宁沈阳 110032;)摘要①目的建立一种比较系统,操作简单,成功率高的大鼠大脑中动脉缺血(MCAO)再灌注动物模型,达到只要读者根据本文所述的方法操作就能制作出MCAO再灌注模型的目的。
②方法成年健康雄性 SD大鼠40只,参照Longa法并适当改进建立MCAO模型20只,假手术组20只。
本文将详细叙述手术过程以及再灌注时间点的合理选择。
最后利用行为学测试、四氮唑(TTC)染色对模型成功与否进行判定。
③结论线栓法是一种操作简单的制备MCAO 再灌注动物模型的方法,并且此方法的再灌注效果较为明显。
关键词动物模型;脑缺血;再灌注;线栓法Establishment a model of rat ischemia-reperfusion injury with intraluminal sutureMa Xian-de1 Sun Hong-wei1 Chai Ji-yan1 Zhao Jin-ru1(1.Liaoning University of Chinese Traditional Medicine, Shenyang, 110032) Abstract: Objective To establish a model of rat ischemia-reperfusion injury, in terms of the model, the operation will be simple, and the achievement ratio will be high. Methods: 40 Male Sprague-Dawley ( SD ) rats were separated into two groups randomly: 20 were model of rat ischemia-reperfusion injury based on Longa method, and the other 20 were sham-operated group. The process of the operation and the selection of different time point following ischemic-reperfusion were discussed in the paper. What’s more , the model was appraised by behavioral test and Triphenyl Tetrazolium Choloride(TTC)Staining. Conclusion: The operation of intraluminal suture method is very simple for the establishment of model of rat ischemia-reperfusion, what’s more, the effect of reperfusion is very obvious.Key words: Animal Model, ischemia, reperfusion, intraluminal suture脑缺血再灌注动物模型是研究缺血性脑血管病的一条重要途径,因为脑缺血再灌注动物模型具有很好的重复性并能最大程度模拟人类缺血性卒中的发生。
线栓法制作大鼠局灶性脑缺血再灌注损伤模型的实验研究

c e a rf ru in ijr d lwih itau n s t r t o n r t. eh d : it rrt r iie a d m l h mi—eef so nu y mo e t n r lmi u u emeh d i as M t o s W sa a sweed vd d r n o y
ig wihe es is r tt edsa n fC o n r lmi u u e Bya j sigt es t r r ie t n t v i n n t y cs o sa h itle d o CA fritau ns t r . du tn h u u ea cdr ci Oa ode - o
线 栓 法 制 作 大 鼠 局 灶 性 脑 缺 血 再 灌 注 损 伤 模 型 的 实 验 研 究
刘 郁 , 瑞 珍 刘
( 西 医科 大 学 第二 医 院 , 山 山西 太 原 000) 3 0 1
摘 要 目的 : 过 对 线 栓 法 制 作 的 大 鼠局 灶 性 脑 缺 血 再 灌 注 模 型 的 实 验 研 究 , 讨 一 种 简 便 稳 定 的模 型 制 作 方 通 探 法 。方 法 : 用 健 康 雄 性 W i a 大 鼠随 机 分 为 假 手 术 组 ( 采 sr t 一6 和 缺 血 再 灌 注 组 ( 一 1 )其 中缺 血 再 灌 注 组 结 扎 苯 基 四 氮 唑 ( TC) 色观 察 脑 梗 死 体 积 ; 2 3 5氯 T 染 HE染 色 观 察 大 鼠脑 组织 的病 理 改 变 。结 果 : 后 大 鼠 术 神经功能缺损明显 ,C T C染 色示 脑 梗 死 区 , 染 色结 果 符 合 脑 梗 死 病 理 过 程 。 论 : 方 法 术 式 简 便 , 术 时 间 短 , HE 结 该 手 缺 血 效 果 可靠 , 一 种 理 想 的 制 作 大 鼠局 灶 性 脑 缺 血 再 灌 注 损 伤 模 型 的 方 法 。 是
脑缺血模型讲义0505
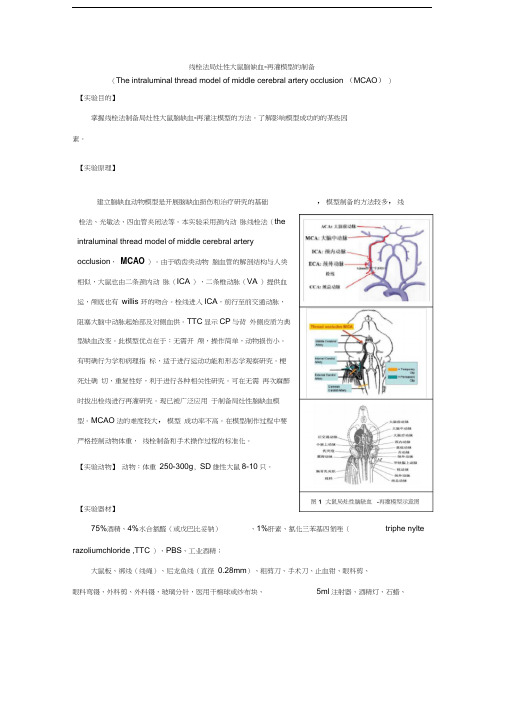
线栓法局灶性大鼠脑缺血-再灌模型的制备(The intraluminal thread model of middle cerebral artery occlusion (MCAO))【实验目的】掌握线栓法制备局灶性大鼠脑缺血-再灌注模型的方法。
了解影响模型成功的的某些因素。
【实验原理】建立脑缺血动物模型是开展脑缺血损伤和治疗研究的基础,模型制备的方法较多,线栓法、光敏法、四血管夹闭法等。
本实验采用颈内动脉线栓法(theintraluminal thread model of middle cerebral arteryocclusion,MCAO )。
由于啮齿类动物脑血管的解剖结构与人类相似,大鼠也由二条颈内动脉(ICA ),二条椎动脉(VA )提供血运,颅底也有willis 环的吻合。
栓线进入ICA,前行至前交通动脉,阻塞大脑中动脉起始部及对侧血供。
TTC显示CP与背外侧皮质为典型缺血改变。
此模型优点在于:无需开颅,操作简单,动物损伤小。
有明确行为学和病理指标,适于进行运动功能和形态学观察研究。
梗死灶确切,重复性好,利于进行各种相关性研究。
可在无需再次麻醉时拔出栓线进行再灌研究。
现已被广泛应用于制备局灶性脑缺血模型。
MCAO法的难度较大,模型成功率不高。
在模型制作过程中要严格控制动物体重,线栓制备和手术操作过程的标准化。
【实验动物】动物:体重250-300g, SD雄性大鼠8-10只。
【实验器材】75%酒精、4%水合氯醛(或戊巴比妥钠)、1%肝素、氯化三苯基四氮唑(triphe nylte razoliumchloride ,TTC )、PBS、工业酒精;大鼠板、绑线(线绳)、尼龙鱼线(直径0.28mm)、粗剪刀、手术刀、止血钳、眼科剪、眼科弯镊、外科剪、外科镊,玻璃分针,医用干棉球或纱布块、5ml注射器、酒精灯、石蜡、烧杯、平皿、毛细滴管、剃须刀片、角针、弯盘、自制拉钩、乳胶手套、劳动手套及长皮手套。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
万方数据
万方数据
万方数据
线栓法大鼠脑缺血再灌注模型改良与评价
作者:吴远华, 朱广旗, 胡蓉, 仲秀艳, 苏红梅, 欧阳泠星, 吴帮启, 舒遵华, 王强
作者单位:吴远华,朱广旗,胡蓉,仲秀艳(贵阳中医学院第一附属医院神经内科,贵阳,550002), 苏红梅(山东临沂市人民医院中医科,临沂,276000), 欧阳泠星(广东清远市人民医院中医科,清远
,511500), 吴帮启(天津中医药大学第一附属医院针灸科,天津,300193), 舒遵华(长春中
医药大学附属医院,长春,130021), 王强(湖北襄樊市中医院,襄樊,441000)
刊名:
中国实用神经疾病杂志
英文刊名:CHINESE JOURNAL OF PRACTICAL NERVOUS DISEASES
年,卷(期):2010,13(18)
1.Garcia JH A reliable method to occlusion a middle cerebral artery in wistar rats 1993(09)
2.Zea Longa E;Weinsten PR;Carlson S Reversible middle cerebral artery occlusion without craniectomy in rats 1989
3.Koizu mi J;Yoshida Y;Nakazawa T Experimental studies of ischemic brain edema:A new experimental model of cerebral embolis m in rats in which recirculation can be induced in the ische mic area[外文期刊] 1986
4.刘亢丁实验性局灶性脑缺皿再灌注动物模型的改进及评价 1997(02)
5.关云谦;孙明;徐超大鼠颈内动脉线栓法制备局灶性脑缺血模型及影响因素[期刊论文]-国外医学(脑血管疾病分册) 2001(03)
6.Belayev L;Alonso OF;Busto R Middle cerebral artery occlusion in the rat by intraluminal
suture.Neurological and pathological evaluation of an improved model 1996(09)
7.Memezawa H;Minamisawa H;Smith ML Ischemic penumbra in a model of reversible middle cerebral artery occlusion in the rat 1992(01)
8.李小凤;孙圣刚;童萼塘大鼠可逆性局灶性脑缺血模型复制方法的改进[期刊论文]-华中医学杂志 2000(04)
9.何学令插线法制作大鼠局灶性脑缺血再灌流模型方法的改进[期刊论文]-四川动物 2003(03)
10.王春霞;刘春风;包仕尧大鼠局灶脑缺血再灌注模型改良后的实验研究[期刊论文]-苏州医学院学报 1999(02)
11.Holland JP;Sydserff SGC;Taylor WAS Rat models of middle cerebral artery ischemia 1993(09)
本文链接:/Periodical_hnsysjjbzz201018002.aspx。
