实验四 金属电化学腐蚀极化曲线
极化曲线 标准

极化曲线标准极化曲线是电化学分析中常用的一种曲线,它反映了电极电位与电流之间的关系。
在不同的电化学测试中,极化曲线的获取和分析方法可能会有所不同,但它们的基本原理和标准是相似的。
以下是关于极化曲线的获取、分析和应用的一些基本标准和原则。
一、极化曲线的获取1. 测量方法:极化曲线通常通过控制电流法或控制电位法来获取。
在控制电流法中,电流保持恒定,而电位随时间变化;在控制电位法中,电位保持恒定,而电流随时间变化。
2. 实验设备:进行极化曲线测量时,需要使用电化学测试系统,包括电极(工作电极、参比电极和辅助电极)、电解池、电流源和电位测量装置。
3. 测试条件:测试条件应保持一致,包括电解质的种类和浓度、温度、搅拌速度等。
这些因素都会影响极化曲线的形状和特征。
二、极化曲线的分析1. 曲线形状:极化曲线通常分为三个区域:活性溶解区、钝化区和过钝化区。
活性溶解区表现为电流随电位增加而线性增加;钝化区电流随电位增加而减少,表明电极表面形成了一层稳定的氧化物膜;过钝化区电流再次增加,表明氧化物膜被破坏。
2. 腐蚀速率:通过极化曲线可以估算金属的腐蚀速率。
在活性溶解区,腐蚀速率可以通过斜率(电流密度/电位)来计算。
3. 钝化行为:钝化区的出现和形态可以用来评估金属的钝化能力,即金属抵抗腐蚀的能力。
三、极化曲线的应用1. 腐蚀研究:极化曲线是研究金属腐蚀行为的重要工具,通过分析极化曲线可以了解金属在不同环境条件下的腐蚀特性。
2. 防腐设计:极化曲线的分析结果可以用于指导金属结构的防腐设计,选择合适的材料和涂层。
3. 电化学测试:极化曲线是电化学测试中的一种基本曲线,它可以用于评估电镀、电池、燃料电池等电化学系统的性能。
四、结论极化曲线是电化学分析中的一种重要工具,它通过反映电极电位与电流之间的关系,提供了关于金属腐蚀行为和电化学系统性能的详细信息。
通过标准的测量方法和分析技术,可以获得准确的极化曲线,为腐蚀研究和电化学应用提供重要的数据支持。
极化曲线-实验报告

上述两种方法都已经获得了广泛应用,尤其是动态法,由于可以自动测绘,扫描速度可控制一定,因而测量结果重现性好,特别适用于对比实验。
(2)恒电流法
恒电流法就是控制研究电极上的电流密度依次恒定在不同的数值下,同时测定相应的稳定电极电势值。采用恒电流法测定极化曲线时,由于种种原因,给定电流后,电极电势往往不能立即达到稳态,不同的体系,电势趋于稳态所需要的时间也不相同,因此在实际测量时一般电势接近稳定(如1min~3min内无大的变化)即可读值,或人为自行规定每次电流恒定的时间。
(1)恒电位法
恒电位法就是将研究电极依次恒定在不同的数值上,然后测量对应于各电位下的电流。极化曲线的测量应尽可能接近体系稳态。稳态体系指被研究体系的极化电流、电极电势、电极表面状态等基本上不随时间而改变。在实际测量中,常用的控制电位测量方法有以下两种:
静态法:将电极电势恒定在某一数值,测定相应的稳定电流值,如此逐点地测量一系列各个电极电势下的稳定电流值,以获得完整的极化曲线。对某些体系,达到稳态可能需要很长时间,为节省时间,提高测量重现性,往往人们自行规定每次电势恒定的时间。
7.实验完成,“电位测量选择”置于“参比”,“工作电源”置于“关”。
四、实验结果及数据分析
图12205双相不锈钢在0.4mol/L HCl溶液中极化曲线
图22205双相不锈钢在3.5%NaCl溶液中极化曲线
经过拟合可以得出2205双相不锈钢在3.5%NaCl中自腐蚀电位为-0.397V、自腐蚀电流为1.3517E-06A/cm2;在0.4mol/L盐酸中自腐蚀电位为-0.38836V
2.通电
插上电源,“工作电源”置于“自然”档,指示灯亮,电流显示为0,电位表显示的电位为“研究电极”相对于“参比电极”的稳定电位,称为自腐电位,其绝对值大于0.8V可以开始下面的操作,否则需要重新处理电极。
章腐蚀金属电极的极化

Ia1 =Icorr1
exp( Eg -Ecorr1 βa1
)
IL
exp(
Eg
Ecorr1 βa1
)
ΔE=Eg -Ecorr1
βa1
ln(1+
A2 A1
)
在A2/A1>>1时,ΔE=Eg
E corr1
βa1
ln
A2 A1
在A2/A11时,例如Ml是基体金属,M2是阴极性杂质,则
ΔE=Eg
-Ecorr1
(2) 不断测定一个电极反应产物的量或反应物的量,得 到产物的增加速度或反应物的消耗速度,由法拉第定 律计算这个电极反应的电流密度,得到这个电极反应 的E-I曲线。
不断分析溶液中金属离子量得到金属阳极溶解反应的 真实E-I线。
在环电极上捕捉腐蚀时一个电极反应的产物,以腐蚀 金属作盘电极,就可同时测定表观极化曲线和一个电 极反应的真实E-I曲线。
若电极上有n个电极反应,每个电极反应的电流 密度与电位的关系为
I1=1(E),I2=2(E),…,In=n(E) 则在电极电位为E时,整个电极的外测电流密度 I为I=I1+I2+…+In=1(E)+2(E)+…+n(E)=(E) 如果已知各个电极反应的E-I关系,就可以得到 整个电极的外测电流密度I与电极电位E的关系, 得到整个电极的极化曲线。
当f=0.5时,1/(1-f)f最小;f越偏离0.5,即Al
和A2相差越大,1/(1-f)f就越大,即
(
ln I A2
a1
)和 A
( ln g ) 越大。
A2 A
如果M2是M1表面上的阴极性杂质,Ml越纯,微 量杂质M2加速M1腐蚀的效应越大。例如:若 A1≈A,A2=A×10-3,则
极化曲线与材料的耐腐蚀性能的研究一、实验目的1、掌握用恒电位仪

极化曲线与材料的耐腐蚀性能的研究一、实验目的1、掌握用恒电位仪测定极化曲线的方法。
2、测定几种不同材料的阳极极化曲线,分析其耐腐蚀性能及原理。
二、实验原理当电极上无电流通过时,电极处于平衡状态,与之相对应的电位称为平衡电位。
电极上有电流通过以后平衡状态遭到破坏,电极电位偏离原来平衡电位值的现象称为极化。
阳极极化时电位往正方向移动;阴极极化时电位往负方向移动,描述电流(或电流密度)与电位间变化关系的曲线称为极化曲线。
广义的讲,控制研究电极电流为一定值测得的电位-时间曲线;或控制电位为一定值测得的电流-时间曲线都称为极化曲线。
电极极化既可以直接通过腐蚀电池电流也可以用外加的电流来进行。
极化曲线的测定通常有恒电流和恒电位两种方法,前者是以电流为自变量,测定的电位为电流的函数关系,即E=f(i);后者是以电位为自变量,测定的电流为电位的函数关系,即i=f(E)。
恒电流法简单、易于掌握,但对电流、电位间呈多值函数的情况不适用,不能测出钝化区和从活化区向钝化区的转变过程。
恒电位法在实际测定极化曲线时又可分为电位台阶法和电位扫描法两种。
本实验用电位扫描法测定纯铁、及两种不同型号的不锈钢在1N H2S04溶液中的极化曲线,并通过比较它们的阳极极化曲线来分析其耐腐蚀性能。
三、实验方法阅读恒电位仪使用说明,了解仪器使用方法,按图1.1接好线路。
各种样品先用砂纸仔细打磨,去除表面的氧化皮,洗净,并用棉花沾酒精擦净,干燥,放人溶液中静置l0~l5分钟后测定稳定电位。
然后把样品做阴极,在10mA/cm2电流密度下阴极极化处理10分钟。
测定极化曲线时,电位从-600mV开始,从负电位区往正电位区进行测定,电位测至1600mV为止。
记录相应的阳极极化曲线。
四、思考题1、研究电极的面积多大最好?为什么?2、鲁金毛细管尖咀应放在什么位置?为什么?3、研究测试中为什么要用辅助电极?4、不锈钢试样耐腐蚀的原因?五、实验报告要求1、叙述实验目的、原理及实验过程;2、分析三种材料的阳极极化曲线,讨论并比较它们的耐腐蚀性能。
金属电极的极化曲线

金属电极的极化曲线是描述金属电极在电化学反应过程中电势与电流之间关系的曲线。
它通常是通过进行极化实验来获取的,其中对电极施加一定的电位或电流,并测量相应的电流或电势响应。
极化曲线通常具有三个主要区域:
1. 阳极极化区:在该区域内,电极表面发生氧化反应,即金属电极溶解或氧化。
在该区域,电流随电位的增加而增加,形成一个斜上升的曲线。
2. 反极化区:在该区域内,电极表面的氧化反应逐渐减弱或停止,电流开始饱和。
在该区域,电流变化缓慢,形成一个相对平缓的曲线。
3. 阴极极化区:在该区域内,电极表面发生还原反应,即金属电极得到电子或还原。
在该区域,电流随电位的增加而减小,形成一个斜下降的曲线。
极化曲线的形状和特征取决于金属电极的特性、电解质溶液的成分和浓度,以及外部施加的电位或电流。
通过分析极化曲线,可以获得有关电极的电化学反应、电化学反应动力学以及电极的电化学性能的信息。
这对于研究腐蚀、电镀、电池等电化学过程具有重要意义。
极化曲线

1mol/LHCl:电动扫描范围为-0.3V-0.5V(相对于开路电位),扫描速率为5mV/s。
1mol/L HCl+1%六亚甲基四胺:电动扫描范围为-0.3V-0.7V(相对于开路电位),扫描速率为5mV/s。
不锈钢在盐酸及含缓蚀剂盐酸中的极化结果对比:
不锈钢电极在1mol/L硫酸中极化
实验条件:参比电极为铂电极,辅助电极为饱和甘汞电极,电动扫描范围:-1.0V-1.5V(相对于参比电极),扫描速率为5mV/s,电极面积假定为 。
由CorrTest电化学测试软件经过Tafel拟合可以得出:
由极ቤተ መጻሕፍቲ ባይዱ曲线可以得出:
所以腐蚀速率为:
不锈钢电极在1mol/LHCl中极化
电解液
1mol/LHCl
1mol/L HCl+1%六亚甲基四胺
/
0.00033081
2.6708E-5
/V
-0.4311
-0.41926
v/
3.46
2.79E-5
缓蚀率
——
0.919
其中:
(完整版)电化学曲线极化曲线阻抗谱分析
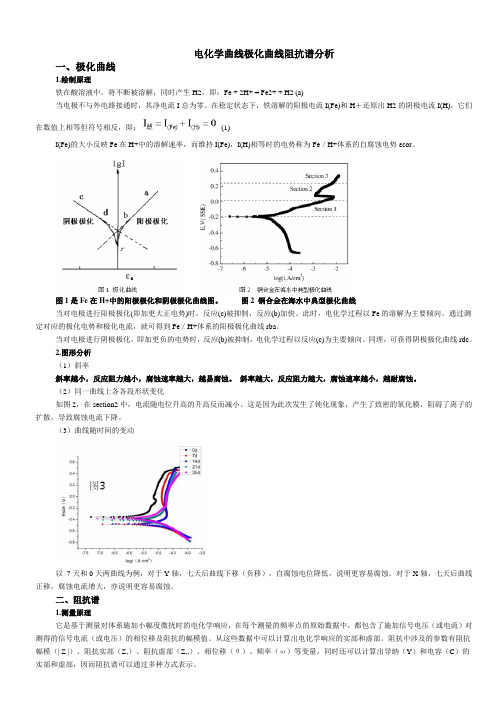
电化学曲线极化曲线阻抗谱分析一、极化曲线1.绘制原理铁在酸溶液中,将不断被溶解,同时产生H2,即:Fe + 2H+ = Fe2+ + H2 (a)当电极不与外电路接通时,其净电流I总为零。
在稳定状态下,铁溶解的阳极电流I(Fe)和H+还原出H2的阴极电流I(H),它们在数值上相等但符号相反,即:(1)I(Fe)的大小反映Fe在H+中的溶解速率,而维持I(Fe),I(H)相等时的电势称为Fe/H+体系的自腐蚀电势εcor。
图1是Fe在H+中的阳极极化和阴极极化曲线图。
图2 铜合金在海水中典型极化曲线当对电极进行阳极极化(即加更大正电势)时,反应(c)被抑制,反应(b)加快。
此时,电化学过程以Fe的溶解为主要倾向。
通过测定对应的极化电势和极化电流,就可得到Fe/H+体系的阳极极化曲线rba。
当对电极进行阴极极化,即加更负的电势时,反应(b)被抑制,电化学过程以反应(c)为主要倾向。
同理,可获得阴极极化曲线rdc。
2.图形分析(1)斜率斜率越小,反应阻力越小,腐蚀速率越大,越易腐蚀。
斜率越大,反应阻力越大,腐蚀速率越小,越耐腐蚀。
(2)同一曲线上各各段形状变化如图2,在section2中,电流随电位升高的升高反而减小。
这是因为此次发生了钝化现象,产生了致密的氧化膜,阻碍了离子的扩散,导致腐蚀电流下降。
(3)曲线随时间的变动以7天和0天两曲线为例,对于Y轴,七天后曲线下移(负移),自腐蚀电位降低,说明更容易腐蚀。
对于X轴,七天后曲线正移,腐蚀电流增大,亦说明更容易腐蚀。
二、阻抗谱1.测量原理它是基于测量对体系施加小幅度微扰时的电化学响应,在每个测量的频率点的原始数据中,都包含了施加信号电压(或电流)对测得的信号电流(或电压)的相位移及阻抗的幅模值。
从这些数据中可以计算出电化学响应的实部和虚部。
阻抗中涉及的参数有阻抗幅模(| Z |)、阻抗实部(Z,)、阻抗虚部(Z,,)、相位移(θ)、频率(ω)等变量,同时还可以计算出导纳(Y)和电容(C)的实部和虚部,因而阻抗谱可以通过多种方式表示。
极化曲线腐蚀电流与腐蚀电位

极化曲线腐蚀电流与腐蚀电位介绍极化曲线是研究腐蚀电流与腐蚀电位之间关系的重要工具。
本文将从极化曲线的定义、测量方法以及与腐蚀电流、腐蚀电位的关系等方面进行详细探讨。
一、极化曲线的定义极化曲线是指在某一刺激作用下,随着刺激量的变化,所得到的反应物性质与刺激量间的关系曲线。
在腐蚀研究中,极化曲线描述的是电流与电位之间的关系。
二、极化曲线的测量方法1. 三电极系统为了测量极化曲线,通常使用一个工作电极、一个参比电极和一个对电极组成的三电极系统。
工作电极是被测样品,参比电极提供参比电位,对电极则是为了维持电路的稳定性。
2. 实验条件在测量极化曲线时,需要控制一些实验条件,比如溶液的组成、温度、电极表面的状态等。
这些条件的变化会对极化曲线产生影响,所以在测量过程中要保持这些条件的稳定性。
3. 电位扫描在测量极化曲线时,常用的方法是通过改变工作电极的电位来扫描整个电位范围。
通过记录工作电极的电流响应,可以得到不同电位下的腐蚀电流。
三、极化曲线与腐蚀电流的关系极化曲线中的腐蚀电流对应着电位上的表面腐蚀速率。
当电位越正时,腐蚀电流也越大,表示腐蚀速率增加。
而当电位越负时,腐蚀电流较小,腐蚀速率减小。
1. 极化曲线的形状极化曲线的形状可以反映出腐蚀行为的特点。
常见的极化曲线形状有Tafel曲线、线性极化曲线和非线性极化曲线等。
2. 极化曲线的参数极化曲线可以通过一些参数来描述。
常见的参数有Tafel斜率、交流阻抗和腐蚀电位等。
这些参数可以用来研究腐蚀行为及其机制。
3. 极化曲线的应用极化曲线在腐蚀研究和工程实践中有着重要的应用。
通过分析极化曲线,可以评估材料的腐蚀性能、预测腐蚀速率以及设计腐蚀防护措施等。
四、腐蚀电位与腐蚀电流的关系腐蚀电位是触发腐蚀过程的电位,而腐蚀电流是腐蚀过程中产生的电流。
腐蚀电位与腐蚀电流之间有一定的关系。
1. 过电位理论过电位理论是解释腐蚀电位与腐蚀电流关系的一种理论模型。
根据该理论,腐蚀过程中的电位是由电化学反应的阻抗决定的,而腐蚀电流则是由电化学反应的速率决定的。
