高中化学选修三、第二章第二节习题(附答案).doc
新人教版高中化学选修3第二章分子的结构与性质课时练习附答案

15白磷结构式为正四面体在o2不足时燃烧则在每两个p原子之间嵌入一个氧原子此化合物的真实分子式为若此分子的分子结构中只含有单健且每个原子的最外层都满足8电子结构则该分子中含有的共价健的数目是
新人教版高中化学选修 3第二章分子的结构与性质课时练 习附答案
第一节《共价键》(1) 共价键的本质 1、下列说法正确的是() A、含有共价键的化合物一定是共价化合物 B、分子中只有共价键的化合物一定是共价化合物 C、由共价键形成的分子一定是共价化合物 D、只有非金属原子间才能形成共价键 2、下列有关σ键的说法错误的是() A、如果电子云图象是由两个s电子重叠形成的,即形成s--sσ键 B、s电子与p电子形成s--pσ键 C、p和p不能形成σ键 D、HCl分子里含有一个s--pσ键 3、下列过程中,共价健被破坏的是() A、碘升华 B、碘蒸气被木炭吸附 C、蔗糖溶于水 D、HCl气体溶于水 4、分子中所含的电子数与HF分子相等且只含有2个极性共价健的是() A.CO B.NO C.H2O D.CH4 ) 5、下列化合物电子式书写正确的是(
(word完整版)高中化学选修3物质结构与性质习题附答案

(word完整版)⾼中化学选修3物质结构与性质习题附答案《物质结构与性质》同步复习第1讲原⼦结构1题⾯(1)34.969是表⽰__________;(2)35.453是表⽰__________;(3)35是表⽰_______________;(4)35.485是表⽰__________;(5)24.23%是表⽰__________;答案:(1)34.969是表⽰同位素35Cl 的相对原⼦质量;(2)35.453是表⽰氯元素的相对原⼦质量;(3)35是表⽰35Cl 原⼦的质量数;(4)35.485是表⽰氯元素的近似相对原⼦质量;(5)24.23%是表⽰同位素37Cl 在⾃然界存在的氯元素中所占的原⼦个数百分⽐。
5题⾯已知A 、B 、C 、D 和E 5种分⼦所含原⼦数⽬依次为1、2、3、4和6,且都含有18个电⼦。
⼜知B 、C 和D 是由两种元素的原⼦组成。
请回答:(1)组成A 分⼦的原⼦的核外电⼦排布式是;(2)B 和C 的分⼦式分别是和;C 分⼦的⽴体结构呈型,该分⼦属于分⼦(填“极性”或“⾮极性”);(3)若向D 的稀溶液中加⼊少量⼆氧化锰,有⽆⾊⽓体⽣成。
则D 的分⼦式是,该反应的化学⽅程式为;(4)若将1mol E 在氧⽓中完全燃烧,只⽣成1mol CO 2和2molH 2O ,则E 的分⼦式是。
答案:(1)1s 22s 22p 63s 23p 6 (2)HCl H 2S V 极性(3)H 2O 2 2H 2O22H 2O+O 2↑(4)CH 4O1题⾯答案:①1s 22s 22p 63s 23p 5 ②3s 23p 5 ③3 ④ⅦA ⑤10 ⑥2s 22p 6 ⑦2 ⑧0 ⑨24 ⑩1s 22s 22p 63s 23p 63d 54s 1 ⑾4 2题⾯(1)砷原⼦的最外层电⼦排布式是4s 24p 3,在元素周期表中,砷元素位于_______周期族;最⾼价氧化物的化学式为,砷酸钠的化学式是。
2021年高中化学选修三第二章《烃》经典测试题(答案解析)(2)

一、选择题1.下列反应中属于取代反应的是A .CH 2=CH 2+Br 2→CH 2BrCH 2BrB .CH 4+Cl 2→CH 3Cl+HClC .CH 2=CH 2+H 2→CH 3CH 3D .CH 2=CH 2+HCl→CH 3CH 2Cl答案:B解析:A .该方程式表示乙烯与Br 2发生加成反应产生1,2-二溴乙烷,A 不符合题意; B .该方程式表示甲烷分子中的1个H 原子被Cl 2中的1个Cl 原子取代产生CH 3Cl ,同时产生HCl 分子,B 符合题意;C .该方程式表示乙烯与H 2发生加成反应产生乙烷,C 不符合题意;D .该方程式表示乙烯与HCl 发生加成反应产生氯乙烷,D 不符合题意;故合理选项是B 。
2.已知某种烯烃经臭氧氧化后,在Zn 存在下水解,可得到醛和酮。
如:32(1)O (2)Zn/H O −−−−→R 〞CHO+现有化学式为714C H 的某烯烃,它与2H 加成后生成2,3-二甲基戊烷,它经臭氧氧化后,在Zn 存在下水解得到乙醛和一种酮,据此推知该烯烃的结构简式为A .B .C .D .答案:C【分析】该烯烃为单烯烃,与氢气的加成产物2,3-二甲基戊烷的结构简式为;该烯烃经臭氧氧化后,在Zn 存在下水解得到乙醛和一种酮,说明该烯烃中含有R |3CH CH C R '-=-结构,进行分析;解析:A .该有机物与氢气发生加成反应,得到产物是,名称为2,4-二甲基戊烷,故A 不符合题意;B.该有机物与氢气加成的产物是,名称为3-甲基己烷,故B不符合题意;C.该有机物与氢气加成后的产物是,名称为2,3-二甲基戊烷,根据题中所给信息,经臭氧氧化,然后在Zn作用下生成的产物是CH3CHO和,故C符合题意;D.该有机物与氢气发生加成反应,得到,名称为2,3-二甲基戊烷,根据题中信息,经臭氧氧化,再在Zn的作用下得到和,不符合题中所说的乙醛和一种酮,故D不符合题意;答案为C。
2021-2022学年人教版高中化学选修三教学案:第二章 第二节 分子的立体构型 Word版含答案
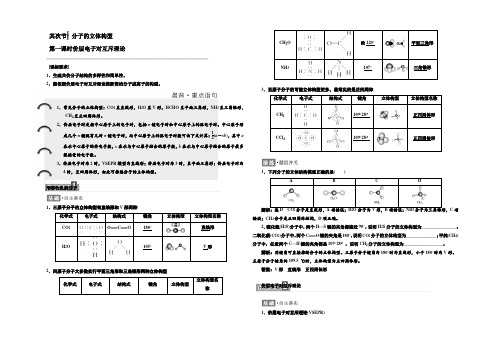
其次节⎪⎪分子的立体构型 第一课时价层电子对互斥理论————————————————————————————————————— [课标要求]1.生疏共价分子结构的多样性和简单性。
2.能依据价层电子对互斥理论推断简洁分子或离子的构型。
1.常见分子的立体构型:CO 2呈直线形,H 2O 呈V 形,HCHO 呈平面三角形,NH 3呈三角锥形,CH 4呈正四周体形。
2.价层电子对是指中心原子上的电子对,包括σ键电子对和中心原子上的孤电子对。
中心原子形成几个σ键就有几对σ键电子对,而中心原子上的孤电子对数可由下式计算:12(a -xb ),其中a表示中心原子的价电子数,x 表示与中心原子结合的原子数,b 表示与中心原子结合的原子最多能接受的电子数。
3.价层电子对为2时,VSEPR 模型为直线形;价层电子对为3时,呈平面三角形;价层电子对为4时,呈四周体形,由此可推想分子的立体构型。
形形色色的分子1.三原子分子的立体构型有直线形和V 形两种化学式 电子式结构式 键角 立体构型立体构型名称CO 2O===C===O180°直线形H 2O105°V 形2.四原子分子大多数实行平面三角形和三角锥形两种立体构型化学式电子式结构式键角立体构型立体构型名称CH 2O约120°平面三角形NH 3107°三角锥形3.五原子分子的可能立体构型更多,最常见的是正四周体化学式电子式结构式键角立体构型立体构型名称CH 4109°28′正四周体形CCl 4109°28′正四周体形1.下列分子的立体结构模型正确的是( )ABCD解析:选D CO 2分子是直线形,A 项错误;H 2O 分子为V 形,B 项错误;NH 3分子为三角锥形,C 项错误;CH 4分子是正四周体结构,D 项正确。
2.硫化氢(H 2S)分子中,两个H —S 键的夹角都接近90°,说明H 2S 分子的立体构型为________________;二氧化碳(CO 2)分子中,两个C===O 键的夹角是180°,说明CO 2分子的立体构型为______________;甲烷(CH 4)分子中,任意两个C —H 键的夹角都是109°28′,说明CH 4分子的立体构型为__________________。
化学选修3答案

化学选修3答案【篇一:高中化学选修三教材答案】习题参考答案1. (略)2. 氧原子最外层有6个电子,还差两个电子达到8e稳定结构,氢原子只有一个电子,差一-个电子达到2e稳定结构,所以一个氧原子只能与两个氢原子成键,氢气和氧气化合生成的分子为h2o。
4. 键能和键长都是对共价键稳定程度的描述,cl2、br2、i2的键能依次下降,键长依次增大,表明cl2、br22、i2分子中的共价键的牢固程度依次减弱。
6. -(注:此题的键长数据和热分解温度,需要通过查阅课外资料获得)第二节习题参考答案1.3. 甲醛分子的立体结构:4. 氢离子接受水分子中氧原子上的孤对电子以配位键形成h3o,电子对给予体是h2o,接受+体是h。
5. 银离子与氯离子形成难溶的氯化银沉淀。
加入氨水后,银离子接受氨分子中氮原子给出++的孤对电子以配位键形成[ag(nh3)2],由于生成了可溶性的[ag(nh3)2],继续加入氨水时氯化银就溶解了。
第三节习题参考答案1. 水是角形分子,氢氧键为极性键,所以水分子中正电荷的中心和负电荷的中心不重合,为极性分子。
而二氧化碳为直线形分子,虽然碳氧键为极性键,但分子的正电荷的中心和负电荷的中心重合,所以为非极性分子。
2. 低碳醇如甲醇或乙醇,其中的—oh与水分子的—oh相近,因而能与水互溶,而高碳醇的烃基较大,使其中的—oh与水分子的—oh的相似因素少多了,因而它们在水中的溶解度明显减小。
3. 水是极性分子,而汽油是非极性分子,根据“相似相溶”规则,汽油在水中的溶解度应很小。
4. (1)氢键不是化学键,而是较强的分子间作用力;(2)由于甲烷中的碳不是电负性很强的元素,故甲烷与水分子间一般不形成氢键;(3)乙醇与水分子间不但存在范德华力,也存在氢键;+(4)碘化氢的沸点比氯化氢高是由于碘化氢的相对分子质量大于氯化氢的,相对分子质量越大,范德华力越大,沸点越高。
5. 两张图表明气态氢化物的沸点一般是随相对分子质量增加而增大的,这是由于相对分子质量越大,范德华力越大,沸点越高。
(常考题)人教版高中化学选修三第二章《烃》测试题(含答案解析)

一、选择题1.(0分)[ID :140496]下列各组中的物质均能发生加成反应的是A .乙烯和乙醇B .苯和氯乙烯C .乙酸和溴乙烷D .丙烯和丙烷 2.(0分)[ID :140491]下列反应中属于取代反应的是A .CH 2=CH 2+Br 2→CH 2BrCH 2BrB .CH 4+Cl 2→CH 3Cl+HClC .CH 2=CH 2+H 2→CH 3CH 3D .CH 2=CH 2+HCl→CH 3CH 2Cl 3.(0分)[ID :140490]已知某种烯烃经臭氧氧化后,在Zn 存在下水解,可得到醛和酮。
如:32(1)O (2)Zn/H O −−−−→R 〞CHO+现有化学式为714C H 的某烯烃,它与2H 加成后生成2,3-二甲基戊烷,它经臭氧氧化后,在Zn 存在下水解得到乙醛和一种酮,据此推知该烯烃的结构简式为A .B .C .D .4.(0分)[ID :140488]下列排序正确的是A .酸性:HClO<H 2CO 3B .熔点:MgBr 2<CCl 4C .碱性:Ca(OH)2<Mg(OH)2D .沸点:正丁烷<异丁烷 5.(0分)[ID :140475]下列说法不正确的是A .乙烯可以发生加成反应,乙苯也可以B .苯和四氯化碳可以用酸性高锰酸钾溶液鉴别C .正丁烷与异丁烷的一氯取代物都只有两种,它们的沸点都相同D .石蜡在高温催化下反应能生成使酸性高锰酸钾溶液褪色的气体6.(0分)[ID :140470]下列关于有机物的说法正确的是A .苯和乙烯是两种重要的化工原料,都可用来衡量一个国家的石油化工发展水平B .糖类、油脂、蛋白质在一定条件下均能水解C .苯乙烯在一定条件下可聚合生成高分子化合物D .处于同一平面上的原子数最多为18个 7.(0分)[ID :140468]下列说法正确的是A .38C H 一定是烷烃,36C H 一定是烯烃B .苯和乙烯的所有原子均共平面,则苯乙烯()中所有原子也一定共平面C .苯的二氯代物,三氯代物均有三种结构D.乙烯和水的反应,淀粉和水的反应均属于水解反应8.(0分)[ID:140446]关于CH4和的叙述错误的是()A.均能用组成通式C n H2n+2来表示B.互为同系物C.它们都不能跟酸性高锰酸钾、强酸、强碱溶液发生反应D.通常情况下它们都是气态烷烃9.(0分)[ID:140438]使用下列装置及相应操作能达到实验目的的是(已知电石主要成分为CaC2 ,含CaS Ca3P2等杂质)A.用装置配制一定浓度的NaCl溶液B.用装置除去氯气中的HCl气体C.用装置观察铁的吸氧腐蚀D.用装置检验乙炔的还原性10.(0分)[ID:140426]2005年的诺贝尔化学奖颁给在烯烃复分解反应研究方面做出突出贡献的化学家。
高中化学选修三第二章第二节习题附复习资料

化学选修三第二章二节习题(附答案)1、下列反应过程中,同时有离子键,极性共价键和非极性共价键的断裂和形成的反应是( )A 、4=3↑+ ↑B 、322O =43C 、22=2OD 、22O 2+2 2=22322.下列分子或离子中,含有孤对电子的是 ( )A .H 2OB .4C .4D .4+3、σ键可由两个原子的s 轨道、一个原子的s 轨道和另一个原子的p 轨道以与一个原子的p 轨道和另一个原子的p 轨道以“头碰头”方式重叠而成。
则下列分子中的σ键是由一个原子的s 轨道和另一个原子的p 轨道以“头碰头”方式重叠构建而成的是 ( ) A .H 2224.有关乙炔分子中的化学键描述不正确的是 ( ) A .两个碳原子采用杂化方式 B .两个碳原子采用2杂化方式C .每个碳原子都有两个未杂化的2p 轨道形成π键D .两个碳原子形成两个π键5.在乙烯分子中有5个σ键、一个π键,它们分别是 ( ) A .2杂化轨道形成σ键、未杂化的2p 轨道形成π键 B .2杂化轨道形成π键、未杂化的2p 轨道形成σ键C .之间是2形成的σ键,之间未参加杂化的2p 轨道形成的是π键D.之间是2形成的σ键,之间是未参加杂化的2p轨道形成的π键6、已知2+的4s轨道和4p轨道可以形成3型杂化轨道,则[4]2-的空间构型为()A、直线形式上B、平面正方形C、正四面体形D、正八面体形7.有关苯分子中的化学键描述正确的是()A.每个碳原子的2杂化轨道中的其中一个形成大π键B.每个碳原子的未参加杂化的2p轨道形成大π键C.碳原子的三个2杂化轨道与其它形成三个σ键D.碳原子的未参加杂化的2p轨道与其它形成σ键8.三氯化磷分子的空间构型是三角锥形而不是平面正三角形,下列关于三氯化磷分子空间构型理由的叙述,不正确的是()A.3分子中三个共价键的键长,键角都相等 B.3分子中的键属于极性共价键C.3分子中三个共价键键能,键角均相等 D.3中磷原子是2D.丁认为如果上述的发现存在,则证明传统的价键理论有一定的局限性有待继续发展9.下列说法正确的是()A.π键是由两个p电子“头碰头”重叠形成的B.σ键是镜像对称,而π键是轴对称C.乙烷分子中的键全是σ键,而乙烯分子中含σ键和π键2分子中含σ键,而2分子中还含有π键10、.在分子中,C—键采用的成键轨道是()—p 2—s 2—p 3—p11.下列物质的杂化方式不是3杂化的是()2432O12.下列说法正确的是()A.原子和其它原子形成共价键时,其共价键数一定等于原子的价电子数B.离子化合物中只有离子键,共价化合物中只有共价键C.铵根离子呈正四面体结构D.氨分子中氢原子、氮原子的化合价已饱和,不能再与其它原子或离子成键13、氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是()A.氯化硼液态时能导电而固态时不导电B.氯化硼中心原子采用杂化C.氯化硼分子呈正三角形,属非极性分子D.其分子空间结构类似于2O14.下列说法中正确的是 ( )。
高中化学选修三第二章第二节习题附答案

化学选修三第二章二节习题(附答案)1、下列反应过程中,同时有离子键,极性共价键和非极性共价键的断裂和形成的反应是( )A、NH4Cl=NH3↑+ HCl↑B、NH3+CO2+H2O=NH4HCO3C、2NaOH+Cl2=NaCl+NaClO+H2OD、2Na2O2+2 CO2=2Na2CO3+O22.下列分子或离子中,含有孤对电子的是()A.H2O B.CH4 C.SiH4 D.NH4+3、σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道以及一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠而成。
则下列分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的是()A.H2 B.HCl C.Cl2 D.F24.有关乙炔分子中的化学键描述不正确的是()A.两个碳原子采用sp杂化方式 B.两个碳原子采用sp2杂化方式C.每个碳原子都有两个未杂化的2p轨道形成π键 D.两个碳原子形成两个π键5.在乙烯分子中有5个σ键、一个π键,它们分别是()A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键C.C-H之间是sp2形成的σ键,C-C之间未参加杂化的2p轨道形成的是π键D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键6、已知Zn2+的4s轨道和4p轨道可以形成sp3型杂化轨道,那么[ZnCl4]2-的空间构型为()A、直线形式上B、平面正方形C、正四面体形D、正八面体形7.有关苯分子中的化学键描述正确的是()A.每个碳原子的sp2杂化轨道中的其中一个形成大π键B.每个碳原子的未参加杂化的2p轨道形成大π键C.碳原子的三个sp2杂化轨道与其它形成三个σ键D.碳原子的未参加杂化的2p轨道与其它形成σ键8.三氯化磷分子的空间构型是三角锥形而不是平面正三角形,下列关于三氯化磷分子空间构型理由的叙述,不正确的是()A.PCl3分子中三个共价键的键长,键角都相等 B.PCl3分子中的P-Cl键属于极性共价键C.PCl3分子中三个共价键键能,键角均相等 D.PCl3中磷原子是sp2D.丁认为如果上述的发现存在,则证明传统的价键理论有一定的局限性有待继续发展9.下列说法正确的是()A.π键是由两个p电子“头碰头”重叠形成的B.σ键是镜像对称,而π键是轴对称C.乙烷分子中的键全是σ键,而乙烯分子中含σ键和π键D.H2分子中含σ键,而Cl2分子中还含有π键10、.在BrCH=CHBr分子中,C—Br键采用的成键轨道是()A.sp—pB.sp2—sC.sp2—pD.sp3—p11.下列物质的杂化方式不是sp3杂化的是()A.CO2B.CH4C.NH3D.H2O12.下列说法正确的是()A.原子和其它原子形成共价键时,其共价键数一定等于原子的价电子数B.离子化合物中只有离子键,共价化合物中只有共价键C.铵根离子呈正四面体结构D.氨分子中氢原子、氮原子的化合价已饱和,不能再与其它原子或离子成键13、氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是()A.氯化硼液态时能导电而固态时不导电B.氯化硼中心原子采用sp杂化C.氯化硼分子呈正三角形,属非极性分子D.其分子空间结构类似于CH2O 14.下列说法中正确的是 ()。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学选修三第二章二节习题(附答案)
1、下列反应过程中,同时有离子键,极性共价键和非极性共价键的断裂和形成的反应是( ) A、NH4Cl=NH3↑+ HCl↑B、NH3+CO2+H2O=NH4HCO3 C、2NaOH+Cl2=NaCl+NaClO+H2O D、2Na2O2+2 CO2=2Na2CO3+O2
2.下列分子或离子中,含有孤对电子的是()A.H2O B.CH4 C.SiH4 D.NH4+
3、σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p 轨道以及一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠而成。
则下列分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的是()A.H2 B.HCl C.Cl2 D.F2
4.有关乙炔分子中的化学键描述不正确的是()A.两个碳原子采用sp杂化方式B.两个碳原子采用sp2杂化方式C.每个碳原子都有两个未杂化的2p轨道形成π键D.两个碳原子形成两个π键
5.在乙烯分子中有5个σ键、一个π键,它们分别是()A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C-H之间是sp2形成的σ键,C-C之间未参加杂化的2p轨道形成的是π键D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键
6、已知Zn2+的4s轨道和4p轨道可以形成sp3型杂化轨道,那么[ZnCl4]2-的空间构型为(
)A、直线形式上B、平面正方形C、正四面体形D、正八面体形
7.有关苯分子中的化学键描述正确的是()A.每个碳原子的sp2杂化轨道中的其中一个形成大π键B.每个碳原子的未参加杂化的2p轨道形成大π键C.碳原子的三个sp2杂化轨道与其它形成三个σ键D.碳原子的未参加杂化的2p轨道与其它形成σ键
8.三氯化磷分子的空间构型是三角锥形而不是平面正三角形,下列关于三氯化磷分子空间构型理由的叙述,不正确的是()
A.PCl3分子中三个共价键的键长,键角都相等B.PCl3分子中的P-Cl键属于极性共价键C.PCl3分子中三个共价键键能,键角均相等D.PCl3中磷原子是sp2
D.丁认为如果上述的发现存在,则证明传统的价键理论有一定的局限性有待继续发展9.下列说法正确的是()
A.π键是由两个p电子“头碰头”重叠形成的
B.σ键是镜像对称,而π键是轴对称
C.乙烷分子中的键全是σ键,而乙烯分子中含σ键和π键
D.H2分子中含σ键,而Cl2分子中还含有π键
10、.在BrCH=CHBr分子中,C—Br键采用的成键轨道是()
A.sp—p
B.sp2—s
C.sp2—p
D.sp3—p 11.下列物质的杂化方式不是sp3杂化的是()
A.CO2
B.CH4
C.NH3
D.H2O 12.下列说法正确的是()
A.原子和其它原子形成共价键时,其共价键数一定等于原子的价电子数
B.离子化合物中只有离子键,共价化合物中只有共价键
C.铵根离子呈正四面体结构
D.氨分子中氢原子、氮原子的化合价已饱和,不能再与其它原子或离子成键
1 13、氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是()
A.氯化硼液态时能导电而固态时不导电
B.氯化硼中心原子采用sp杂化
C.氯化硼分子呈正三角形,属非极性分子
D.其分子空间结构类似于CH2O 14.下列说法中正确的是( )。
A.NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构B.P4和CH4都是正四面体分子且键角都为109°28′
+··
+C.NH4的电子式为[H·N··H ·H],离子呈平面正方形结构
D. NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
15.用价层电子对互斥理论预测H2S和BF3的立体构型,两个结构都
正确的是( )。
A.直线形;三角锥形B.V形;三角锥形C.直线形;平面三角形D.V形;平面三角形16.
若中心原子A上没有孤对电子运用价层电子对互斥模型下列说法正确的是()
A.若=2,则分子的立体结构为V形
B.若=3,则分子的立体结构为三角锥形
C.若=4,则分子的立体结构为正四面体形
D.以上说法都不正确
17、已知Zn2+的4s轨道和4p轨道可以形成sp3型杂化轨道,那么[ZnCl4]2-的空间构型为A、直线形式上B、平面正方形C、正四面体形D、正八面体形18、下列配合物的配位数不是6的是
A、K2[Co(NCS)4]
B、Na2[SiF6]
C、Na3[AlF6]
D、[Cu(NH3)
4]Cl2 19、下列物质不能溶于浓氨水的是
A、AgCl
B、Cu(OH)2
C、AgOH
D、Fe(OH)3
20、下列过程与配合物的形成无关的是( ) A.除去Fe粉中的SiO2可用强碱溶液B.向一定量的AgNO3溶液中加入氨水至沉淀消失
3
+C.向Fe溶液中加入KSCN溶液D.向一定量的CuSO4溶液中加入氨水至沉淀消失
21. 2006年是伟大的化学家、1954年诺贝尔化学奖得主、著名的化学结构大师、20世纪的科学怪杰鲍林(Linus Pauling)教授诞辰105周
年(1901—1994)。
1994年这位世纪老人谢世,人们打开他的办公室,发现里面有一块黑板,画得满满的,其中一个结构式如右下图,老人为什么画这个结构式?它是生命前物质吗?它有什么性质?这是鲍林留给世人的一个谜,也许这是一个永远无法揭开的谜,也许你有朝一日能揭开它。
不管结果如何,让我们对这个结构式作一番考察:
N
(1)它的分子式是;
N (2)它的所有原子是否处于同一个平面上?
N ;
(3)它是否带有电荷?;
N N
(4)该分子中sp杂化的N原子有个;
sp2杂化的N原子有个;
N N N
sp3杂化的N原子有
HO N N OH
2 22、(2012年福建)
(1) 元素的第一电离能:Al_Si(填“>”或“<”)。
(2) 基态Mn的核外电子排布。
(3)硼砂是含结晶水的四硼酸钠,其阴离子X(含B、0、H 三种元素)的球棍模型如右图所示:
①在X中,硼原子轨道的杂化类型有;配位键存在于原子之间(填原子的数字标号); m = (填数字)。
②硼砂晶体由Na、X和H2O构成,它们之间存在的作用力有(填序号)。
A离子键B共价键C金属键D范德华力E氢键23、(2012年江苏)一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2基态的电子排布式可表示为。
②NO3的空间构型是(用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O。
①根据等电子体原理,CO分子的结构式为。
②H2O分子中O原子轨道的杂化类型为。
③1mol CO2中含有的σ键数目为。
(3)向CuSO4溶液中加入过量NaOH 溶液可生成[Cu(OH)4]2。
不考虑空间构型[Cu(OH)4]2的结构可用示意图表示
为。
3
-
--
+
+m-m-m-2
+
4。
