官能团保护工作,转换和引入
有机合成——官能团的引入转化消除及保护课件高二化学人教版选择性必修3

氧化
CH3-CHO
CH3-COOH
五、官能团的转化(种类、数目和位置的变化)
2、官能团数目变化
原创:WJ化学研究院
CH3CH2-OH 消去
CH2=CH2
加Br2
水解 CH2Br-CH2Br
HO-CH2CH2-OH
3、官能团位置变化
消去
CH3CH2CH2-Br
CH3CH=CH2
加HBr CH3CH-CH3 Br
卤素原子 烯烃(炔烃)的加成 烷烃(苯及苯的同系物)的取代 醇(酚)的取代
羟基 烯烃与水的加成 酯的水解 卤代烃的水解 醛、酮的加氢
醛基 炔烃水化 烯烃氧化 伯醇的催化氧化 糖类水解
羧基 烯炔烃、苯的同系物、醛、醇的氧化 酯、酰胺、R-CN的水解
酯基
酯化反应、酰氯醇解
八、练习
原创:WJ化学研究院
1.由苯酚制取
①醇的催化氧化引入碳氧双键
2RCH2OH+O2
催化剂 △
2RCHO+2H2O
2RCH(OH)R'+O2 催化△ 剂2R—C—R+2H2O
O
②某些烯烃被氧化
2CH2=CH2+O2 一定条件 2CH3CHO
①O3
②Zn/H2O OHCCH2CH2CH2CH2CHO
三、引入官能团--碳氧双键
2、引入碳氧双键
4、醛基的保护
醛基可被弱氧化剂氧化,为避免在反应过程中受到影响,保护一般是把 醛基制成缩醛,最后再将缩醛水解得到醛基(常用乙二醇)
缩醛 也可以先生成醇,然后再氧化恢复
四、官能团的保护--氨基的保护
5、氨基(-NH2)的保护
胺基易被O2、O3、H2O2等氧化,一般采用下列方法保护
高中化学-有机合成路线的分析与设计

有机合成路线的分析与设计一、有机合成中官能团的衍变1、官能团的引入(或转化)方法(1)引入或转化为碳碳双键的三种方法①醇的消去反应引入②卤代烃的消去反应引入③炔烃与H2、HX、X2的不完全加成反应(2)引入卤素原子的三种方法①烷烃、苯及其同系物与卤素单质发生取代反应②不饱和烃与卤素单质、卤化氢的加成反应③醇与氢卤酸的取代反应(3)引入羟基的四种方法①烯烃与水加成生成醇②卤代烃的碱性水解成醇③醛或酮与氢气加成生成醇④酯水解生成醇(4)引入醛基(或羰基)的方法①醇的催化氧化(5)引入羧基的四种方法①醛被氧化成酸②酯在酸性条件下水解③含侧链的芳香烃被强氧化剂氧化④醇被强氧化剂氧化2、官能团的保护:有机合成过程中,为了避免有些官能团发生变化,必须采取措施保护官能团,待反应完成后再使其复原。
有时在引入多官能团时,需要选择恰当的顺序保护特定官能团被保护的官能团被保护的官能团性质保护方法酚羟基易被氧气、臭氧、双氧水、酸性高锰酸钾溶液氧化碳碳双键易与卤素单质加成,易被氧气、臭氧、双氧水、酸性高锰酸钾溶液氧化醛基易被氧化3、官能团的消除(1)通过加成消除不饱和键双键或三键(2)通过加成或氧化等消除醛基(—CHO)(3)通过消去、氧化、与氢卤酸取代或酯化反应等消除羟基(—OH)(4)通过水解反应消除酯基、肽键、卤素原子三、有机合成中碳骨架的衍变1、使有机物碳链增长的反应①乙炔自身加成②卤代烃与NaCN的反应③卤代烃与炔钠的反应④卤代烃和钠反应⑤醛、酮与氢氰酸的加成反应⑥醛、酮与格氏试剂反应⑦羟醛缩合反应⑧烯烃、炔烃加聚反应⑨苯环与卤代烃反应(傅克反应)⑩苯环与酰卤反应⑪缩聚反应2、使有机物碳链缩短的反应①脱羧反应②氧化反应③水解反应④烃的裂化或裂解反应3、使有机物碳链的成环的反应①二烯烃成环反应(双烯合成)②羟基酸酸的酯化成环③多元羧酸与多元醇的酯化成环④氨基酸的成环⑤二元羧酸与二氨基化合物成环⑥形成环醚4、使有机物碳链的开环的反应①环酯水解开环②环烯烃氧化开环四、有机合成路线的设计与分析1、常见有机物的转化关系2、有机合成路线设计思路3、常见的有机合成路线 (1)一元化合物合成路线:R —CH===CH 2−→−HX R —CH 2—CH 2X ∆−−−→−溶液NaOH R —CH 2—CH 2OH []−→−O R —CH 2—CHO []−→−OR —CH 2—COOH −−−−→−∆醇、浓硫酸、酯 (2)二元化合物合成路线CH 2===CH 2−→−2X CH 2X —CH 2X ∆−−−→−溶液NaOH HOH 2C —CH 2OH []−→−O OHC —CHO []−→−O HOOC —COOH −−−→−一定条件链酯、环酯、聚酯(3)芳香化合物合成路线 ①∆−−−→−溶液NaOH②光照−→−2Cl ∆−−−→−溶液NaOH −−−−→−∆醇、浓硫酸、芳香酯4、有机合成的分析方法(1)正向合成分析法: (2)逆向合成分析法: (3)正、逆合成分析:(4)逆合成分析法设计有机合成路线的思维程序(5)逆向合成分析法应用例析:利用“逆合成分析法”分析由乙烯合成草酸二乙酯的过程逆合成分析思路,概括如下 具体步骤如下5、解决有机合成题的基本步骤第一步:要正确判断合成的有机物属于何种有机物,它带有什么官能团,它和哪些知识、信息有关,它所在的位置的特点等第二步:根据现有原料、信息和有关反应规律,尽可能合理地把目标有机物解剖成若干片段,或寻找官能团的引入、转换、保护方法,或设法将各片段(小分子化合物)拼接衍变,尽快找出合成目标有机物的关键和突破点。
有机合成 官能团引入转换和保护

3.氨基的保护
伯胺和仲胺很容易被氧化,且易发生烃 基化,酰基化以及与醛酮羰基的亲核加成反 应。在合成中常采用: (1)氨基质子化 (2)变为酰基衍生物 (3)变为烃基衍生物等方法将氨基保护起 来
3.1
质子化
此方法仅用于防止氨基的氧化,因为理论上说 采用氨基质子化,即占据氮尚未共用电子对,以阻 止取代反应的发生。这是对氨基保护最简单的法。
COCl COOH (C H 3)2C C O O C (C H 3)3 C H 2 ,H 2 S O 4
CH3 加热
S O 3H COOH
叔丁酯可由羧酸先变为酰氯,再与叔丁醇作 用,或者通过羧酸与异丁烯直接作用而得。 它不能氢解,在通常条件下也不被氨解及碱 催化水解.
5.羧基的保护
KOH COOH COOK C H 2C l
4.羰基的保护
羰基具有许多反应性能,是有机化学中 最易发生反应的活性官能团之一. 保护羰基常用的方法:生成缩醛和缩酮 来降低羰基活性而保护羰基.
4.羰基的保护
保护醛酮羰基最常用的方法是通过乙 二醇和2-疏基乙醇的反应,生成相应 的叫做环缩醛或缩酮的产物.
H O C H 2 C H 2 O H ,T sO H
优点:对碱及催化氢化是稳定的。
缺点:对酸敏感,其稳定性低于甲醚。由 于脱保护基所用的酸性条件剧烈,当分子 中存在对酸敏感的基团时不适用
2.1
• 三甲硅醚
转变成醚
三甲硅醚广泛用于保护糖类、甾类及其他醇 羟基。通常引入三甲基硅基保护基所用的试 剂有三甲基氯化硅和碱;六甲基二硅氨烷。 在含水醇溶液中加热回流即可除去保护基。 优点:醇的三甲硅醚对催化氢化、氧化还 原反应是稳定的,该保护基可在非常温和 的条件下引入和去除。 缺点:对酸和碱敏感,只能在中性条件下 使用。
第3章 官能团的导入、除去、互换及保护

§3.1 官能团的导入
3.1.1 饱和碳原子上官能团的导入
1. 饱和烃的卤代反应 氢原子的活性为:叔氢>仲氢>伯氢;卤素活性为: F2>Cl2>Br2>I2, 卤素活性越大,其选择性越差。因此,在饱和烃卤代 反应中溴代反应最为常见。
Br2 / hv r,t.~105℃ Br
+
20℃ C6H5SO2NCl
CH3 CH3 Cl Cl
+
C6H5SO2NH
3. 羰基化合物的α-卤代反应
O C C H H
+
OH C C H
-H+ slow X X C
OH C
fast
-X
-
OH C C X
-H
+
O C C X
fast
fast
O C H C
+ OH
O -H2O slow X X O C X C C C C
Hofmann eliminations
Anti elimination
2. Pyrolytic syn eliminations(顺式热消去反应)
C H O
C O
300 ~ 500 C
o
C
C
+
RCO2 H
R
Applications: Synthesis of terminal alkenes from primary acetates
O C
-X fast
-
① 醛的α-卤代反应
R' R CH CHO R' R' C H O Si(CH3)3 X2 X=Cl, Br R C CHO X
有机合成中有机物官能团的引入、消除和转化方法.

有机合成中有机物官能团的引入、消除和转化方法1.官能团的引入2.官能团的消去(1通过加成反应消除不饱和键。
(2通过消去反应、氧化反应或酯化反应消除羟基(—OH。
(3通过加成反应或氧化反应消除醛基(—CHO。
(4通过消去反应或水解反应消除卤素原子。
3.官能团的转化(1利用衍变关系引入官能团,如卤代烃伯醇(RCH2OH醛羧酸。
(2通过不同的反应途径增加官能团的个数,如(3通过不同的反应,改变官能团的位置,如有机合成中碳架的构建1.有机成环反应(1有机成环:一种是通过加成反应、聚合反应来实现的;另一种是通过至少含有两个相同或不同官能团的有机物脱去小分子物质来实现的。
如多元醇、羟基酸、氨基酸通过分子内或分子间脱去小分子水等而成环。
(2成环反应生成的五元环或六元环比较稳定。
2.碳链的增长有机合成题中碳链的增长,一般会以信息形式给出,常见的方式如下所示。
(1与HCN的加成反应(2加聚或缩聚反应,如n CH2(3酯化反应,如CH3CH2OH+CH3COOH浓CH3COOCH2CH3+H2O。
3.碳链的减短(1脱羧反应:R—COONa+NaOHR—H+Na2CO3。
(3水解反应:主要包括酯的水解、蛋白质的水解和多糖的水解。
(4烃的裂化或裂解反应:C16H34C8H18+C8H16;C8H18C4H10+C4H8。
合成路线的选择1.中学常见的有机合成路线(1一元合成路线:卤代烃一元醇―→一元醛―→一元羧酸―→酯(2二元合成路线:二元醇―→二元醛―→二元羧酸―→(3芳香化合物合成路线:2.有机合成中常见官能团的保护(1酚羟基的保护:因酚羟基易被氧化,所以在氧化其他基团前可以先使其与NaOH反应,把—OH 变为—ONa(或—OCH3将其保护起来,待氧化后再酸化将其转变为—OH。
(2碳碳双键的保护:碳碳双键也容易被氧化,在氧化其他基团前可以利用其与HCl等的加成反应将其保护起来,待氧化后再利用消去反应转变为碳碳双键。
(3氨基(—NH2的保护:如在对硝基甲苯对氨基苯甲酸的过程中应先把—CH3氧化成—COOH之后,再把—NO2还原为—NH2。
第七章官能团的引入、转换与保护

NH H2S O4
OCH3
O 2N
Cl
O2N
Cl
SO3Na NH
OCH3
11
CH3O-PhNH2
O 2N
SO3Na
磺基水解
O 2N
NH
OCH3
硝基还原
H 2N
NH
OCH3
安安蓝B色基
12
钝化导向基团
NH2
Br2
起钝化官能团的作用,使反应停留在某一阶段。
NH2
NHCOCH3
(CH3CO)2O
NHCOCH3
选择性好的反应以产生唯一的目标物为最佳结 果,避免进行化合物分离的困扰。
21
选择性反应
对减少反应步骤、提高产物收率具有重 要意义 是具有原子经济性合成的新手段 是有机合成的重要策略
22 22
在有机合成中,反应的选择性一般包括:
化学选择性 区域选择性 立体选择性
23
化学选择性:在不利用保护基或活化
PhCH=CHNO2
H2 , (Ph3P)3RhCl , PhH
PhCH2CH2NO2
39
特别是那些次序较为靠近的基团,或者随 着反应条件的改变、官能团不同位置、或 受其它基团的影响上述活性次序可能会发 生改变。
40
2.负氢转移试剂
铝氢试剂——LiAlH4、LiAlH(OR)3、二 异丁基铝锂(DIBAL) 硼氢试剂——NaBH4、KBH4、 NaBH3CN、NaBHR3
NH2
(CH3CO)2O
NHCOCH3
98%H2SO4
NHCOCH3
NHCOCH3
H2SO4-HNO3
NO2 SO3H
SO3H NH2 NO2
(完整版)官能团的引入和转化关系
CHO
O O=C CH2 O=C CH2
O
COOH COOH
必备的基本知识
➢官能团的引入 ➢官能团的消除 ➢官能团的衍变
➢有机成环反应规律
在碳链上引入卤原子的途径
1.烷烃,苯与卤素反应:CH4 + Cl2
hv CH3Cl + HCl
C6H6 + Br2 Fe C6H5Br + HBr
3.烯/炔加成卤素/卤化氢:CH2=CH2 + Br2 CCl4 CH2BrCH2Br
CH3CH3
水解
氧化
醇类
醛类
氧化
羧酸
酯化
取代 R—OH 加氢 R—CHO
R—COOH 水解
CH3CH2Br
CH3COOC2H5
酯类 RCOOR`
CH2=CH2
CH3CH2OH
CH3CHO
CH3COOH
CH=CH CH2=CHCl
CH2Br CH2Br
[ CH2—CH ]n Cl
CH2OH
CHO
2OH
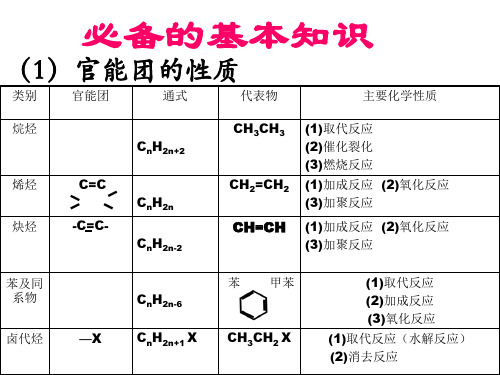
类别官能团通式代表物主要化学性质烷烃2n2ch1取代反应2催化裂化3燃烧反应烯烃2nch1加成反应2氧化反应3加聚反应2n2chch1加成反应2氧化反应3加聚反应甲苯1取代反应2加成反应3氧化反应1取代反应水解反应2消去反应类别官能团通式代表物主要化学性质ohrohoh1与钠反应2取代反应3消去反应4分子间脱水5氧化反应6酯化反应oh1有弱酸性2取代反应3显色反应4缩聚反应chorchocho1氧化反应2还原反应加成反应羧酸coohrcoohcooh1具有酸性2酯化反应coorcoor水解反应还原还原羧酸羧酸氧化氧化氧化氧化醇醇水解水解烯烃烯烃烷烃甲烷苯醇的卤代苯的硝化醇的分子间脱水酯化反应酯的水解反应等
有机合成化学2-官能团的引入与转化

benzene
+
O
O
O
O
(1) 共轭二烯烃是以顺式构象参与反应。被固定为反式的二烯体不 能发生此反应,如
而被固定的顺式反应速率大大加快,如
(2) 亲双烯体上有吸电子取代基,有利于反应。 (3) 此反应属协同反应,没有中间体,一步完成。
(4) 顺式加成,保持了二烯体、 亲二烯体的原有构型。
3. 还原反应
RCH CHCH2OH
Br2
RCH CHCH2OH Br Br
RCH CHCOOH
Zn
HNO3 RCHBrCHBrCOOH
3)醇脱水
RCH2CHR' OH
RCH CHR' + H2O
常用的酸性脱水剂有硫酸;磷酸;草酸;五氧化二磷等
CH3 H3C C CH
H3C OH
CH3
85% H3PO4
CH3
H3C C CH CH2
81%
19%
区域选择性——查依采夫(Saytzeff)规则
CH3 CH2CHCHCH3 KOH
Br
ห้องสมุดไป่ตู้
X CH3
CH2CH=C CH3
CH3 CH=CH CH
CH3
当消除能够得到共轭烯烃时,优先得到共轭烯烃。
2) 二卤代物脱卤
RCHCHR' XX
RCH CHR' + X2
常用的脱卤试剂有锌粉(或镍)的乙醇或乙酸溶液;钠的液氨溶液 等
CH3
CH3 + H3C C C CH3
CH3
醇脱水反应特点: ① 脱水速度—— 叔醇 > 仲醇 > 伯醇 ② 酸催化碳正离子中间体—— 易重排 ③ 区域选择性—— Saytzeff规则——形成多取代的烯烃 ④ 立体选择性—— 反式产物为主
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
羟基的保护基
• 最常用的醋酸酯保护基一般在温和 的 碱 性 条 件 下 就 可 以 除 去,常 用 的 碱 为 K2CO3、 NH3、 肼、 guanidine、 KCN、 Et3N 或 iPr2NEt 等。 在 水 或 醇 的 体 系 中 ,醋酸酯在酸催化下也能发生水解 或 酯 交 换 除 去, 但 在 无 质 子 性 物 质 参 与 时, 醋 酸 酯 一 般 是 比 较 稳 定 的。
官能团保护工作,转换和引入
羟基的保护基
• 酯类保护基 • 酯 类 保 护 基 的 生 成 (Formation):酯 类
保护基生成方法一般由醇和相应的 酸 酐、 酰 氯 在 吡 啶 或 三 乙 胺 存 在 下, 0-20oC 下 反 应 获 得。 如 果 反 应 过 慢, 可 加 入 催 化 量 4-dimethylaminopyridine (DMA可 以 用 含 氟 试 剂 除 去, 如
通 等
常
用
的
HF/CH3CN、TBAF/THF、HF-Py/CH3CN
官能团保护工作,转换和引入
羟 基 的 保 护 基(硅醚)
•生成反应:通常在二氯甲烷或DMF中,使 用R3SiCl or R3SiOTf为试剂,在三乙胺、吡啶 或咪唑等弱碱存在下生成硅醚保护基。 •TES 可 以 用 来 保 护 - 羟 基 醛、 酮 和 酯, 而 不 会 发 生 消 除 反 应。
官能团保护工作,转换和引入
羟 基 的 保 护 基(硅醚)
• 硅、tBu醚tPBhu2保MSie护(2TSBi基D(TPB主SDoM要r BSP有oSr):T等BMS。)e、3SiiP(Tr3MSiS()T、IPSE)t、3Si (TES) • 对 酸 水 解 的 相 对 稳 定 次 序 为: TMS (1) < TES
官能团保护工作,转换和引入
羟基的保护基
• 在 多 羟 基 底 物 上, tBuCOCl 可 以 选 择 性 地 保 护 伯 羟 基:
官能团保护工作,转换和引入
羟基的保护基
• 一 般 情 况 下, 酯 类 保 护 基 均 在 碱 性 条 件 下 除 去。 但 各 种 酰 基 的 水 解 敏 感 性 也 不 同, 特 别 是 Me3CCOO 由 于 立 体 位 阻 大, 反 应 很 慢, 在 它 存 在 下 可 以 选 择 性 除 去 醋 酸 酯 保 护; 相 反, CF3COO 在 pH 7 时 就 能 水 解。 这 些 保 护 基 的 水 解 能 力 次 序 大 致 为:tBuCO < PhCO < MeCO < ClCH2CO ......。
官能团保护工作,转换和引 入
官能团的保护,转换 与引入
官能团保护工作,转换和引入
• 引言
官能团的保护
• 羟基的保护基团
• 醛酮的保护基团
• 氨基的保护基团
官能团保护工作,转换和引入
为什么使用保护基
• 有机合成中,合成目标物的直 接 的 办 法 是 采 用 选 择 性 的 反 应 条 件 和 试 剂。
官能团保护工作,转换和引入
羟基的保护基
• 位 阻 较 大 的 Piv 需 要 较 强 的 碱 性 体 系 , 例 如 KOH/MeOH 除 去; 这 种 条 件 下 , TBDMS 醚 是 不 能 承 受 的。
• 除 去 Piv 的 另 一 种 办 法 是 用 金 属 氢 化 物 还 原, 例 LiAlH4、 DIBAL37 或 KBHEt3 等 。
(64) < TBDMS (20,000) < TIPS (700,000) < TBDPS (5,000,000)。
• 对 碱 的 相 对 稳 定 性 次 序 为:TMS (1) < TES
(10~100) < TBDMS = TBDPS (20,000) < TIPS (100,000) 。
• 由 于 F-Si (142 kcal/mol) > O-Si (112 kcal/mol), 因
• 始于Fischer的碳官水能团保化护工合作,转物换和引合入 成;在实验室化
保 护 基 团 的 选择 和互 不 相 干 性 原 则
• 保护试剂易得 • 保护和去保护条件温和,效率要高。 • 当合成过程中存在多种保护基的选
择 性 脱 除 时, 预 先 作 一 周 密 的 考 虑 是 必 需 的, 最 理 想 的 情 形 是 多个 保 护 基 团 之间 符 合 互 不 相 干 性 原 则, 即 其中一个保护基的脱除不影响另外 的 保 护 基(选择性脱除)。
官能团保护工作,转换和引入
羟 基 的 保 护 基(硅醚)
• TES 的 水 解 稳 定 性 较 TMS 好 10 到 100 倍 左 右, 但 比 TBDMS 差。 它 对 Grignard 反 应、 Swern 氧 化、 WittigHorner 反 应、 Sulfone LDA 金 属 化、DDQ/CH2Cl2 和 DessMartin 氧 化 都 是 稳 定 的。 一 般 可 以 用 2% HF/Py-THF 、 H2O-HOAc-THF (3:5:11) 等 条 件 除 去。 Merck 公 司 在 FK-506 的 合 成 中 用 下 列 条 件 除 去 TES 而 保 留 其 它 硅 醚不动
• 在 复 杂 分 子 合 成 中, 许 多 情 况 下 尚 未发展出 这 样 的 直 接 条 件, 或 选 择 性 不 好, 于 是 必 须 采 用 另 外 的 办 法, 将 易于发 生 反 应 的 官能团 保 护 起 来 成 为 衍 生 物 形 式, 待 达 到 目 的 后 再将之 恢 复 , 这 样 的 办 法 称 为 “保 护 基 团”(Protecting Groups) 法。
官能团保护工作,转换和引入
羟基的保护基
• 作为保护基的酰基的-位有吸电子 因 素 的 话, 酯 水 解 的 速 度 将 会 大 大 加 快。 如 - 甲 氧 基 醋 酸 酯 比 醋 酸 酯 水 解 快 20 倍; - 苯 氧 基 醋 酸 酯 则 要 快 50 倍; - 卤 代 之 后 水 解 速 度 更 快。 - 氯 代 醋 酸 酯 可 以 用 硫 脲、 NH3/MeOH or benzene、 吡 啶 水 溶 液、 H2NCH2CH2SH、 H2NCH2CH2NH238、 PhHNCH2CH2NH2 等 除 去。
