电子排布式杂化轨道理论判断分子空间构型练习题(附答案)
空间构型

孤对电子-孤对电子 > 孤对电子-成键电子 > 成键电子-成键电子
b. 在ABn中,若A与B之间通过双键或叁键结合时,则按单键处理。
实验内容
1.根据杂化轨道理论判断分子或者基团的空间构型
种 类 BeCl2 BCl3 [Zn(NH3)4 ]2+, CCl4 NH3 H2O [FeF6]3-
杂 化 类 型 键角
sp
180° 直线
sp2
120° 平面三 角
sp3
109°28 ′ 正四面体
不等性sp3 不等性sp3
107°18 ′ 三角锥 104°30 ′ 角(V)形
sp3d2
90° 正八面体
分子的几何 构型
2.价电子对数与理想几何构型关系
价层电子对数 2 3 平面三角形 4 120° 价层电子对的理想几何排 排 布 型 式 布 :-A-: 直 线 形 角 度 180°
价电子对数=(5+1×4-1)/2=4); 如果是阴离子,价层电子总数应加上阴离子的电荷数,例如,PO43-, 价电子对数=(5+0+3)/2=4。
b. 如果是阳离子,价层电子总数应减去阳离子的电荷数,例如,NH4+,
(3) 价电子对数与理想几何构型关系
理想几何构型: 中心原子的价层电子对全是成键电子对。
空间结构的画法,以a为例
Cl
a
最后,判断空间构型
找出不同类型电子对之间排斥作用数(选90°) (a)(b)(c) 90°孤对电子对—孤对电子对排斥作用数 90°孤对电子对—成键电子对排斥作用数 90°成键电子对—成键电子对排斥作用数 0 6 6 1 3 2 0 4 2
最后,判断空间构型
排斥作用数越多排斥越大,此结构就越不稳定,在上述
结构化学第三章习题

习题卷1.下面的排序不正确的是A.晶体熔点由低到高:CF4<CCl4<CBr4<CCI4B.硬度由大到小:金刚石>碳化硅>晶体硅C.熔点由低到高:Na<Mg<AlD.晶格能由大到小:NaI>NaBr>NaCl>NaF2.下列有关金属晶体判断正确的是A.简单立方、配位数6、空间利用率68%B.钾型、配位数6、空间利用率68%C.镁型、配位数8、空间利用率74%D.铜型、配位数12、空间利用率74%3.下列对各组物质性质的比较中,正确的是A.硬度:Li>Na>KB.熔点:金刚石>晶体硅>二氧化硅>碳化硅C.第一电离能:Na<Mg<AlD.空间利用率:六方密堆<面心立方<体心立方4.X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:(1)Q在元素周期表中的位置是____________。
基态Q原子的价电子排布图为____________。
(2)X的氢化物的VSEPR模型为____________。
属于____________(填“极性”或“非极性”)分子。
(3)根据表中数据推测,Y的原子半径的最小范围是____________。
(4)甲、乙是上述部分元素的最高价氧化物对应的水化物,且甲+乙→丙十水。
若丙的水溶液呈碱性,则丙的化学式是____________。
(5)M的氢化物是常见溶剂,白色硫酸铜粉末溶解于其中能形成蓝色溶液,请解释原因:____________。
(6)Z晶体的原子堆积模型为体心立方堆积,设Z原子半径为rcm,则Z晶体的密度为____________g/cm3(写出表达式,假设阿伏加德罗常数为N A)。
5.【化学――选修3物质结构与性质】物质的结构决定性质,性质反映其结构特点。
(1)金刚石和石墨是碳元素的两种常见单质,下列叙述中正确的有a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化b.晶体中共价键的键长:金刚石中C-C<石墨中C-Cc.晶体的熔点:金刚石<石墨d.晶体中共价键的键角:金刚石>石墨(2)某石蕊的分子结构如右图所示。
教材第三章习题解答

第三章分子结构习题解答1.用列表的方式分别写出下列离子的电子分布式。
指出它们的外层电子分别属于哪种构型(8、9~17、18或18+2)?未成对电子数是多少?Al3+、V2+、V3+、Mn2+、Fe2+、Sn4+、Pb2+、I-【解答】离子离子的电子分布式外层电子构型未成对电子数Al3+1s22s22p68 0V2+1s22s22p63s23p63d39~17 3V3+1s22s22p63s23p63d29~17 2 Mn2+1s22s22p63s23p63d59~17 5 Fe2+1s22s22p63s23p63d69~17 4 Sn4+1s22s22p63s23p63d104s24p64d105s218+2 0 Pb2+1s22s22p63s23p63d104s24p64d104f145s25p65d106s218+2 0I-1s22s22p63s23p63d104s24p64d105s25p68 02.下列离子的能级最高的电子亚层中,属于电子半充满结构的是_________。
A.Ca2+;B.Fe3+;C.Mn2+;D.Fe2+;E.S2-【解答】B,C。
离子离子的电子分布式属于电子半充满的结构Ca2+1s22s22p63s23p6 ×Fe3+1s22s22p63s23p63d5∨Mn2+1s22s22p63s23p63d5∨Fe2+1s22s22p63s23p63d4×S2-1s22s22p63s23p2 ×3.指出氢在下列几种物质中的成键类型:HCl中_______;NaOH中_______;NaH中_______;H2中__________。
【解答】极性共价键;极性共价键;离子键;非极性共价键。
4.对共价键方向性的最佳解释是_________。
A.键角是一定的; B.电子要配对;C.原子轨道的最大重叠; D.泡利原理。
【解答】C。
分析:原子间相互成键时,必须符合原子轨道最大重叠原则和对称性匹配原则,因而原子间形成共价键时,总是按确定的方向成键,这决定了共价键的方向性。
无机化学(上册):第9章 化学键与分子结构 习题答案
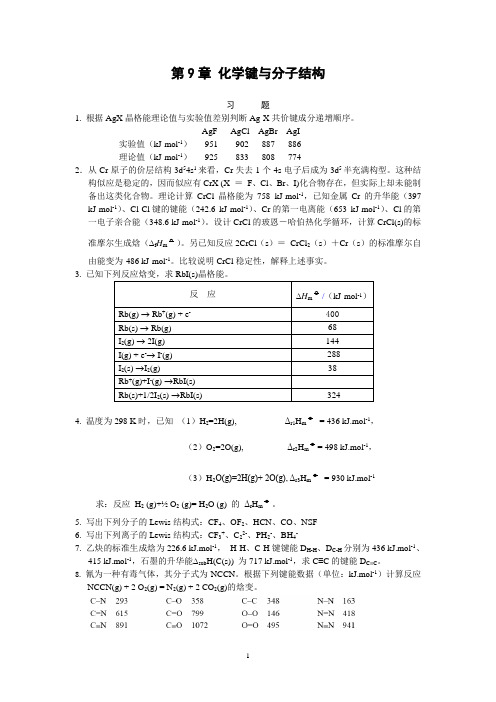
第9章化学键与分子结构习题1. 根据AgX晶格能理论值与实验值差别判断Ag-X共价键成分递增顺序。
AgF AgCl AgBr AgI实验值(kJ·mol-1)951 902 887 886理论值(kJ·mol-1)925 833 808 7742.从Cr原子的价层结构3d54s1来看,Cr失去1个4s电子后成为3d5半充满构型。
这种结构似应是稳定的,因而似应有CrX (X =F、Cl、Br、I)化合物存在,但实际上却未能制备出这类化合物。
理论计算CrCl晶格能为758 kJ·mol-1,已知金属Cr的升华能(397 kJ·mol-1)、Cl-Cl键的键能(242.6 kJ·mol-1)、Cr的第一电离能(653 kJ·mol-1)、Cl的第一电子亲合能(348.6 kJ·mol-1)。
设计CrCl的玻恩-哈伯热化学循环,计算CrCl(s)的标准摩尔生成焓(∆f H m o)。
另已知反应2CrCl(s)=CrCl2(s)+Cr(s)的标准摩尔自由能变为-486 kJ·mol-1。
比较说明CrCl稳定性,解释上述事实。
3.4. 温度为298 K时,已知(1)H2=2H(g), Δr1H m o= 436 kJ.mol-1,(2)O2=2O(g), Δr2H m o= 498 kJ.mol-1,(3)H2O(g)=2H(g)+ 2O(g), Δr3H m o= 930 kJ.mol-1 求:反应H2 (g)+½ O2 (g)= H2O (g) 的Δr H m o。
5. 写出下列分子的Lewis结构式:CF4、OF2、HCN、CO、NSF6. 写出下列离子的Lewis结构式:CF3+、C22-、PH2-、BH4-7. 乙炔的标准生成焓为226.6 kJ.mol-1,H-H、C-H键键能D H-H、D C-H分别为436 kJ.mol-1、415 kJ.mol-1,石墨的升华能∆sub H(C(s)) 为717 kJ.mol-1,求C≡C的键能D C≡C。
杂化轨道精编教案+练习含答案

轨道杂化理论班级:姓名:小组:.【学习目标】1.通过阅读课本39-40页,说出sp、sp2、sp3轨道的组成和杂化轨道的特点;2.通过阅读课本40页图2-16、图2-17,能正确说出杂化轨道的形成过程;3.通过阅读课本41页表2-6,利用VSEPR模型判断中心原子的杂化类型和立体构型;4.通过教师讲解,能通过杂化方式和故对电子解释相关物质键角不同的原因;【重点难点】重点:正确判断中心原子的杂化类型及立体构型难点:理解杂化轨道的形成过程【导学流程】一、基础感知1、杂化轨道理论分析⑴.杂化理论是一种__________理论,是鲍林为了解释分子的________提出的。
⑵发生杂化的轨道一定是__________(中心、配位)原子。
⑶只有能量__________(相近、相远)的轨道才能发生杂化。
⑷杂化前后原子轨道数目__________(变、不变),参加杂化的轨道数目__________(等于、不等于)形成的杂化轨道数目,且杂化轨道的能量相同。
⑸杂化轨道只用于形成__________或者用来_______________________________________。
未参与杂化的p轨道可用于形成π键,故杂化轨道数=__________+__________,分子的构型主要取决于原子轨道的杂化类型。
2、杂化轨道的形成过程以CH4分子的sp3杂化为例:⑴碳原子的2s轨道上的1个电子吸收能量跃迁到2p空轨道上⑵1个2s轨道和3个2p轨道发生混杂,形成能量相等、成分相同的4个_____杂化轨道,其中每个杂化轨道中s成分占____,p成分占____⑶4个sp3杂化轨道位于正四面体的四个顶点,与4个氢原子的1s轨道重叠,形成4个C-H键,从而形成CH4.3、确定杂化轨道和分子构型铺路搭桥:确定分子构型的方法①计算中线原子价层电子对数②确定VSEPR模型③确定分子构型⑴根据课本41页表2-6,判断下列粒子的中心原子轨道杂化类型和空间构型①PCl3②BF3③CS2④H3O+⑤SO42-【思考】有机物CH3CH=CH-C≡CH,判断有机物中所有碳原子的杂化类型一.选择题(每题2分共60分)1.下列有关杂化轨道的说法不正确的是()A. 原子中能量相近的某些轨道,在成键时能重新组合成能量相等的新轨道B. 轨道数目杂化前后可以相等,也可以不等C. 杂化轨道成键时,要满足原子轨道最大重叠原理、最小排斥原理D. 杂化轨道可分为等性杂化轨道和不等性杂化轨道2.关于原子轨道的说法正确的是A. 凡中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体B. CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和1个C原子的2p轨道混合起来而形成的C. sp3杂化轨道是由同一原子中能量相近的s轨道和p轨道混合起来形成的一组能量相等的新轨道D. 凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键3.下列关于三氯化磷分子的叙述不正确的是()A.PCl3分子中三个共价键的键长和键角都相等B.PCl3分子中的P-Cl键属于极性共价键C.PCl3分子中三个共价键键能相等D.PCl3分子中磷原子是sp2杂化4.在BrCH=CHBr分子中,C—Br键采用的成键轨道是()A.sp—p B.sp2—s C.sp2—p D.sp3—p5.关于PCl3和CCl4的说法正确的是A.两种分子的中心原子杂化轨道类型相同B.键角PCl3比CCl4大C.二者均为非极性分子D.两者中的化学键都是p-p σ键6.BF3是典型的平面三角形分子,它溶于氢氟酸或NaF溶液中都形成BF-4,则BF3和BF-4中的硼原子的杂化轨道类型分别是()A.sp2、sp2B.sp3、sp3C.sp2、sp3D.sp1、sp27.下列关于杂化轨道的叙述正确的是( )A.杂化轨道可用于形成σ键,也可用于形成π键B.在乙烯分子中,1个碳原子的3个sp2杂化轨道与3个氢原子的s轨道重叠形成3个C—H σ键C.NH3中N原子的sp3杂化轨道是由N原子的3个p轨道与H原子的s轨道杂化而成的D.杂化轨道可用来容纳未参与成键的孤电子对8.以下关于杂化轨道的说法中,错误的是()A.ⅠA族元素成键时不可能有杂化轨道B.s轨道和p轨道杂化不可能有sp4出现C.孤电子对有可能参加杂化D.杂化轨道既可能形成σ键,也可能形成π键9.用Pauling的杂化轨道理论解释甲烷分子的四面体结构,下列说法不正确的是()A、C原子的四个杂化轨道的能量一样B、C原子的sp3杂化轨道之间夹角一样C、C原子的4个价电子分别占据4个sp3杂化轨道D、C原子有1个sp3杂化轨道由孤对电子占据10.下列说法中正确的是A.PC l3分子是三角锥形,这是因为P原子是以sp2杂化的结果B.sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道C.凡中心原子采取sp3杂化的分子,其VSEP R模型都是四面体D .AB 3型的分子立体构型必为平面三角形11.氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为 A .两种分子的中心原子杂化轨道类型不同,NH 3中的N 为sp 2型杂化,而CH 4中的C 是sp 3型杂化B .NH 3分子中N 原子形成3个杂化轨道,CH 4分子中C 原子形成4个杂化轨道 C .NH 3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强D .氨气分子是极性分子而甲烷是非极性分子 12.下列描述中正确的是A .ClO 3—的空间构型为平面三角形B .SF 6的中心原子有6对成键电子对,无孤电子对C .BF 3和PCl 3的中心原子均为sp 2杂化D .BeCl 2和SnCl 2的空间构型均为直线形 13.下列分子或离子中键角由大到小的排列顺序是( ) ①CO 32- ②NH 3 ③H 2O ④SiF 4 ⑤CO 2 A .⑤④①②③ B .④①②⑤③ C .⑤①④②③ D .③②④①⑤ 14下列分子的空间构型可用sp 2杂化轨道来解释的是 ( ) ①BF 3 ②CH 2=CH 2 ③④CH≡CH ⑤NH 3 ⑥CH 4A . ①②③B . ①⑤⑥C . ②③④D . ③⑤⑥15.如图所示,在乙烯分子中有5个σ键、1个π键,下列表述正确的是( )A .C 、H 之间是2sp 杂化轨道形成的键,C 、C 之间是未参加杂化的2p 轨道形成的π键B .C 、C 之间是2sp 杂化轨道形成的键,C 、H 之间是未参加杂化的2p 轨道形成的π键 C .2sp 杂化轨道形成σ键,未杂化的2p 轨道形成π键D .2sp 杂化轨道形成π键,未杂化的2p 轨道形成σ键16.乙烯分子中含有4个C —H 键和1个C=C 键,6个原子在同一平面上。
分子的立体结构的判断(解析版)(全国版)1

分子的立体结构的判断1(2023·重庆·统考高考真题)NCl 3和SiCl 4均可发生水解反应,其中NCl 3的水解机理示意图如下:下列说法正确的是A.NCl 3和SiCl 4均为极性分子B.NCl 3和NH 3中的N 均为sp 2杂化C.NCl 3和SiCl 4的水解反应机理相同D.NHCl 2和NH 3均能与H 2O 形成氢键【答案】D【解析】A .NCl 3中中心原子N 周围的价层电子对数为:3+12(5-3×1)=4,故空间构型为三角锥形,其分子中正、负电荷中心不重合,为极性分子,而SiCl 4中中心原子周围的价层电子对数为:4+12(4-4×1)=4,是正四面体形结构,为非极性分子,A 错误;B .NCl 3和NH 3中中心原子N 周围的价层电子对数均为:3+12(5-3×1)=4,故二者N 均为sp 3杂化,B错误;C .由题干NCl 3反应历程图可知,NCl 3水解时首先H 2O 中的H 原子与NCl 3上的孤电子对结合,O 与Cl 结合形成HClO ,而SiCl 4上无孤电子对,故SiCl 4的水解反应机理与之不相同,C 错误;D .NHCl 2和NH 3分子中均存在N -H 键和孤电子对,故均能与H 2O 形成氢键,D 正确;故答案为:D 。
2(2023·北京·统考高考真题)下列化学用语或图示表达正确的是A.NaCl 的电子式为Na :Cl ····:B.NH 3的VSEPR 模型为C.2p z 电子云图为D.基态24Cr 原子的价层电子轨道表示式为【答案】C【解析】A .氯化钠是离子化合物,其电子式是 ,A 项错误;B .氨分子的VSEPR 模型是四面体结构,B 项错误:C .p 能级电子云是哑铃(纺锤)形,C 项正确;D .基态铬原子的价层电子轨道表示式是 ,D 项错误;故选C 。
大学化学习题集

1
原子结构(填空题)
• 1.N原子中2P轨道上三个电子的四个量子数分别为( )、 ( )、 ( )。 • 2.电子云角度分布图比原子轨道角度分布图要( )些,因为Y 值是( )的。 • 3. 29Cu元素原子的核外电子排布式为( ),有( )个未 成对电子,Cu2+的外层电子构型为( ),未成对电子数 为( )。 • 4. 15P基态原子的核外电子排布式为( )。 • 5.元素24Cr的外层电子构型是( ) ,该元素在周期表中 属于第( )周期,( )族。 • 6.主族元素的原子半径随原子序数的递增呈现周期性变化, 同一周期从左到右逐渐 ( ),同一主族从上到下逐渐( )。
四周期ad区杂化轨道理论化合物中心原子杂化轨道类型空间构型偶极矩是否为杂化轨道理论答案化合物中心原子杂化轨道类型空间构型偶极矩是否为sp杂化直线型正四面体型conh正八面体型10分子结构填空题o分子之间的作用力有o分子为分子且o原子电负性原子半径o的熔点比同族氢化物的熔点3
大学化学习题
原子结构 分子结构 配合物
4
原子结构(判断题)答案
1. s电子云是球形对称的,所以s轨道上的电子在核外是沿球壳表 面运动的。 ( ) 2. 4f符号表示第四电子层中f亚层,该亚层共有7个轨道。( ) 3. 多电子原子中原子轨道的能量只决定于主量子数n。( ) 4.下列原子核外的电子运动状态并不存在: n=2,l=3,m=2,ms=+1/2。 ( ) 5 . 3d轨道n=3,l=3,有5个伸展方向不同的等价轨道。 ( ) 6. 电子云的实际形状虽与角度分布曲面有关,但又是不相同的, 它是2的空间分布,综合考虑了径向分布和角度分布。( ) 7. 对Cr3+的外层电子构型为(3d24s1) 。( ) 注: 3s2 3p6 3d3 8. 每周期的元素数目等于相应能级组中的原子轨道数。( ) 9. 元素在周期表中所在的族数等于它的最外层电子数。( ) 10.同一周期,从左到右元素的金属性减弱,非金属性增强。( )
高中化学第2章分子的立体构型(第2课时)杂化轨道理论、配合物理论习题 新人教版选修3

杂化轨道理论、配合物理论一、选择题1.下列分子的中心原子是sp 2杂化的是导学号 09440309( )A .PBr 3B .CH 4C .H 2OD .BF 3 答案:D解析:杂化轨道数=中心原子的孤电子对的对数+中心原子的σ键个数,A 、B 、C 采用的都是sp 3杂化。
2.(双选)下列各组离子中,中心原子的杂化轨道类型相同的是导学号 09440310( )A .NO -3、ClO -3B .SO 2-3、CO 2-3C .NH +4、PH +4D .SO 2-3、SO 2-4 答案:CD解析:可以由VSEPR 模型来判断离子的立体构型,再判断杂化轨道类型。
NO -3中N 原子上无孤电子对[12(5+1-3×2)=0],ClO -3中Cl 原子上孤电子对数为1[12(7+1-3×2)=1],分别为平面三角形和三角锥形,N 、Cl 原子采取sp 2和sp 3杂化。
同理,SO 2-3中S 原子上孤电子对数为1、CO 2-3中C 原子上无孤电子对,S 、C 原子分别采取sp 3、sp 2杂化。
因此,SO 2-3、SO 2-4中S 原子均为sp 3杂化。
3.用过量硝酸银溶液处理0.01 mol 氯化铬水溶液,产生0.02 mol AgCl 沉淀,则此氯化铬最可能是导学号 09440311( )A .[Cr(H 2O)6]Cl 3B .[Cr(H 2O)5Cl]Cl 2·H 2OC .[Cr(H 2O)4Cl 2]Cl·2H 2OD .[Cr(H 2O)3Cl 3]·3H 2O 答案:B解析:0.01 mol 氯化铬能生成0.02 mol AgCl 沉淀,说明1 mol 配合物的外界含有2mol Cl -。
4.由配位键形成的离子[Pt(NH 3)6]2+和[PtCl 4]2-中,中心原子铂的化合价是导学号 09440312( )A .都是+8B .都是+6C .都是+4D .都是+2 答案:D解析:NH3是中性配位体,Cl-带一个单位的负电荷,所以配离子[Pt(NH3)6]2+和[PtCl4]2-中,中心原子铂的化合价都是+2。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电子排布式杂化轨道理论判断分子空间构型练习题一、单选题1.下列不属于共价键成键因素的是( ) A.共用电子对在两原子核之间高概率出现 B.共用的电子必须配对C.成键后体系能量降低,趋于稳定D.两原子体积大小要适中2.关于CS 2、SO 2、NH 3三种物质的说法中正确的是( ) A.CS 2在水中的溶解度很小,是由于其属于极性分子 B.SO 2和NH 3均易溶于水,原因之一是它们都是极性分子 C.CS 2为非极性分子,所以在三种物质中熔、沸点最低 D.NH 3在水中溶解度很大只是由于NH 3分子有极性3.下列说法正确的是( )A.若把H 2S 分子写成H 3S 分子,违背了共价键的饱和性B.H 3O +的存在说明共价键不具有饱和性C.所有共价键都有方向性D.两个原子轨道发生重叠后,电子仅存在于两核之间4.374℃、22.1MPa 以上的超临界水具有很强的溶解有机物的能力,并含有较多的H +和OH -,由此可知超临界水( ) A.显中性,pH 等于7 B.表现出非极性溶剂的特性 C.显酸性,pH 小于7D.表现出极性溶剂的特性5.某物质的实验式为43PtCl 2NH ⋅,其水溶液不导电,加入3AgNO 溶液也不产生沉淀,以强碱处理并没有3NH 放出,则关于此化合物的说法中正确的是( )A. 配合物中中心原子的电荷数和配位数均为6B. 该配合物可能是平面正方形结构C. -Cl 和3NH 分子均与4+Pt 配位D. 配合物中-Cl 与4+Pt 配位,而3NH 分子不配位6.下列说法中正确的是( )A.NO 2、SO 2、BF 3、NCl 3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构B.P 4和CH 4都是正四面体形分子且键角都为109°28′C.4NH +的电子式为,离子呈平面正方形结构D.NH 3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强7.下列关于原子轨道的说法正确的是( )A.凡是中心原子采取sp3杂化轨道成键的分子其立体构型都是正四面体B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的C.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组能量相近的新轨道D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键8.X、Y为核电荷数小于18的两种元素,元素X的原子的最外层电子数是次外层电子数的一半,元素Y的原子的最外层电子数与最内层电子数之和等于次外层电子数。
下列有关叙述正确的是( )A.X、Y—定是非金属元素B.X的最外层电子数比Y的少C.Y的单质在化学反应中只能作还原剂D.X与Y的最外层电子数相等9.“胃舒平”的主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8·n H2O)等化合物。
下列叙述中错误的 ( )A.镁元素基态原子的核外电子排布式是:1s22s22p63s2B.铝元素原子核外共有5种不同运动状态的电子C.钠元素离子半径比铝离子半径大AlO D.金属铝与钠的最高价氧化物的水化物溶液发生反应的离子方程式为2Al+2OH-+2H2O=22+3H2↑10.下列说法正确的是( )A.原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似B.Fe3+的最外层电子排布式为3s23p63d5C.基态铜原子的轨道表示式D.基态碳原子的轨道表示式11.230Th和232Th是钍的两种同位素,232Th可以转化成233U,下列说法正确的是( )A.Th元素的质量数是232B.Th元素的相对原子质量是231C.232Th转化成233U是化学变化D.230Th和232Th的化学性质相同12.R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)( )A.若R(OH)n为强碱,则W(OH)n+1也为强碱B.若H n XO m为强酸,则Y是活泼非金属元素C.若Y 的最低化合价为-2,则Y 的最高正化合价为+6D.若X 的最高正化合价为+5,则五种元素都是非金属元素 13.下列说法正确的是( ) A.35Cl 原子的核外电子数为18 B.118mol 的135H Cl 分子中所含中子为1mol C.7.0g 352Cl 的体积为2.24L D.352Cl 的摩尔质量为70g14.下列有关Na 、Mg 、Al 的性质的叙述,正确的是( ) A.碱性: ()()23NaOH Mg OH Al OH <<B.第一电离能: Na Mg Al <<C.电负性: Na Mg Al >>D.还原性: Na Mg Al >>15.下列叙述中正确的是( )A.无机含氧酸分子中含有几个氢原子,它就属于几元酸B.同周期非金属元素的氧化物对应水化物的酸性从左到右依次增强C.同一元素的含氧酸,该元素的化合价越高,酸性越强D.H 3PO 4和H 2CO 3分子中非羟基氧的个数均为1,它们的酸性相近,均为中强酸。
二、填空题17.23592U 是重要的核工业原料,在自然界的丰度很低。
23592U 的浓缩一直为国际社会关注。
回答下列有关问题: 1.(1) 23592U 表示的含义是__________。
(2)23492U 、23592U 、23892U 互为同位素,下列对同位素的理解不正确的是__________(填序号,下同)。
A.元素符号相同B.物理性质相同C.化学性质基本相同D.在周期表中位置相同(3)下列有关23592U 说法不正确的是__________。
A. 23592U 原子核的中子数与质子数之差为51B.23592U 与23892U 的质子数、电子数都相等C.23592U 与23892U 是两种质子数相同,中子数不同的原子D. 23592U 与23892U 是同种原子2.锂的材料在社会生活中广泛应用,如亚氨基锂()2Li NH 是一种储氢容量高、安全性好的固体储氢材料, 2LiCoO 作便携式电源的正极材料,碳酸锂()23Li CO 广泛应用于陶瓷和医药等领域。
根据下列要求回答相关问题:(1) 63Li 和73Li 作核反应堆最佳载热体, 73LiH 和73LiD 作高温堆减速剂。
下列说法中正确的是__________(填序号,下同)。
A. 63Li 和73Li 互为同位素 B.63Li 和73Li 属于同种核素C. 73LiH 和73LiD 的化学性质不同 D.73LiH 和73LiD 是同种物质(2)下列说法不正确的是__________。
A.碱性: ()2Be OH LiOH NaOH KOH <<<B.半径: K Na Li Li +>>>C.氧化性: Li Na K Rb Cs +++++<<<<D.金属性: Cs Rb K Na Li Be >>>>>(3)锂是碱金属族首元素,其性质明显不同于其他碱金属性质,下列能支持这一观点的性质是__________。
A.碱金属与水反应 B.碱金属在氧气中燃烧 C.碱金属与氢气反应 D.碱金属与氯气反应(4)在元素周期表中,锂和镁的性质非常相似,如氢氧化物难溶于水,在氧气中燃烧生成氧化物等。
从原子结构角度分析,锂与镁性质相似的原因是__________。
18.元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题: 1.按原子序数递增的顺序(稀有气体除外),以下说法正确的是__________。
A.原子半径和离子半径均减小 B.金属性减弱,非金属性增强C.氧化物对应的水化物碱性减弱,酸性增强D.单质的熔点降低2.原子最外层电子数与次外层电子数相同的元素名称为__________,氧化性最弱的简单阳离子是__________。
工业制镁时,电解2而不电解的原因是__________; 制铝时,电解23Al O 而不电解3AlCl 的原因是__________。
4.晶体硅(熔点为1410℃)是良好的半导体材料。
由粗硅制纯硅的过程如下:Si (粗)4?SiCl 4SiCl (纯) Si (纯) 写出4SiO 的电子式:__________。
在上述由4SiCl 制纯硅的反应中,测得每生成1.12kg 纯硅需吸收a kJ 热量,写出该反应的热化学方程式:__________。
5. 25P O 是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用25P O 干燥的是__________(填字母)。
A .3NHB .HIC .2SOD .2CO6. 3KClO 可用于实验室制2O ,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴、阳离子个数比为1:1。
写出该反应的化学方程式:__________。
三、推断题19.短周期的5种非金属元素,其中A 、B 、C 的特征电子排布可表示为:A :a as ,B :b b bs bp ,C :2c c cs cp ,D 与B 同主族,E 在C 的下一周期,且是同周期元素中电负性最大的元素。
回答下列问题:1.由A 、B 、C 、E 四种元素中的两种元素可形成多种分子,下列分子①2BC ②4BA ③22A C ④4BE ,其中属于极性分子的是__________(填序号)。
2. C 的氢化物比下周期同族元素的氢化物沸点还要髙,其原因是__________。
3. B 、C 两元素都能和A 元素组成两种常见的溶剂,其分子式为__________、__________。
4DE 在前者中的溶解性__________(填“大于”或“小于”)在后者中的溶解性。
4. 4BA 、4BE 和4DE 的沸点从高到低的顺序为__________(填化学式)。
5. A 、C 、E 三种元素可形成多种含氧酸,如AEC 、2AEC 、3AEC 、4AEC 等,以上列举的四种酸其酸性由强到弱的顺序为__________(填化学式)20.X 、Y 、Z 、Q 、E 五种元素中, X 原子核外的M 层中只有两对成对电子, Y 原子核外的L 层电子数是K 层的两倍, Z 是地壳内含量(质量分数)最高的元素, Q 的核电荷数是X 与Z 的核电荷数之和, E 在元素周期表的各元素中电负性最大。
1. X 、Y 的元素符号依次为__________、__________。
2. 2XZ 与2YZ 分子的立体结构分别是__________和__________,相同条件下两者在水中的溶解度较大的是__________(写分子式),理由是__________。
3. Q 的元素性符号是___________,它属于第_________周期,它的核外电子排布式为_______,在形成化合物时它的最高化合价为__________。
