酸钙化学式
碳酸钙反应的化学方程式

碳酸钙反应的化学方程式碳酸钙是一种常见的无机化合物,化学式为CaCO3、它是一种白色固体,可在自然界中以矿物方解石(calcite)和方解石(aragonite)的形式存在。
碳酸钙具有多种应用,如建筑材料、农业、医药和食品等领域。
在许多实验室和工业过程中,我们也可以观察到碳酸钙参与许多反应,生成其他化合物。
以下是一些常见的碳酸钙反应的化学方程式:1.碳酸钙分解反应:CaCO3(s)→CaO(s)+CO2(g)这是碳酸钙高温分解反应,当加热至高温时,碳酸钙会分解成氧化钙和二氧化碳气体。
2.碳酸钙与酸反应:CaCO3(s) + 2HCl(aq) → CaCl2(aq) + CO2(g) + H2O(l)在此反应中,碳酸钙与盐酸反应生成氯化钙、二氧化碳和水。
3.碳酸钙与硫酸反应:CaCO3(s) + H2SO4(aq) → CaSO4(s) + CO2(g) + H2O(l)这是碳酸钙与硫酸反应的化学方程式,生成硫酸钙、二氧化碳和水。
4.碳酸钙与钌酸钠反应:CaCO3(s) + 2NaIO4(aq) → Ca(IO4)2(s) + 2NaCl(aq) + CO2(g)在该反应中,碳酸钙与钌酸钠反应生成碘酸钙、氯化钠和二氧化碳。
5.碳酸钙与亚硫酸反应:CaCO3(s) + H2SO3(aq) → CaSO3(s) + CO2(g) + H2O(l)在此反应中,碳酸钙与亚硫酸反应生成亚硫酸钙、二氧化碳和水。
上述是一些常见的碳酸钙反应的化学方程式。
这些反应可以在实验室中进行,也可以在工业生产中用于制备其他化合物。
了解这些反应方程式有助于我们理解碳酸钙的化学性质和其在不同领域的应用。
硫酸钙高温分解的化学方程式

硫酸钙高温分解的化学方程式硫酸钙是一种常见的化合物,其化学式为CaSO4,是由钙离子和硫酸根离子组成的。
硫酸钙有很多用途,例如用于制造水泥、石膏等建筑材料,也可用于制造陶瓷、玻璃等工业材料,以及作为饲料添加剂等。
但在高温条件下,硫酸钙会发生分解反应,产生一系列的物质。
本文将探讨硫酸钙高温分解的化学方程式和反应过程。
硫酸钙高温分解的化学方程式为:CaSO4 → CaO + SO3反应过程如下:首先,将硫酸钙加热至高温状态。
在高温下,硫酸钙分解成钙氧化物和二氧化硫。
硫酸钙分解的首要反应是:CaSO4(s)→ CaO(s) + SO3(g)该反应是一个放热反应,需要消耗大量的热量才能发生分解。
在反应过程中,硫酸钙的固态结构被破坏,其中的石膏晶体逐渐失去水分,变为熟石膏或析出水。
同时,硫酸根离子(SO42-)也失去一个氧原子,形成二氧化硫。
CaSO4(s)→ CaO(s) + SO3(g) + 1/2O2(g)硫酸钙分解出的钙氧化物(CaO)是一种无色固体,具有较高的熔点和热性质。
它是一种碱性氧化物,可以与其他酸产生反应。
钙氧化物在空气中与水分子反应,形成氢氧化钙(Ca(OH)2)。
CaO(s) + H2O(l)→ Ca(OH)2(s)二氧化硫(SO3)是一种无色有刺激性气体,可通过加水反应生成亚硫酸酸(H2SO3)。
SO3(g) + H2O(l)→ H2SO4(aq)硫酸钙高温分解的反应是一个重要的化学反应,产生的产物具有广泛的应用价值。
例如,钙氧化物可以用于工业中的热反应,例如钙化反应,而二氧化硫是一种重要的工业原料,可用于制造硫酸等产品。
通过掌握硫酸钙高温分解的化学方程式和反应过程,有助于我们更好地理解该反应的本质和应用。
常见单质和化合物的化学式
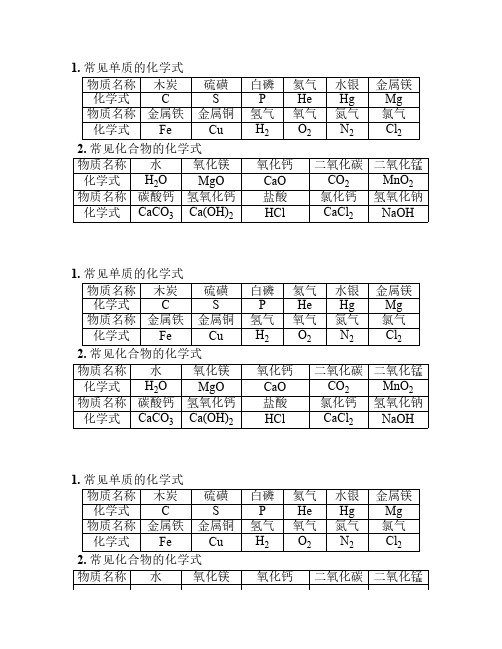
1. 常见单质的化学式
物质名称木炭硫磺白磷氦气水银金属镁化学式C S P He Hg Mg
物质名称金属铁金属铜氢气氧气氮气氯气
化学式Fe Cu H2O2N2Cl2 2. 常见化合物的化学式
物质名称水氧化镁氧化钙二氧化碳二氧化锰化学式H2O MgO CaO CO2MnO2物质名称碳酸钙氢氧化钙盐酸氯化钙氢氧化钠化学式CaCO3Ca(OH)2HCl CaCl2NaOH
1. 常见单质的化学式
物质名称木炭硫磺白磷氦气水银金属镁化学式C S P He Hg Mg
物质名称金属铁金属铜氢气氧气氮气氯气
化学式Fe Cu H2O2N2Cl2 2. 常见化合物的化学式
物质名称水氧化镁氧化钙二氧化碳二氧化锰化学式H2O MgO CaO CO2MnO2物质名称碳酸钙氢氧化钙盐酸氯化钙氢氧化钠化学式CaCO3Ca(OH)2HCl CaCl2NaOH
1. 常见单质的化学式
物质名称木炭硫磺白磷氦气水银金属镁化学式C S P He Hg Mg
物质名称金属铁金属铜氢气氧气氮气氯气
化学式Fe Cu H2O2N2Cl2 2. 常见化合物的化学式
物质名称水氧化镁氧化钙二氧化碳二氧化锰
化学式H2O MgO CaO CO2MnO2物质名称碳酸钙氢氧化钙盐酸氯化钙氢氧化钠化学式CaCO3Ca(OH)2HCl CaCl2NaOH。
初三化学式及方程式

初三化学式及方程式一.化学式:氧气:O2氢气:H2氯气:Cl2 氮气:N2氦气:He 氖气:Ne 氩气:Ar氯化钠:NaCl 硫化钠:Na2S 氧化钠:Na2O 氢氧化钠:NaOH 硫酸钠:Na2SO4碳酸钠:Na2CO3亚硫酸钠:Na2SO3磷酸钠:Na3PO4溴化钠:NaBr 碳酸氢钠:NaHCO3硝酸镁NaNO3氯化镁:MgCl2氧化镁:MgO 硫化镁:MgS氢氧化镁:Mg(OH)2硫酸镁:MgSO4碳酸镁:MgCO3硝酸镁:Mg(NO3)2亚硫酸镁:MgSO3水:H2O 硫化氢:H2S 氯化氢:HCl 硫酸:H2SO4亚硫酸:H2SO3碳酸:H2CO3磷酸:H3PO4乙醇:C2H6O(CH3CH2OH)乙酸(醋酸):CH3COOH 硝酸:HNO3氧化铝:Al2O3氯化铝:AlCl3硫酸铝:Al2(SO4)3硝酸铝:Al(NO3)3甲烷CH4氯化钙:CaCl2氧化钙:CaO 硫化钙:CaS 硫酸钙:CaSO4亚硫酸钙CaSO3氢氧化钙Ca(OH)2碳酸钙CaCO3硝酸钙Ca(NO3)2氯化钾:KCl 氧化钾:K2O 硫化钾:K2S 氢氧化钾:KOH 硫酸钾:K2SO4碳酸钾:K2CO3硝酸钾:KNO3亚硫酸钾:K2SO3碳酸氢钾:KHCO3氧化亚铁:FeO氧化铁(三氧化二铁):Fe2O3四氧化三铁:Fe3O4氯化亚铁:FeCl2硫化亚铁:FeS 碳酸亚铁:FeCO3硫酸亚铁:FeSO4亚硫酸亚铁:FeSO3氢氧化亚铁:Fe(OH)2硝酸亚铁:Fe(NO3)2氯化铁:FeCl3硫酸铁:Fe2(SO4)3硝酸铁:Fe(NO3)3氢氧化铁:Fe(OH)3氧化银:Ag2O 氯化银:AgCl硫酸银:Ag2SO4硝酸银:AgNO3氢氧化银AgOH 氧化汞:HgO氯化汞:HgCl2硝酸汞:Hg(NO3)2硫酸汞:HgSO4氧化钡:BaO氯化钡:BaCl2硫酸钡BaSO4碳酸钡:BaCO3亚硫酸钡:BaSO3硝酸钡Ba(NO3)2氢氧化钡:Ba(OH)2氧化铜:CuO 氯化铜:CuCl2硫酸铜:CuSO4碳酸铜CuCO3硝酸铜:Cu(NO3)2碱式碳酸铜:Cu2(OH)2CO3氢氧化铜:Cu(OH)2氧化锌:ZnO 氯化锌:ZnCl2硫酸锌:ZnSO4碳酸锌:ZnCO3硫化锌:ZnS氢氧化锌Zn(OH)2硝酸锌:Zn(NO3)2高锰酸钾:KMnO4锰酸钾:K2MnO4氯酸钾KClO3二氧化锰MnO2二氧化硫:SO2三氧化硫:SO3五氧化磷:P2O5二氧化碳:CO2一氧化碳:CO 一氧化氮:NO 二氧化氮:NO2二.化学方程式:汞在空气(氧气)中加热2Hg +O2△2HgO硫在氧气(空气)中燃烧:S +O2点燃SO2红磷在氧气(空气)中燃烧:4P +5O2点燃2P2O5碳在充足氧气(空气)中燃烧:C +O2点燃CO2硫在不足氧气(空气)中燃烧:2C +O2点燃2CO镁在氧气(空气)中燃烧:2Mg +O2点燃2MgO铁在氧气中燃烧:3Fe +2O2点燃Fe3O4一氧化碳在氧气(空气)中燃烧:2CO +O2点燃2CO2实验室制氧气:2KMnO4△KMnO4+MnO2+O2↑;2KClO3MnO2△2KCl +3O2↑;2H2O2MnO22H2O +O2↑实验室制二氧化碳:CaCO3+2HCl =CaCl22+H2O乙醇(酒精)在空气中燃烧CH3CH2COH +3O2点燃2CO2+3H2O氧化汞加热:2HgO △2Hg +O2↑铜在空气中加热:2Cu +O2△2CuO二氧化碳通入澄清石灰水中:Ca(OH)2+CO2=CaCO3↓+H2O煅烧石灰石(大理石):CaCO3高温CaO +CO2↑电解水:2H2O 电解2H2↑+O2↑生石灰与水反应:CaO +H2O = Ca(OH)2甲烷在空气(氧气)里燃烧:CH4+2O2点燃CO2+2H2O氢气在空气(氧气)里燃烧:2H2+O2点燃2H2O锌和稀硫酸反应Zn +H2SO4 = ZnSO4+H2↑(实验室制氢气)铁和稀硫酸反应:Fe +H2SO4 = FeSO4+H2↑铝和稀硫酸反应2Al +3H2SO4 = Al2(SO4)3+3H2↑锌和盐酸反应Zn +2HCl = ZnCl2+H2↑铁和盐酸反应Fe +2HCl = FeCl2+H2↑铝和盐酸反应2Al +6HCl = 2AlCl3+3H2↑铁与硫酸铜反应:Fe +CuSO4 = Cu +FeSO4铜于硝酸银反应:Cu +2Ag(NO3)2 = 2Ag +C u(N O3)2一氧化碳还原氧化铜:CuO +CO △Cu +CO2木炭还原氧化铜:C +2CuO △CO2↑+2Cu氢气还原氧化铜: H2+Cu △Cu +H2O一氧化碳还原氧化铁:Fe2O3+3CO △2Fe +3CO2一氧化碳还原四氧化三铁:Fe3O4+4CO △3Fe+4CO3木炭还原氧化铁:2Fe2O3+3C △4Fe +3CO2 ↑酸碱中和反应:HCl+NaOH=NaCl+H2OH2SO4+2NaOH=Na2SO4+2H2OHNO3+NaOH=NaNO3+H2OH2SO4+ Ba(OH)2=BaSO4↓+2H2O2HNO3+C a(O H)2=C a(N O3)2 +H2O2HCl +C a(O H)2=CaCl2 + 2H2O+3H2SO4 +2F e(O H)3=Fe2(SO4)3 +3H2O 酸和盐的反应CaCO3+2HCl =2 CaCl2+ CO2↑+ H2ONa2CO3+2HCl=2NaCl+CO2↑+H2OBaCO3+H2SO4=BaSO4↓+CO2↑+2H2O氢H碳钠磷钾钙Ca四:金属活动顺序:(背熟练)钾钙钠镁铝锌铁锡铅氢铜汞银铂金友情提示:范文可能无法思考和涵盖全面,供参考!最好找专业人士起草或审核后使用,感谢您的下载!+。
常见离子符和化学式

常见的离子符号和化学式一、一些常见离子1、阳离子:铵根离子:NH4+ 钾离子:K+钠离子:Na+ 氢离子:H+ 银离子:Ag+ 钙离子:Ca2+镁离子:Mg2+ 钡离子:Ba2+ 锌离子:Zn2+亚铜离子:Cu+ 铜离子:Cu2+ 亚铁离子:Fe2+ 铁离子:Fe3+铝离子:Al3+ 2、阴离子:氢氧根离子:OH- 硝酸根离子:NO3-氟离子:F- 氯离子:Cl - 溴离子:Br- 碳酸根离子:CO32-硫酸根离子:SO42- 氧离子:O2- 硫离子:S2-二、一些常见物质的化学式1、单质氢气:H2氮气:N2氧气:O2氯气:Cl2臭氧:O3氦气:He 氖气:Ne 氩气:Ar碳:C 硫:S 磷:P 石墨:C 金刚石:C钠:Na 镁:Mg 铝:Al 钾:K 钙:Ca 铁:Fe 铜:Cu 锌:Zn 汞:Hg2、化合物(1)氧化物:水:H2O 过氧化氢:H2O2一氧化碳:CO 二氧化碳:CO2一氧化氮:NO 二氧化氮:NO2 五氧化二磷:P2O5二氧化硫:SO2 氧化钠:Na2O 氧化钾:K2O 氧化镁:MgO 氧化铝:Al2O3氧化钙/生石灰:CaO 二氧化锰:MnO2氧化亚铁:FeO 氧化铁:Fe2O3四氧化三铁:Fe3O4氧化亚铜:Cu2O 氧化铜:CuO 氧化汞:HgO (2)酸盐酸:HCl 的水溶液硝酸:HNO3硫酸:H2SO4碳酸:H2CO3 (3)碱氢氧化钠:NaOH 氢氧化钾:KOH 氢氧化镁:Mg(OH)2氢氧化钙:Ca(OH)2氢氧化铝:Al(OH)3氢氧化亚铁:Fe(OH)2氢氧化铁:Fe(OH)3氢氧化铜:Cu(OH)2(4)盐(部分)氯化钠:NaCl 硝酸钠:NaNO 3 硫酸钠:Na2SO4 碳酸钠:Na2CO3 氯化钾:KCl 硝酸钾:KNO 3 硫酸钾:K2SO4 碳酸钾:K2CO3 氯化铝:AlCl3 硝酸铝:Al(NO3)3 硫酸铝:Al2(SO4)3氯化亚铁:Fe Cl2硝酸亚铁:Fe(NO3)2 硫酸亚铁:FeSO4氯化铁:FeCl3 硝酸铁:Fe(NO3)3 硫酸铁:Fe2(SO4)3氯化镁:MgCl2 硝酸镁:Mg(NO3)2 硫酸镁:MgSO4 碳酸镁:MgCO3 氯化钙:CaCl2 硝酸钙:Ca(NO3)2 硫酸钙:CaSO4 碳酸钙:CaCO3氯化锌:ZnCl2硝酸锌:Zn(NO3)2硫酸锌:ZnSO4氯化铜:CuCl2 硝酸铜:Cu(NO3)2 硫酸铜:CuSO4氯化银:AgCl 硝酸银:AgNO3硫酸银:Ag2SO4氯化钡:BaCl2 硝酸钡:Ba(NO3)2 硫酸钡:BaSO4碳酸钡:BaCO3氯化铵:NH4Cl 硝酸铵:NH4NO3硫酸铵:(NH4 )2SO4 碳酸铵:(NH4)2CO3 高锰酸钾:KMnO4 锰酸钾:K2MnO4 氯酸钾:KClO3三、物质构成的规律:1、由分子构成的物质:(1)某些非金属氧化物:如H2O、CO、CO2、H2O2、P2O5、SO2 ……(2)非金属气体单质:如H2、O2、N2、Cl2、O3 ……(3)稀有气体(特殊的单原子分子):如He、Ne、Ar ……(4)酸:如HCl、H2SO4、H2CO3、HNO3、H2S……2、由原子构成的物质:(1)金属单质:如Hg、Fe、Mg……(2)某些固体非金属单质:如Si 金刚石、石墨……3、由离子构成的物质:(1)盐:如NaCl、KCl、MgCl2、CuSO4……(2)碱:如NaOH KOH ……。
常见化学式

常见化学式酸:盐酸HCl 硫酸H2SO4 亚硫酸H2SO3硝酸HNO3磷酸H3PO4碳酸H2CO3醋酸CH3COOH 硼酸H3BO3氢硫酸H2S碱:氢氧化钾:KOH 氢氧化钠:NaOH 氢氧化钡:Ba(OH)2 氢氧化钙:Ca(OH)2氢氧化铝:Al(OH)3 氢氧化亚铁Fe(OH)2 氢氧化铁Fe(OH)3氢氧化铜:Cu(OH)2 氢氧化镁:Mg(OH)2氢化物:甲烷CH4氨气NH3硝酸盐:硝酸铵NH4NO3 硝酸钾KNO3硝酸钠NaNO3 硝酸银AgNO3硝酸钡Ba(NO3)2硝酸镁Mg(NO3)2 硝酸铝Al(NO3)3硝酸锌Zn(NO3)2硝酸亚铁Fe(NO3)2 硝酸铁Fe(NO3)3 硝酸铜Cu(NO3)2 硝酸钙Ca(NO3)2盐酸盐:氯化铵NH4Cl 氯化钠NaCl 氯化钾KCl 氯化镁MgCl2氯化钙CaCl2质氯化钡BaCl2氯化铝AlCl3氯化锌ZnCl2氯化亚铁FeCl2 氯化铁FeCl3氯化铜CuCl2氯化银AgCl硫酸盐:硫酸钠Na2SO4硫酸钾K2SO4硫酸钙CaSO4 硫酸钡BaSO4 硫酸锌ZnSO4 硫酸亚铁FeSO4硫酸铜CuSO4 硫酸铵(NH4)2SO4硫酸铝Al2(SO4)3硫酸铁Fe2(SO4)3 碳酸盐:碳酸钠Na2CO3碳酸钾K2CO3碳酸镁MgCO3碳酸钙CaCO3碳酸钡BaCO3碳酸锌ZnCO3碳酸亚铁FeCO3碳酸铵(NH4)2CO3氧化物:水H2O 过氧化氢H2O2氧化镁MgO 氧化钙CaO 氧化钡BaO二氧化锰MnO2氧化亚铁FeO 氧化铁Fe2O3四氧化三铁Fe3O4氧化铜CuO 氧化锌ZnO 氧化银Ag2O 氧化铝Al2O3一氧化碳CO二氧化碳CO2二氧化硅SiO2一氧化氮NO 二氧化氮NO2五氧化二磷P2O5二氧化硫SO2 三氧化硫SO3氧化汞HgO 二氧化钛TiO2其它:氯酸钾KClO3磷酸钙Ca3(PO4)2 碳酸氢铵NH4HCO3碳酸氢钠NaHCO3碳酸氢钾KHCO3 碳酸氢钙Ca(HCO3)2 磷酸二氢铵NH4H2PO4磷酸二氢钙Ca(H2PO4)2高锰酸钾KMnO4锰酸钾K2MnO4 乙醇C2H5OH H2He O2 O3 Ne Na Mg AlSi P S Cl2 A r Ca Fe Cu Zn Kr Xe Ba Pt Au Hg Ag Sn常见离子H+Na+K+Ag+Mg2+Ca2+Ba2+Cu2+Fe2+Fe3+Cl―NO3―OH―O2―S2―SO42―CO32―NH4+九年级化学常见的化学方程式(书写化学式要学会类比)1.化合反应2Mg + O 22MgO 3Fe + 2O 2 Fe 3O 4 2Cu + O 2 2CuO 4Al + 3O 2 2Al 2O 3 2Hg + O 2 2HgO 2H 2 + O 2 2H 2O4P + 5O 2 2P 2O 5 S + O 2 SO 2 C + O 2 CO 2 2C + O 22 2CO 2 CO 2 + C 2CO CO 2 + H 2O ==== H 2CO3 CaO + H 2O =====C a (O H )2 2.分解反应H 2CO 3 ====== H 2O + CO 2↑ 2H 2O 2 2H 2O + O 2↑ 2H 2O 2H 2↑ + O 2↑2KMnO 4 K 2MnO 4 + MnO 2 + O 2↑ 2KClO 32KCl +3O 2↑ CaCO 3 CaO + CO 2↑2NaHCO 3 Na 2CO 3 +H 2O + CO 2↑ 3.置换反应H 2 + CuO CuO + H 2O C +2CuO 2Cu +CO 2↑3C + 2Fe 2O 3 4Fe +3CO 2↑ 2C + Fe 3O 4 3Fe +2CO 2↑ Zn + H 2SO 4 ====== ZnSO 4 + H 2 Fe +H 2SO 4 ====== FeSO 4 + H 2↑ Mg + H 2SO 4 ====== MgSO 4 + H 2↑ 2Al +3H 2SO 4 ==== A l 2(S O 4)3 + 3H 2↑ Zn + 2HCl ====== ZnCl 2 + H 2↑ Fe + 2HCl ====== FeCl 2 + H 2↑ Mg + 2HCl ====== MgCl 2 + H 2↑ 2Al + 6HCl ====== 2AlCl 3 + 3H 2↑ Fe + CuSO 4====== FeSO 4 + Cu Cu + 2AgNO 3====== Cu(NO 3)2 + 2Ag4.复分解反应酸 + 金属氧化物 -------- 盐 + 水Fe 2O 3 + 6HCl ====== 2 FeCl 3 + 3H 2O Fe 2O 3 + 3H 2SO 4 ====== Fe 2(S O 4)3+ 3H 2O 酸 + 碱 -------- 盐 + 水盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H 2O盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl 2 + 2H 2O盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl 2 + 2H 2O氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl 3 + 3H 2O硫酸和烧碱反应:H 2SO 4 + 2NaOH ==== Na 2SO 4 + 2H 2O硫酸和氢氧化铜反应:H 2SO 4 + Cu(OH)2 ==== CuSO 4 + 2H 2O酸 + 盐 -------- 另一种酸 + 另一种盐大理石与稀盐酸反应:CaCO 3 + 2HCl === CaCl 2 + H 2O + CO 2↑碳酸钠与稀盐酸反应: Na 2CO 3 + 2HCl === 2NaCl + H 2O + CO 2↑碳酸氢钠与稀盐酸反应: NaHCO 3 + HCl === NaCl + H 2O + CO 2↑硫酸和碳酸钠反应:Na 2CO 3 + H 2SO 4 === Na 2SO 4 + H 2O + CO 2↑碳酸钾与稀盐酸反应: K 2CO 3 + 2HCl === 2KCl + H 2O + CO 2↑碱 + 盐 -------- 另一种碱 + 另一种盐(碱和盐都要可溶)氢氧化钠与硫酸铜:2NaOH + CuSO 4 ==== Cu(OH)2↓ + Na 2SO 4氢氧化钙与硫酸铜:Ca(OH)2+ CuSO 4 ==== Cu(OH)2↓ + CaSO 4氢氧化钙与碳酸钠:Ca(OH)2+ Na 2CO 3 ==== CaCO 3↓+ 2NaOH盐+ 盐 -------- 两种新盐(反应前两种盐都要可溶)Na 2CO 3 + CaCl 2 ==== CaCO 3↓+ 2NaCl NaCl + AgNO 3====AgCl ↓+ NaNO 3 其它反应CO 2 + 2NaOH ==== Na 2CO 3 + H 2O SO 2+ 2NaOH ==== Na 2SO 3+ H 2O (还有SiO 2、SO 3呢)CO 2 + Ca(OH)2 ==== CaCO 3 ↓+ H 2O CH 4 + 2O 2 CO 2 + 2H 2O3CO + Fe 2O 3 2Fe +3CO 2 CO + CuOCu + CO 2 C 2H 5OH + 3O 2 2CO 2 + 3H 2O点燃 通电 点燃 点燃 点燃 点燃 点燃 高温MnO 2 △ 高温 △△ 高温 高温高温 MnO 2 △ 点燃 点燃 点燃 点燃 △ 高温 高温 点燃 点燃。
常见的化学式100个

常见的化学式100个1. 水 H₂O2. 氯 Cl₂3. 氢氧化钾 KOH4. 醋酸 CH₃COOH5. 氢氧化钠 NaOH6. 氯酸 HCl7. 碳酸钙 CaCO₃8. 硫酸 H₂SO₄9. 碳酸氢钠 NaHCO₃10. 焦磷酸 Na₃PO₄11. 盐酸 HClO₂12. 次氯酸 NaClO13. 稀硫酸 H₂SO₃14. 氧化铁(Ⅲ) Fe₂O₃15. 氧化铝 Al₂O₃16. 铁粉 Fe₃O₄17. 氯化锌 ZnCl₂18. 碳酸氢钙 Ca(HCO₃)₂19. 氯化钾 KCl20. 氢氧化钙 Ca(OH)₂21. 高锰酸钾 K₂MnO₄22. 亚硝酸 NaNO₂23. 氢氧化镁 Mg(OH)₂24. 氧化钠 Na₂O25. 氯酸钠 NaClO₃26. 氧化亚铁 FeO27. 氯化钙 CaCl₂28. 硝酸钾 KNO₃29. 氯化钛 TiCl₄30. 硅酸钙 CaSiO₃31. 硫酸铁 FeSO₄32. 硫酸钠 Na₂SO₄33. 硝酸氢钠 NaNO₂34. 硫酸钙 CaSO₄35. 氯酸钙 CaCl₂36. 氢氧化铝 Al(OH)₃37. 氢氧化镁 Mg(OH)₂38. 碳酸氢铵 NH₄HCO₃39. 氯化钛 TiCl₃40. 氧化钙 CaO41. 氧化钡 BaO42. 氧化锑 Sb₂O₃43. 氯化钒 VCl₃44. 硝酸钾 KNO₃45. 氯化钒 VCl₂46. 氧化钒 V₂O₅47. 氧化汞 HgO48. 氯氧化钠 NaClO49. 硫钾酸 KHSO₄50. 硫酸钙 CaSO₃51. 硫酸钾 K₂SO₄52. 硅酸钠 Na₂SiO₃53. 氢氧化硅 Si(OH)₄54. 硝酸钠 NaNO₃55. 亚铁氰化物 Fe(CN)₆56. 氯化汞 HgCl₂57. 氯硫酸 Na₂S₂O₃58. 氯硝酸 NaClO₂59. 氯汞酸 HgCl₃60. 磷酸铵 NH₄H₂PO₄61. 磷酸钙 Ca(H₂PO₄)₂62. 氯化钴 CoCl₂63. 苯二酚 C₆H₄OH64. 氯气 Cl₂65. 苯三醇 C₆H₈O66. 亚磷酸钠 NaH₂PO₄67. 氟酸 HF68. 氯氢化钠 NaHCl69. 氢氧化镁 Mg(OH)₂70. 硫酸锌 ZnSO₄71. 乙酸 C₂H₄O₂72. 氯片 Cl₂O73. 氧化锰 MnO₂74. 氯酸铜 CuCl₂75. 氢氧化钠 NaOH76. 乙烯 C₂H₄77. 氯乙酸 ClCH₂COOH78. 硅硫酸 Na₂Si₂O₅79. 溴 B₂80. 氯钠 NaCl81. 烯醇 C₂H₅OH82. 硫酸 CuSO₄83. 氯乙烯 ClC₂H₄84. PCL₃ PCl₃85. 氧化钙 Ca⁺₂O86. 氯化钆 GaCl₃87. 丙醇 C₃H₈O88. 二甲醚 CH₃OCH₃89. 水合硅胺 Si(NH₂)₄90. 氯化物 Cl⁻91. 铁磁性氧化物 Fe₃O₄92. 硫化钠 Na₂S93. 盐酸钙 CaCl₂O₄94. 氧化铜 CuO95. 氧化锆 ZrO₂96. 硝酸氢铜 Cu(NO₃)₂97. 硝酸铱 IrNO₃98. 氯化钙 CaCl₃99. 碳酸钙 CaCO₂100. 氯化乙醇 C₂H₅OCl。
碳酸钙和硝酸钙

碳酸钙和硝酸钙全文共四篇示例,供读者参考第一篇示例:碳酸钙和硝酸钙是两种常见的钙化合物,在生产和生活中具有重要的应用价值。
下面我们就来深入了解一下碳酸钙和硝酸钙的性质、用途和制备方法。
一、碳酸钙1. 性质:碳酸钙,化学式为CaCO3,是一种白色结晶性粉末,无味无毒。
它是一种强酸性物质,在水中不溶解,但可以溶解在含二氧化碳的水中生成碳酸。
2. 用途:碳酸钙在工业生产中有着广泛的应用。
碳酸钙是建筑材料中的重要原料,用于制造水泥、石灰和其他建筑材料。
碳酸钙被广泛应用于化工行业,用于制备其他钙盐和药品。
碳酸钙还可以用于造纸、涂料、塑料等领域。
3. 制备方法:碳酸钙可以通过多种方式制备,其中最常见的方法是从天然石灰石中提取。
将石灰石经过碎石机破碎成粉末状,然后将粉末状的石灰石加入石灰石煅烧炉中,加热到适当温度,石灰石中的碳酸气体会被释放出来,生成碳酸钙。
二、硝酸钙2. 用途:硝酸钙在农业和生活中有着广泛的应用。
硝酸钙可以被用作肥料,提供植物生长所需的氮元素。
硝酸钙还可以用于制备火药、炸药等爆炸物品。
在医药和化工领域,硝酸钙也具有重要的用途。
3. 制备方法:硝酸钙可以通过将氢氧化钙与硝酸反应制备而成。
将固体氢氧化钙溶解在水中,然后慢慢滴加硝酸,生成硝酸钙的沉淀。
通过过滤,可以得到纯净的硝酸钙晶体。
碳酸钙和硝酸钙是两种重要的钙化合物,在工业生产和生活中发挥着重要作用。
我们应该更加了解这两种物质,充分发挥它们的应用价值,为人类的发展和进步做出更大的贡献。
【本段字数约450字】在实际应用过程中需了解这两种物质的性质以及相关操作方法,从而避免不必要的事故。
碳酸钙和硝酸钙的存放应按照规定的标准,避免接触火源或其他易燃物品,保持干燥和通风处。
在使用过程中,需佩戴防护手套、护目镜等防护措施,严格遵守操作规程,以确保安全生产。
【本段字数约150字】希望我们可以加深对碳酸钙和硝酸钙的了解,更好地利用它们的特性和功能,为我们的生产生活带来更多的便利和效益。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酸钙化学式
一.碳酸钙的化学式:CaCO₃。
二.碳酸钙性质:
英文名称: Calcium carbonate
分子式: CaCO₃
分子量: 100.09
熔点:825 °C
密度: 2.93 g/mL at 25 °C(lit.)
折射率: 1.6583
溶解度: 5 M HCl: 0.1 M at 20 °C, clear, colorless 三.碳酸钙用途:
用于提高聚氯乙烯软质制品的抗挠曲性,也广泛用于橡胶、胶粘剂和密封胶作填料和补强剂
用作分析试剂、基准试剂、硅单晶切片胶和厚膜电容材料
主要用作橡胶、塑料、涂料行业的填充、补强材料
用于生产水泥、陶瓷、石灰、二氧化碳、粉笔、人造石、油灰,并用作颜料、中和剂、擦光剂、塑料与橡胶填充剂
用于生产无水氯化钙、重铬酸钠、玻璃、水泥、建筑材料等
可用于牙粉、牙膏、化妆品等日化用品中
用于生产微孑L橡胶时,可使其发泡均匀。
医药行业中用于药品的填充、补钙保健品等
作化学膨松剂,我国规定可用于各类需添加膨松剂的食品,按生产需要适量使用;作面粉改良剂,用于面粉中,最大使用量为0.03g/kg。
