化学反应平衡的标志共15页
化学平衡标志图像

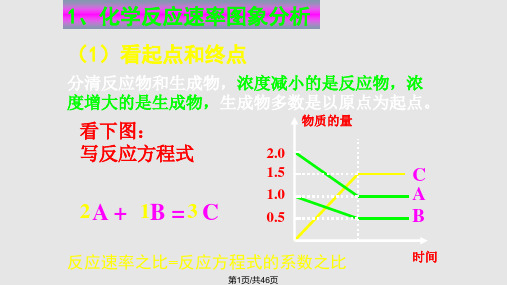
考点二 速率和化学平衡的各种图像
内容回顾 复习学案:P23 27; P30 28 ; P29 20
复习学案:P24 例3
解答图像题目的方法思路: 1、看懂图像:一看面(看清横、纵坐标),二 看线(看线的走向、变化趋势),三看点(即看 线是否通过原点、非原点、终点、两条线的交点 及线的拐点),四看要不要作辅助线(如等温线、 等压线、延长和反向延长线、某点的切线等)。 2、联系所学规律:即必须能熟练准确的联系内 外因对反应速率和化学平衡两方面的影响规律。 另外还要注意区别过程量和状态量的比较问题! 3、作出准确的判断:认准某些关键数据在解题 中的特定作用,全面准确的从图中找出直接和隐 含的间接信息!平时做题可以将图像根据坐标不 同进行小结分类。如:时间进程类、温度或压强 状态类、速率图像类等。
⑥若固体A的质量不再变化呢呢?由于体系密闭,可以
⑦若向体系中加入少量固体A,平衡是否移动?不移动 ⑧若增大该反应体系的压强,也即压缩该体系,速 率是否变化?平衡是否移动?
正逆反应速率都变化(增大);平衡不移动。 注意区别速率问题和平衡问题,速率是平衡的 基础!!!
转化为同一物质在同一段时间内的生成量 与消耗量是否一致,即:v正是否等于v逆
解析:曲线交点表示建立平衡时 的温度或压强,升高温度,增加压 强,v正v逆都增大,B中和D中v正 或v逆有减小的走向,所以错误。 根据反应正反应是一个气体体积增 大的吸热反应,升高温度向正反应 方向移动则有v正大于v逆;增大压 强,向逆反应方向移动则有v正小 于v逆
答案:AC
练习5.(09广东化学15)
课堂练习
1、下列方法中可以证明A(s) + 2B2(g) 2C2(g) +D2(g) ⑴、⑸、⑹、(7) 已经达到平衡状态的是______________________. ⑴、单位时间内生成了2molC2的同时也生成了1molA ⑵、一个B — B键的断裂的同时有一个C — C键的生成
化学平衡状态的判断标志

化学平衡状态的判断标志湖北省巴东县第二高级中学444324 谭贤凤化学平衡状态的判断是化学平衡教学中的难点,为了帮助同学们有效地掌握这方面的知识,笔者对化学平衡的概念深入剖析,总结规律,从不同侧面认识化学平衡,以化解难点,提高对知识的应用能力。
一.剖析概念,把握标志化学平衡状态是指在一定条件下的可逆反应里,正反应和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
从其概念可知,判断一个可逆反应在一定条件下是否达到平衡状态主要根据两点:一是根据化学平衡状态的本质特征——正反应速率与逆反应速率相等;二是根据化学平衡状态的宏观表现——各组分的浓度保持不变。
二.深入理解,把握规律㈠化学平衡状态的一般标志化学平衡状态的标志可概括为“一等五不变”,现以mA(g)+nB(g)2pC(g)+qD(g)为例,化抽象为具体,提高学生对此标志的理解。
1.一等“一等”即正反应速率等于逆反应速率,其意义是针对反应体系中同一反应物(或生成物)而言的,而不是同一反应中的不同物质。
若用同一反应中不同物质来表示正反应速率和逆反应速率,必须要求两速率反向(切忌单向速率)且两速率之比等于其对应的化学计量数之比。
在试题中可有以下几种具体形式出现:⑴同一物质的正反应速率等于逆反应速率,如υA(消耗)=υA(生成)或υD(消耗)=υD(生成)。
⑵某反应物的正反应速率与另一反应物的逆反应速率之比等于化学计量数之比,如υA(消耗):υB(生成) =m:n,或υC(消耗):υD(生成) =p:q。
⑶某反应物的正反应速率与某生成物的逆反应速率之比等于化学计量数之比,如υA(消耗):υC(消耗) =m:p,或υB(生成):υD(生成) = n:q。
⑷对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等。
2.五不变“五不变”即反应混合物中各组分的浓度保持不变,其意义是指各组分的物质的量不变;各组分的浓度不变;各组分的百分含量不变;反应物的转化率不变;对于全为气体的可逆反应,当m+n╪p+q 时,混合气体总物质的量不变。
化学平衡图像PPT课件
(D)
D%
1 增大 B 的浓度
2 升高反应温度 3 缩小反应容器的体积 4 加入催化剂
a
b
时间 t
A. 1 2 B. 1 3
C. 2 3 D. 3 4
第31页/共46页
五.基本题型
题型1:由化学方程式的特点判断图像
例:可表示为可逆反应2A(g)+B(g)
的图象是( B )
C%
700oC v V正
v
Z%
B. 增大Y的浓度
C. 降低温度
D. 增大体系压强
b
a
0
t
第17页/共46页
反应X(g)+Y(g) 2Z(g); △H<0,在 一定条件下,反应物Y的转化率与反 应时间(t)的关系如右下图所示。若 使曲线a变为曲线b可采取的措施是 A 加催化剂 B 降低温度 C 增大压强 D 增大Y的浓度
第18页/共46页
v
V(正)
V(正)
V(逆)
V(逆)
时间 t
第37页/共46页
3 .在容积固定为2L的密闭容器中充入X、Y各2mol,发生反应:
X( g) + 2Y(g)
2Z(g)
达到平衡时,以Y的浓度改变表示的关系如下图所示:
回答下列问题:
(1)用S表示面积,如 Obd 的面积 意可义表是示:为表_S_(示_O_bd反_),_应__则正__S向_(a_bd进_O_)行_表__时示__减的__少_
___的__Y__的__物__质__的__量__浓__度________。
v(Y)
a V(正) b
(2)平衡时 Y 的物质的量浓度可
表示为:__1_-__S__( a_O__b_) __mol/L。
化学平衡状态的判断标志

化学平衡状态的判断标志湖北省巴东县第二高级中学444324 谭贤凤化学平衡状态的判断是化学平衡教学中的难点,为了帮助同学们有效地掌握这方面的知识,笔者对化学平衡的概念深入剖析,总结规律,从不同侧面认识化学平衡,以化解难点,提高对知识的应用能力。
一.剖析概念,把握标志化学平衡状态是指在一定条件下的可逆反应里,正反应和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
从其概念可知,判断一个可逆反应在一定条件下是否达到平衡状态主要根据两点:一是根据化学平衡状态的本质特征——正反应速率与逆反应速率相等;二是根据化学平衡状态的宏观表现——各组分的浓度保持不变。
二.深入理解,把握规律㈠化学平衡状态的一般标志化学平衡状态的标志可概括为“一等五不变”,现以mA(g)+nB(g)2pC(g)+qD(g)为例,化抽象为具体,提高学生对此标志的理解。
1.一等“一等”即正反应速率等于逆反应速率,其意义是针对反应体系中同一反应物(或生成物)而言的,而不是同一反应中的不同物质。
若用同一反应中不同物质来表示正反应速率和逆反应速率,必须要求两速率反向(切忌单向速率)且两速率之比等于其对应的化学计量数之比。
在试题中可有以下几种具体形式出现:⑴同一物质的正反应速率等于逆反应速率,如υA(消耗)=υA(生成)或υD(消耗)=υD(生成)。
⑵某反应物的正反应速率与另一反应物的逆反应速率之比等于化学计量数之比,如υA(消耗):υB(生成) =m:n,或υC(消耗):υD(生成) =p:q。
⑶某反应物的正反应速率与某生成物的逆反应速率之比等于化学计量数之比,如υA(消耗):υC(消耗) =m:p,或υB(生成):υD(生成) = n:q。
⑷对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等。
2.五不变“五不变”即反应混合物中各组分的浓度保持不变,其意义是指各组分的物质的量不变;各组分的浓度不变;各组分的百分含量不变;反应物的转化率不变;对于全为气体的可逆反应,当m+n╪p+q 时,混合气体总物质的量不变。
化学人教版(2019)必修第二册6.2.3化学平衡状态(共33张ppt)

任 务 02
2.1 化学平衡的建立
高温高压
N2 + 3H2 催化剂 2NH3
反应刚开始时:
速
率 v
v正
v逆
0
反应过程中:
v正 = v逆
化学平衡状态
t1
时间t
反应物浓度—最—大——,正反应速率—最—大—— , 反应物浓度—逐—渐—减——小—,正反应速率—逐—渐—减——小,
生成物浓度为—0——,逆反应速率为—0—。 生成物浓度—逐—渐—增——大—,逆反应速率—逐—渐—增— 大
2.建立个性与共性、对立与统一的科学辩证观。
教学引入:高炉炼铁尾气之谜
教学引入:高炉炼铁尾气之谜
增加炼铁高炉的高度,不能改变高
炉尾气中CO的比例,原因是:
C+CO2
2CO是一个可逆反应,不
能完全进行,存在一定的反应限度。在
高炉中Fe2O3与CO的反应也不能全部转 化为Fe和CO2。
任 务 01
×100%
课堂检测
2.合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
高温高压
N2 + 3H2 催化剂 2NH3
673 K、30 MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示。
下列叙述中正确的是( B )
A.c点处正反应速率和逆反应速率相等 B.a点的正反应速率比b点的大 C.d点(t1时刻)和e点(t2时刻)处n(N2)不同 D.在t2时刻,正反应速率大于逆反应速率
课堂检测
3.一定条件下,对于可逆反应
N2 + 3H2
高温高压 催化剂
2NH3
,表示正、逆
反应速率可以用N2或H2或NH3来表示:下列能表示反应达到化学平衡状态
如何判断一个化学反应是否处于平衡状态

如何判断一个化学反应是否处于平衡状态化学平衡的本质是正逆反应速率相等,特征是体系中各组分的含量保持不变。
具体如何判断是否平衡,主要看哪些量是变量,哪些量是恒量。
当变量不变时,化学反应就达到平衡状态。
一、判断反应体系中的变量和衡量1.总量:反应体系的总质量;气体的总物质的量(气体的总分子数);气体的总体积;气体的总质量;气体的密度;绝热体系的温度;混合气体的平均相对分子质量;混合气体的压强。
2. 个量:某反应物的质量、物质的量、分子数;某反应物的转化率、利用率或产物的产率;某气体的体积分数、物质的量分数、质量分数、气体的分压;某物质表示的反应速率;正反应速率或逆反应速率;同一方向的某种或几种物质的转化量和生成量(与反应物质化学计量数成比例);相反方向的某种或几种物质的转化量和生成量(与反应物质化学计量数成比例);相反方向的某种或几种物质的断裂的化学键或生成的化学键(与反应物质化学计量数成比例对应数目的键)。
二、判断平衡状态的方法1.观察变量:当反应体系中的某个变量不变时,说明正逆反应速率相等,反应达到平衡状态。
2.极限思维法:假设反应向一个方向进行到底,观察这个方向的相关量是否发生变化。
若不变,说明反应已达到平衡状态。
三、实例分析反应体系:aA(g)+ bB(g)→cC(g)1.判断平衡状态的标志:(1)当反应体系中各组分的物质的量、浓度、含量等变量不变时,说明反应达到平衡状态。
(2)观察反应速率、转化率、产率等指标,若不变,说明反应达到平衡状态。
2.实例分析:(1)降低温度,二氧化硫转化率增大,反应速率减小。
(2)在600℃时,反应进行至20min时,曲线发生波动,说明反应达到平衡状态。
综上所述,判断一个化学反应是否处于平衡状态,需关注反应体系中的变量,运用极限思维法分析各变量是否发生变化。
当变量不变时,可判断反应已达到平衡状态。
判断化学平衡状态的标志

判断化学平衡状态的标志---小析一、判断化学平衡状态的标志1、什么是化学平衡状态化学平衡状态是指一定条件下的可逆反应里,正反应速率=逆反应速率,反应混合物中各组分的含量保持不变的状态。
2、平衡状态的判断方法:直接判定: V正=V逆①同一物质:该物质的生成速率等于它的消耗速率。
②不同的物质:速率之比等于方程式中的系数比,但必须是不同方向的速率。
即必须是一个V正一个是V逆之比等于系数比才能判断是平衡状态。
例1、可逆反应:2NO2(g)= 2NO(g) + O2(g),在体积固定的密闭容器中,达到平衡状态的标志是(B )A 单位时间内生成n mol O2的同时生成2n mol NO2B 单位时间内生成n mol O2的同时生成2n mol NOC 用NO2、NO、O2表示的反应速率的比为2 : 2 : 1的状态例2、判断在反应2HI(g) H2(g)+I2(g)中能判断达平衡状态的有2molH-I键断裂就有1molH-H生成(错误)间接判定:①各组成成分的质量、物质的量、分子数、体积(气体)、物质的量浓度保持不变。
②各组成成分的质量分数、物质的量分数、气体的体积分数保持不变。
③若反应前后的物质都是气体,且系数不等,总物质的量、总压强(恒温、恒容)、平均摩尔质量、混合气体的密度(恒温、恒压)保持不变。
④反应物的转化率、产物的产率保持不变。
总之:能变的量保持不变说明已达平衡。
二、具体方法注意事项:在研究化学平衡时注意各物质的状态,和左右两边气体系数和是否相等。
在做题时注意用公式推出结论,在进行讨论,在此要注意哪些是可变量,哪些是不变量。
一、密度ρ密度=质量/体积①可逆反应:2NO2(g) =2NO(g) + O2(g),在体积固定的密闭容器中,密度保持不变能否判断是平衡状态(否)原因:在反应中质量不变,体积不变,密度是个恒定量,不随时间的变化而变化。
②可逆反应:2NO2(g) =2NO(g) + O2(g),在压强固定的密闭容器中,密度保持不变能否判断是平衡状态(能)原因:该反应左右两边气体系数不等,说明随着反应的进行体积是变化的,而气体总质量保持不变,所以密度是个变化量,现在不变说明已经达到平衡。
化学反应达到平衡的标志

化学反应达到平衡的标志以m A(g)+n B(g)p C(g)为例直接标志:①速率关系:正反应速率与逆反应速率相等:A消耗速率与A的生成速率相等,A的消耗速率与C的消耗速率之比等于m:p,B生成速率与C的生成速率之比等于n:p。
②各物质的百分含量保持不变。
间接标志:①混合气体的总压强、总体积、总物质的量不随时间的改变而改变。
(注:m+n≠p)②各物质的浓度不随时间的改变而改变。
③各物质的物质的量不随时间的改变而改变。
④各气体的体积、各气体的分压不随时间的改变而改变。
总结:对于密闭容器中的可逆反应:mA(g)+nB(g)pC(g)+qD(g),根据对化学平衡概念的理解,判断下列各情况下,是否达到平衡。
1.在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )A.此反应的化学方程式为2M N B.t2时,正逆反应速率相等,达到平衡C.t3时,正反应速率大于逆反应速率D.t1时,N的浓度是M浓度的2倍2.能充分说明可逆反应N 2(g)+O2(g)2NO(g)已达到平衡状态的是( ) A.O2的消耗速率等于NO的消耗速率B.容器内始终有N2、O2和NO共存C.容器内反应混合物的总物质的量不随时间改变D.单位时间内每生成n mol N2,同时生成2n mol NO3.一定温度下,反应N 2(g)+3H2(g)2NH3(g)达到化学平衡状态的标志是A.c(N2)∶c(H2)∶c(NH3)=1∶3∶2B.N2,H2和NH3的物质的量分数不再改变C.N2与H2的物质的量之和是NH3的物质的量的2倍D.单位时间里每增加1molN2,同时增加3molH24、在定容催化剂作用下发生反应:2SO2+O22SO3(正反应放热),判断该反应达到平衡状态的标志是。
(填字母)a.SO2和SO3浓度相等b.SO2百分含量保持不变c.容器中气体的压强不变d.SO3的生成速率与SO2的消耗速率相等f 、气体密度不变5、在2L密闭容器内,800℃时反应:2NO(g)+O 2(g)2NO2(g)体系中能说明该反应已达到平衡状态的是。
