重金属沉淀PH值
硫化物去除铅的最佳ph

硫化物去除铅的最佳pH引言铅是一种常见的重金属污染物,对人类健康和环境造成严重影响。
硫化物是一种常用的去除铅的方法之一,通过与铅形成不溶性的硫化物沉淀物,将铅从水体中去除。
而硫化物的去除效果受到pH值的影响,因此确定最佳的pH值可以提高硫化物去除铅的效率。
本文将探讨硫化物去除铅的最佳pH值,并从实验原理、实验步骤和结果分析等方面进行详细介绍。
实验原理硫化物去除铅的原理是通过硫化物与铅形成硫化物沉淀物,将铅从水体中去除。
硫化物可以与铅形成不溶性的硫化物沉淀物,其沉淀速度和效果受到pH值的影响。
在不同pH值下,硫化物与铅的反应速率和沉淀效果都会发生变化。
实验步骤1.准备实验所需材料和设备,包括硫化物溶液、铅溶液、酸碱溶液、pH计等。
2.将一定浓度的硫化物溶液和铅溶液分别取出,用容量瓶稀释至相同浓度。
3.准备一系列不同pH值的酸碱溶液,可以使用醋酸和氢氧化钠来调节pH值。
4.将不同pH值的酸碱溶液分别与硫化物溶液和铅溶液混合,使其达到相同体积。
5.在反应开始后,定时取出一定体积的反应液,用离心机离心沉淀物。
6.将沉淀物用去离子水洗涤,并放入烘箱中干燥。
7.将干燥后的沉淀物称重,计算沉淀率。
8.根据实验结果绘制硫化物去除铅的沉淀率-pH曲线。
实验结果分析根据实验结果,可以得到硫化物去除铅的沉淀率-pH曲线。
通过分析曲线,可以确定硫化物去除铅的最佳pH值。
在低pH值下,硫化物与铅的反应速率较慢,沉淀效果不佳。
这是因为在酸性条件下,硫化物分子会与H+离子结合,形成硫酸根离子,导致硫化物与铅的反应速率降低。
在中性pH值下,硫化物与铅的反应速率较快,沉淀效果较好。
这是因为在中性条件下,硫化物和铅可以直接反应生成硫化物沉淀物,反应速率较高。
在高pH值下,硫化物与铅的反应速率再次降低,沉淀效果下降。
这是因为在碱性条件下,铅会与OH-离子结合形成铅的碱式盐,导致硫化物与铅的反应速率降低。
根据实验结果,可以确定硫化物去除铅的最佳pH值在中性范围内,大约在7左右。
各种金属离子沉淀的ph值

各种金属离子沉淀的ph值金属离子沉淀的pH值是影响沉淀形成和稳定性的重要参数。
pH值越低,金属离子与水中的氢离子反应生成二氧化碳或金属氧化物,从而形成沉淀。
本文将探讨不同金属离子在不同pH条件下的沉淀情况,并分析其应用。
1. 铁离子沉淀的pH值范围铁离子在水中沉淀主要是生成Fe(OH)3或Fe(OH)2,其pH范围分别为3-5和7-10。
在弱碱性条件下,pH 7-10,Fe(OH)3沉淀生成稳定,可用于废水处理中去除重金属离子。
而在弱酸性条件下,pH 3-5,Fe(OH)2沉淀生成稳定,可以应用于铁材料腐蚀防护。
2. 铝离子沉淀的pH值范围铝离子在水中主要以Al(OH)3的形式沉淀,其pH范围为5-9。
在中性或弱碱性条件下,铝离子沉淀稳定,可以用于悬浮物的去除和固体废物的处理。
此外,铝离子沉淀还可用于水源的净化和蓝藻水华的控制。
3. 镁离子沉淀的pH值范围镁离子在水中主要以Mg(OH)2的形式沉淀,其pH范围为9-11。
在高碱性条件下,镁离子沉淀稳定,可用于软化水处理中,去除水中的镁离子和钙离子,减少水垢的生成。
4. 钙离子沉淀的pH值范围钙离子在水中主要以CaCO3的形式沉淀,其pH范围为8-10。
在中性到弱碱性条件下,钙离子与碳酸根离子反应生成CaCO3,沉淀稳定。
这种沉淀可以应用于水处理中去除水中的钙离子以及一些无机污染物。
5. 锌离子沉淀的pH值范围锌离子在水中以Zn(OH)2的形式沉淀,其pH范围为9-11。
在高碱性条件下,锌离子沉淀稳定,可以用于废水处理中去除锌离子。
此外,锌离子沉淀还可用于电镀废水中锌的回收。
总结:不同金属离子的沉淀pH值范围各不相同,对应不同的应用领域。
了解各种金属离子的pH范围可以帮助我们选择合适的处理方法来去除水中的金属离子污染物。
ph水质检测标准值

ph水质检测标准值PH水质检测标准值。
PH值是衡量水质酸碱度的重要指标,它对水体的生态环境和人体健康都有着重要的影响。
不同的水体在不同的环境下,其PH值也会有所不同,因此对于不同类型的水体,其PH值的标准也有所不同。
首先,我们来了解一下PH值的含义。
PH值是指水体中氢离子浓度的负对数,通常用来表示水体的酸碱度。
PH值在0-14之间,7为中性,小于7为酸性,大于7为碱性。
对于不同类型的水体,其PH值的标准范围也会有所不同。
对于自来水和地表水来说,其PH值应该在6.5-8.5之间,这是因为PH值在这个范围内对人体和生态环境的影响较小。
当PH值低于6.5时,水体会呈现酸性,这会对水中的金属离子溶解度产生影响,对人体的健康和水生生物造成危害。
而当PH值高于8.5时,水体则呈现碱性,这可能导致水中的重金属沉淀,对水生生物造成危害。
因此,自来水和地表水的PH值标准范围被设定为6.5-8.5。
对于工业废水和农村生活污水来说,其PH值标准范围也有所规定。
工业废水和农村生活污水的PH值应该在6.0-9.0之间。
这是因为工业废水和农村生活污水中通常含有大量的有机物和化学物质,其PH值偏离标准范围会对水体的处理和净化造成困难,对周围的生态环境产生负面影响。
此外,对于水产养殖用水来说,其PH值标准范围也有专门的要求。
一般来说,水产养殖用水的PH值应该在7.0-9.0之间。
这是因为水产养殖用水的PH值偏离标准范围会影响水生生物的生长和代谢,对水产养殖产生不利影响。
总的来说,不同类型的水体对PH值的要求是有所不同的,但无论是自来水、地表水、工业废水、农村生活污水还是水产养殖用水,都需要保持其PH值在一定的标准范围内。
因此,在进行水质检测时,我们需要根据不同类型的水体,选择相应的PH值检测标准,确保水体的酸碱度处于合适的范围内,从而保护生态环境,维护人体健康。
重金属沉淀剂

重金属沉淀剂1 什么是重金属沉淀剂重金属污染是一种严重的环境问题,它会对人体健康产生不良影响。
为了合理地处理重金属污染,科学家们发明了重金属沉淀剂。
重金属沉淀剂是一种能够将水中的重金属离子转化为比较稳定的化合物,从而实现去除的方法。
2 重金属沉淀剂的工作原理重金属沉淀剂通常是由多种化学物质混合而成的。
这些化学物质能够与水中的重金属离子发生化学反应,从而产生比较稳定的化合物。
这些化合物往往比较大,它们会逐渐沉淀到水中底部形成沉积物,从而使重金属离子被去除。
3 重金属沉淀剂的应用重金属沉淀剂广泛应用于水源的净化和工业废水的处理中。
在水源净化中,重金属沉淀剂可以有效地去除水中的重金属离子,避免对人体的威胁;在工业废水的处理中,重金属沉淀剂可以将废水中的重金属离子转化为比较稳定的化合物,避免对环境造成污染。
4 重金属沉淀剂的优缺点重金属沉淀剂的优点主要有以下几个:首先,它可以有效地去除水中的重金属离子,从而保障人体健康;其次,它比较容易使用,在水中添加一定量的重金属沉淀剂即可;再者,它的成本比较低,不会造成财务上的负担。
重金属沉淀剂的缺点也有一些:首先,它只能对水中的重金属离子进行去除,对于其它污染物则无法处理;其次,重金属沉淀剂可能会对水体的pH值产生影响,需要进行调整;最后,沉淀剂处理后的污泥需要进一步安全处理,避免再次造成污染。
5 结论重金属沉淀剂在环境保护方面发挥着重要作用。
虽然它有一些缺点,但总的来说,重金属沉淀剂是一种较为成熟、可靠的处理方法。
我们希望,在未来的研究中,能够进一步提高沉淀剂的效率和安全性,更好地保护我们的环境。
十大沉淀化学式

十大沉淀化学式1.重金属沉淀:重金属的沉淀反应通常遵循经典的氧化还原反应或协同反应机制,氧化还原分子受到电荷的影响而对重金属离子产生影响。
常见的总体反应为M2+ + 2e- = M,其中M2+ 为沉淀的重金属离子;2.硫酸盐沉淀:硫酸盐沉淀是一种常见的沉淀反应,它以催化释放硫酸根离子的形式,将溶液中存在的部分成分沉淀出来。
反应如下:M^n+ + xH2SO4 → MSO4 + xH+ + (n – x)e-;3.氢氧化物沉淀:氢氧化物沉淀是将溶液中的部分组分通过加入还原剂(通常是碳酸钠)将其氧化转换成氢氧化物(氢氧化钠或氢氧化钾),使其沉淀出溶液中的反应。
反应如下:M2+ + 2e- + 2HCO3- = MHCO3 + H2O;4.硝酸盐沉淀:硝酸盐沉淀是一种氧化还原反应,使硝酸盐能够结晶并沉淀出溶液中的反应,其反应如下:M3+ + 3 NO3 + 11H+ = MH+ + 3 NO2 + 8 H2O;5.磷酸盐沉淀:磷酸盐沉淀是将磷酸根离子在碱性或弱酸性溶液中以沉淀形式凝固出来的反应,微量金属离子也可以与磷酸根离子结合,形成中性的无机磷酸盐,结晶并沉淀出溶液中的反应,其反应公式为M3+ + H3PO4 = MPH3O4 ;6.铵盐沉淀:铵盐沉淀是将铵离子溶于氯化钠等可溶解钠盐溶液中,由于溶液pH值超过7,会出现氢氧化钠(NaOH)离子,使铵离子产生反应,形成中性的铵盐,并沉淀出溶液中的反应,其反应如下:M3+ + NaOH = M(OH)3 ;7.海洛因沉淀:海洛因沉淀是使海洛因在溶液中以沉淀形式凝固出来的反应,反应原理是将海洛因的碱性结晶和非结晶态结合起来,形成一种新的纳米结晶,沉淀出溶液中的反应,反应式为H2C2NH2 + H2O → H2C2NH3+ + OH- ;8.铁锈沉淀:铁锈沉淀是将氢氧化铁与氢氧化镁、氢氧化钙等反应,使其结合成结晶态的三水氢氧化铁沉淀出溶液中的反应,反应式为2Fe2+ + 2H2O + Mg2+ = 2Fe3+ + Mg2+ + 4OH- ;9.铝酸盐沉淀:铝酸盐沉淀是将铝离子及其衍生物在碱性溶液中以沉淀形式凝固出来的反应,由于溶液pH值超过7,会出现氢氧化钠离子,使铝离子产生反应,形成中性的铝酸盐,结晶并沉淀出溶液中的反应,其反应如下:Al3+ + 3OH- = Al(OH)3 ;10.硼酸盐沉淀:硼酸盐沉淀是将硼离子在碱性或弱酸性溶液中以沉淀形式凝固出来的反应,微量金属离子也可以与硼酸根结合,形成中性的无机硼酸盐,结晶并沉淀出溶液中的反应,其反应公式为:M2+ +2H2BO3- = M(H2BO3)2- 。
草酸钴沉淀ph

草酸钴沉淀ph全文共四篇示例,供读者参考第一篇示例:草酸钴沉淀是指在实验室中使用草酸钴与其他试剂反应产生的沉淀物。
草酸钴是一种无机化合物,化学式为CoC2O4,是一种常见的钴盐。
草酸钴沉淀常常用于化学实验中,可以用于检测钴的存在和分离纯化钴离子。
在实验室中,草酸钴沉淀的pH值是一个重要的参数。
pH值是用来表示溶液的酸碱性强弱的指标,其数值越低表示溶液越酸性,越高表示溶液越碱性。
草酸钴沉淀的形成和稳定性与溶液的pH值密切相关。
下面我们将详细介绍草酸钴沉淀的pH值以及其相关实验过程。
草酸钴沉淀的形成可以通过在含有草酸钴的溶液中加入氢氧化钠(NaOH)来实现。
在中性或微碱性条件下,草酸钴会与氢氧化钠反应生成草酸钴沉淀。
此时,溶液的pH值会呈现碱性或中性。
通常情况下,pH值在7-9之间是适宜的条件来形成稳定的草酸钴沉淀。
当草酸钴沉淀的pH值超过9或低于7时,都会对沉淀的形成和稳定性产生影响。
当pH值过高时,会导致草酸钴沉淀不易形成或溶解;而当pH值过低时,也会影响草酸钴的沉淀效果。
控制草酸钴沉淀的pH值是至关重要的。
为了准确地控制草酸钴沉淀的pH值,我们可以通过使用pH试纸或pH计来进行检测和调节。
在实验中,我们可以在溶液中加入适量的NaOH或盐酸(HCl)来调节溶液的pH值,以确保草酸钴沉淀的形成和稳定性。
草酸钴沉淀的pH值在实验中起着重要的作用。
通过控制溶液的pH值,我们可以有效地控制草酸钴沉淀的形成和稳定性,从而实现实验的准确性和可靠性。
希望通过以上介绍,您能更深入了解草酸钴沉淀的pH值以及与实验相关的知识。
第二篇示例:草酸钴沉淀ph值是指在草酸钴沉淀实验中,水溶液的ph值。
草酸钴是一种常见的铜离子沉淀剂,它可以与水溶液中的金属铜离子发生反应,使其沉淀出来。
ph值是一个表示溶液酸碱程度的指标,数值范围从1到14,其中7为中性,小于7为酸性,大于7为碱性。
在草酸钴沉淀实验中,ph值的变化会影响沉淀率和沉淀效果,因此控制ph 值是非常重要的。
重金属沉淀蛋白质原理

重金属沉淀蛋白质原理
重金属沉淀蛋白质是一种常用的蛋白质纯化方法,其原理基于重金属离子与蛋白质中的硫醇基团形成稳定的络合物。
重金属离子通常以氯化汞(HgCl2)、硫酸铜(CuSO4)或氯化铵(NH4Cl2)等形式使用。
蛋白质中的氨基酸残基(尤其是半胱氨酸)具有硫醇基团,这些硫醇基团可以与重金属离子发生配位键结合,形成一个稳定的结合物。
这种配位反应是可逆的,在一定的条件下,重金属离子会与蛋白质分子中的硫醇基团之间形成金属硫醇桥。
在重金属沉淀蛋白质的过程中,通常将含有蛋白质的样品与重金属离子溶液混合。
在酸性条件下,重金属离子会与蛋白质中的硫醇基团发生反应,形成金属硫醇络合物。
通过离心的方式,可以将重金属蛋白质络合物沉淀下来,使其与溶液中的其他蛋白质分离。
在沉淀过程中,蛋白质与重金属络合物的稳定性取决于多个因素,包括pH值、离子浓度、沉淀时间和沉淀温度等。
调节这
些参数可以改变沉淀的选择性和纯度,从而达到对特定蛋白质的纯化目的。
需要注意的是,重金属离子具有一定的毒性,使用时需要小心操作,并且进行充分的后续洗脱步骤,以去除残留的重金属离子。
此外,对于一些对重金属离子敏感的蛋白质,该方法可能不适用。
因此,在选择合适的纯化方法时,应根据具体样品和研究目的进行考虑。
2020年常见沉淀物的PH值
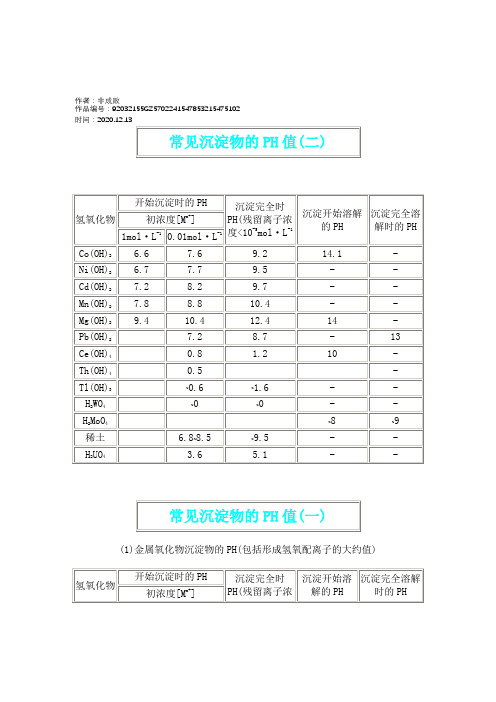
作者:非成败作品编号:92032155GZ5702241547853215475102时间:2020.12.13(1)金属氧化物沉淀物的PH(包括形成氢氧配离子的大约值)1mol·L-10.01mol·L-1度<10-5mol·L-1Sn(OH)40 0.5 1 13 15TiO(OH)20 0.5 2.0 - -Sn(OH)20.9 2.1 4.7 10 13.5ZrO(OH)21.32.33.8 - -HgO 1.3 2.4 5.0 11.5 -Fe(OH)31.52.3 4.1 14Al(OH)33.34.05.2 7.8 10.8Cr(OH)34.0 4.9 6.8 12 15Be(OH)25.26.2 8.8 - -Zn(OH)25.4 6.4 8.0 10.5 12~13Ag2O 6.2 8.2 11.2 12.7 -Fe(OH)26.57.5 9.7 13.5 -废水中重金属离子在碱性条件下可形成氢氧化物沉淀,然后通过固液分离装置除掉沉渣。
但各金属氢氧化物沉淀析出的最佳pH值有所不同。
根据文献报道[1],镍氢氧化物沉淀析出的理论pH值范围分别为8.49~9.49、、铅氢氧化物沉淀析出的理论pH值范围分别为7.88~8.88<18.3>重金屬廢水處理重金屬廢水處理最經濟而簡單的處理方法為化學沉澱,就是加入石灰提高廢水之PH,使重金屬離子變成氫氧化物沉澱去除重金屬離子之沉澱作用與PH的關係如下表所示:重金屬離子適合沉澱之PH 最佳沉澱之PHFe^3+,Sn^2+,Al^2+ 4 7 Cu^2+,Zn^2+,Cr^3+,Be^2+ 6 9 Fe^2+ 7 10 Cd^2+,Ni^2+,Co^2+,Cu^2+ (濃) 8 11 Ag^+,Mn^2+,Hg^+ 9 12作者:非成败作品编号:92032155GZ5702241547853215475102时间:2020.12.13。
