常见有机化合物的紫外可见吸收光谱
有机化合物的紫外吸收光谱及溶剂性质对吸收光谱的影响

2、试剂:苯、乙醇、正己烷、氯仿、丁酮等
四、实验步骤
1、苯的吸收光谱的测绘(五指峰) 2、乙醇中杂质苯的检测 3、溶剂的性质对紫外吸收光谱的影响 (1)做三条吸收光谱:丁酮和水、丁酮和乙 醇、丁酮和氯仿,比较它们λmax的变化。 (2)做三条吸收光谱:异亚丙基丙酮分别用 水、氯仿、正己烷配制,比较它们λmax的 变化。
紫外吸收光谱
可见吸收光谱
红外吸收光谱
主要有四种跃迁类型
跃迁所需能量为: σ→σ* n→σ* π→π* n→π*
分子中电子的能级和跃迁
π→π*跃迁 π电子跃迁到反键π* 轨道所产生的跃迁,这
类跃迁所需能量比σ→σ*跃迁小,若无共轭, 与n→σ*跃迁差不多。200nm左右 吸收强度大,在104~105范围内,强吸收
若有共轭体系,波长向长波方向移动,相
当于200~700 nm
含不饱和键的化合物发生π→π*跃迁
C=O ,
C=C,
C≡C
n→π*跃迁
n电子跃迁到反键 π* 轨道所产生的跃迁,这类
跃迁所需能量较小,吸收峰在200~400 nm左右 吸收强度小,ε <102,弱吸收 含杂原子的双键不饱和有机化合物 C=S O=N- -N=N例:丙酮 λmax=280 nm
传统型:722
瑞丽:UV-1201
主要部件光 源单色器源自样品室检测器显示系统
普通玻璃
石英玻璃
仪器操作步骤: 打开电脑及仪器开关 运行Instrument 1 online
按需取/使用数据
Mode中选Standard 放入参比溶液 Blank 放入样品溶液 Sample 保存文件
有机化合物的紫外-可见吸收光谱
O O
(共轭双键)
一些含有n电子的基团,本身没有生色功能,但当 它们与生色团相连时,就会发生n—π共轭作用,增 强生色团的生色能力,这样的基团称为助色团。
: : :
助色团:-NH2,-OH,-X (孤对电子)等
2
:
红移和蓝移
3
有机化合物的紫外光谱解析
了解共轭程度、空间效应、氢键等;可对饱和与不饱 和化合物、异构体及构象进行判别。 ⑴ 在200~750nm波长范围内若无吸收峰,则可能是 直链烷烃、环烷烃、饱和脂肪族化合物或仅含一个双 键的烯烃等。若有低强度吸收峰(ε=10~100 L·mol1·cm-1),(n→π跃迁),则可能含有一个简单非共轭且 含有n电子的生色团,如羰基。 ⑵ 若在250~300 nm波长范围内有中等强度的吸收峰 则可能含苯环。
滴定剂与待 测物均吸收
产物吸收
Vsp
Vsp
24
8.5.4 络合物组成的测定
1. 摩尔比法: 固定cM ,改变cR
A
1:1 1.0 2.0
3:1 3,0 c(R)/c(M)
25
2. 等摩尔连续变化法:
M:R=1:1
cM + cR = c(常数)
M:R=1:2
0.5 cM/c cM/c
0 0.2 0.4 0.6 0.8 1 0 0.2 0.4
6
电荷转移吸收光谱
分子中金属离子轨道上的电荷吸收光能后转移到 配体的轨道上,或按反方向转移,这种跃迁称为电 荷转移跃迁,所产生的吸收光谱称为荷移光谱。 本质上属于分子内氧化还原反应 ε一般都较大(104左右),适于微量金属的检测 例:Fe3+与SCN-形成血红色配合物,在490 nm处 有强吸收峰。其实质是发生了如下反应: [Fe3+-SCN-]2+ +hν= [Fe2+-SCN]2+
实验三: 有机化合物的紫外-可见吸收光谱及溶剂效应

实验三:有机化合物的紫外-可见吸收光谱及溶剂效应一、实验目的1、了解紫外-可见分光光度法的原理及应用范围。
2、了解紫外-可见分光光度计的基本构造及设计原理。
3、了解苯及衍生物的紫外吸收光谱及鉴定方法。
4、观察溶剂对吸收光谱的影响。
二、实验原理紫外-可见分光光度法是光谱分析方法中吸光测定法的一部分。
1、紫外-可见吸收光谱的产生紫外可见吸收光谱是由于分子中价电子的跃迁而产生的。
这种吸收光谱决定于分子中价电子的分布和结合情况。
分子内部的运动分为价电子运动、分子内原子在平衡位置附近的振动和分子绕其重心的转动。
因此分子具有电子能级、振动能级和转动能级。
通常电子能级间隔为1至20eV,这一能量恰落在紫外与可见光区。
每一个电子能级之间的跃迁,都伴随着分子的振动能级和转动能级的变化,因此,电子跃迁的吸收线就变成了内含有分子振动和转动精细结构的较宽的谱带。
芳香族化合物的紫外光谱的特点是具有由π→π*跃迁产生的3个特征吸收带。
例如,苯在184nm附近有一个强吸收带,ε=68000;在204nm处有一较弱的吸收带,ε=8800;在254nm附近有一个弱吸收带,ε=250。
当苯处在气态时,这个吸收带具有很好的精细结构。
当苯环上带有取代基时,则强烈地影响苯的3个特征吸收带。
2、紫外-可见光谱分析法的应用1)化学物质的结构分析;2)有机化合物分子量的测定;3)酸碱离解常数的测定;4)标准曲线法测定有机化合物的含量;5)络合物中配位体/金属比值的测定;6)有机化合物异构物的判别等。
3、紫外-可见分光光度计的基本构造三、实验仪器与试剂仪器:Cary500紫外-可见-近红外分光光度计比色管(带塞):5mL10支,10mL3支;移液管:1mL6支,0.1mL2支试剂:苯、乙醇、环己烷、正己烷、氯仿、丁酮溶液:HCl(0.1mol•L-1),NaOH(0.1 mol•L-1),苯的环己烷溶液(1:250),甲苯的环己烷溶液(1:250),苯的环己烷溶液(0.3g•L-1),苯甲酸的环己烷溶液(0.8g •L-1),苯酚的水溶液(0.4 g•L-1)。
有机化合物的紫外可见吸收光谱
1:1
3:1
1.0
2.0 3,0 c(R)/c(M)
25
2. 等摩尔连续变化法: cM + cR = c(常数)
M:R=1:1
M:R=1:2
0.5
cM/c
0 0.2 0.4 0.6 0.8 1
0.33
cM/c
0 0.2 0.4 0.6 0.8 1
M + nR �������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������
化学实验室-有机化合物的紫外吸收光谱及溶剂性质对吸收光谱

利用其在235nm波长处的吸 Mode中选Standard
品浓度。 无酚水,酚标准溶液,1mol/L NaOH
01mol/L的NaOH溶液作参与,用2cm比色皿于波长235nm处分别测定其吸光度。 紫外分光光度计,2cm比色皿 1、石英吸收池每换一种溶剂或溶液必须清洗干净,并用被测溶液或参比溶液荡洗三次。 01mol/L的NaOH溶液作参与,用2cm比色皿于波长235nm处分别测定其吸光度。 利用其在235nm波长处的吸 01mol/L的NaOH溶液作参与,用2cm比色皿于波长235nm处分别测定其吸光度。 光度可定量测定总酚的含量。
紫外光度法测定水中的总酚量
一、实验目的 1、了解水中总酚量测定的重要性。 2、掌握紫外法测定水中总酚量的原理与技术。
二、实验内容 1、工作曲线的绘制。 2、测定水样中总酚量。
二、基本原理
波长范围:200-400nm
酚在碱性溶液中(PH=10-12)在紫外光区有强吸收。利用其在235nm波长处的吸 光度可定量测定总酚的含量。
三 仪器与试剂
四
紫外分光光度计,2cm比色皿
五
无酚水,酚标准溶液,1mol/L
NaOH
四 实验步骤
1.工作曲线的绘制: 分别吸取酚标准溶液0 0.25 ,0.50,1.00,
1.50,2.00,2.50ml于7支50ml比色管中,分 别加入0.5ml 1mol/L NaOH溶液,加水至标 线,混匀,调节PH在10-12之间。以 0.01mol/L的NaOH溶液作参与,用2cm比色 皿于波长235nm处分别测定其吸光度。
以浓度为横坐标,吸光度为纵坐标,建立 工作曲线。
(完整版)图吸收光谱曲线

(8) B带
➢ 由芳香族化合物的π →π*跃迁而产生的精 细结构吸收带。
例如: 苯的B带: 摩尔吸光系数:200 L ·mol-1 ·cm-1 吸收峰的位置:230~270nm之间
(9) E带
➢ 芳香族化合物的π →π*跃迁所产生的吸收带, 也是芳香族的特征吸收峰。
苯的紫外吸收光谱
4、影响紫外-可见吸收光谱的因素
(2) 助色团
➢ 助色团是指本身不产生吸收峰,但与生色团 相连时,能使生色团的吸收峰向长波方向移动, 并使其吸收强度增强的基团。
例如:
—NH2 、—OH 、—OR 、—SH 、—SR 、—Cl 、—Br等
(3) 红移和蓝移
➢ 在有机化合物中,常常因取代基的变更或溶 剂的改变,使其吸收带的最大吸收波长max发生 移动。
例如:含有杂原子的不饱和基团:
(4) 电荷转移跃迁:
➢ 某些分子同时具有电子给予体和电子接受体, 它们在外来辐射照射下会强烈吸收紫外光或可 见光,使电子从给予体轨道向接受体轨道跃迁, 这种跃迁称为电荷转移跃迁,其相应的吸收光 谱称为电荷转移吸收光谱。
➢ 电荷转移跃迁实质上是一个内氧化还原过程。
例如:某些取代芳烃可产生这种分子内电荷转移 跃迁的吸收带。
➢ n → σ* 跃迁的摩尔吸光系数ε较小
(2) π→ π*跃迁:
➢ 吸收峰处于近紫外光区,在200nm左右,摩
ε 尔吸收系数 max > 104 L ·mol-1 ·cm-1 ,为强吸收带。
例如:含有π电子的基团:
(3) n → π*跃迁:
➢ 近紫外-可见光区,ε<100 L ·mol-1 ·cm-1
3、常用术语 (1) 生色团
➢ 生色团是指分子中能吸收紫外或可见光的 基团,它实际上是一些具有不饱和键和含有 孤对电子的基团。
第五章 紫外-可见吸收光谱 第三节 紫外-可见吸收光谱与分子结构的关系

含取代基时,B带简化, 红移,增色。
1,3,5-三甲苯
六甲苯
23:09:45
266
272
305
300
共轭多烯的λmax的计算
Woodward-Fieser 规则
链状及环状共轭多烯的λmax的计算。 首先从母体得到一个最大吸收的基本值,然 后对连接在母体π电子体系上的不同取代基 以及其它结构因素加以修正。
H 3C
O
OH
CH3
六元环不饱和酮基本值 215 nm 烷基取代 β位2 + 2 × 12nm 羟基取代 α位1 + 35 nm λmax计算值 =274nm (λmax实测值=274nm)
23:09:45
小的现象分别称为增色效应 或减色效应,如图所示。
23:09:45
吸收带
R吸收带:这是由n→π* 跃迁而产生的吸收带,特点是强度 较弱,摩尔吸光系数小于100,吸收峰位于200400nm之间(德文Radikalartig )。 K吸收带:共轭非封闭体系中的π→π*跃迁吸收带,一般为 强吸收(ε在104以上)。应用较多。极性溶剂使 K带发生红移(德文Konjugierte) 。 B吸收带(苯吸收带):芳香族和杂芳香族化合物的π→π* 跃迁吸收带,为弱吸收带(230-270nm),摩尔吸光 系数约为102。多重峰,精细结构,芳环上有取代基 时,B带的精细结构消失(英文Benzenoid) 。 E吸收带:封闭共轭体系中π→π*跃迁吸收带。吸收较强。 分为E1(185nm)和E2(204nm)吸收带,可以分别看成 乙烯和共轭乙烯的吸收带。也是芳香结构化合物 的特征谱带(英文Ethylenic )。
23:09:45
(2) 含有孤立双键或三键化合物
典型化合物是乙烯 乙烯π→π*跃迁的λmax为162nm,εmax为: 1×104 L· -1· -1。 mol cm
紫外可见吸收光谱基本原理
n→π* < π→π* < n→σ* < σ→σ*
11:51:47
2
σ→σ*跃迁
所需能量最大;σ电子只有吸收远紫外光的能量
才能发生跃迁;
饱和烷烃的分子吸收光谱出现在远紫外区; 吸收波长λ <200 nm; 例:甲烷的λ max为125nm , 乙烷λ max为135nm 。 只能被真空紫外分光光度计检测到; 作为溶剂使用;
max(甲醇) max(水) max(氯仿)
n → p*跃迁:蓝移; ;
max(正己烷)
p → p* n → p*
230 329
11:51:47
238 315
237 309
243 305
溶剂的影响
苯 酰 丙 酮 1 1:乙醚 2:水
2
250
300
极性溶剂使精细结构 消失;
11:51:47
11:51:47
11:51:47
精品课件!
11:51:47
精品课件!
11:51:47
(三) 金属离子影响下的配位体内π→π*跃迁 金属离子的微扰,将引起配位体吸收波长和 强度的变化。变化与成键性质有关,若共价 键和配位键结合,则变化非常明显。 茜素磺酸钠: 弱酸性介质:黄色(λ max=420nm) 弱碱性介质:紫红色(λ max=560nm )
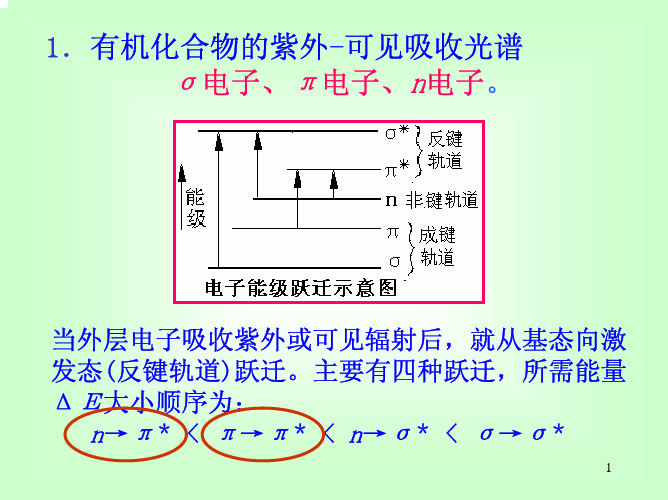
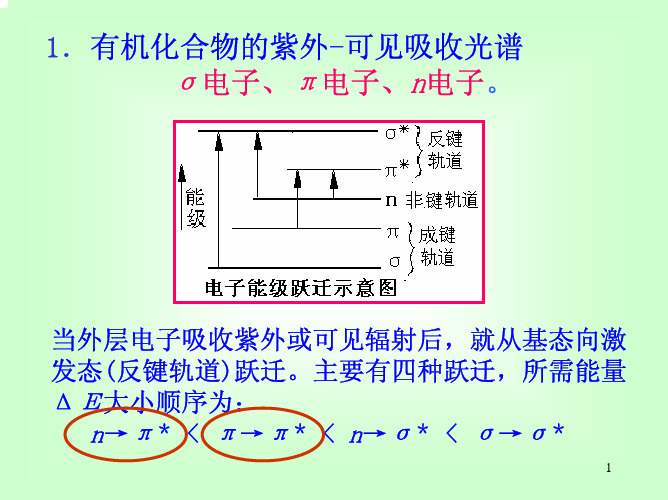
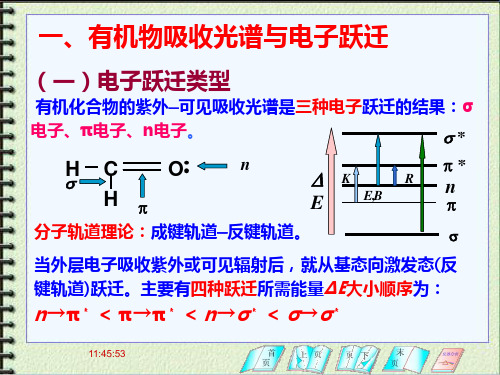
一、有机物吸收光谱与电子跃迁
(一)电子跃迁类型
有机化合物的紫外—可见吸收光谱是三种电子跃迁的结果: σ电子、π电子、n电子。 s*
E p 分子轨道理论:成键轨道—反键轨道。
s
H
C H
OnKR Nhomakorabeap*
E,B
n
p
s
当外层电子吸收紫外或可见辐射后,就从基态向激发态(反 键轨道)跃迁。主要有四种跃迁所需能量ΔΕ大小顺序为:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
A=a b ρ
a 的单位: L·g-1·cm-1
②当c的单位用mol·L-1时,比例常数用ε表示,称为摩尔吸光系数
A= εb c
ε的单位: L·mol-1·cm-1
ε=Ma
M—物质的摩尔质量
摩尔吸光系数的物理意义:
溶液浓度为1mol/L、液层厚度为1cm时物质对光的 吸收程度
(1)吸收物质在一定波长和溶剂条件下的特征常 数
频率( עHz)、波长λ(nm)和波数σ(cm-1) 等参数描述。它们之间的关系为: =1/T=c/λע /cעσ=1/λ=
波谱区名称
射线
X射线
远紫外 光
近紫外 光
光
可见光
学
光
谱 区
近红外 光
中红外 光
远红外 光
微波
射频(无线电波)
波长范围
0.005 nm~0.14nm
0.001 nm ~10nm 10 nm ~200nm
电子自旋、分子转 动能级
电子和核自旋
分析方法 放射化学分析法
X射线光谱法 真空紫外光度法 紫外分光光度法
比色法、可见分光光 度法
近红外光光谱法
中红外光光谱法
远红外光光谱法
微波光谱法 核磁共振光谱法
2.光的粒子性 光具有粒子性,光是由光子组成的,光子具
有能量,其能量与频率或波长的关系为:
E=h =עh·c /λ J·s34-h=6.626x10 例1-1 P2
定义吸光度 :
A 取值为 0.0 ~∞
二者关系为:
A lg I 0 It
全部透射~~~全部吸收
A = lg(1/T) = -lgT
2.朗伯-比尔定律
朗伯-比尔定律:当一束平行单色光通过含有 吸光物质的稀溶液时,溶液的吸光度与吸 光物质浓度、液层厚度乘积成正比,即 A= κbc 式中比例常数κ与吸光物质的本性,入射 光波长及温度等因素有关。K可用a(吸光
白光 紫
青蓝 蓝
一种物质现何种颜色,与入射光组成和物质本身的结构 有关,而溶液呈现不同的颜色是由于溶液中的吸光质点(离子或 分子)选择性地吸收某种颜色的光而引起的。
常见的有下列三种情况:
①当白光通过某一均匀溶液时,如果各种波长光几乎全部被吸 收,则溶液呈黑色。
②如果入射光全部透过(不吸收),则溶液无色透明。
光子作用于物质分子时,如果光子的能量 与物质分子的电子能级间的能级差满足
△E=h ע 光子将能量传递给物质分子,分子获得能量 可发生电子能级的跃迁。在光吸收过程中 基于分子中电子能级的跃迁而产生的光谱, 可见吸收光谱(或电子光谱)。-称为紫外
吸收曲线:测定某种物质对不同波长单色光的吸 收程度,以波长为横坐标,吸光度为纵坐标作图。
200 nm ~400nm
400 nm ~750nm 0.75μm ~2.5μm
2.5μm ~50μm
15μm ~1000μm
0.1 cm ~100cm
1m ~1000m
跃迁能级类型
原子核能级
内层电子能级 内层电子能级 价电子或成键电子
能级 价电子或成键电子
能级 分子振动能级
分子振动能级
分子转动能级
例: 铬酸盐或重铬酸盐溶液中存在下列平衡: 2 CrO42- +2H+ = Cr2O72- +H2O
溶液中CrO42-、 Cr2O72-的颜色不同,吸光性质也不相同。 故此时溶液pH 对测定有重要影响。
故:朗伯—比耳定律只适用于稀溶液
例:显色剂KSCN与Fe3+形成红色配合物Fe(SCN)3,存在下列平 衡:
⑴ σ→σ*跃迁
所需能量最大,σ电子只有吸收远紫 外光的能量才能发生跃迁。饱和烷烃 的分子吸收光谱出现在远紫外区(吸 收波长λ<200nm,只能被真空紫外 分光光度计检测到)。如甲烷的λmax 为125nm,乙烷λmax为135nm。
⑵ n→σ*跃迁
所需能量较大。吸收波长为150~ 250nm,大部分在远紫外区,近紫外区 仍不易观察到。含非键电子的饱和烃衍生 物(含N、O、S和卤素等杂原子)均呈现 n→σ*跃迁。如一氯甲烷、甲醇、三甲基 胺n→σ*跃迁的λmax分别为173nm、 183nm和227nm。
于分子中外层电子的性质。有机化合 物分子中通常有三类电子,
σ电子、π电子、n电子
即形成单键的σ电子、形成不饱 和键的π电子以及未参与成键的n 电子(孤对电子)。处于基态的 分子在吸收一定波长的光后,分 子中的成键电子和非键电子可被 激发跃迁至σ* 和π* 反键轨道
有机化合物的紫外—可见吸收光谱,是其分子 中外层价电子跃迁的结果:
四、光吸收定律
当一束平行单色光,通过一均匀的溶液后,光的强度会减弱 。
入 射 光I0
透 射 光It
I0 = Ia + It
入射光强度
吸收光强度 透过光强度
透光度T (透射比)Transmittance
定义透光度:
T It I0
T 取值为0.0 ~ 1.0 全部吸收 ~~~~ 全部透射
吸光度A (Absorbance)
也适用红外光;在同一波长下,各组分吸 光度具有加和性
A=A1+A2++An (1)入射光必须为单色光 (2)被测样品必须是均匀介质 (3)在吸收过程中吸收物质之间不能发生相
互作用。
4.偏离朗伯一比尔定律的原因
定量分析时,通常液层 厚度是相同的,按照比尔 定律,浓度与吸光度之间 的关系应该是一条通过直 角坐标原点的直线。但在 实际工作中,往往会偏离 线性而发生弯曲。
系数)或ε(摩尔吸光系数)表示。 c为 吸光物质浓度,b为透光液层厚度。
朗伯-比尔定律是紫外-可见分光光度法的理 论基础。
2.朗伯-比尔定律
朗伯和比尔分别研究了吸光度与液层厚度和吸光度与浓度之 间的定量关系,合称朗伯-比尔定律,其数学表达式为:
A=lg(I0/It)=κbc
吸光质点浓度
吸光度
吸收层厚度
(2)不随浓度c和液层厚度b的改变而改变。
在温度和波长等条件一定时,ε仅与吸收物质本 身的性质有关,与待测物浓度无关;
(3)同一吸光物质在不同波长下的ε值是不同的。 在最大吸收波长λmax处的摩尔吸光系数,常以 εmax表示
εmax表明了该吸收物质最大限度的吸光能力。
3.朗伯-比尔定律的应用条件 朗伯-比尔定律不仅适用于紫外光、可见光,
分子轨道理论:一个成键轨 道必定有一个相应的反键轨 道。通常外层电子均处于分 子轨道的基态,即成键轨道 或非键轨道上。
其跃迁类型有σ→σ*、n→σ*、π→π* 和n →π*四种,其相对能量 大小次序为:
σ→σ*> n→σ*> π→π*> n →π* 有机物最有用的吸收光谱是基于 n →π*和π→π*跃迁而产生的。
二、光与物质的作用
1.光的吸收 物质粒子如原子、分子、离子等总是处于特
定的不连续的能量状态,各状态对应的能 量称为能级,用E表示。基态E0 ,激发态Ej
EL=h △=עE(能级差) P3】 2-1例【
2.物质颜色的产生
物质的颜色是由于物质对不同波长的光具 有选择性吸收而产生的。
绿 黄
青
橙 红
四种不同浓度KMnO4溶液的吸收曲线
Absorbance
Cr2O72-、MnO4-的吸收曲线
350
1.0
Cr2O72-
0.8
0.6
525 545 MnO4-
0.4
0.2 300 350 400
500
600
700
/nm
吸收曲线的讨论:
(1)同一种吸光物质对不同波长的光吸收程度不 同。吸光度最大处对应的波长称为最大吸收波长
最大吸收波长,max
定量分析的基础:某一波长 下测得的吸光度与物质浓度 关系的有关
KMnO4 的吸收曲线
2、吸收光谱或吸收曲线
任何一种溶液对不同波长光的吸收程度是不一样的。 若以不同波长的光照
射某一溶液,并测量每 一波长下溶液对光的吸 收程度(即吸光度A), 以吸光度为纵坐标,相 应波长为横坐标,所得 A-λ曲线,称为吸收曲线。 它更清楚地描述了物质 对光的吸收情况。
⑶ π→π*跃迁
所需能量较小,吸收波长处于远紫外区 的近紫外端或近紫外区,摩尔吸光系数 εmax一般在104L·mol-1·cm-1以上, 属于强吸收。不饱和烃、共轭烯烃和芳香 烃类均可发生该类跃迁。如乙烯π→π*跃 迁的λmax为162nm,εmax为: 1×104L·mol-1·cm-1。
⑷ n→π*跃迁
λmax 。
吸收曲线是定量分析中选择入射光波长的重要依 据。 (2)同一种物质浓度不同,其吸收曲线形状相似
λmax不变。 在λmax处,吸光度A正比于浓度C。测定最灵敏。
(3)不同物质吸收曲线的特性不同。吸收曲线的特 性包括曲线的形状、峰的数目、峰的位置和峰的 强度等。它们与物质特性有关,吸收曲线可以提 供物质的结构信息,并作为物质定性分析的依据 之一。
第一章 紫外—可见分光光度法
紫外—可见分光光度法是利用物质对紫 外 —可见光的吸收特征和吸收强度,对物质 进行定性和定量分析的一种仪器分析方法。
特点:灵敏度和准确度较高,仪器设备简 单,操作方便,应用广泛等。
第一节 基本原理
一、光的基本特性 1.光的波动性 光是一种电磁波,电磁波可以用周期T(s)、
③如果对某种色光产生选择性吸收,则溶液呈现透射光的颜 色,即溶液呈现的是它吸收光的互补色光的颜色。如硫酸铜 溶液选择性地吸收了白色光中的黄色光,所以呈现蓝色。
溶液的颜色与光吸收的关系
完全吸收
光谱示意 复合光 表观现象示意
完全透过
吸收黄色光
物质呈现颜色与吸收光波长的关系见下表。
三、光谱吸收曲线
