高考化学-氧化物分类
高考化学物质性质总结

重排反应
频哪醇重排、贝克曼重排等, 涉及碳正离子或碳负离子的重
排。
典型例题解析
例题1
某有机物的分子式为C5H10O2,能与NaHCO3反应生成气体,则该有机物可能的结构 有( )种。
例题2
下列关于有机物的说法正确的是( )A. 乙醇和乙酸都存在碳氧双键 B. 甲烷和乙烯都可 以与氯气反应 C. 高锰酸钾可以氧化苯和甲烷 D. 乙烯可以与氢气发生加成反应,苯不能
典型例题解析
例题2:下列关于铁及其化合物的说 法中正确的是 ( )
B. 铁在潮湿的空气中易生锈,其负极 反应式为 Fe - 3e⁻ = Fe³⁺
A. 铁元素在自然界中只以化合态存在
典型例题解析
C. 铁与氯气反应时,无论氯气是否过 量,反应都生成 FeCl₂
D. 常温下,铁与浓硝酸不反应,故可 用铁槽车运输浓硝酸
与氢气加成。
06
无机非金属材料及新型材料简介
无机非金属材料概述
定义
无机非金属材料是以某些元素的氧化物、碳化物、氮化物、卤素化合物、硼化物以及硅酸 盐、铝酸盐、磷酸盐、硼酸盐等物质组成的材料。是除有机高分子材料和金属材料以外的 所有材料的统称。
分类
无机非金属材料的分类,根据材料晶格特征的不同,又分为单质和化合物,例如金刚石、 石墨、硼、硅等;化合物又可以分为酸、碱、盐和氧化物等。
日期:
高考化学物质性质总结
演讲人:
目 录
• 物质分类与性质概述 • 金属及其化合物性质 • 非金属及其化合物性质 • 离子反应与电解质溶液性质 • 有机化合物性质与结构特点 • 无机非金属材料及新型材料简介
01
物质分类与性质概述
物质分类方法
01
02
高考化学易错点汇总(含详解)

高考化学易错点汇总(含详解)1.对氧化物分类的认识错误地认为酸性氧化物一定是非金属氧化物,非金属氧化物一定是酸性氧化物,金属氧化物一定是碱性氧化物。
酸性氧化物与非金属氧化物是两种不同的分类方式,酸性氧化物不一定是非金属氧化物,如CrO3、Mn2O7是酸性氧化物;非金属氧化物不一定是酸性氧化物,如CO、NO和NO2等。
碱性氧化物一定是金属氧化物,而金属氧化物不一定是碱性氧化物,如Al2O3是两性氧化物,CrO3是酸性氧化物。
2.认为胶体带有电荷胶体是电中性的,只有胶体粒子即胶粒带有电荷,而且并不是所有胶体粒子都带有电荷。
如淀粉胶体粒子不带电荷。
3.认为有化学键被破坏的变化过程就是化学变化。
化学变化的特征是有新物质生成,从微观角度看就是有旧化学键的断裂和新化学键的生成。
只有化学键断裂或只有化学键生成的过程不是化学变化,如氯化钠固体溶于水时破坏了其中的离子键,离子晶体和金属晶体的熔化或破碎过程破坏了其中的化学键,从饱和溶液中析出固体的过程形成了化学键,这些均是物理变化。
4.认为同种元素的单质间的转化是物理变化。
同种元素的不同单质(如O2和O3、金刚石和石墨)是不同的物质,相互之间的转化过程中有新物质生成,是化学变化。
5.认为气体摩尔体积就是22.4L·mol-1两者是不同的,气体摩尔体积就是1 mol气体在一定条件下占有的体积,在标准状况下为22.4 L,在非标准状况下可能是22.4 L,也可能不是22.4 L6.在使用气体摩尔体积或阿伏加德罗定律时忽视物质的状态或使用条件。
气体摩尔体积或阿伏加德罗定律只适用于气体体系,既可以是纯净气体,也可以是混合气体。
对于固体或液体不适用。
气体摩尔体积在应用于气体计算时,要注意在标准状况下才能用22.4 L·mol-17.在计算物质的量浓度时错误地应用溶剂的体积。
物质的量浓度是表示溶液组成的物理量,衡量标准是单位体积溶液里所含溶质的物质的量的多少,因此在计算物质的量浓度时应用溶液的体积而不是溶剂的体积。
(完整版)高三化学知识点填空

高三化学知识小卡片(1)知识点:氧化物的分类:一.氧化物的分类:1.成盐氧化物:⑴酸性氧化物:如SO3 + NaOH =⑵碱性氧化物:如MgO + H2SO4 =⑶两性氧化物:如Al2O3 + HCl =Al2O3 + NaOH =⑷复杂氧化物:如Na2O2、KO2、Fe3O4、Pb3O4Na2O2 + HCl =Fe3O4 + HCl(浓) =Pb3O4 + HCl(浓) =2.不成盐氧化物:如CO、NO二.易混淆概念的分辨:判断正误,并举例说明:(画“√”或“×”)⑴非金属氧化物一定是酸性氧化物()如⑵酸性氧化物一定是非金属氧化物()如⑶金属氧化物一定是碱性氧化物()如⑷碱性氧化物一定是金属氧化物()如高三化学知识小卡片(2)知识点:离子共存(一):判断溶液中离子是否大量共存可以从以下几方面加以具体分析1.分析溶液的颜色:若题目限定是无色透明:则溶液中一定无Fe2+(色)、Fe3+(色)、Cu2+(色)、MnO4-(色)等离子。
2.生成沉淀:SO42-+ Ba2+ =Ag+ + Cl-= Ca2+ + CO32-=3.分析溶液的酸碱性:⑴若题目限定为碱性,不能大量存在的有:a、H+,H+ + OH-=b、生成弱碱或不溶碱的阳离子:Fe3+、Al3+、Mg2+、Cu2+、Ag+、NH4+等。
Fe3+ + OH-= Al3+ + OH-(过量) = NH4+ + OH-=c、酸式酸根离子:HCO3-、HSO3-、H2PO4-、HS-等。
HCO3-+ OH-= H2PO4-+ OH-(过量) =HS-+ OH-=高三化学知识小卡片(3)知识点:离子共存(二):3.⑵若题目限定为酸性,不能大量存在的有:a、OH-b、弱酸根离子AlO2-、CO3-、HCO3-、SiO32-、S2-、HS-、PO43-、CH3COO-、F-、HSO3-、SO32-等。
SiO32-+ H+= AlO2-+ H+(过量) =4.各种离子间发生氧化还原反应:Fe3+与S2-、I-、SO32-;ClO-、MnO4-(H+)、NO3-(H+)与S2-、I-、SO32-、Fe2+Fe3+ + S2-= Fe3+ + I-=Fe3+ + SO32-+ H2O =MnO4-+ Fe2+ + H+ =5.能发生双水解反应的离子:Al3+与(S2-、CO32-、HCO3-、AlO2-)Fe3+与(CO32-、HCO3-、ClO-)NH4+与(AlO2-、SiO32-)Al3+ + AlO2-+ H2O =Al3+ + S2-+ H2O =Al3+ + HCO3-=Fe3+ + HCO3-=NH4+ + SiO32-+ H2O = 高三化学知识小卡片(5)知识点:离子方程式的书写(一):量多量少写法不一样⑴Al2(SO4)3溶液中加入少量NaOH溶液⑵Al2(SO4)3溶液中加入过量NaOH溶液⑶NaAlO2溶液中加入少量HCl⑷NaAlO2溶液中加入过量HCl⑸NaAlO2溶液中通入少量CO2⑹NaAlO2溶液中通入过量CO2⑺过量的Fe粉跟稀HNO3反应知识点:离子方程式的书写(二):与量有关的离方。
高考化学物质分类最全汇总(附易错分类汇总)(理科生必收)

高考化学物质分类汇总一、混合物混合物是由两种或两种以上物质混合而成的物质。
下面列举常见的混合物:●分散系:溶液、胶体、浊液等●高分子化合物:蛋白质、纤维素、淀粉、塑料等●其他物质:石油及其各种馏分、天然气、油脂、福尔马林、氨水、王水、碱石灰等二、纯净物纯净物与混合物相对,是由一种物质组成,有固定的物理性质和化学性质的物质。
纯净物有专门的化学符号,能用一个化学式表示。
继续细化纯净物的组成可将其分为:1.单质单质是由同一种元素组成的纯净物。
●金属单质:例如:K、Ca、Na、Mg、Al 等●非金属单质:例如:S、Cl2、He 等注意:●只含一种元素的物质不一定是纯净物。
如氧气O2 和臭氧O3 混合得到的物质是混合物●同种元素的同位素单质混合得到的物质是纯净物。
如氢的同位素氕氘氚组成的双原子分子H2、D2、T2 混合在一起得到的是纯净物●含水的物质不一定是混合物。
如胆矾CuSO4 • 5H2O、绿矾FeSO4 • 7H2O、明矾KAl(SO4)2 • 12H2O 都是纯净物2.化合物化合物是由两种或两种以上的元素组成的纯净物。
A. 按化合物的性质分类①氧化物氧元素与另外一种化学元素组成的二元化合物叫做氧化物。
氧化物可分为:I.酸性氧化物酸性氧化物指与水反应生成相应价态的酸,或与碱反应只生成一种相应价态的盐和水的氧化物。
例如:SO2、SO3、P2O5、SiO2、Mn2O7 等注意:●酸性氧化物不一定是非金属氧化物。
如高锰酸酐Mn2O7 既是酸性氧化物,又是金属氧化物●非金属氧化物不一定是酸性氧化物。
如一氧化碳CO、一氧化氮NO、二氧化氮NO2 都是不成盐氧化物●酸性氧化物不一定能与水反应生成相应的酸。
如二氧化硅SiO2 不与水反应●能与碱反应生成盐和水的氧化物不一定是酸性氧化物。
如二氧化氮NO2 是不成盐氧化物,氧化铝Al2O3 是两性氧化物●酸性氧化物一定是酸酐,但酸酐不一定是酸性氧化物。
如乙酸酐CH3COOOCCH3 含有三种元素,不是氧化物,故不是酸性氧化物II.碱性氧化物碱性氧化物指与水反应生成相应价态的碱,或与酸反应只生成一种相应价态的盐和水的氧化物。
2019高考化学考点点拨 离子反应
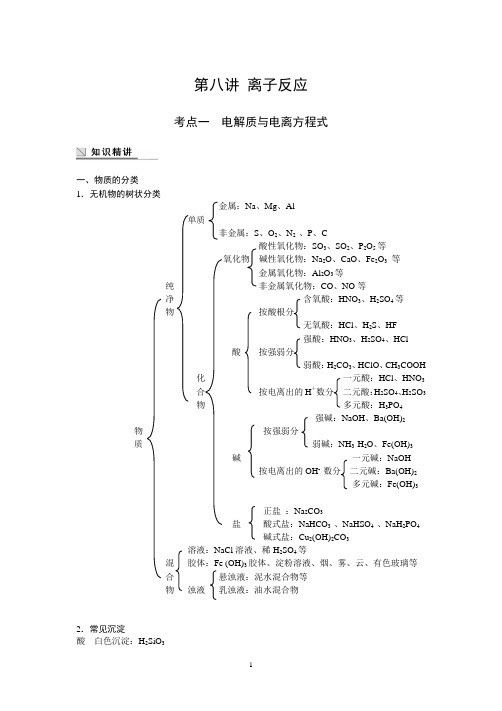
第八讲离子反应考点一电解质与电离方程式一、物质的分类1.无机物的树状分类金属:Na、Mg、Al单质非金属:S、O2、N2 、P、C酸性氧化物:SO3、SO2、P2O5等氧化物碱性氧化物:Na2O、CaO、Fe2O3等金属氧化物:Al2O3等纯非金属氧化物:CO、NO等净含氧酸:HNO3、H2SO4等物按酸根分无氧酸:HCl、H2S、HF强酸:HNO3、H2SO4、HCl酸按强弱分弱酸:H2CO3、HClO、CH3COOH化一元酸:HCl、HNO3合按电离出的H+数分二元酸:H2SO4、H2SO3物多元酸:H3PO4强碱:NaOH、Ba(OH)2 物按强弱分质弱碱:NH3·H2O、Fe(OH)3碱一元碱:NaOH按电离出的OH- 数分二元碱:Ba(OH)2多元碱:Fe(OH)3正盐:Na2CO3盐酸式盐:NaHCO3 、NaHSO4 、NaH2PO4碱式盐:Cu2(OH)2CO3溶液:NaCl溶液、稀H2SO4等混胶体:Fe (OH)3胶体、淀粉溶液、烟、雾、云、有色玻璃等合悬浊液:泥水混合物等物浊液乳浊液:油水混合物2.常见沉淀酸白色沉淀:H2SiO3红褐色沉淀:Fe(OH)3碱 蓝色沉淀:Cu(OH)2白色沉淀:Fe(OH)2、Mg(OH)2、Al(OH)3白色沉淀:CaCO 3、BaCO 3、AgCl 、BaSO 4盐 黑色沉淀:AgS 、CuS(不溶于水和酸);FeS(不溶于水,可溶于酸)黄色沉淀:AgBr 、AgI四大微溶物质:Ca(OH)2、Ag 2SO 4、CaSO 4、MgCO 3二、酸、碱、盐在水溶液中的电离1.电离、电离方程式(1)电离:酸、碱、盐等溶于水或受热熔化时,离解成能够自由移动的离子的过程。
(2)电离方程式:表示电解质电离的化学方程式。
电离方程式用“”电解质和非电解质的相同之处在于他们都是化合物。
单质和混合物既不是电解质又不属于非电解质。
电解质与非电解质的不同之处就在水溶液中或融融状态下能否自身解离导电。
高考二轮复习核心突破专题物质的组成和分类提升篇(新高考专用)

高考二轮复习核心突破专题 物质的组成和分类提升篇(新高考专用)一、单选题,共13小题1.(2022春·高一单元测试)下列关于氧化物分类的说法不正确的组合是①金属氧化物也可以形成酸性氧化物②非金属氧化物一定是酸性氧化物③SiO 2是酸性氧化物,硅酸是它与水反应形成的水化物④碱性氧化物一定是金属氧化物⑤Na 2O 和Na 2O 2均能与H 2O 反应生成NaOH ,故二者都是碱性氧化物⑥能与酸反应生成盐和水的氧化物一定是碱性氧化物⑦能与碱反应生成盐和水的氧化物一定是酸性氧化物A .②③⑤⑥⑦B .①④C .②④⑤D .①②④⑥⑦ 2.(2022·全国·高三专题练习)中国医药学是一个伟大的宝库。
古代制取下列药物过程中未发生氧化还原反应的是 A《本草纲目》:制取“玄明粉”(24Na SO )以芒硝于风日中消尽水气,自成轻飘白粉也 B 《通玄秘术》:制取“华盖丹”(醋酸铅) 以铁筋穿作窍,以绳子穿之;用净瓷瓮子盛米醋1斗,将铅片子悬排于瓮子口……C 《本草蒙筌》:制取“灵砂”(硫化汞)水银一两,硫黄六铢,先炒作青砂头,后入水火炉抽之…… D《本草图经》:制取“铁华粉”(醋酸亚铁)以铁拍做段片,置醋糟中,积久衣生…… A .A B .B C .C D .D3.(2022·全国·高三专题练习)磁流体是电子材料的新秀。
在一定条件下,将含等物质的量的FeSO 4和Fe 2(SO 4)3的溶液混合,再滴入稍过量的NaOH 溶液,可得到分散质粒子大小在36-55nm 之间的黑色磁流体。
下列说法中正确的A .所得的分散系属于悬浊液B .用一束光照射该分散系能产生丁达尔效应C.所得的分散系中分散质为Fe2O3,不能透过滤纸D.分散系为胶体,分散质粒子大小即Fe(OH)3分子直径大小4.(2023·全国·高三专题练习)下列物质分类正确的是A.2NO——酸性氧化物B.血液——胶体C.干冰——弱电解质D.4NaHSO——酸5.(2022·全国·高三专题练习)“分类”思想能帮助我们寻找物质的通性,下列物质分类正确的是A.CO、CO2为酸性氧化物B.84消毒液、洁则灵为混合物C.盐酸、氢硫酸为强电解质D.NH4Cl、AlCl3为共价化合物6.(2023·全国·高三专题练习)化学促进了科技进步和社会发展,下列叙述中没有涉及化学变化的是A.《神农本草经》中记载的“石胆能化铁为铜”B.利用“侯氏联合制碱法”制备纯碱C.科学家成功将2CO转化为淀粉或葡萄糖D.北京冬奥会场馆使用2CO跨临界直冷制冰7.(2023·全国·高三专题练习)北京冬奥会成功举办、神舟十三号顺利往返、“天宫课堂”如期开讲及“华龙一号”核电海外投产等,均展示了我国科技发展的巨大成就。
2020年高考江苏版高考化学第1讲 物质的分类 分散系
解析 纳米碳均匀地分散到蒸馏水中,形成的分散系属于胶体,具有 丁达尔效应,胶体能够透过滤纸不能透过半透膜,胶体是较稳定的体系, B项正确。
反思归纳 胶体知识七提醒
1.胶体区别于其他分散系的本质特征是分散质粒子直径的大小 (1~100 nm),而不是其具有丁达尔效应。 2.区分胶体和其他分散系的最简便方法是利用丁达尔效应,有丁达尔效 应的是胶体,常用渗析的方法净化胶体。 3.胶体不能透过半透膜,但可以透过滤纸,故不能用过滤的方法分离胶体 与溶液。
答案 以物质所含阳离子的不同进行分类 以物质所含阴离子的不同 进行分类
氧化物的分类与关系 (1)氧化物的分类 ①按与氧元素化合的另一种元素的类型分为金属氧化物与非金属氧化物。 ②按成键类型或组成粒子类型分为离子型氧化物与共价型氧化物。 离子型氧化物:部分活泼金属元素形成的氧化物,如Na2O、CaO等。 共价型氧化物:部分金属元素和所有非金属元素的氧化物,如SO2、ClO2等。
题组 物质的组成和分类
1.常温下,不可能与 NaHCO3溶液反应生成气体的物质是 ( B ) A.酸 B.碱 C.盐 D.氧化物 解析 A项,盐酸、硫酸均能与碳酸氢钠溶液反应生成CO2;B项,碱 如氢氧化钠与碳酸氢钠溶液反应生成碳酸钠与水,无气体生成;C项,强 酸的酸式盐如硫酸氢钠可与碳酸氢钠溶液反应生成气体;D项,氧化物如 SO3、SO2均能与碳酸氢钠溶液反应生成气体。
A.②④
B.①⑤⑥
C.①②③⑤ D.②④⑤
答案 A ①棉花的主要成分是纤维素,蚕丝的主要成分是蛋白质,错
误;②淀粉可水解生成葡萄糖,油脂可水解生成高级脂肪酸和甘油,蛋白
质在一定条件下能水解生成氨基酸,正确;③有机物往往易溶于有机溶
剂,有些单质或无机化合物也可能易溶于有机溶剂,错误;④乙酸乙酯不
全国卷高考化学 简单分类法及其应用专题练习含答案
全国卷高考化学 简单分类法及其应用专题练习1.下列化合物中,属于氧化物的是( ) A .Na 2SO 4 B .NaOH C .HNO 3D .FeO解析:选D 由两种元素组成,其中一种元素是氧的化合物是氧化物。
2.将下列各组物质按酸、碱、盐分类顺序排列正确的是( ) A .硫酸、纯碱、石膏 B .氢硫酸、烧碱、绿矾 C .碳酸、生石灰、醋酸钠D .磷酸、熟石灰、苛性钾解析:选B A 项中纯碱是Na 2CO 3,属于盐而不是碱;C 项中生石灰不属于碱;D 项中苛性钾不属于盐。
3.对下列反应类型的判断不正确的是( ) A .CO 2+H 2O===H 2CO 3 化合反应 B .Cu(OH)2=====△CuO +H 2O 分解反应 C .Fe 2O 3+3CO=====高温2Fe +3CO 2 置换反应 D .NaCl +AgNO 3===AgCl ↓+NaNO 3 复分解反应解析:选C C 选项中反应物CO 是化合物不是单质,所以该反应不是置换反应。
4.符合如图中阴影部分的物质是( ) A .NaHCO 3 B .Cu 2(OH)2CO 3 C .NaCl D .Na 2CO 3解析:选D A 项属于酸式盐,B 项为碱式盐、铜盐,C 项不属于碳酸盐。
5.中国科学技术大学的钱逸泰教授等以CCl 4和金属钠为原料,在700 ℃时制造出纳米级金刚石粉末。
该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”。
同学们对此有下列一些理解,其中错误的是( )A .金刚石属于金属单质B .制造过程中元素种类没有改变C .CCl 4是一种化合物D .这个反应是置换反应解析:选A 反应的化学方程式为4Na +CCl 4=====高温C +4NaCl ,金刚石是碳元素组成的单质,属于非金属单质,A 选项不正确;化学反应的过程中元素种类不发生改变,B 选项正确;CCl 4由不同种元素组成的纯净物,属于化合物,C 选项正确;此反应的反应物为单质和化合物,生成也是单质和化合物,属于置换反应,D选项正确。
高考化学复习考点知识专题讲解17 SO2与CO2的性质比较,SO2等有漂白性的物质归类
高考化学复习考点知识专题讲解专题十七、SO2与CO2的性质比较,SO2等有漂白性的物质归类考点知识SO2、CO2是重要的酸性氧化物,有关它们的知识年年都要考,这体现在:一是物质的制备及其化合物之间的转化关系;二是物质的性质及应用;三是实验现象及原理;四是气体或离子的的检验。
主要题型为选择、计算、实验探究等。
以现代科技有关的问题,与社会生产生活紧密相连的问题为背景,考查酸性氧化物的性质及SO2的氧化性、还原性、漂白性。
饮用水的消毒、净化、食品的漂白、大气污染及治理等。
重点、难点探源一、SO2与CO2的性质比较SO2CO2物理性质颜色、气味无色、刺激性气味的气体无色无味的气体密度比空气大比空气大毒性有毒无毒溶解性易溶,常温下1:40 微溶,常温常压下1:1 熔点相对较高,易液化相对较低,难液化化学性质与水反应SO2+H2O H2SO3(亚硫酸)CO2+H2O H2CO3(碳酸)与Na2O反应Na2O+SO2Na2SO3Na2O+CO2Na2CO3与Na2O2反应Na2O2+SO2=Na2SO42Na2O2+2CO2=Na2CO3+O2二、漂白剂的类型与特点能用于漂白的物质的漂白原理有三种:一种是利用物质的吸附性,将有色物质吸附掉;另一种是利用物质的强氧化性,将有色物质的显色基团氧化掉转化为无色的基团;再一种是与有色物质结合生成无色物质。
常见的能用于漂白的物质及漂白原理如下:追踪高考1.【2022海南卷】分别将足量下列气体通入稀Na2S溶液中,可以使溶液变浑浊的是A.COB.SO2C.HClD.CO2【答案】B【解析】A、CO不与Na2S发生反应,因此没有沉淀产生,故A错误;B、SO2具有弱氧化性,与Na2S发生氧化还原反应,即SO2+2S2-+4H+=3S↓+2H2O,故B正确;C、利用酸性强的制取酸性弱的,即发生2H++S2-=H2S,没有沉淀产生,故C错误;D、不产生沉淀,故D错误。
2.【2022年10月浙江选考】下列能使品红溶液褪色的是()A.SO2B.BaSO4C.KCl D.CO2【答案】【解析】SO2与品红发生化合反应生成无色物质,可使品红褪色,而BaSO4、KCl、CO2不能使品红溶液褪色,故选A。
高考化学知识点分类总结
高考化学知识点总结第一部分化学基本概念和基本理论一.物质的组成、性质和分类:(一)掌握基本概念1.分子分子是能够独立存在并保持物质化学性质的一种微粒。
(1)分子同原子、离子一样是构成物质的基本微粒.(2)按组成分子的原子个数可分为:单原子分子如:He、Ne、Ar、Kr…双原子分子如:O2、H2、HCl、NO…多原子分子如:H2O、P4、C6H12O6…2.原子原子是化学变化中的最小微粒。
确切地说,在化学反应中原子核不变,只有核外电子发生变化。
(1)原子是组成某些物质(如金刚石、晶体硅、二氧化硅等原子晶体)和分子的基本微粒。
(2)原子是由原子核(中子、质子)和核外电子构成的。
3.离子离子是指带电荷的原子或原子团。
(1)离子可分为:阳离子:Li+、Na+、H+、NH4+…阴离子:Cl–、O2–、OH–、SO42–…(2)存在离子的物质:①离子化合物中:NaCl、CaCl2、Na2SO4…②电解质溶液中:盐酸、NaOH溶液…③金属晶体中:钠、铁、钾、铜…4.元素元素是具有相同核电荷数(即质子数)的同—类原子的总称。
(1)元素与物质、分子、原子的区别与联系:物质是由元素组成的(宏观看);物质是由分子、原子或离子构成的(微观看)。
(2)某些元素可以形成不同的单质(性质、结构不同)—同素异形体。
(3)各种元素在地壳中的质量分数各不相同,占前五位的依次是:O、Si、Al、Fe、Ca。
5.同位素是指同一元素不同核素之间互称同位素,即具有相同质子数,不同中子数的同一类原子互称同位素。
如H有三种同位素:11H、21H、31H(氕、氘、氚)。
6.核素核素是具有特定质量数、原子序数和核能态,而且其寿命足以被观察的一类原子。
(1)同种元素、可以有若干种不同的核素—同位素。
(2)同一种元素的各种核素尽管中子数不同,但它们的质子数和电子数相同。
核外电子排布相同,因而它们的化学性质几乎是相同的。
7.原子团原子团是指多个原子结合成的集体,在许多反应中,原子团作为一个集体参加反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(一)氧化物的分类: 成盐氧化物:酸性氧化物、碱性氧化物、两性氧化物、复杂氧化 物(过氧化物、超氧化物、Fe3O4、Pb3O4等) 不成盐氧化物CO、NO (二)易混淆概念分辨 酸酐不一定是酸性氧化物:如乙酸酐酐(CH3CO)2O等;酸性氧化物 一定是酸酐。 非金属氧化物不一定是酸性氧化物:如NO、CO、NO2、N2O4、H2O 酸性氧化物不一定是非金属氧化物:如Mn2O7、CrO3 金属氧化物不一定是碱性氧化物:如 Al2O3、ZnO(两性),Mn2O7、 CrO3(酸性氧化物) 碱性氧化物一定是金属氧化物 ※NO 2 因与碱反应不仅生成盐和水,还有 NO ,因而不是酸性氧化 物。 ※Na2O2因与酸反应不仅生成盐和水,还有O2,因而不是碱性氧化 物。
