1.4气体的液化与液体的饱和蒸气压
第一章 气体的pT关系

第—章气体的pVT关系物质的聚集状态:气态gas 流体结构最简单液态liquid 结构最复杂固态solid 凝聚体其它还有:等离子态、超固态、中子态等§1.1 理想气体ideal /perfect gas状态方程一、理想气体状态方程三个经验定律:波义耳定律:恒温下肯定量气体V∞1/p盖-吕萨克定律:恒压下肯定量气体V∞T阿伏加德罗定律:同温同压同体积气体分子数相同理想气体状态方程:pV = nRTSI单位:Pa m3mol K ∙K-1∙mol-1V m = V/n n = m/M ρ = m/V (P8)例:用管道输送天然气,当输送压力为200kPa,温度为25℃时,管道内天然气(可视为纯甲烷)的密度是多少二、理想气体模型E = E吸引+ E排斥= -A/r6+B/r12两大假设:①分子之间无相互作用②分子本身不占有体积对理想气体,R=pV m/T;对实际气体,R=(pV m/T)p→0R=N A.k=6.0221367X1023×1.380658X10-23=J/K.mol§1.2 理想气体混合物一、混合物的组成三种表示法:摩尔分数x,质量分数w,体积分数φ (混合前,某纯组分的体积与各纯组分体积总和之比)二、理想气体混合物的状态方程pV = nRT =mMRT如M空气=∑x i M i M O2 M N2三、道尔顿分压定律Dalton’s law of partial pressure分压,即某组分气体它对混合气体总压的奉献,显然pB = p总.x B∑p B = p总对混合理想气体,pB = p总.x B = p总.n B /∑n B = n B RT / V(P13)例:今有300K,104.365kPa的含水蒸气的湿烃,其中水蒸气的分压3.167kPa,现欲得到除去水蒸气的1000mol干烃,试求:(1)应从湿烃中除去的水蒸气的量;(2)所需湿烃的初始体积。
真实气体的液化及临界参数

对应状态原理: 当不同气体有两个对比参数相等时,第三个对比
参数也将(大致)相等。
3. 普遍化压缩因子图
将对比参数引入压缩因子,有:
Z
pVm RT
pcVm,c RTc
prVr Tr
Zc
prVr Tr
Zc 近似为常数(Zc 0.26~0.29 ) 当pr , Vr , Tr 相同时,Z大致相同,
Z = f (Tr , pr ) 适用于所有真实气体
•
(0.035+0.025)×8.314×373.15
=
Pa
2.0×10-3
•
• =93.07kPa < 101.325kPa
• 所以H2O肯定为气态 • 定T,pB < pB*,B液体蒸发为气体至pB = pB*
2. 临界参数
由表1.3.1可知:p*=f (T) T ,p*
当T=Tc 时,液相消失,加压不再可使气体液化。 临界温度 (Tc或tc):使气体能够液化所允许的最高温度
Z
Vm ห้องสมุดไป่ตู้m
真实 理想
理想气体 Z=1 真实气体 Z < 1 : 比理想气体易压缩
Z > 1 : 比理想气体难压缩
在一定的T,p下,某真实气体的Vm,真实大于理想 气体的Vm,理想,则该气体的压缩因子Z()
a. >1 b. <1 c. =1 d. 无法判断
答案:a
临界点时的 Zc :
Zc
pcVm,c RTc
a. 气 b. 液 c. 气-液两相平衡 d. 无法确定其状 态
答案:a
3. 真实气体的 p-Vm 图及气体的液化
三个区域: T > Tc T < Tc T = Tc
真实气体的液化及临界参数
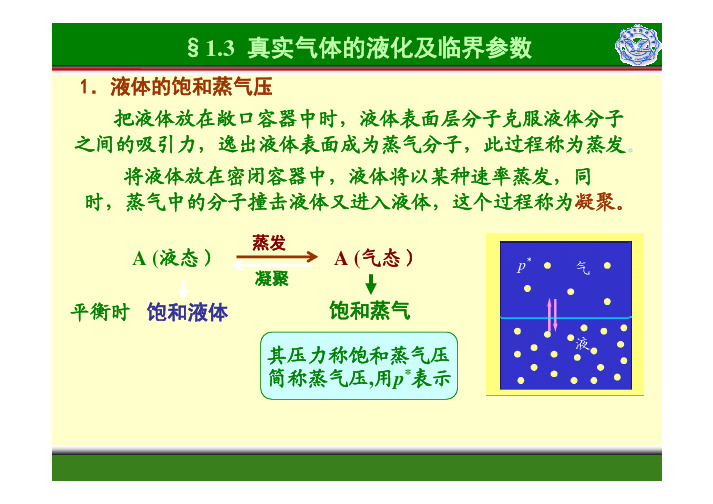
1.液体的饱和蒸气压苯乙醇水表不同温度的水、乙醇和苯的饱和蒸气压表不同温度的水、乙醇和苯的饱和蒸气压●同一物质,蒸气压随温度的升高而增大●大气中水蒸气的压力达到其饱和蒸气压时,称为相对湿度为100%2. 临界参数如图势能曲线所示,随着分子间距的缩小,分子间力将从吸引转为排物质的饱和蒸气压随温度的升高而急速增大,温度越高,使气体液化所一种纯气体的温度超过某一定值以后,靠加压来缩小分子间距使其液3. 真实气体的p-V图及气体的液化cm饱和曲线西安电子科技大学技大学图1.1.3真实气体的p-V m等温线技大学 技大学 技大学 西安电子科技大学西安电子科技大学西安电子科技大学超临界流体气和风味。
采用超临界流体技术脱除咖啡因,可避免以上缺点。
mm技大学 技大学西安电子科技大学西安电子科技大学9理想气体p V m /J ·m o l -1p V mp V m /J ·m o l -1m -p 图技大学 技大学 西安电子科技大学西安电子科技大学技大学 技大学 技大学 西安电子科技大学西安电子科技大学西安电子科技大学m <RT )范德华方程()a ⎛⎞技大学 技大学 技大学 西安电子科技大学西安电子科技大学西安电子科技大学★设分子A 、B 是半径为r 的圆球,当两个分子相碰时,质心间的最短距离x = 2r 。
★把分子B 看成是位于其球心处的质点,这个质点不能进入以分子A 为圆心、2r 为半径的球形禁区内,球形禁区的体积等于②b 是lmol 硬球气体分子本身体积的4倍★由于是两个分子碰撞,这个体积属于两个分子。
对每个分子来说,不能进入的体积为331444233x r ππ⎛⎞⎛⎞×=×⎜⎟⎜⎟⎝⎠⎝⎠即相当于分子本身体积的4倍。
3344(2)833r r ππ⎛⎞=×⎜⎟⎝⎠即等于分子本身体积的8倍。
技大学 技大学 西安电子科技大学西安电子科技大学27过饱和蒸汽过饱和液体方法,为以后建立更准确的真实气体状态方程,奠定了基础。
01第一章理想气体-2

4. 其他重要方程举例 (略)
2011-08 20
§1.5 对应状态原理及普遍化压缩因子图
1. 压缩因子
引入压缩因子Z来修正理想气体状态方程,
描述实际气体的 pVT 性质:
pV = ZnRT 或 pVm= ZRT
Z =
2011-08
(Vm:实际气体摩尔体积)
压缩因子的定义为:
• Br2(g)冷却发生液化. 液 化现象表明 Br2分子在 气相时就不具有零体积.
1. 液体的饱和蒸气压
理想气体不会液化(因为分子间没有相互作用力)
实际气体:在一定T、p 时,气-液可共存达到平衡. 气-- 液平衡时: 气体称为饱和蒸气; 液体称为饱和液体; 压力称为饱和蒸气压 p**。
图1.3.1 气-液平衡示意图
2011-08
( pV lim p 0 p
m
) = 0 TB
14
每一种气体均有自己的波义尔温度; TB一般为Tc的2 ~ 2.5 倍; T= TB时,气体在几百 kPa 的压力范围内
符合理想气体状态方程
2. 范德华方程 (1) 范德华方程 理想气体状态方程 pVm=RT
实质为:
(分子间无相互作用力时气体的压力)× (1 mol 气体分子的自由活动空间)=RT
2011-08 15
实际气体:
1) 分子间有相互作用力
器 壁
内部分子
靠近器壁的分子
分子间相互作用减弱了分子对器壁的碰撞, 所以: p = p理-p内
p内= a / Vm2
2011-08
p理= p + p内= p + a / Vm2
2011-08 24
压缩因子示意图
真实气体
拐点C; S 型曲线两端有过饱和蒸气和 过热液体的含义。
pVm3 bp RT Vm2 aVm ab 210
2. 维里方程
Virial: 拉丁文“ 力” 的意 思 Kammerling-Onnes于二十世纪初提出的经验式
p*=f (T) 曲线终止于临界温度;
临界温度 Tc 时的饱和蒸气压称为临界压力 5
临界压力 pc : 在临界温度下使气体液化所需的最低压力
临界摩尔体积Vm,c: 在Tc、pc下物质的摩尔体积
Tc、pc、Vc 统称为物质的临界参数
6
3. 真实气体的 p-Vm 图及气体的液化
CO2的PV图
7
p / [p]
水
乙醇
苯
t / C p*/ kPa t / C p */kPa t / C p */kPa
20
2.338
20
5.671
20 9.9712
40
7.376
40 17.395 40 24.411
60 19.916 60 46.008 60 51.993
80 47.343 78.4 101.325 80.1 101.325
反映出气体低压易压缩,高压难压缩 30
Tr 较大时,Z 1
压缩因子图的应用
(1)已知 T、p , 求 Z 和 Vm
T,p 求
Vm
1
Tr , pr
查图
2
3 计算(pVm=ZRT)
Z
(2)已知T、Vm,求 Z 和 pr
需在压缩因子图上作辅助线
Z
pVm RT
pcVm RT
常用瓶装气体的饱和蒸气压、充装系数及物性查询表
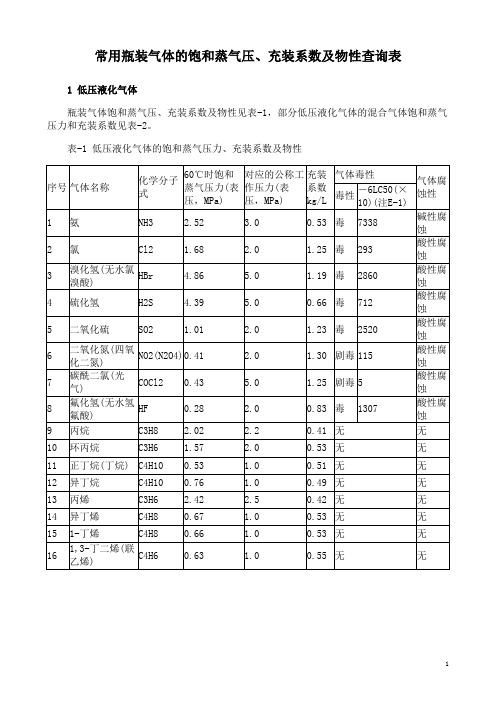
常用瓶装气体的饱和蒸气压、充装系数及物性查询表
1 低压液化气体
瓶装气体饱和蒸气压、充装系数及物性见表-1,部分低压液化气体的混合气体饱和蒸气压力和充装系数见表-2。
表-1 低压液化气体的饱和蒸气压力、充装系数及物性
×10-6,列入表-1供气瓶设计人员参考,有助于了解气体毒性的大小。
注-2:标记“—”表示目前没有可靠的数据来源(下同)。
表-2 部分低压液化气体的混合气体饱和蒸气压力和充装系数
2 高压液化气体
高压液化气体充装系数及物性见表-3。
表-3 高压液化气体的充装系数及物性
3 低温液化气体
低温液化气体物性参数见表-4。
表-4 低温液化气体物性参数
压缩气体物性参数见表-5。
表-5 压缩气体物性参数。
物理化学课件分压定律和分体积定律.

(2) 压力修正
器 壁
内部分子
靠近器壁的分子
分子间相互作用减弱了分子对器壁的碰撞, 所以:
2018/12/7
p= p理-p内 p内= a / Vm2 p理= p + p内= p + a / Vm2
a为范氏常数,其值与各气体性质有关,均为正 值。一般情况下,分子间作用力越大, a值越大。 将修正后的压力和体积项引入理想气体状态方 程:
VB y BV
y B=1
理想气体混合物的总体积V为各组分分体积VB*之和: yB = 1 V= VB*
n RT n B RT B V VB p p p B B n B RT VB p 理想气体混合物的总体积,等于气体B在与气体混 合物具有相同温度及压力条件下所占有体积的总和。 阿玛格分体积定律
注:该定律仅适用于理想气体,低压真实气体近似 服从该定律
2018/12/7
n
B
RT
气体混合物的平均摩尔质量 假定混合气体各组分之间不发生任何化学反应 , 组分A的物质的量为 nA,摩尔质量为MA;组分B的物 质的量为nB,摩尔质量为MB,则由A和B组成的混合 物体系的摩尔质量M,令nA+nB=n,则有
l2018/12/7 继续增加外压,液体被压缩,体积变化不大。
在敞口容器中,液体的饱和蒸气压等于外压时, 液体发生剧烈的汽化现象,称为沸腾,此时的温 度称为沸点 饱和蒸气压 1个大气压时的温度称为正常沸点 (373.15K) 饱和蒸气压 1个标准压力( 1个标准压力=100kPa, p)时的温度称为标准沸点(372.78K)
第一章 气体的pVቤተ መጻሕፍቲ ባይዱ性质
理想气体混合物的分压定律和分体积定律
1-4临界状态

1. T > Tc的等温线
§1-4 临界状态与对应状态原理
一、饱和蒸汽压与临界状态 1. T > Tc的等温线 2. T < Tc的等温线
T5 T4 p
无突变点
ps
l1 Vm(l)
g1 T1 Vm(g) Vm
T
2. T < Tc的等温线
§1-4 临界状态与对应状态原理
§1-4 临界状态与对应状态原理
一、饱和蒸汽压与临界状态 实际气体分子间存在吸引力 任何气体在一定温度压力下都会液化 任何气体在一定温度压力下都会液化 理想气体不可能液化 气体的液化一般需要降温和 气体的液化一般需要降温和加压 降温 降温可减小分子热运动产生的离散倾向 加压可以缩小分子间距从而增大分子间引力 气体的液化有个温度界限: 气体的液化有个温度界限: 临界温度T 气体加压液化所允许的最高温度. 临界温度 c: 气体加压液化所允许的最高温度 临界压力p 气体在临界温度下液化所需要的最小压力. 临界压力 c: 气体在临界温度下液化所需要的最小压力 临界体积V 物质在临界温度, 临界压力下的摩尔体积. 临界体积 c: 物质在临界温度 临界压力下的摩尔体积 Tc, pc, Vc总称为气体的临界参数 是物质的一种特性参数 总称为气体的临界参数 是物质的一种特性参数. 临界参数,
二、对应状态原理
二、对应状态原理与压缩因子图 1. 对应状态原理 2. 压缩因子图 f ( pr, Vr, Tr ) = 0
对比压力 对比温度
pr= p / pc Tr = T / Tc p = pr pc Vm = Vr Vc T = Tr Tc
对比摩尔体积 Vr = Vm / Vc
def pV m p CV C p r V r prVr Z = ⋅ = Zc = f ( pr Tr ) RT RT C Tr Tr
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
气体的pVT pVT性质 第一章 气体的pVT性质 根据上述对不同温度下的等温线的分析,可以把p-Vm 图划分为三个区域。将等温线上的转折点,即饱和液体 的状态点(如E,N,Q点等)、饱和蒸气的状态点(如B,M, P点等)及临界点C连成曲线,该曲线称为饱和曲线。饱和 曲线之内为液气平衡共存区。饱和液体线(E,N,Q连线) 及Tc等温线C点以上段的左侧为液体区。图上的其余部分 则为气体区。
气体的pVT pVT性质 第一章 气体的pVT性质 临界压力pc和临界摩尔体积Vc,m,统称为物质的临界参量。 它们是物质的一组重要的特性参量。下表给出了一些物 质的临界参量的数值。物质在临界状态下的压缩因子称 为临界压缩因子,记作Zc:
(3) T>Tc 当T>Tc时,无论施加多大的压力,H2O(g)将不再被 液化,此时等温线成为光滑的曲线。温度越高,等温线 越接近理想气体状态方程。
气体的pVT pVT性质 第一章 气体的pVT性质 液体的饱和蒸气压 饱和蒸气压是指物质在一定温度下处于液气平衡 饱和蒸气压 共存时蒸气的压力。当物质处于液气平衡共存时,液体蒸发 成气体的速率与气体凝聚成液体的速率相等。此时,若不改 变外界条件(例如在上面所示的实验中,保持温度不变,不 人为地去移动活塞,改变体积),则气体和液体可以长期稳 定地共存,其状态及组成均不改变。液气平衡共存时的气体 称为饱和蒸气,液体称为饱和液体。当物质处于液气平衡时, 若稍稍减小外界压力,使p外<p*,则液体将逐渐蒸发,直至 全部变为气体。反之,若稍稍增大外界压力,使pp外>p*,则 蒸气将全部凝聚成液体。因此,液体在某一温度下的饱和蒸 气压也是在该温度下使其蒸气液化所需施加的最小压力。 动画演示: 动画演示: 衡定温度下,水蒸气的液压过程。 衡定温度下,水蒸气的液压过程。
气体的pVT pVT性质 第一章 气体的pVT性质 当气体全部凝聚成液体后,若再增大外界压力,则 液体的体积将减小。但由于液体比气体难压缩得多,因此 液体的体积随压力的变化与气体相比是极其微小的。 在上面所示的实验中,如果提高恒温槽的温度(例如 提高到150 ℃),我们将发现,饱和蒸气压也将随之提高 ( p2将为476.027 kPa)。从分子运动的观点来看,液体的 蒸发过程实际上是液体中一部分动能较高的分子挣脱液体 分子间引力的束缚而逸出到液体上方空间的结果。温度越 高,分子的热运动越剧烈,具有较高能量的液体分子越多, 因而单位时间内从单位面积的液面上逸出的分子数越多, 使得液体上方的蒸气体积质量增大,压力增高。因此,饱 和蒸气压可以看作是衡量液体分子逸出能力,或者说液体 蒸发能力的物理量。它与物质的本性(分子间作用力的大 小)有关,也与温度有关。
水的p-Vm等温线图 等温线图 水的
气体的pVT pVT性质 第一章 气体的pVT性质
水的p-Vm等温线图 等温线图 水的
气体的pVT pVT性质 第一章 气体的pVT性质 图中的等温线可以分为三种情况: (1) T<Tc 当T<Tc时,如100 ℃的等温线ABDEF。 在AB段,曲线代表了水蒸气的Vm随压力的增加而减少 的变化情况。BDE段则代表了水蒸气的液化过程。由于液 化过程的压力始终保持不变,所以该段等温线为一水平线 段,所对应的压力p2即为该温度下H2O的饱和蒸气压。B点 和E点分别对应于饱和蒸气和饱和液体的摩尔体积。由于在 液化过程中,随着液体的不断增加,气体不断减少,所以 容器内H2O的平均摩尔体积是沿着B→D→E的方向不断减少 的。液化过程自B点开始,至E点结束。EF段代表了液态水 的Vm随压力的变化。由于液体一般是难于压缩的,所以该 段等温线很陡。
气体的pVT pVT性质 第一章 气体的pVT性质
1.4气体的液化与液体的饱和蒸气压
能够说明气体分子之间存在吸引力的一个显著事实是,在一定 的温度范围内,只要施加足够大的压力,任何真实气体都可以凝聚 成液体,该过程称为气体的液化 气体的液化。 气体的液化 在一个温度为100 ℃的恒温浴槽中放入一个带有活塞的刚性容 器,容器内充入一定量的水蒸气,水蒸气的压力可由连接在器壁上 的压力计读出。开始时,水蒸气的压力p1很低。现将活塞上的压力 逐渐增加,活塞非常缓慢地推进,气体被压缩,体积减小,压力增 加。当压力增加到p2=101.325 kPa时,若再进一步推进活塞,即可 观察到容器中出现一些液态的水,但此时容器内的压力仍维持p2不 变。活塞进一步缓慢向下移动,容器中凝聚出的液态的水将越来越 多,水蒸气将越来越少,直到水蒸气全部转变为液态的水。在此凝 聚过程中,容器内的压力始终保持在p2=101.325 kPa不变,我们称 p2为水蒸气在100 ℃的饱和蒸气压,记作p*(H2O)。
气体的pVT pVT性质 第一章 气体的pVT性质 如果我们将上图中的恒温槽的温度 进一步提高到374 ℃,相应压力增加到 22 MPa左右时,容器内将呈现一种乳白 色的混沌状态。此时,气体与液体之间 已没有明显的界面,这种现象称为临界 现象。当恒温槽的温度高于374 ℃时, 无论施加多大的压力,气态的H2O都不 会被液化。因此,374 ℃是气态H2O能 够被液化的最高温度,称为H2O的临界 温度,记作Tc。 根据上述实验现象,可以作出H2O 的p-Vm图,如图所示。图中的曲线代表 在一定的温度下,H2O的摩尔体积随压 力的变化关系,称为H2O的等温线。
气体的pVT pVT性质 第一章 气体的pVT性质 正如前面所讨论过的,液体的饱和蒸气压随温度升高 而增大,所以在T<Tc时,不同温度的等温线上的水平部分 随温度升高而上升。同时,由于温度上升、压力增加时, 液体和气体的体积质量逐渐接近,其摩尔体积也逐渐接近, 所以水平部分的长度随着温度升高而逐渐变短,如图中MN, PQ所示。 (2) T=Tc = 当温度升到374 ℃,即T= T c时,等温线上代表液化 过程的水平线段缩成一点C,这意味着此时气体和液体具 有相同的体积质量和相同的摩尔体积,因此在液化过程中 不再出现明显的气液分界面。此点称为临界点。临界点所 对应的温度、压力、摩尔体积分别称为物质的临界温度T c,
气体的pVT pVT性质 第一章 气体的pVT性质 如果将液体放在敞口容器中加热,则当液体的温度 升高到其饱和蒸气压等于外界压力时,液体内部会产生大 量的气泡并迅速浮升到表面,发生剧烈的汽化现象,称为 沸腾。此时的温度称为沸点,记作T*b。显然,液体的沸 点将随外界压力变化而改变。由于一般情况下,大气的压 力约为101.325 kPa,所以,称液体的饱和蒸气压为 101.325 kPa时的温度为该液体的正常沸点。按照新的国 际标准及国家标准,将标准压力p定为100 kPa,故将液体 的饱和蒸气压为100 kPa的温度称为该液体的标准沸点。 例如,水的正常沸点为100 ℃(373.15 K),标准沸点为 99.63 ℃ (372.78 K)。
气体的pVT pVT性质 第一章 气体的pVT性质
