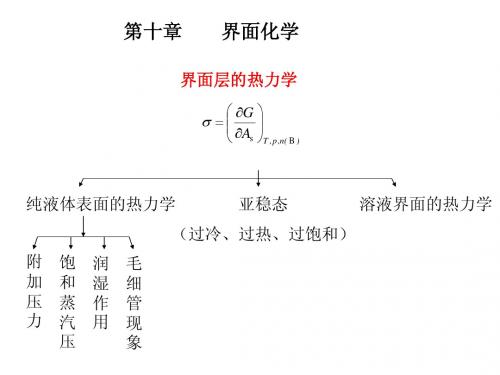
第十章 界面化学
第10章 界面化学
r
θ
R
θ
h
2σ cosθ h= ρ B gR
σ——液体表面张力; ρB——液体体积质量;
g——重力加速度。
亚稳状态 液体的过热现象——定压下,当液体的温度高于该压力下的沸 液体的过热现象 点,而液体仍不沸腾的现象。 液体的过冷现象——定压下,当液体的温度已低于该压力下 液体的过冷现象 液体的凝固点,而液体仍不凝固的现象。 蒸气的过饱和现象——定温下,当蒸气分压超过该温度下的饱 蒸气的过饱和现象 和蒸气压,而蒸气仍不凝结的现象。 溶液的过饱和现象——定温、定压下,当溶液中溶质的浓度 溶液的过饱和现象 已超过该温度、压力下的溶质的溶解 度,而溶质仍不析出的现象。
p* 2σ M B ln r = ± p r ρ B RT
(“+”——球形液滴或毛细管中的凸液面;“-”——毛 细管中的凹液面)
(3)液体对固体的润湿作用 )
固体
沾附润湿
液体
∆Ga,w=σ(s/l)-[σ(s/g)+σ(l/g)]
固体
浸渍润湿
液体
∆Gd,w=σ(s/l)-σ(s/g) 铺展润湿
液体 固体
溶液界面的热力学 (1)溶液的表面张力 )
Ⅰ
水中加无机酸、碱、盐等。
{σ} Ⅱ
水中加有机酸、醇、酯、醚、酮等。
Ⅲ
水中加入肥皂、合成洗涤剂等。
{c}
溶液的表面张力与浓度的关系
(2)表面活性剂及其结构特征 ) 表面活性剂定义: 表面活性剂定义: 把能显著降低液体表面张力的物质称为该液体的表面活性剂。 表面活性剂。 表面活性剂 表面活性剂结构: 表面活性剂结构: 一般水的表面活性剂都是由亲水性的极性基团(亲水 基)和憎水性的非极性基团(亲油基)两部分构成。
10 第十章 界面现象习题解

第十章界面化学 课后作业题解10.3 计算373.15K 时,下列情况下弯曲液面承受的附加压力。
已知373.15K 时水的表面张力为58.91×10-3N.m -1。
(1)水中存在的半径为0.1μm 的小气泡;(2)空气中存在的半径为0.1μm 的小液滴;(3)空气中存在的半径为0.1μm 的小气泡。
解:10.4 在298.15K 时,将直径为0.1mm 的玻璃毛细管插入乙醇中。
问需要在管内加多大的压力才能防止液面上升?若不加任何压力,平衡后毛细管内液面的高度为多少?已知该温度下乙醇的表面张力为22.3×10-3N.m -1,密度为789.4 kg.m -3 ,重力加速度为9.8m.s -2。
设乙醇能很好地润湿玻璃。
解:乙醇能很好地润湿玻璃,可看作cos θ=0,所以r=r 1(曲率半径与毛细管半径相等)需要在管内加892 Pa 的压力才能防止液面上升。
若不加任何压力,平衡后毛细管内液面的高度为0.115m 。
kPa 2356Pa 2356400101091584r 4p 3kPa 1178Pa 1178200101091582r 2p 217373==⨯⨯=γ=∆==⨯⨯=γ=∆----..)())((Pa 892100.051022.32r 2p 33=⨯⨯⨯=γ=∆--m 1150100.0589789.41022.32gr 2h 33..=⨯⨯⨯⨯⨯=ργ=--10.9 已知在273.15K 时,用活性炭吸附CHCl 3,其饱和吸附量为93.8dm 3.kg -1,若CHCl 3的分压力为13.375 kPa ,其平衡吸附量为82.5 dm 3.kg -1。
试求:(1)朗缪尔吸附等温式中的b 值;(2)CHCl 3的分压为6.6672 kPa 时,平衡吸附量为若干?解:(1)朗缪尔吸附等温式(2)根据朗缪尔吸附等温式10.14 293.15K 时,水的表面张力为72.75mN.m -1,汞的表面张力为486.5mN.m -1,而汞和水之间的界面张力为375mN.m -1,试判断:(1)水能否在汞的表面上铺展开?(2)汞能否在水的表面上铺展开?解:(1)水能在汞的表面上铺展(2)汞不能在水的表面上铺展bp 1bp V V m +=b 375131b 37513893582....+=0m 38.75mN 72.75-375-486.5--S -1->⋅==γγγ=水水汞汞0m -788.75mN 486.5-375-72.75--S -1-<⋅==γγγ=汞水汞水1-3m kg 73.58dm 6.66720.54591 6.66720.545993.8bp 1bp V V ⋅=⨯+⨯⨯=+=1kPa 545901-82.593.8375131b -=⎪⎭⎫ ⎝⎛⨯=..10.17 292.15K 时,丁酸水溶液的表面张力可以表示为)bc 1(a -0+γ=γln ,式中0γ为纯水的表面张力,a 和b 皆为常数。
第十章界面化学思考题答案(1)

第十章界面化学思考题答案1.已知水在两块玻璃间形成凹液面,而在两块石蜡板间形成凸液面。
试解释为什么两块玻璃间放一点水后很难拉开,而两块石蜡板间放一点水后很容易拉开?答:水在两玻璃和两石蜡板间的状态如下图。
水能润湿玻璃,在两块玻璃之间的水层两端液面呈凹形,故其附加压力方向指向空气,使水层内的压强小于外部大气压强,两者相差2γ/r,即相当于两块玻璃板外受到2γ/r的压力作用,所以要把它们分开很费力。
且两板越靠近,此压力差越大,使两板难以拉开。
石蜡板的情况相反,液体压力p大于外压力,易于拉开。
2.如下图所示,在一玻璃管两端各有一大小不等的肥皂泡。
当开启活塞使两泡相通时,试问两泡体积将如何变化?为什么?2图3图答:开启活塞后,大泡将变大,小泡将变小。
活塞关闭时,由于肥皂泡膜产生附加压力,Δp=p内-p外=4γ/r.泡的半径r越小,附加压力越大,而大、小泡的p外是相同的,故小泡内空气压力大于大泡内空气压力。
因此打开活塞后,小泡内空气就流向大泡,导致小泡变成更小。
当小泡收缩至其半径等于玻璃管口半径时的r最小,若再收缩,其曲率半径反而增大。
所以当小泡收缩至其曲率半径与大泡半径相等时,停止收缩。
3.如上图所示,玻璃毛细管A插入水中后,水面上升高度应能超过h,因此推断水会从弯口B处不断流出,于是便可构成第一类永动机,如此推想是否合理?为什么?答:不合理,由于毛细管上方弯曲,当液面上升到顶端后,又沿弯曲管下降到弯口B处,液面下降时,由于弯曲部分液体受到重力作用,使凹液面的曲率半径由r增大到r',故附加压力也相应减小到Δp'=2γ/r ' 。
到B处,Δp'与B处高度的静压力达到平衡,曲率不再变化(仍是凹液面)。
故水滴不会落下。
4.一定量的小麦,用火柴点燃并不易着火。
若将它磨成极细的面粉,并使之分散在一定容积的空气中,却很容易着火,甚至会引起爆炸。
这是为什么?答:这有两方面原因。
磨成极细的面粉后,比表面积大大增加,磨得越细,其表面能越高,所处的状态就越不稳定,其化学活性也越大,因而容易着火。
天津大学物理化学第十章 界面现象

4. 亚稳态及新相生成
系统分散度增大、粒径减小引起液滴和固
体颗粒的饱和蒸气压大于普通液体、固体的情
况,只有在粒径很小时才需要考虑。 在蒸气冷凝、液体凝固和沸腾、溶液结晶 等过程中,新相从无到有,最初尺寸极其微小, 比表面积和表面吉布斯函数都很大,新相的产
生非常困难,会出现一些特殊的状态——亚稳
态(介安态)。
dG dA 8πr dr
pr 4πr 2 (dr ) pr dG (dn) RT ln RT ln p M p
dG dA 8πr dr
pr 2 M RT ln p r
开尔文公式
由Kelvin公式可知: 凸液面 r 越小pr 越大 p 2 M 对于凹液面: RT ln pr r 比较饱和蒸气压: p凸> p平> p凹
吸附等温线:
Va
Ⅰ
Va
Ⅱ
0
Va
Ⅲ
p/p*
Ⅳ
1
0 Va
p/p*
Ⅴ
1
Va
0p/p*ຫໍສະໝຸດ 10p/p*
1
0
p/p*
1
p: 达平衡时的吸附压力; p*: 该温度下吸附气体的饱和蒸气压。
2. 吸附经验式——弗罗因德利希公式
Freundlich用指数方程描述 型吸附等温线
V a kpn
n、k 是两个经验参数,均是 T 的函数。 k: 单位压力时的吸附量。一般T ,k; n :介于0~1之间,反映 p 对V a 影响的强弱。 直线式: lgV
§10.4 液 - 固界面
固体表面力场不对称,存在润湿和吸附 1. 接触角与杨氏方程
平衡时
cos
s ls lg
第十章__界面现象2005.11.20

有等于系统增加单位面积时所增加的吉布斯函数,
所以也称为表面吉布斯函数
9
例:
20 ℃时汞的表面张力 =4.85×10
-1
N· m
-1
,若在此温度
及101.325 kPa 时,将半径r1 = 1 mm的汞滴分散成半径为 r2 =10-5 mm 的微小液滴时,请计算环境所做的最小功。 解:因为T,p 恒定,所以为常数,环境所做的最小功为可逆过程 表面功W’,
6
此实验证明,液体表面层存在着一个平行于液面,垂直 于分界线的力,此力使表面收缩 —— 表面张力。
对于弯曲液面,表面张力则与液面 相切。
表面张力
7
2. 表面功与表面张力表面吉布斯函数:
dx
当T、p、n不变的条件下,若把 MN移动dx,
F外
l
则增加面积dA=2l· dx,
此时外界必反抗表面张力做功。 WR' F外 dl 在可逆条件下:F外=F表+dF≌F表
15
5. 影响表面张力的因素
(1)表面张力和物质性质有关和它接触的另一相的性质有关。 (i)和空气接触时,液体和固体中的分子间作用力越大表面 张力越大。一般:
(金属键)> (离子键)> (极性共价键)> (非极性共价键)
(ii)同一种物质和不同性质的其它物质接触时,界面层中分 子所处的力场不同,界面张力出现明显差异。(看下表数据)
16
某些液体、固体的表面张力和液/液界面张力
物质 水(溶液) 乙醇(液)
/(10-3
N· -1) m 72.75 22.75
T/K 293 293
物质 W(固) Fe(固)
第十章界面化学欢迎莅临烟台大学化学生物理工学院.pptx

溶液的过饱和现象——定温、定压下,当溶液中溶质的浓度 已超过该温度、压力下的溶质的溶解 度,而溶质仍不析出的现象。
溶液界面的热力学 (1)溶液的表面张力
Ⅰ 水中加无机酸、碱、盐等。
{}
Ⅱ 水中加有机酸、醇、酯、醚、酮等。
Ⅲ 水中加入肥皂、合成洗涤剂等。
{c}
溶液的表面张力与浓度的关系
(2)表面活性剂及其结构特征 表面活性剂定义:
把能显著降低液体表面张力的物质称为该液体的表面活性剂。 表面活性剂结构:
一般水的表面活性剂都是由亲水性的极性基团(亲水 基)和憎水性的非极性基团(亲油基)两部分构成。
CH3(CH2)7=CH(CH2)7 COO- H+
油酸表面活性剂的结构特征
表面过剩物质的量
Γ def nB
B
As
吉布斯方程
Γ B
aB RT
A
B
k2
*
*
(表面反应控制)
9、春去春又回,新桃换旧符。在那桃花盛开的地方,在这醉人芬芳的季节,愿你生活像春天一样阳光,心情像桃花一样美丽,日子像桃子一样甜蜜。20.10.2 020.10.20Tuesday, October 20, 2020 10、人的志向通常和他们的能力成正比例。08:12:5508:12:5508:1210/20/2020 8:12:55 AM 11、夫学须志也,才须学也,非学无以广才,非志无以成学。20.10.2008:12:5508:12Oct-2020-Oct-20 12、越是无能的人,越喜欢挑剔别人的错儿。08:12:5508:12:5508:12Tuesday, October 20, 2020 13、志不立,天下无可成之事。20.10.2020.10.2008:12:5508:12:55October 20, 2020
第十章界面化学

产生表面(界面)现象的原因是什么?
§10.1界面张力
§10.1界面张力
1、表面张力、表面功及表面吉布斯函数 表面分子及内部分子的受力分析
表面分子受到一个向内的力。使液体 分子总是向液体内部移动,力图缩小 表面积。内部分子所受到的力在各个 方向的力相等,其合力为零。
用金属丝制成的框架上涂有肥皂泡其受力情况 如图:
r1
2 r
2
eg: ①小液滴 ②液体中的气泡
p pl pg
2 r
p pg pl
2 r
③肥皂泡
p p i p o ( p g ,i p l ) ( p l p g ,o )
2 r2 rFra bibliotek4 r
⑤ ④毛细管连通的大小不等的气 泡
T↑
气相中分子密度降 低 液相中分子距离↑ 极限情况:T→Tc时,γ→0
γ↓ (有例外)
④压力的影响。 a.表面分子受力不对称的程度 ↓
P↑
b.气体分子可被表面吸附,改变γ, ↓
c.气体分子溶于液相 一般:p↑10atm, γ ↓1mN/m。eg:
γ↓
1atm
10atm
γH2O = 72.8 mN/m
T
露点:T小< T正常
( 2)实验中加热为何加沸石,加晶种?铝壶底为
何做成波纹状?
p大气压 Δp
静液压p静
pi
∵pi = p静+p大气压+Δp ∴液体内部产生气泡所需的温度Ti>T正常,产生暴沸。
(3)对固体也适用。
4.过饱和溶液
在一定温度下,溶液浓度超过了饱和浓度,而未析出晶 体的现象,该溶液称为过饱和溶液
G
第五版物理化学第十章习题答案

第十章界面现象请回答下列问题:(1)常见的亚稳定状态有哪些?为什么会产生亚稳定状态?如何防止亚稳定状态的产生?解:常见的亚稳定状态有:过饱和蒸汽、过热或过冷液体和过饱和溶液等。
产生亚稳定状态的原因是新相种子难生成。
如在蒸气冷凝、液体凝固和沸腾以及溶液结晶等过程中,由于要从无到有生产新相,故而最初生成的新相,故而最初生成的新相的颗粒是极其微小的,其表面积和吉布斯函数都很大,因此在系统中产生新相极其困难,进而会产生过饱和蒸气、过热或过冷液体和过饱和溶液等这些亚稳定状态,为防止亚稳定态的产生,可预先在系统中加入少量将要产生的新相种子。
(2)在一个封闭的钟罩内,有大小不等的两个球形液滴,问长时间恒温放置后,会出现什么现象?解:若钟罩内还有该液体的蒸气存在,则长时间恒温放置后,出现大液滴越来越大,小液滴越来越小,并不在变化为止。
其原因在于一定温度下,液滴的半径不同,其对应的饱和蒸汽压不同,液滴越小,其对应的饱和蒸汽压越大。
当钟罩内液体的蒸汽压达到大液滴的饱和蒸汽压时。
该蒸汽压对小液滴尚未达到饱和,小液滴会继续蒸发,则蒸气就会在大液滴上凝结,因此出现了上述现象。
(3)物理吸附和化学吸附最本质的区别是什么?解:物理吸附与化学吸附最本质的区别是固体与气体之间的吸附作用力不同。
物理吸附是固体表面上的分子与气体分子之间的作用力为范德华力,化学吸附是固体表面上的分子与气体分子之间的作用力为化学键力。
(4)在一定温度、压力下,为什么物理吸附都是放热过程?解:在一定温度、压力下,物理吸附过程是一个自发过程,由热力学原理可知,此过程系统的ΔG<0。
同时气体分子吸附在固体表面,有三维运动表为二维运动,系统的混乱度减小,故此过程的ΔS<0。
根据ΔG=ΔH-TΔS可得,物理吸附过程的ΔH<0。
在一定的压力下,吸附焓就是吸附热,故物理吸附过程都是放热过程。
在K及下,把半径为1×10-3m的汞滴分散成半径为1×10-9m小汞滴,试求此过程系统的表面吉布斯函数变为多少?已知汞的表面张力为·m-1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2M RT ln ' pg R
pg p
0 g
凹液面(如气泡中)上方的饱和蒸气压比平液面小
产生毛细凝结的原因
毛细凝结: 液体在毛细管中形成凹液面时,一定温度下,平液面没有达到饱和 的蒸气,对毛细管内的液面已经达到饱和或过饱和状态,蒸气将在毛细 管中凝结。
②
Kelvin 公式可以推广到比较两个不同半径液滴或晶
B
dG SdT Vdp γdA BdnB
B
利用全微分性质可知
S γ A V ,T ,nB T V , A,nB
S γ A T , p,nB T A, p,nB
1 1 p γ ( ' ' ) ——杨—拉普拉斯方程 R1 R2
对于球面,
R R R
' 1 ' 2
'
水平液面:
R , p 0
'
2γ p ' R
p 0
对凸液面,曲率中心在液体内部,
曲面下液体多承受△P 力作用 对凹液面,曲率中心在液体外部, 曲面下液体少承受△P 力作用
② 毛细管上升法 ③ 环法 ④ 吊片法等
§9-2
弯曲表面下的附加压力和蒸气压
一、弯曲表面下的附加压力 1. 附加压力的产生
f
A
p0 B p0
p0
f
f
A
B p0 + p S
G f L
水平液面
凸液面
分析表明:平液面下液体与弯
p0
G
pS
曲液面下液体受力情况不同。
f
A
f
曲界面压力差:
B pS p0 —
L
② 相界面性质 如293K
γH2O 72.88103 N m1
当与液体相接触的另一相物质改变时,表面张力会发生改变,如
γC6H6 H2O 0.035N m1
③ 温度影响 一般温度上升,表面张力下降,至临界温度时,液气界面消失,
0
热力学分析: 考虑表面功时有
dA SdT pdV γdA BdnB
因此,总体积不变时,若把“大块”物质分散成极细的微粒,由于表 面层中物质数量的急剧增加,导致体系性质产生质的变化,即体系表面积 的不断增加必然引起体系的性质完全由物质的表面性质所左右。
比如油在水中或水在油中的分散,形成的小液滴都是球形的(大量液体 是容器的形状),活性炭脱色,水在毛细管中自动上升,脱脂棉易于被润湿, 微小液滴易于蒸发……,这些在相界面上发生的物理化学现象都属于界面现 象。
T S Q A A
等于温度不变时扩大单位表面积吸的热
一般增加表面积都是吸热的 即
Q
A
0
∴
γ 0 T
④ 压力影响
即温度升高,表面张力下降。
对于纯液体:
0(1 T / Tc )
压力增加,表面张力也下降,但变化不大,可忽略。
3. 表面张力的测量方法 ① 最大压差法
③一定T、p及组成下,
dG γdA dA 0, dG 0
γ 0,
故
即表面积自动变小的过程是自发过程。
2. 影响表面张力的因素 ① 物性 相同条件下,不同物质不同
如20℃、101325Pa下,
γH2O 72.88103 N m1 γHg 0.4865 N m
1
理解开尔文公式的推导及含义,会用其解释人 工降雨、毛细凝聚等常见的亚稳平衡现象。
5、理解吉布斯等温方程式中各项的物理意义,会 用其作简单计算,会用其解释正吸附、负吸附 等界面现象。
6、什么叫表面活性物质,了解表面活性剂的大致 分类及它的几种重要作用。
7、了解液-液、液-固界面润湿性能的热力学
基础。
体系分散度↗,比表面↗ 二、表面吉布斯函数 1. 表面分子的特点 液体内部分子: 受力是球形对称的,合力为零
表面
(重力不计)
在相界面上分子受合力不为零: 合力指向液体内部,使表面分子有被拉
L
入液体内部之倾向,所以任何液体表面都有 自发收缩的趋势。
此外,由于界面上不对称力场的存在,使得界面层分子有自发与外 来分子发生化学或物理结合的趋势,借以补偿力场的不对称性。
故小气泡不可能存在,计算表明附加压力是造成液体过热之主要 原因。
若要使小气泡存在,必须继续加热(T
,pg,,
△P)使小气泡内水蒸气压力等于或超过它应克服的压力时,小气泡
才可能产生,液体才开始沸腾。此时液体的温度必然高于该液体的正常 沸点,即液体产生过热现象。
T, pg0 饱和蒸气(p.g)
△ G2
△ G4
T, pl小液滴
G3 0
T, pg饱和蒸气(p.g)
G1 G2 G3 G4 0
G2 G4
单组分体系
dG SdT Vdp dG Vdp
温度一定
∴
pl
0
pl
Vm (l)dpl 0 Vm (g)dpg
粒的蒸气压
p2 2M 1 1 RT ln ( ' ') p1 R2 R1
③ 利用Kelvin公式解释以下几种现象(亚稳状态与新相的形成) a.过热现象 ——达到沸腾温度时液体不沸腾的现象。
原因: 凹液面的附加压力使新相(气泡)难以生成
101325Pa
在101325Pa
、373K的纯水中,
(1)、(2)两边同乘以T,则
(1)
(2)
γ TS T T V , A,nB A V ,T ,nB
γ TS T T A, p,nB A T , p ,nB
(3)
(4)
γ T T
p p内 p外 pS 0
方向指向曲率中心。
凹液面
弯曲液面凹面一侧的压力定为p内;弯曲液面凸面一 侧的压力定为p外 2. △P 的计算——Young-Laplace 方程
D' D A' A
x+d x y+dy B' B R 1' O' R 2' C' C
曲面ABCD面积:
dz x
A1 xy
曲面A`B`C`D`面积:
y
A2 ( x dx)( y dy)
则增加的面积:
A xdy ydx
外界做的功为
Wf γA γ( xdy ydx)
O
曲面移动相应体积之改变:
V x y dz
扩大表面积需克服弯曲表面的附加压力△P做功
Wf pV p ( x y dz )
∴ p( x y dz ) γ( xdy ydx)
据相似三角形(见下页)比较可得: (1)
( x dx) /( R dz) x / R
' 1 ' 2
' 1 ' 2
dx xdz / R1'
' dy ydz / R2
(2) (3)
( y dy) /( R dz) y / R
N m -1
1、已知20℃时水的表面张力为7.28×10-2N·m-1,在此温度和标准压力下将水的 表面积可逆地增大10cm2时,体系的△G等于[ ] A、7.28×10-5J; B、–7.28×10-5J; C、7.28×10-1J; D、–7.28×10-1J。
三、表面张力
1. 表面张力
图9-2 表面张力动画演示图
h=0.02m
小气泡半径 10-8m ,小气泡若能存在必 承受三个力的作用:
p p0 gh p
(1 0.002 116.2)atm 117.2atm
小气泡内水蒸气的压力:
RT ln
pg P g
0
2M , ' R
pg 0.931 atm 117.2atm p
D' D A' A
x+ dx y+dy B' B R 1' O' R 2' C' C
相似三角形 ABO∽A`B`O
dz x
y
x dx R1' dz x R1' x dx ' d z R1
同理相似三角形 BCO`∽B`C`O`
O
y d y ' dz R2
(2)、(3)代入(1)中,得到:
§9-1
表面吉布斯函数和界面张力
一、界面、表面和比表面
界面:两相之间的接触面或密切接触的两相之间的 过渡区称为界面。 表面:两相中若其中的一相为气体,则称为表面。 通常泛指液体(或固体)与空气的接触面,如桌面。 比表面:单位体积或单位质量的固体或液体具有的表面积。
A A0 V
或
A A0 W
质产生质的变化,即表面积的不断增加必然引起体系的性质完全由物质的表面
性质所左右。
分散度对体系性质的影响: 1克水,以一个球形水滴存在 表面积: 4.85×10-4m2
表面能: 3.5×10-5J;
把相同数量的水分散成半径为10-7cm的小液滴 小液滴的数量: 2.4×1020个 体系的总表面积: 3.0×103m2 表面能: 218J 相当于把1克水升高温度约: 50℃
8、什么是物理吸附,什么是化学吸附?
掌握兰谬尔吸附模型、BET多层吸附模型的意 义和应用。
9、了解多相催化动力学速率方程的特点,能解
释简单的表面反应动力学为何在不同的压力 下有不同的反应级数。
第十章
界面现象
热力学研究系统的整体性质,由“大块”物质组成的体系对于整个系统而 言,处于表面上的分子所占的比例很小因而可忽略表面性质的影响。但是当一 定量物质高度分散后,由于表面层中物质数量的急剧变化(增加),导致体系性
