波谱分析.ppt
合集下载
波谱分析讲整理.ppt

第二篇 波谱分析
第一章 光谱分析 第二章 核磁共振波谱 第三章 质谱
第一章 光谱分析
1.1 概述 1.2 紫外吸收光谱分析(UV) 1.3 红外吸收光谱分析(IR) 1.4 激光拉曼光谱(RS)
1.1 概述
1.1.1光谱分析法
因光的作用引起被照物体内分子运动状态发 生变化,并产生特征能态的跃迁进行分析的方 法
n→π*的影响
1.2 紫外吸收光谱分析(UV)
b. π→π*跃迁所产生的吸收峰随着溶 剂极性的增加而向长波长方向移动。 因为在多数π→π*跃迁中,激发态的 极性要强于基态,极性大的π*轨道 与溶剂作用强,能量下降较大,而π 轨道极性小,与极性溶剂作用较弱, 故能量降低较小,致使π及π*间能量 差值变小。因此,π→π*跃迁在极性 溶剂中的跃迁能小于在非极性溶剂 中的跃迁能。所以在极性溶剂中, π→π*跃迁产生的吸收峰向长波长方 向移动。
(4)n→π* 跃迁 指分子中处于非 键轨道上的n电子吸收能量后向 π*反键轨道的跃迁。
1.2 紫外吸收光谱分析(UV)
电子跃迁类型不同,实际跃迁需要的能量不同, σ→σ* ~150nm n→σ* ~200nm π→π* ~200nm n→π* ~300nm
吸收能量的次序为: σ→σ*>n→σ*≥π→π*>n→π*
1.2 紫外吸收光谱分析(UV)
iii B—带 它是芳香族化合物的特征吸收带。是苯环振动及
π→π* 重叠引起的。在230~270nm之间出现精细结构 吸收,又称苯的多重吸收
iv E-带 它也是芳香族化合物的特征吸收之一,E带可分为E1及
E2两个吸收带,二者可以分别看成是苯环中的乙烯键和 共轭乙烯键所引起的,也属π→π* 跃迁。
溶剂对π→π*
1.2 紫外吸收光谱分析(UV)
第一章 光谱分析 第二章 核磁共振波谱 第三章 质谱
第一章 光谱分析
1.1 概述 1.2 紫外吸收光谱分析(UV) 1.3 红外吸收光谱分析(IR) 1.4 激光拉曼光谱(RS)
1.1 概述
1.1.1光谱分析法
因光的作用引起被照物体内分子运动状态发 生变化,并产生特征能态的跃迁进行分析的方 法
n→π*的影响
1.2 紫外吸收光谱分析(UV)
b. π→π*跃迁所产生的吸收峰随着溶 剂极性的增加而向长波长方向移动。 因为在多数π→π*跃迁中,激发态的 极性要强于基态,极性大的π*轨道 与溶剂作用强,能量下降较大,而π 轨道极性小,与极性溶剂作用较弱, 故能量降低较小,致使π及π*间能量 差值变小。因此,π→π*跃迁在极性 溶剂中的跃迁能小于在非极性溶剂 中的跃迁能。所以在极性溶剂中, π→π*跃迁产生的吸收峰向长波长方 向移动。
(4)n→π* 跃迁 指分子中处于非 键轨道上的n电子吸收能量后向 π*反键轨道的跃迁。
1.2 紫外吸收光谱分析(UV)
电子跃迁类型不同,实际跃迁需要的能量不同, σ→σ* ~150nm n→σ* ~200nm π→π* ~200nm n→π* ~300nm
吸收能量的次序为: σ→σ*>n→σ*≥π→π*>n→π*
1.2 紫外吸收光谱分析(UV)
iii B—带 它是芳香族化合物的特征吸收带。是苯环振动及
π→π* 重叠引起的。在230~270nm之间出现精细结构 吸收,又称苯的多重吸收
iv E-带 它也是芳香族化合物的特征吸收之一,E带可分为E1及
E2两个吸收带,二者可以分别看成是苯环中的乙烯键和 共轭乙烯键所引起的,也属π→π* 跃迁。
溶剂对π→π*
1.2 紫外吸收光谱分析(UV)
核磁共振波谱分析ppt课件

DE=hν ——②
则:处于低能级态的1H就会吸收电磁波的能量,跃迁到 高能级态,发生核磁共振。
11
核磁共振波谱分析
1.2.4 核磁共振的条件
发生核磁共振时,必须满足下式:
n=
g 2p
Ho
3
③式称为核磁共振基本关系式。
❖ 可见,固定H0,改变ν射或固定ν射,改变H0都可满足③ 式,发生核磁共振。
但为了便于操作,通常采用后一种方法。
• 乙酸乙酯的核磁共振氢谱
1H NMR ( 300 MHz, CDCl3 ),δ( ppm) 1.867 ( t, J= 7.2 Hz, 3H ), 2.626 ( s, 3H ), 4.716 ( q, J= 7.2 Hz, 2H )
• s—单峰;d—双峰(二重峰);t—三峰 (三重峰);q—四峰(四重峰);m—多 峰(多重峰)
C6H5CH2CH3 C6H5
CH3
CH2
17
17
核磁共振波谱分析
核磁共振氢谱信号 结构信息
信号的位置 (化学位移)
信号的数目
信号的强度 (积分面积)
信号的裂分 (自旋偶合)
质子的化学环境 化学等价质子的组数 引起该信号的氢原子数目
邻近质子的数目,J(偶
合常数)单位:Hz
18
核磁共振波谱分析
(2)核磁共振数据
19
核磁共振波谱分析
§3 化学位移 (Chemical shift)
化学环境不同 的1H 核在不 同位置(ν) 产生共振吸 收
化学环境不同的1H 核在外磁场中 以不同的Larmor频率进动;1H 核在分子中所处的化学环境不同 导致Larmor频率位移
20
核磁共振波谱分析
波谱分析.ppt

紫外光谱中常以吸收带最大的吸收波长λmax 和该波长下的摩尔吸光系数εmax 来表征化合 物的特征吸收,吸收光谱反应了物质分子对 不同紫外光的吸收能力,吸收带的形状以及 λmax εmax 与分子的结构有密切的关系。
紫外吸收光谱是由分子中的价电 子能级跃迁所产生的,在跃迁过 程中,电子能级的跃迁往往伴随 着分子振动能级的跃迁和转动能 级的跃迁,因此电子能级的跃迁 多产生的吸收带由于附加了分子 振动能级和转动能级的跃迁而变 成了较宽的谱带。
• 学习的目的和要求:
1、分子中电子能级及电子跃迁的规律,σ、π、n轨道及σσ*, n- σ*, π- π*, n- π* 跃迁与分子结构的关系,电子跃 迁产生的吸收带波长及其光谱特征。
2、分子结构变化及取代基对吸收光谱的影响,共轭体系对 吸收波长的影响。
3、各类化合物的紫外吸收特征,共轭二烯烃α,β不饱和羰基 化合物及其酰基苯衍生物的K带波长计算方法。
二 分子轨道与电子跃迁类型 分子轨道
..
CH3CH2O. .H n
电子跃迁类型
电子在不同轨道间跃迁所吸收的光辐射波长不 同。 σ→σ*跃迁所需要的能量最高,吸收波长 最短;n →π*跃迁所需要的能量最低,吸收 波长较长。
(1)σ →σ*跃迁:饱和烃△E = hυ= hc/λ 高能跃迁,大约需780kJ.mol-1的能量,相 当于真空紫外区的波长。 乙烷的σ →σ* :135nm 环丙烷σ →σ* :190nm
2、波谱分析法(UV、IR、NMR、MS) 特点:样品微量化,测定速度快,结果准确,重复 性好。 解析方法: ①、与已知纯物质的标准图谱对照。 ②、对比实验法(空白对照、底物对照、设计实 验)。 几种图谱应互相参照,相互补充,能自园其说,不 互相矛盾,才能准确地确定未知物的分子结构。
仪器分析 第十三章 核磁共振波谱分析PPT课件

原子实际上受到的磁场强度B
B= B0-B’=B0-σB0=B0(1-σ)
σ为屏蔽常数, σB0为感应产生的次级磁场强度。
B为氢核真正受到的有效外磁场强度。 核外电子云产生感应磁场,抵消一部分
磁场,产生共振向高磁场方向移动。
2μB
B
h
2
2μB( 0 1σ)
h
hν B0 2μ(1σ)
B(0 1σ) 2
实际上各种化合物中的氢核的化学环境或结 合情况不同,所产生的共振吸收峰频率不同。
任何原子核都被电子云所包围,当1H核自旋时 ,核周围的电子云也随之转动,在外磁场作用下,会 感应产生一个与外加磁场方向相反的次级磁场,实际 上会使外磁场减弱,这种对抗外磁场的作用称为屏蔽 效应.
1H核由于在化合物中所 处的化学环境不同,核外电 子云的密度也不同,受到的 屏蔽作用的大小亦不同,所 以在同一磁场强度B0 下, 化学环境不同 1H核的共振 吸收峰频率不同。
(3)I=1/2的原子核 1H,13C,19F,31P
核电荷均匀分布的球体,并象陀螺一样自旋,有磁矩产 生,是核磁共振研究的主要对象,H、C也是有机化合物的主 要组成元素。
I=1/2的核自旋能级裂分与B0的关系
• 1H核在磁场 中,由低能级E1向高能级E2跃迁, 所需能量为
△E=E2-E1= B0 -(-B0) = 2 B0
四甲基硅烷 [(CH3)4Si] TMS
TMS
CH3OCH3
TMS
低场
高场 0
化学位移
TMS的优点
1)单峰:TMS分子中有12个氢核,所有质子等同 ,只有一个吸收峰。
2)TMS的屏蔽系数几乎比所有其他物质的都大(电 子云密度大),处在高场位置,对大多数有机化合 物氢核吸收峰不产生干扰。规定TMS氢核的 =0, 则其他化合物H核的共振频率都在左侧。
第八章 波谱分析_PPT幻灯片
3. 723cm-1
C—H [—(CH2)n—, n ≥ 4]平面摇摆振动 若n<4 吸收峰将出现在734~743cm-1处
16
2.烯烃的主要吸收峰为:
特征峰
吸收峰位置/cm-1 振动形式
强度
CH CC
3000~3100 1620~1680
伸缩振动
伸缩振动
取决于双键上取代 基的数目和性质
CH
650~1000
弯曲振动
RH CC
HH ~ 910和 ~ 990RHCC
R
H
~ 890
R
H
CC
H
R
~ 970
R
R
CC
HH
~ 690
R
RR
R
CC
CC
R
HR
R
790 ~ 840 无
17
1. 3080cm-1
=C—H 伸缩振动
2. 1642cm-1
C = C 伸缩振动
3. 2860~2960cm-1
C—H 伸缩振动
4. 1465cm-1、1380cm-1
C—H(—CH3、—CH2)面内弯曲振动
5. 992cm-1、912cm-1
=C—H 弯曲振动 单取代
18
1. 3042cm-1 2. 1662cm-1 3. 2858~2950cm-1
=C—H 伸缩振动 C=C 伸缩振动
C—H 伸缩振动
19
3.炔烃的主要吸收峰为:
特征峰 吸收峰位置/cm-1 振动形式
◆弯曲振动——成键原子在键轴上、下、左、右弯曲,键角改变 而键长基本不变。
νs 对称伸缩振动
νas 不对称伸缩振动
δs 剪切振动
《有机波谱分析》PPT课件

不对称伸缩振动(vas) 精选课件ppt (2926 cm-1)
5
(2)弯曲振动:
+
+
+ +
C
C
C
C
剪式振动(δs)
面内摇摆振动(ρ) 面外摇摆振动(ω)
扭式振动(τ)
面内
面外 弯曲振动只改变键角,不改变键长
值得注意的是:不是所有的振动都能引起红外吸收,
只有偶极矩(μ)发生变化的,才能有红外吸收。
X-H 伸缩振动吸收范围。X代表O、N、C、S, 对应醇、酚、羧酸、胺、亚胺、炔烃、烯烃、芳烃 及饱和烃类的 O-H、N-H、C-H 伸缩振动。
1. O-H 醇与酚:游离态--3640~3610cm-1,峰形尖锐。
缔合--精3选30课0件cpmpt -1附近,峰形宽而钝 11
羧酸:3300~2500cm-1,中心约3000cm-1,谱带宽
2 . N-H
胺类: 游离——3500~3300cm-1
缔合——吸收位置降低约100cm-1 伯胺:3500,3400cm-1,(吸收强度比羟基弱) 仲胺:3400cm-1(吸收峰比羟基要尖锐) 叔胺:无吸收
酰胺:伯酰胺:3350,3150cm-1 附近出现双峰
仲酰胺:3200cm-1 附近出现一条谱带
第三章 红外光谱
3.1 基本原理
3.1.1波长和波数
电磁波的波长( )、频率( v)、能量(E)之间的关系:
精选课件ppt
1
3.1.2 近红外、中红外和远红外
波段名称 近红外 中红外 远红外
波长 μ 0.75—2.5 2.5-25
25-1000
波数(cm-1) 13300-4000 4000-400
波谱分析法ppt课件
n→*跃迁引起的。
该带的特征:吸收峰强度弱ε<100, λmax>260nm
*
练习
预测下列化合物产生哪些电子跃迁? 能出现什么吸收带?
CH CH COOH
NO2
O C H C H C H C H 3 2 2
*
第一章
紫外吸收光谱法
Ultraviolet Absorption Spectroscopy( UV)
n→*跃迁产生的吸收带发生蓝移
*
溶剂极性改变使吸收带位移的原因:一般认为是极性溶剂 对n 、 、*轨道的溶剂化作用不同引起的。 轨道的极性 顺序:n > * > ,轨道极性越大,受溶剂极性的影响 也越大。
n→*跃迁所需的能量最低 (max 270-300nm)
例如 饱和酮:n→*跃迁max 270-290nm附近的弱谱 带 (同时也产生→*跃迁max 180nm左右的强谱带 ) *
电子跃迁类型与分子结构及存在的基团有密切 的联系,因此,可依据分子结构预测可能产生的电 子跃迁。
例如 饱和烃 只有→* 跃迁 烯烃有 →* 、→* 跃迁 脂肪醚 →* 、n→* 跃迁 醛、酮存在 →* 、n→*、 →*、n→* 四种跃迁
第三节
影响UV的主要因素
一、分子结构的影响
二、共轭体系的影响 三、取代基的影响 四、溶剂的影响 五、pH值的影响
*
影响UV的主要因素:
1、分子内部因素:分子结构
2、外部因素:分子与分子间相互作用 或与溶剂分子之间的 作用。
*
一、分子结构的影响
1、双键位置的影响
O CH CH C CH3 CH3
O CH CH C CH3 CH3
4、质谱分析法(MS)
用于鉴别有机化合物结构的定性分析方法。
《有机波谱分析》课件
紫外-可见光谱分析
紫外-可见光谱原理
解释紫外-可见光谱的原理和 作用。
紫外-可见光谱仪的 组成和使用
详细介绍紫外-可见光谱仪的 构成和正确使用方法。
吸收峰的解析和比 较光法、内标法、 工作曲线法的应用
教授如何分析紫外-可见光谱 图中的吸收峰,并介绍比较 光法、内标法和工作曲线法 的应用。
质谱分析
《有机波谱分析》PPT课件
基本概念介绍
波谱分析的定义、有机化合物的基本特点、波长、频率和波数的关系。
红外光谱分析
1
红外光谱原理
介绍红外光谱分析的原理和应用。
红外光谱仪的组成和使用
2
详细解释红外光谱仪的组成,以及如
何正确使用。
3
光谱峰的解析和峰谷法、拔山
法的应用
教授如何分析红外光谱图中的峰和谷, 并介绍峰谷法和拔山法的应用。
1 质谱分析的原理
解释质谱分析的原理和作用。
2 质谱仪的组成和使用
详细介绍质谱仪的构成和正确使用方法。
3 质谱图的解析和母离子峰、片段离子峰的应用
教授如何分析质谱图中的母离子峰和片段离子峰,并介绍它们的应用。
多元分析
多光谱分析的原理
介绍多光谱分析的原理和它在 有机波谱分析中的应用。
主成分分析和聚类分析 的应用
说明主成分分析和聚类分析如 何应用于有机波谱分析中。
多元分析在有机波谱分 析中的实践
详细说明多元分析是如何在有 机波谱分析中得到实际应用的。
结论
1 有机波谱分析的应用前景
展望有2 knowledge check: 选择题
提供一些选择题,用于检验听众对于有机波谱分析的理解。
有机波谱分析课件第一章
核磁共振波谱
总结词
核磁共振波谱是一种基于原子核磁性的 检测技术,用于研究分子结构和化学环 境。
VS
详细描述
核磁共振波谱的基本原理是利用原子核的 自旋磁矩进行研究。在外加磁场中,原子 核的自旋磁矩会分裂成两个能级,通过测 量能级的跃迁可以获得核磁共振信号。核 磁共振波谱在有机化合物结构解析中具有 重要应用,可以提供分子中氢、碳等元素 的化学环境信息。
有机波谱分析的应用
有机波谱分析在化学、生物学、医学、药学等领域有着广泛 的应用,如化合物的鉴定、化学反应机理的研究、生物大分 子的结构和功能研究、药物开发等。
它对于有机化学、高分子化学、生物化学等领域的发展起到 了重要的推动作用,是现代化学和生物学研究不可或缺的重 要手段之一。
02
有机波谱分析的基本原理
高通量分析
高通量分析技术将进一步提高分 析的效率和速度,能够在短时间 内对大量样品进行快速、准确的 分析。
理论研究的深入
理论模型的完善
随着理论研究的深入,有机波谱分析 的理论模型将进一步完善,能够更好 地解释实验现象和预测结果。
新理论方法的探索
未来将会有更多新的理论方法被应用 于有机波谱分析中,如量子化学计算 、分子模拟等,这些方法将有助于深 入理解实验现象和结果。
有机波谱分析课件第一章
目录
• 有机波谱分析简介 • 有机波谱分析的基本原理 • 有机波谱分析实验技术 • 有机波谱分析的未来发展 • 有机波谱分析的案例分析
01
有机波谱分析简介
有机波谱分析的定义
01
有机波谱分析是一种通过测量有 机分子与电磁辐射相互作用产生 的吸收、发射或散射的信号,来 研究有机分子结构的方法。
05
有机波谱分析的案例分析
有机化学课件-波谱分析
995~985,915~905(单 取代烯) 980~960(反式二取代烯) 690(顺式二取代烯) 910~890(同碳二取代烯) 840~790(三取代烯)
C H 面外 弯曲振动
660~630(末端炔烃)
烷烃:C—H伸缩振动 2940 cm-1和 2860 cm-1,C—H 面内
弯曲1460(不对称)和1380 cm-1 (对称), -(CH2)n- (n>=4)一般在 720 cm-1处有特征峰(弱)
第八章 有机化合物的波谱分析
1.分子吸收光谱和分子结构 2.红外吸收光谱 3.核磁共振谱
第八章
1.紫外光谱(UV) 2.红外光谱(IR)
有机化合物的波谱分析
3.核磁共振谱(NMR ) 4.质谱(MS)
有机化学中应用最广泛的四大波谱:
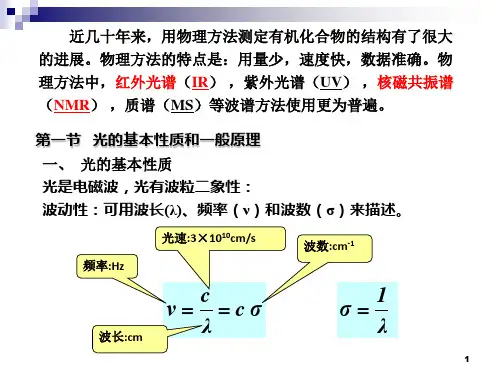
一、分子的吸收光谱和分子结构 E= hν= hc/λ ν= c/λ 1/λ=σ E 代表光子的能量,单位为J; h planck 常数 6.63x10-34J•S
TMS:四甲基硅烷
低场
屏蔽效应大,共振信号在高场,
CH3
吸收峰为单峰,化学惰性。
TMS 化学位移定为0 ppm 高场
10
9
8பைடு நூலகம்
7
6
5
4
3
2
1
零 点
-1
-2
-3
TMS
三、核磁共振谱
3. 影响化学位移的因素
(1). 电负性的影响 电负性较大的吸电子基团,使与之相连的碳上的质子周围 电子云密度降低,屏蔽作用弱,共振信号→低场(位移增大)
1
0
一张NMR谱图,通常可以给出四种重要的结构信息:化学位 移、自旋裂分、偶合常数和峰面积(积分线) 峰面积大小与质子数成正比,可由阶梯式积分曲线高度求出。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3 JCH 7.4Hz 2 JCH 1.0Hz
3 J CC 类似上述,但数据较小。
5、长程偶合常数与跨越空间的偶合
对于n>3的nJ偶合常数,称为长程偶合常数。一般而言, 通过键电子传递作用引起的长程偶合。常数很小 (0~3Hz), 难以分别,但有双键或叁键, 由于π电子的非定域性,nJ数值较 大,而且它和空间结构有关。
3Jae =90 15Hz
H
3Jee =60 1.5 Hz
H
二面角只有0(顺式) 与180(反式)
H
在同一取代基的化合物总有3JHH(反)>3JHH(顺),取代 基对3JHH均有影响。
对于芳环体系,也有类似的关系 由于π电子的传递,邻位、间位、对位氢之间均有
nJHH偶合,但邻位最大,间位次之,对位最小。
概念回顾:
化学位移:质子或其它种类的核,由于在分子中所处的化 学环境不同,而在不同的共振磁场下显示吸收蜂的现象。
§3.1 定义— 一级近似
只有δ这一效应,则NMR谱都将由一些单峰所组成。峰面 积正比于等性核的数目。
而fact ,NMR 谱随着仪器分辨率的提高,高分辨的NMR谱 也由一组组“多重峰”(multiplet)所组成。
n=1
111
n=2
12321
n=3 1 3 6 7 6 3
1
§3.2 J 偶合常数
1.旋磁比的影响 J偶合本质上是两个核磁矩通过外围电子的间接作用偶合起
来的,由于的影响,偶合常数看起来很少有规律性。
2、单键的偶合常数1JCH和JCC。 一、 1JCH
决定1JCH的主要因素有二: (一)是杂化轨道中S成分ρ;(二)是取代基的影响。
• Trifluoroacetic Acid-d1
7.24(7.27) 4.67(4.70) 2.04 7.15 1.38 2.49 8.01 2.91 2.74 4.78 3.30 8.71 7.55 7.19 3.58 1.77 7.09 7.00 6.98 2.09(s) 11.50
第三节 自旋——自旋偶合
(5)上面的例子是1H-1H的偶合。对于异核之间(如13C-1H)同
样也有J偶合,而且异核之间 多数是满足的。
|A
B
|
很大,一级近似条件
CHCl3的100MHzNMR,在强主峰1两3C(侧I 有1) 两条相距210Hz的卫线,
这就是自然丰度为1.1%
和21H核J偶合所引起的。
如氘核,常可看到J偶合裂分,对于有n个等性的氘核来 说,等宝塔规则为:
b:电负性取代基对SP2碳的影响要更显著一些。
CH3F
--149
CH4 -125
CH2=CHF --200Hz (电子的贡献)
CH2=CH2(156HZ)
c、取代基如果在碳位置,影响就小得多。
CH2=CHF --200Hz
H
C H
H J顺=159Hz C F J反=162Hz
d、取代基影响最显著的是 R CHO 醛类化合物。
CH3 CHO 173
(CH3 )2 N
191
பைடு நூலகம்
HCOOH 222
二、 1JCC
1JCC=50012 1JC-CH3=0.271JC-H
3、同碳偶合常数:2JHH,2JCH和2JCC
(一)2JHH 在氢谱中同碳偶合常数是相当有用的,其值可 正可负,但多数为负值。2JHH和杂化情况,取代基性质,超 共扼效应,环系的影响等有复杂的关系。
另外,当四个键成五个键构成“折线型”的情况,则有较 大的nJ值。
H
H
H
H
* 另一种传递作用是-π相互作用引起的。这相关于π轨道 与在CH键中氢的1S轨道重叠程度。
H-C=C-C-H H-C-C=C-C-H
4JHH=0-- -3Hz 4JHH=0-- +4Hz
长程偶合也会与二面角有关。 特例:
CF3
§2.2 化位移的测量 四:常用氘代溶剂的吸收峰位置
• Compound
• Chloroform-d
• Deuterium Oxide
• Acetone-d6 • Benzene-d6 • Cyclohexane-d12 • DMSD-d6 • DMF-d7 • Methyl alcohol –d4 • Pyridine-d5 • Tetrabyclrofuran-d8 • Toluene -d8 •
如果一个 I 1 2
核和n个等性的
I
1 2
的核彼此发
生J偶合,则此核产生n+1条谱线,其强度为:
Ckn
n! k!(n k )!
即宝塔式规则:
1
1
1
1
2
1
3
3
1 1
1
4
6
4
1
1
5
10
10
5
1
若一个 I 1 核和n个不等性的 I 1 核彼此发生不同的J偶
2
2
合,则其信号是2n条等强度的谱线,对于一级近似谱来说, 多重线的中心是,多重线间的距离即为|J|。
(2)化学位移 | A B | 正比于HO,而|J|不依赖于
H0,因此,如果原来谱图不满足一级近似条件 J的绝对值远
小于 | A B | ,我们可以用增强H0的办法,使它满足
这一条件。 这就可以把低磁场条件下所得到的复杂谱变成一级近似谱 ---发展超导NMR谱仪的原因之一。
(3)上面所述,只是双核自旋体系,对于多核自旋体系, 理论和实验表明,J偶合作用仍只是一对对双核作用的代数 和,不存在所谓的多核相互作用,处理方法均用一级规则:
同理B核也有两条谱线 整个NMR谱一共有四条谱线。 这就是由J偶合引起自旋分裂的物理实质。
关于JAB的几点说明。
(1)|J|的大小与外磁场H0无关,而且其符号可正可负, 一般情况是,当两核自旋的反平行时,能量较低,这种情况均 定为J>0,但是由于核磁距能级很低,完全有可能在某些情况 下,核自旋平行状态反处于有利地位,这时J<0.通常J的单位 用Hz表示。
Cl
CF3
CF3
CF3 Cl
Cl Cl
CN CF3
CN
CN
NC
F3C
F3C
F3C
这种顺式的情况,很大的5J不是通过折线途径或-π相互 作用传递的,而是两个F原子在空间接近时产生电子自旋的 直接关联传递的——跨越空间偶合机制。
对于(F,F)(H,H)或(H,F)偶合常数,只要两个 核空间只够近就会发生电子自旋关联,它对nJHH的贡献通常 是正的。
H
H
H H
3J HH(12) =59Hz 4J HH(13) =23Hz 5J HH(14) =01Hz
(二)3JCH 与3JHH一样服从于类似的二面角关系。 如在烯烃中,3JCH(反) >3JCH(顺)
HOOC
C H
H C
H
3JCH (反)=14.1Hz 3JCH (顺)=7.6Hz
在芳烃中,由于3JCH全是反式中,因此它常比2JCH大,如苯
(4)当分子中具有等性核时,例如CHCl2CH2Cl.A核和两个B 核之间有J偶合JAB,,而两个等性B核之间也有J偶合JBB,但是 现在的NMR谱只能反映出JAB,也就是说,尽管这种偶合是存在 的,但我们不能从NMR谱图中求得等性核之间偶合常数,要求出 等性核之间的综合常数用别的方法,如用同位素交换方法。
(二)大致上的规a 律性: (1)当HCH键角增加时,即增加杂化轨道中S成分,则2JHH 向正的方向增加。
(2)对于SP2和SP3 CH2基团,在位置上有电负性取代基 时,则2JHH向正的方向移动。 CH2 (12.4Hz) ,CH3Cl(-10,8Hz). CH2Cl2(-7.5),CH3OH(-10.8),CH3F(-9.6HZ)
(3)如果在位置上带有电负性取代基团,则2JHH向负的 方向移动。 CH4(-12.4HZ),CH3-CCl3(-13.OHZ)
O H
( -21.5Hz )
H
O
对于给电子基因,则情况正好相反
(二)2JHH。
由于13C的磁矩大约只有质子磁矩的1/4,2JCH大约等于2JHH 的60%-70%,杂化影响,取代基影响。
(一) 1JCH=500
分子 CH4 CH2=CH2
复杂情况 SP3 SP2
S成分 1/4 1/3
SP2
1/3
计算值 125 165
观察JCH 125 177
165
156
CHCH
SP
1/2
250
249
(二)取代基的影响具有加合性
a: CH4(125Hz)
CH3Cl(150HZ)
CH2Cl2(178Hz) CHCl3(209HZ)
Karplus 公式:
J A B cos C cos2
其中,
是H-C-C-H二面角.A,B,C分别为
4.22,-0.5,4.5Hz
由此可知,当两个质子处于的反式时(Ø=180°) 3JHH最大,当Ø=90°时,其值最小。
应用于:
H H
H H
H
H
3Jaa =180 812Hz
①原因:核自旋与核自旋间有着能量的偶合。
②能量偶合的分类。 a:直接偶合,是A核的核磁矩和B核的核磁矩产生的直
接的偶极相互作用。 b:间接偶合,是A核的核磁矩和B核的核磁矩通过围
绕在A核和B核外的电子云的间接传递作用使A、B核磁矩 产生能量偶合。
c:偶合(常数)几种情形
(1)在固体NMR谱中,这两种作用都存在。 (2)在液晶溶剂中,直接偶合也有残余的贡献。 (3)在非粘溶液中由于分子的快速滚动,这种直接的作用被
3 J CC 类似上述,但数据较小。
5、长程偶合常数与跨越空间的偶合
对于n>3的nJ偶合常数,称为长程偶合常数。一般而言, 通过键电子传递作用引起的长程偶合。常数很小 (0~3Hz), 难以分别,但有双键或叁键, 由于π电子的非定域性,nJ数值较 大,而且它和空间结构有关。
3Jae =90 15Hz
H
3Jee =60 1.5 Hz
H
二面角只有0(顺式) 与180(反式)
H
在同一取代基的化合物总有3JHH(反)>3JHH(顺),取代 基对3JHH均有影响。
对于芳环体系,也有类似的关系 由于π电子的传递,邻位、间位、对位氢之间均有
nJHH偶合,但邻位最大,间位次之,对位最小。
概念回顾:
化学位移:质子或其它种类的核,由于在分子中所处的化 学环境不同,而在不同的共振磁场下显示吸收蜂的现象。
§3.1 定义— 一级近似
只有δ这一效应,则NMR谱都将由一些单峰所组成。峰面 积正比于等性核的数目。
而fact ,NMR 谱随着仪器分辨率的提高,高分辨的NMR谱 也由一组组“多重峰”(multiplet)所组成。
n=1
111
n=2
12321
n=3 1 3 6 7 6 3
1
§3.2 J 偶合常数
1.旋磁比的影响 J偶合本质上是两个核磁矩通过外围电子的间接作用偶合起
来的,由于的影响,偶合常数看起来很少有规律性。
2、单键的偶合常数1JCH和JCC。 一、 1JCH
决定1JCH的主要因素有二: (一)是杂化轨道中S成分ρ;(二)是取代基的影响。
• Trifluoroacetic Acid-d1
7.24(7.27) 4.67(4.70) 2.04 7.15 1.38 2.49 8.01 2.91 2.74 4.78 3.30 8.71 7.55 7.19 3.58 1.77 7.09 7.00 6.98 2.09(s) 11.50
第三节 自旋——自旋偶合
(5)上面的例子是1H-1H的偶合。对于异核之间(如13C-1H)同
样也有J偶合,而且异核之间 多数是满足的。
|A
B
|
很大,一级近似条件
CHCl3的100MHzNMR,在强主峰1两3C(侧I 有1) 两条相距210Hz的卫线,
这就是自然丰度为1.1%
和21H核J偶合所引起的。
如氘核,常可看到J偶合裂分,对于有n个等性的氘核来 说,等宝塔规则为:
b:电负性取代基对SP2碳的影响要更显著一些。
CH3F
--149
CH4 -125
CH2=CHF --200Hz (电子的贡献)
CH2=CH2(156HZ)
c、取代基如果在碳位置,影响就小得多。
CH2=CHF --200Hz
H
C H
H J顺=159Hz C F J反=162Hz
d、取代基影响最显著的是 R CHO 醛类化合物。
CH3 CHO 173
(CH3 )2 N
191
பைடு நூலகம்
HCOOH 222
二、 1JCC
1JCC=50012 1JC-CH3=0.271JC-H
3、同碳偶合常数:2JHH,2JCH和2JCC
(一)2JHH 在氢谱中同碳偶合常数是相当有用的,其值可 正可负,但多数为负值。2JHH和杂化情况,取代基性质,超 共扼效应,环系的影响等有复杂的关系。
另外,当四个键成五个键构成“折线型”的情况,则有较 大的nJ值。
H
H
H
H
* 另一种传递作用是-π相互作用引起的。这相关于π轨道 与在CH键中氢的1S轨道重叠程度。
H-C=C-C-H H-C-C=C-C-H
4JHH=0-- -3Hz 4JHH=0-- +4Hz
长程偶合也会与二面角有关。 特例:
CF3
§2.2 化位移的测量 四:常用氘代溶剂的吸收峰位置
• Compound
• Chloroform-d
• Deuterium Oxide
• Acetone-d6 • Benzene-d6 • Cyclohexane-d12 • DMSD-d6 • DMF-d7 • Methyl alcohol –d4 • Pyridine-d5 • Tetrabyclrofuran-d8 • Toluene -d8 •
如果一个 I 1 2
核和n个等性的
I
1 2
的核彼此发
生J偶合,则此核产生n+1条谱线,其强度为:
Ckn
n! k!(n k )!
即宝塔式规则:
1
1
1
1
2
1
3
3
1 1
1
4
6
4
1
1
5
10
10
5
1
若一个 I 1 核和n个不等性的 I 1 核彼此发生不同的J偶
2
2
合,则其信号是2n条等强度的谱线,对于一级近似谱来说, 多重线的中心是,多重线间的距离即为|J|。
(2)化学位移 | A B | 正比于HO,而|J|不依赖于
H0,因此,如果原来谱图不满足一级近似条件 J的绝对值远
小于 | A B | ,我们可以用增强H0的办法,使它满足
这一条件。 这就可以把低磁场条件下所得到的复杂谱变成一级近似谱 ---发展超导NMR谱仪的原因之一。
(3)上面所述,只是双核自旋体系,对于多核自旋体系, 理论和实验表明,J偶合作用仍只是一对对双核作用的代数 和,不存在所谓的多核相互作用,处理方法均用一级规则:
同理B核也有两条谱线 整个NMR谱一共有四条谱线。 这就是由J偶合引起自旋分裂的物理实质。
关于JAB的几点说明。
(1)|J|的大小与外磁场H0无关,而且其符号可正可负, 一般情况是,当两核自旋的反平行时,能量较低,这种情况均 定为J>0,但是由于核磁距能级很低,完全有可能在某些情况 下,核自旋平行状态反处于有利地位,这时J<0.通常J的单位 用Hz表示。
Cl
CF3
CF3
CF3 Cl
Cl Cl
CN CF3
CN
CN
NC
F3C
F3C
F3C
这种顺式的情况,很大的5J不是通过折线途径或-π相互 作用传递的,而是两个F原子在空间接近时产生电子自旋的 直接关联传递的——跨越空间偶合机制。
对于(F,F)(H,H)或(H,F)偶合常数,只要两个 核空间只够近就会发生电子自旋关联,它对nJHH的贡献通常 是正的。
H
H
H H
3J HH(12) =59Hz 4J HH(13) =23Hz 5J HH(14) =01Hz
(二)3JCH 与3JHH一样服从于类似的二面角关系。 如在烯烃中,3JCH(反) >3JCH(顺)
HOOC
C H
H C
H
3JCH (反)=14.1Hz 3JCH (顺)=7.6Hz
在芳烃中,由于3JCH全是反式中,因此它常比2JCH大,如苯
(4)当分子中具有等性核时,例如CHCl2CH2Cl.A核和两个B 核之间有J偶合JAB,,而两个等性B核之间也有J偶合JBB,但是 现在的NMR谱只能反映出JAB,也就是说,尽管这种偶合是存在 的,但我们不能从NMR谱图中求得等性核之间偶合常数,要求出 等性核之间的综合常数用别的方法,如用同位素交换方法。
(二)大致上的规a 律性: (1)当HCH键角增加时,即增加杂化轨道中S成分,则2JHH 向正的方向增加。
(2)对于SP2和SP3 CH2基团,在位置上有电负性取代基 时,则2JHH向正的方向移动。 CH2 (12.4Hz) ,CH3Cl(-10,8Hz). CH2Cl2(-7.5),CH3OH(-10.8),CH3F(-9.6HZ)
(3)如果在位置上带有电负性取代基团,则2JHH向负的 方向移动。 CH4(-12.4HZ),CH3-CCl3(-13.OHZ)
O H
( -21.5Hz )
H
O
对于给电子基因,则情况正好相反
(二)2JHH。
由于13C的磁矩大约只有质子磁矩的1/4,2JCH大约等于2JHH 的60%-70%,杂化影响,取代基影响。
(一) 1JCH=500
分子 CH4 CH2=CH2
复杂情况 SP3 SP2
S成分 1/4 1/3
SP2
1/3
计算值 125 165
观察JCH 125 177
165
156
CHCH
SP
1/2
250
249
(二)取代基的影响具有加合性
a: CH4(125Hz)
CH3Cl(150HZ)
CH2Cl2(178Hz) CHCl3(209HZ)
Karplus 公式:
J A B cos C cos2
其中,
是H-C-C-H二面角.A,B,C分别为
4.22,-0.5,4.5Hz
由此可知,当两个质子处于的反式时(Ø=180°) 3JHH最大,当Ø=90°时,其值最小。
应用于:
H H
H H
H
H
3Jaa =180 812Hz
①原因:核自旋与核自旋间有着能量的偶合。
②能量偶合的分类。 a:直接偶合,是A核的核磁矩和B核的核磁矩产生的直
接的偶极相互作用。 b:间接偶合,是A核的核磁矩和B核的核磁矩通过围
绕在A核和B核外的电子云的间接传递作用使A、B核磁矩 产生能量偶合。
c:偶合(常数)几种情形
(1)在固体NMR谱中,这两种作用都存在。 (2)在液晶溶剂中,直接偶合也有残余的贡献。 (3)在非粘溶液中由于分子的快速滚动,这种直接的作用被
