第十章+醇和醚ppt课件
合集下载
醇, 酚和醚ppt课件

1 H / 2 C H O K + 2 2 5
C ( H C ) H O H A l 3 / 2 C [ ( H C ) H O A ]l H 3 + 2 3 2 3 2 3 +
反应随着醇分子烃基的加大而反应速率减慢。醇的活性为:
甲醇>伯醇>仲醇>叔醇
醇
醇的化学性质
醇的酸性比水弱,故醇钠遇水即分解成原来的醇 和氢氧化钠。
三元醇
二元醇
醇
醇的构造异构
(3) 醇的构造异构
醇的构造异构有三种:一是烃基碳链结构的不同 (碳链异构),二是羟基位置的不同(官能团位置异 构)。另外,醇与同分子量的醚互为官能团异构的同分 异构体.
例:
H C C H H O H 3 2C 2
1-丙醇
H3 H3 C C H C O H
2-丙醇
醇
醇的构造异构
醇, 酚和醚PPT课件
醇(Aocohol)
本节主要内容
1 醇的构造、分类、构造异构和命名
2 醇的物理性质
3 醇的化学性质
4 重要的醇
5 硫 醇
醇
1 醇的构造、分类、构造异构和命名
(1) 甲醇的结构
醇的结构
甲醇分子中,碳和
氧均采取sp3杂化, 氧原子以两个sp3杂
化轨道分别与氢和碳
形成O-H键和C-O键, 剩余的两个sp3杂化
C H 3 H C C H H H 3 2 C 2 C 2 C C H O H 2 C H C H 3 2
2-甲基-2-乙基-1-己醇
C H C H C H 3
H O H C 3
2-甲基-1-环己基-1-丙醇
醇
醇的命名
如果为不饱和醇,应选择含有羟基并含有双键或 叁键的最长碳链作为主链,编号时应使羟基的位号最 小;在定名称时,表示主链碳原子数的“天干”或汉 字应写在“烯”字或“炔”字名称的前面.
C ( H C ) H O H A l 3 / 2 C [ ( H C ) H O A ]l H 3 + 2 3 2 3 2 3 +
反应随着醇分子烃基的加大而反应速率减慢。醇的活性为:
甲醇>伯醇>仲醇>叔醇
醇
醇的化学性质
醇的酸性比水弱,故醇钠遇水即分解成原来的醇 和氢氧化钠。
三元醇
二元醇
醇
醇的构造异构
(3) 醇的构造异构
醇的构造异构有三种:一是烃基碳链结构的不同 (碳链异构),二是羟基位置的不同(官能团位置异 构)。另外,醇与同分子量的醚互为官能团异构的同分 异构体.
例:
H C C H H O H 3 2C 2
1-丙醇
H3 H3 C C H C O H
2-丙醇
醇
醇的构造异构
醇, 酚和醚PPT课件
醇(Aocohol)
本节主要内容
1 醇的构造、分类、构造异构和命名
2 醇的物理性质
3 醇的化学性质
4 重要的醇
5 硫 醇
醇
1 醇的构造、分类、构造异构和命名
(1) 甲醇的结构
醇的结构
甲醇分子中,碳和
氧均采取sp3杂化, 氧原子以两个sp3杂
化轨道分别与氢和碳
形成O-H键和C-O键, 剩余的两个sp3杂化
C H 3 H C C H H H 3 2 C 2 C 2 C C H O H 2 C H C H 3 2
2-甲基-2-乙基-1-己醇
C H C H C H 3
H O H C 3
2-甲基-1-环己基-1-丙醇
醇
醇的命名
如果为不饱和醇,应选择含有羟基并含有双键或 叁键的最长碳链作为主链,编号时应使羟基的位号最 小;在定名称时,表示主链碳原子数的“天干”或汉 字应写在“烯”字或“炔”字名称的前面.
有机化学醇和醚
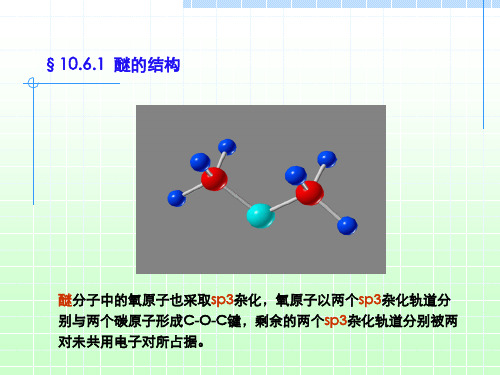
3. 溶解性 醚一般微溶于水,能与水分子形成氢键;易溶于有机溶剂。 由于 醚的化学性质不活泼,是良好的溶剂。
§10.9 醚的化学性质
醚键(C-O-C)的极性很小,比较稳定。
对碱、氧化剂、还原剂都很稳定; 在常温下醚也不与金属钠作用; 但是在一定条件下,醚也能发生某些化学反应。
§10.9 醚的化学性质
+ CH3CH2I
CH 3CH 2I
+ H2O
混醚与氢碘酸作用时,一般是较小的烃基生成碘代烷,较大的烃基
生成醇或酚。
CH 57%HI O C H 2 5 3 △ O C H 2 5 HI △ C H OH 2 5 OH + C H I 2 5 +
CH I 3
§10.9.2 络合物的生成 醚可以将氧上的未共用电子对与缺电子的试剂(如BF3、AlCl3、 RMgX等)形成相应的络合物。
HOCl
HOCH2 CH2 Cl
§10.10 重要的醚
环氧乙烷
b. 化学反应
在酸或碱催化下可以与许多含活泼氢的试剂(如水、氢卤酸、醇、氨
等)发生化学反应。
CH2 O
CH2
+
HA
CH2 OH
CH2 A
式中:A代表-OH,-X,-OR,-NH2等。
§10.10 重要的醚
环氧乙烷
b. 化学反应
① 与水反应
用,形成佯盐,而溶于强酸体系(如浓硫酸、浓盐酸)。
金 羊盐不稳定,遇水很快分解为原来的醚。
§10.9.1 佯盐的形成和醚键的断裂
醚键的断裂
醚与浓氢卤酸(一般用氢碘酸)共热,醚键可以断裂生成卤代烷 和醇。如果氢卤酸过量,生成的醇进一步反应生成卤代烷。
《医学有机化学教学课件》醇酚醚PPT课件

高级酚
在常温下呈固态的酚类化合物, 如愈疮木酚、焦性没食子酸等。
酚的结构与性质
酚的结构特点
酚的官能团是羟基(-OH),直接连在 苯环上,并且羟基的邻位和间位碳原 子上常有氢原子。
酚的性质
由于酚的羟基与苯环的π电子产生共轭 效应,使酚具有一些特殊的性质,如 酸性、亲电取代反应等。
酚的制备
01
02
03
烷基苯氧化法
通过烷基苯与氧气在催化 剂存在下反应,生成相应 的酚和酮。
芳香卤代烃水解法
通过芳香卤代烃与氢氧化 钠或氢氧化钾水溶液反应 ,生成相应的酚和卤化钠 或卤化钾。
芳香磺酸盐碱熔法
通过芳香磺酸盐与氢氧化 钠或氢氧化钾在高温下反 应,生成相应的酚和硫酸 钠或硫酸钾。
03
醚
醚的分类
芳香醚
脂肪醚
脂肪醚是指烃基直接与氧原子相 连的醚类,如甲基乙醚、乙基丙 醚等。
醇的性质
02
醇具有低毒、易溶于水、易燃等特点。
醇的化学反应
03
醇可以发生氧化、酯化、脱水等反应。
醇的制备
通过烃基的氧化制备
烃基在催化剂作用下被氧化成相应的醇。
通过酯的水解制备
酯在酸或碱的催化下水解生成相应的醇和羧酸。
通过卤代烃的水解制备
卤代烃在碱的作用下水解生成相应的醇。
02
酚
酚的分类
低级酚
在常温下呈气态或液态的酚类化 合物,如苯酚、甲酚等。
芳香醚是指芳香族化合物中的醚 类,如苯甲醚、硝基苯甲醚等。
单醚
单醚是指分子中只含有一个醚键 的醚类,如甲醚、乙醚等。
醚的分类
根据醚键两侧取代基的种类,醚 可以分为脂肪醚和芳香醚。根据 醚分子中氧原子数的不同,醚可 以分为单醚和多醚。
在常温下呈固态的酚类化合物, 如愈疮木酚、焦性没食子酸等。
酚的结构与性质
酚的结构特点
酚的官能团是羟基(-OH),直接连在 苯环上,并且羟基的邻位和间位碳原 子上常有氢原子。
酚的性质
由于酚的羟基与苯环的π电子产生共轭 效应,使酚具有一些特殊的性质,如 酸性、亲电取代反应等。
酚的制备
01
02
03
烷基苯氧化法
通过烷基苯与氧气在催化 剂存在下反应,生成相应 的酚和酮。
芳香卤代烃水解法
通过芳香卤代烃与氢氧化 钠或氢氧化钾水溶液反应 ,生成相应的酚和卤化钠 或卤化钾。
芳香磺酸盐碱熔法
通过芳香磺酸盐与氢氧化 钠或氢氧化钾在高温下反 应,生成相应的酚和硫酸 钠或硫酸钾。
03
醚
醚的分类
芳香醚
脂肪醚
脂肪醚是指烃基直接与氧原子相 连的醚类,如甲基乙醚、乙基丙 醚等。
醇的性质
02
醇具有低毒、易溶于水、易燃等特点。
醇的化学反应
03
醇可以发生氧化、酯化、脱水等反应。
醇的制备
通过烃基的氧化制备
烃基在催化剂作用下被氧化成相应的醇。
通过酯的水解制备
酯在酸或碱的催化下水解生成相应的醇和羧酸。
通过卤代烃的水解制备
卤代烃在碱的作用下水解生成相应的醇。
02
酚
酚的分类
低级酚
在常温下呈气态或液态的酚类化 合物,如苯酚、甲酚等。
芳香醚是指芳香族化合物中的醚 类,如苯甲醚、硝基苯甲醚等。
单醚
单醚是指分子中只含有一个醚键 的醚类,如甲醚、乙醚等。
醚的分类
根据醚键两侧取代基的种类,醚 可以分为脂肪醚和芳香醚。根据 醚分子中氧原子数的不同,醚可 以分为单醚和多醚。
第十章_醇和醚 共102页PPT资料

C H 3 C H 2 C H O H
b. 一取代环氧乙烷与格氏试剂反应
O M g B r + C H 3C H C H 2E t 2 O
O M g B r C H 2 C H C H 3H H 2 O +
在格氏试剂烃基上一次增加两个以上碳原子。
O H C H 2 C H C H 3
( 3 ) 制 3o 醇
C H 3 C (C H 3 )= C H C H 2 C H 2 O H
C H 3 C C C H O H C H 3
二、醇的物理性质
1、分子间氢键
R
O HH H
O R
醇与水分
R
子间也能
形成氢键
O
氢键20kJ/mol
2.沸点
1)比相应的烷烃的沸点高100~120℃(形成分子间氢 键的原因), 如乙烷的沸点为-88.6℃,而乙醇的 沸点为78.3℃。
在格氏试剂烃基上一次增加两个碳原子
(2)制 2°醇 (格氏试剂与醛反应)
O
R '
R '
a .R M g X + R '- C -H 无 水 乙 醚 R -C H -O M g X H H 2 O + R C H O H
C H 2 M g C l+ C H 3 C H O 无 水 乙 醚
H + H l
C H 3
SN2机理(直链伯醇):
X+R - O H 2
X R O H 2
X - R + H 2 O
H3C
CH3 C CHCH3 H+ H OH ZnCl2/HCl
H3C
CH3 C CHCH3 H
第十章醇和醚-精品文档227页

33
醇除了可与碱金属作用外,还可与其它活泼金属, 如镁、铝等作用生成醇镁和醇铝。生成醇镁的反应需用 少量碘催化。醇镁与醇钠一样,也很容易水解。
25.09.2019
26
(2)氢键对水溶性的影响
醚和醇都可以分别与水形成氢键,故分子量相 当的醚与醇的水溶性相似,而醚与相当分子量的烃却 大不相同。
例如:1-丁醇与二乙醚在水中的溶解度相同,在 室温下接近8.0g/100ml,而戊烷实际上是不溶于水的。 甲醇、乙醇、丙醇和叔丁醇都可以完全与水混溶,而丁 醇在水中的溶解度为7.9-12.5g/100ml,醇的水溶性 随着烃基部分的碳链增长而减少。根据“相似相溶”原 理,长链醇的极性更多与烷烃相似,而更少与水相似, 它与水羟基的缔合力减弱。
pKa
36 25 15.9 15.7 10.6 10 6.35
醇与水相似,也能与活泼金属(如 Na、K、Mg、Al)作 用,生成相应的醇化物(醇盐)并放出氢气。
例如:
H 3 C C H 2O H+N a
H 3 C C H 2 ON +H 2 a
醇的酸性:伯醇>仲醇>叔醇
25.09.2019
31
在溶液中醇的共轭碱,烷氧基 负离子是溶剂化的,溶剂化使 烷氧基负离子的稳定性增加。
25.09.2019
练习3
28
四、醇的化学性质
醇性质的总分析
25.09.2019
29
醇的化学性质
1. 酸碱性 2. 2. 卤代烷的生
成 3. 3. 脱水反应 4. 酯的生成 5. 氧化 6. 多元醇
25.09.2019
30
1. 酸碱性
a. 酸性
H 3 C C H 2 O HkaH 3 C C H 2 O -+ H + 乙烯 乙炔 乙醇 水 乙硫醇 苯酚 碳酸 硫酚
徐寿昌《有机化学》 课件 第十章 醇、醚

R CH CH R' OH OH
+
Pb(OAc)4
RCHO
+
R'CHO
+ Pb(OAc)2 +
HOAc
这个反应常定量完成,因此可用于乙二醇的定量测定,并可根 据氧化产物推断原醇的结构。 7、邻二醇的重排反应—频哪醇重排
CH3 CH 3 H3C C C CH3
H2SO4 (HCI)
△
CH3 H3C C O C CH3 CH3
M= b.p=
74 117.2
OH OH
频哪醇
频哪酮
CH3 CH3 H3C C C CH3
H2SO4
CH3 CH3 H3C C C CH3
+
OH OH CH3 CH 3 H3C C OH C
OH OH2
CH3 H3C C C CH3
-H
+
CH3 H3C C O C CH3 CH3
+CH3O Nhomakorabea CH3
第二节 醚(ethers)
325℃
5、与酸反应——酯化
醇可与有机酸、无机酸作用生成酯。
O H3C C OH + H
O
O CH2
H+ CH3
△
CH3 C O CH2 CH3
发生酯化反应时,羧酸的C – O键断裂,醇的O – H键断 裂。 CH3 – OH + H2SO4 (CH3)2SO4(硫酸二甲酯)
硫酸二甲酯剧毒,对皮肤的阀限值1ppm,空气中最 高限量5mg/m3。
CH3CH2Cl + H2O
通常用无水氯化锌与浓盐酸按1:1的比例配成溶液与醇反 应, 代替不易操作的氯化氢气体,这样的溶液称为卢卡斯 (Lucas)试剂。结构不同的醇与卢卡斯试剂反应的活性顺序 为:
有机化学 10醇酚醚

脂肪醇
脂环醇
芳香醇
饱和烃基与羟基相连为饱和醇,反之为不饱和醇。
烯醇:不稳定,容易转变为较稳定的醛或酮。
[CH2 CH OH ] [CH3 C CH2]
OH
CH3CH O
互变异构
CH3 C CH3 O
❖根据分子中羟基的数目:一元醇、二元醇、三元醇等。
CH2 CH2 OH OH
乙二醇
R' R C OH
5-甲基-3-己醇 5-methylhexan-3-ol
CH3CHCH2CHCH2CH3 CH3 Cl
2-甲基-4-氯己烷 4-chloro-2-methylhexane
(3) 习惯命名法 ❖根据和羟基相连的烃基命名,在“醇”字前加上烃基 的名称。英文名是在烃基名称的后面加上alcohol。
CH3
❖利用反应的快慢,区别伯、仲、叔醇,试剂用浓盐酸 和催化剂ZnCl2配成,称为Lucas试剂。
HCl- ZnCl2
R OH
R Cl
叔醇在室温下很快出现浑浊,并分层; 仲醇要5~10分钟后出现浑浊; 伯醇在室温下放置几小时,也看不到卤代烃生成。 适用范围:六个碳以下的醇。
❖大多数伯醇是按SN2历程进行的。
❖醇的羟基氢为活泼氢,能迅速进行质子交换,因此无自 旋偶合,为单峰。
❖氧的诱导效应使碳链上的氢周围的电子云密度减小, δ值增大。
❖乙醇的核磁共振谱:
a. b. c. CH3CH2OH
a.
b. c.
δ值: a,1.1 b,3.7 c,2.6
2 醇的化学性质
氧化反应
H ··
R C C ·O· H H
CH3 CH CH3 异丙醇
CH3 C CH3 叔丁醇
醇、酚、醚—醚(药学有机化学课件)

三、醚的化学性质
醚的化学性质较稳定,其稳定性仅次于烷烃,常温下不与 稀酸、稀碱、氧化剂、还原剂发生反应。 (一)醚与浓酸作用:生成 盐 醚的氧原子具有孤对电子,可以接受质子生成可溶于强酸的 盐。
生成的盐不稳定,遇水易分解成原来的醚。 此现象可区别醚与烷烃,烷烃不溶于强酸。
(二)醚键的断裂 在浓氢卤酸(HI或HBr)存在下,醚键断裂,生成醇和卤代烃
有机化学/ 醚
醚的结构和命名
•一、醚的结构特征
醚可以看作是醇或酚羟基的氢原子被烃基取代的产物。 醚的通式为:(Ar) R–O -R' (Ar') 醚的官能团是醚键(C-O-C)
醚中氧原子是sp3杂化,C-O-C之间有角度,醚有极性
醚分子间不能形成氢键
•二、醚的分类
单醚
根据与氧原子相连的烃基的结构或方式 混醚
在强酸性环境中形成氧正离子后, C-O键极性加大, 容易断裂。 混醚醚键的断裂发生在小烷基一端; 空阻小的烃基生成卤代烷;空阻大的烃基生成醇或酚
(三)过氧化物的生成
CH3CH2-O-CH2CH3 + O2
hγ
CH3CH2-O-CHCH3
OOH
过氧化物在受热或摩擦等情况下,易发生爆炸。 过氧化乙醚
蒸馏乙醚前,必须检查是否存在过氧化物。 检验方法:淀粉碘化钾试纸。(兰色) 去除过氧化物的方法:用FeSO4、Na2SO3或KI等处理。
乙醚的沸点低,易挥发,易着火,周围要避免明火,以防 引起火灾;乙醚易氧化,贮存时,应放在棕色瓶中。
环醚
【例如】 CH3 O CH3
CH3 O C2H5
• 单醚
混醚
醚
根据与氧原子相连的烃基的不同可分为
CH2 CH2 O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
根据官能团 所 连 烃 基 类 型 仲 醇 ( 二 级 醇 ) : R2CH O H
叔 醇 ( 三 级 醇 ) : R3CO H
根据烃基结构
饱 和 醇 : CH 3CH 2CH 2O H 不 饱 和 醇 :C H 2 C H C H 2O H
芳香醇:
CH 2O H
根据羟基数目
一 元 醇 : CH 3CH 2O H
二 元 醇 :CH 2 OH
CH2 OH
(乙 二 醇 )
多 元 醇 :C H 2 C H C H OH OH OH
(丙 三 醇 )
1.4 命名
1)普通命名法 将相应烷烃名称前的“烷”改为“醇”
C3H
C3H
C3H CC H 2 O HH C3H CO H
OH C2 O HH
C3H
异 丁 醇
叔 丁 醇 环 己 醇 苄 醇
以下醇的普通名被IUPAC接受
CH2 CHCH2OH 烯丙醇
CH CH CH2 OH OH OH
甘油(丙三醇)
CH2OH 苄醇
ClCH2CH2OH 氯乙醇
4-甲基-3-戊烯-1-醇, 3-戊炔-2-醇
C H 3 C ( C H 3 ) = C H C H 2 C H 2 O H
C H 3 C C C H O H C H 3
1.2 醇的构造异构
C H 3
C H C 3H C 2H C 2H O 2HC H C 3H C H O 2HH C 3 CC H 3 C H C 3H C H C 2H 3
C H 3
O H
O H
正丁醇
异丁醇
叔丁醇
仲丁醇
1.3 分类(3种分类方法)
伯 醇 (一 级 醇 ) : R C H 2O H
烯烃的水合
RC HC H 2 H 2 O /H RC HC H 3 O H
特点是什么?
3)羰基合成法
H 2 CC H 2+ C O + H 2C o ( , C 加 O 压 ) 8C H 3 C H 2 C H 2 O H
4.醛、酮的还原
醛、酮分子中的羰基用还原剂(NaBH4,LiAlH4) 还原或催化加氢可还原为醇。
二、醇的物理性质
1、分子间氢键
R
R
O
O
HH H O
醇与水分 子间也能 形成氢键
R 氢键20kJ/mol
2.沸点
1)比相应的烷烃的沸点高100~120℃(形成 分子间氢键的原因), 如乙烷的沸点为88.6℃,而乙醇的沸点为78.3℃。
2) 比分子量相近的烷烃的沸点高,如乙烷(分子 量为30)的沸点为-88.6℃,甲醇(分子量32)的 沸点为64.9℃。
3)含支链的醇比直链醇的沸点低,如正丁醇 (117.3)、异丁醇(108.4)、叔丁醇 (88.2)。
3、溶解度
低级醇溶于水,甲醇、乙醇、丙醇与水 混溶。随分子量增大,水溶性降低。
R OH
H OH 亲脂基(疏水基)
亲水基
4、结晶醇的形成
低级醇能和一些无机盐类(MgCl2、CaCl2、
CuSO4)形成结晶状分子化合物,也称结晶醇,如 MgCl2.6C2H5OH、CaCl2.4C2H5OH、 CaCl2.4CH3OH。结晶醇不溶于有机溶剂而溶于水。 利用此来除去少量低级醇。
H2O N2aCO 3 CH2=CHCH2OH +HCl
C2H ClNaOH+H2O
C2H OH
3、格氏试剂与羰基化合物等反应
R M g X +C = O 无 水 乙 醚 R - C - O M g X H + R - C - O H + M gO H
H 2 O
X
(1)制1o醇(格氏试剂与甲醛反应)
O
H
a .R M g X +H -C -H无 水 乙 醚R -C -O M g XH H 2 O + R C H 2 O H
H
M g C l+ H C H O 无 水 乙 醚H + H 2 O
C H 2 O H
在格氏试剂烃基上增加一个碳原子
b .C H 3 C H 2 C H 2 M g B r +O1 2 ) ) 无 H 水 3 O E + t 2 O C H 3 C H 2 C H 2 C H 2 C H 2 O H
格氏试剂与酮反应
O
C -C H 3+C H 3C H 2M gB r
1) E t2O 2) H 3O +
O H
C -C H 2C H 3 C H 3
第十章 醇和醚
一、醇的结构、分类和命名
醇(ROH)可以看成是烃(RH)分子中 的H原子被OH(羟基)取代后的生成物;又 可以看成是HOH分子中的H原子被烃基(R) 取代的产物。
C是sp3杂化。醇除了C-C、C-H键外, 还有C-O和O-H键。化学反应是容易断 裂的化学键是 C-O和O-H键,常见的化 学反应是与活泼金属作用(O-H,断裂, 酸性)、亲核取代反应(OH被取代)、消除 反应(消除OH和-H).
9. 3 醇的制法
一.有合成气合成甲醇 二、由烯烃合成 直接水合,间接水合,环氧化水解 三、羰基合成 由烯烃和CO、H2合成 四、醛、酮的还原
五、格氏试剂
2.由烯烃制备
硼氢化-氧化反应: 硼氢化
C C + B2H6
氧化
C C OH
CC H
3B
特点:1.氢加到含氢较少的双键碳原子
上;2.顺式加成(指H和OH加在同一边), 选择性好;3.产率高;4.反应条件温和。
例如:
CH3CH2CH2CHONH2aOB4H
CH3CH2CH2CH2OH 85%
O
CH3CH2-C-C3H NaB4H H2O
CH3CH2-CH-C 3 H OH
87%
不饱和醛、酮还原时,若要保存双键,
则应选用特定还原剂。
5.由卤代烃水解
此法只适应在相应的卤代烃比醇容易得到的 情况时采用。
CH2 = CHCH2Cl
在格氏试剂烃基上一次增加两个碳原子
(2)制 2°醇 (格氏试剂与醛反应)
O
R '
R '
a .R M g X + R '- C - H 无 水 乙 醚 R - C H - O M g X H H 2 O + R C H O H
C H 2 M g C l+ C H 3 C H O 无 水 乙 醚H H 2 O +
C H 3 C H 2 C H O H
b. 一取代环氧乙烷与格氏试剂反应
O
O M g B r
M g B r + C H 3 C H CH H 2 O +
O H C H 2 C H C H 3
在格氏试剂烃基上一次增加两个以上碳原子。
( 3 ) 制 3o 醇
叔 醇 ( 三 级 醇 ) : R3CO H
根据烃基结构
饱 和 醇 : CH 3CH 2CH 2O H 不 饱 和 醇 :C H 2 C H C H 2O H
芳香醇:
CH 2O H
根据羟基数目
一 元 醇 : CH 3CH 2O H
二 元 醇 :CH 2 OH
CH2 OH
(乙 二 醇 )
多 元 醇 :C H 2 C H C H OH OH OH
(丙 三 醇 )
1.4 命名
1)普通命名法 将相应烷烃名称前的“烷”改为“醇”
C3H
C3H
C3H CC H 2 O HH C3H CO H
OH C2 O HH
C3H
异 丁 醇
叔 丁 醇 环 己 醇 苄 醇
以下醇的普通名被IUPAC接受
CH2 CHCH2OH 烯丙醇
CH CH CH2 OH OH OH
甘油(丙三醇)
CH2OH 苄醇
ClCH2CH2OH 氯乙醇
4-甲基-3-戊烯-1-醇, 3-戊炔-2-醇
C H 3 C ( C H 3 ) = C H C H 2 C H 2 O H
C H 3 C C C H O H C H 3
1.2 醇的构造异构
C H 3
C H C 3H C 2H C 2H O 2HC H C 3H C H O 2HH C 3 CC H 3 C H C 3H C H C 2H 3
C H 3
O H
O H
正丁醇
异丁醇
叔丁醇
仲丁醇
1.3 分类(3种分类方法)
伯 醇 (一 级 醇 ) : R C H 2O H
烯烃的水合
RC HC H 2 H 2 O /H RC HC H 3 O H
特点是什么?
3)羰基合成法
H 2 CC H 2+ C O + H 2C o ( , C 加 O 压 ) 8C H 3 C H 2 C H 2 O H
4.醛、酮的还原
醛、酮分子中的羰基用还原剂(NaBH4,LiAlH4) 还原或催化加氢可还原为醇。
二、醇的物理性质
1、分子间氢键
R
R
O
O
HH H O
醇与水分 子间也能 形成氢键
R 氢键20kJ/mol
2.沸点
1)比相应的烷烃的沸点高100~120℃(形成 分子间氢键的原因), 如乙烷的沸点为88.6℃,而乙醇的沸点为78.3℃。
2) 比分子量相近的烷烃的沸点高,如乙烷(分子 量为30)的沸点为-88.6℃,甲醇(分子量32)的 沸点为64.9℃。
3)含支链的醇比直链醇的沸点低,如正丁醇 (117.3)、异丁醇(108.4)、叔丁醇 (88.2)。
3、溶解度
低级醇溶于水,甲醇、乙醇、丙醇与水 混溶。随分子量增大,水溶性降低。
R OH
H OH 亲脂基(疏水基)
亲水基
4、结晶醇的形成
低级醇能和一些无机盐类(MgCl2、CaCl2、
CuSO4)形成结晶状分子化合物,也称结晶醇,如 MgCl2.6C2H5OH、CaCl2.4C2H5OH、 CaCl2.4CH3OH。结晶醇不溶于有机溶剂而溶于水。 利用此来除去少量低级醇。
H2O N2aCO 3 CH2=CHCH2OH +HCl
C2H ClNaOH+H2O
C2H OH
3、格氏试剂与羰基化合物等反应
R M g X +C = O 无 水 乙 醚 R - C - O M g X H + R - C - O H + M gO H
H 2 O
X
(1)制1o醇(格氏试剂与甲醛反应)
O
H
a .R M g X +H -C -H无 水 乙 醚R -C -O M g XH H 2 O + R C H 2 O H
H
M g C l+ H C H O 无 水 乙 醚H + H 2 O
C H 2 O H
在格氏试剂烃基上增加一个碳原子
b .C H 3 C H 2 C H 2 M g B r +O1 2 ) ) 无 H 水 3 O E + t 2 O C H 3 C H 2 C H 2 C H 2 C H 2 O H
格氏试剂与酮反应
O
C -C H 3+C H 3C H 2M gB r
1) E t2O 2) H 3O +
O H
C -C H 2C H 3 C H 3
第十章 醇和醚
一、醇的结构、分类和命名
醇(ROH)可以看成是烃(RH)分子中 的H原子被OH(羟基)取代后的生成物;又 可以看成是HOH分子中的H原子被烃基(R) 取代的产物。
C是sp3杂化。醇除了C-C、C-H键外, 还有C-O和O-H键。化学反应是容易断 裂的化学键是 C-O和O-H键,常见的化 学反应是与活泼金属作用(O-H,断裂, 酸性)、亲核取代反应(OH被取代)、消除 反应(消除OH和-H).
9. 3 醇的制法
一.有合成气合成甲醇 二、由烯烃合成 直接水合,间接水合,环氧化水解 三、羰基合成 由烯烃和CO、H2合成 四、醛、酮的还原
五、格氏试剂
2.由烯烃制备
硼氢化-氧化反应: 硼氢化
C C + B2H6
氧化
C C OH
CC H
3B
特点:1.氢加到含氢较少的双键碳原子
上;2.顺式加成(指H和OH加在同一边), 选择性好;3.产率高;4.反应条件温和。
例如:
CH3CH2CH2CHONH2aOB4H
CH3CH2CH2CH2OH 85%
O
CH3CH2-C-C3H NaB4H H2O
CH3CH2-CH-C 3 H OH
87%
不饱和醛、酮还原时,若要保存双键,
则应选用特定还原剂。
5.由卤代烃水解
此法只适应在相应的卤代烃比醇容易得到的 情况时采用。
CH2 = CHCH2Cl
在格氏试剂烃基上一次增加两个碳原子
(2)制 2°醇 (格氏试剂与醛反应)
O
R '
R '
a .R M g X + R '- C - H 无 水 乙 醚 R - C H - O M g X H H 2 O + R C H O H
C H 2 M g C l+ C H 3 C H O 无 水 乙 醚H H 2 O +
C H 3 C H 2 C H O H
b. 一取代环氧乙烷与格氏试剂反应
O
O M g B r
M g B r + C H 3 C H CH H 2 O +
O H C H 2 C H C H 3
在格氏试剂烃基上一次增加两个以上碳原子。
( 3 ) 制 3o 醇
