化学工程与工艺专业分析化学实验讲义
化学工程与工艺专业课

化学工程与工艺专业课
课程简介:
本课程是化学工程与工艺专业的核心课程之一。
旨在培养学生在化学工程与工艺领域的科学素养和工程实践能力,为学生提供深入了解化学反应、传质、传热、流体力学、过程控制等相关领域的知识和理论基础。
一、化学反应工程
1. 化学反应原理与动力学
- 化学反应的速率方程
- 反应动力学模型
- 化学反应器的类型及其原理
2. 反应器设计与操作
- 反应器的能量平衡和物质平衡
- I型反应器的设计和分析
二、传质与传热工程
1. 传质过程与传质模型
- 传质过程的基本概念和特点
- 传质操作设备的设计和优化
- 传热方程和传热模型
三、流体力学与流体操作工程
1. 流体力学基础
- 流体力学的基本概念和基本方程
- 流体输运现象的分析和计算
- 流体运动控制与调节
- 流体操作设备的分类和特点
四、过程控制与优化
1. 过程控制基础
- 控制系统的基本概念和结构
- 反馈控制和前馈控制
- 控制器的选型和调节
2. 过程优化和先进控制技术
- 过程优化的基本原理和方法
- 先进控制技术的应用和发展趋势
以上为本课程的大致内容。
通过学习本课程,学生将能够掌握化学工程与工艺领域的核心理论和实践技能,为日后从事相关工作和研究打下坚实的基础。
本课程也将为学生提供思考和解决实际问题的能力,并培养学生的创新精神和团队合作意识。
化学工程与工艺专业实验

化学工程与工艺专业实验课程名称:化学工程与工艺专业实验英文名称:Special Experiment for Chemical Engineering and Technology学分:2课程总学时:64 实验学时:64(其中,上机学时:0)课程性质:☑必修□选修是否独立设课:☑是□否课程类别:□基础实验□专业基础实验☑专业领域实验含有综合性、设计性实验:☑是□否面向专业:化学工程与工艺专业先修课程:化工原理、化学反应工程、化工热力学、现代分离技术、精细化学工艺学大纲编制人:课程负责人:董新法实验室负责人:吕扬效一、教学信息实验教学的目标与任务:为了更好地适应21世纪知识经济的挑战,培养学生的动手能力和创新精神,同时根据该门学科基础课、专业领域课程的教学内容,开设本专业的实验技术课程。
该课程是技术实践课。
要求学生根据3年来所掌握的专业知识,结合每门专业课程的内容,由学生独立完成专业实验。
其目的是:学生通过实验教学,能巩固和加深对课堂教学知识的理解,学生通过实验技能的训练培养,提高学生从事实验研究的能力。
教学基本要求:本课程由实验理论课、实验操作课、仿真实验、实验讨论课等四部分组成。
每个实验包括四个环节:实验预习、实验操作、实验数据的处理、实验报告撰写。
考核方式实验课程评分标准;1、做实验的认真态度10分。
2、完成实验报告质量30分。
3、完成化工工艺专业实验60分。
总共100分。
其中:实验态度成绩由实验指导老师根据学生实验预习情况、实验中的实际操作能力和处理、解决问题的能力而给出分数。
实验报告成绩,由老师根据其报告内容和对实验过程、实验数据的分析和处理方法,实验结果及讨论等各方面给予成绩。
并将学生的各个实验报告成绩取平均值。
二、教学资源(一)实验指导书与参考书1、实验指导书:《化学工程与工艺专业实验讲义》(自编)(二)多媒体教学资源(课程网站、课件等资料)无三、实验内容与学时安排化学工程与工艺综合实验教学大纲课程名称:化学工程与工艺综合实验英文名称:Integration Experiments of Chemical Engineering and Technology学分:2课程总学时:两周实验学时:64 (其中,上机学时:0)课程性质:☑必修□选修是否独立设课:☑是□否课程类别:□基础实验□专业基础实验☑专业领域实验含有综合性、设计性实验:☑是□否面向专业:化学工程与工艺专业先修课程:化工原理、化学反应工程、化工热力学、现代分离技术、精细化学工艺学大纲编制人:课程负责人:陈砺实验室负责人:李琼一、教学信息实验教学的目标与任务本实验教学的主要目的在于;如何提高学生的独立思考能力和实际操作能力,使即将毕业学生更加适应于现实社会的需要。
化学工程与工艺专业化学分析与检测课程优秀教案范本仪器分析与质量控制

化学工程与工艺专业化学分析与检测课程优秀教案范本仪器分析与质量控制一、引言在化学工程与工艺专业的教学中,化学分析与检测是一门非常重要的课程。
本文旨在提供一份优秀的教案范本,重点介绍了仪器分析与质量控制的教学内容与方法。
二、教学目标1. 了解常见的仪器分析方法,如色谱、质谱、光谱等,并能够运用这些方法进行样品分析。
2. 掌握质量控制的基本原理,学会建立与运用质量控制体系。
3. 锻炼学生的实验操作能力,提高他们的分析思维与判断能力。
三、教学内容1. 仪器分析方法在本部分,依次介绍色谱、质谱、光谱等常见的仪器分析方法。
对于每种方法,首先简要介绍其原理,并给出一个相关的实例,以帮助学生理解。
然后详细解释该方法的操作流程、常见问题和解决方法,同时引导学生进行实验操作与结果分析。
最后,介绍该方法的应用领域和发展趋势,激发学生的进一步探索兴趣。
2. 质量控制在本部分,重点介绍质量控制的基本原理与方法。
首先介绍质量控制的定义与意义,强调其在化学工程领域的重要性。
然后介绍质量控制的基本流程,包括样品采集、样品制备和数据处理等。
接着,介绍质量控制的指标与标准,以及如何进行质量控制的实施与评价。
最后,引导学生进行案例分析,让他们能够将所学知识应用到实际问题的解决中。
四、教学方法1. 理论讲授通过讲授仪器分析方法的原理、操作流程和应用,以及质量控制的基本原理与方法,对学生进行基础知识的补充和理论学习。
在讲授过程中,可采用多媒体展示辅助教学,如展示实验操作视频、引用相关研究论文等,以提高学生的学习兴趣与理解能力。
2. 实验操作通过设计一系列与教学内容相关的实验,让学生亲自操作仪器,进行样品分析与质量控制实践。
在实验操作中,注重培养学生的实验技能、分析思维和团队合作意识。
3. 讨论与案例分析设立小组讨论环节,让学生自由讨论仪器分析方法和质量控制的相关问题。
同时,引导学生进行案例分析,让他们通过对实际问题的思考和分析,提高解决问题的能力。
化工《化学工程与工艺专业实验》教学大纲

《化学工程与工艺专业实验》实验教学大纲课程所在学院:材料科学与工程;所在实验室:化学工程与工艺一、课程基本信息二、实验目的与基本要求化学工程与工艺专业实验是在完成化学工程与工艺专业学科基础课程、专业理论课程学习的基础上,根据我校学科特色,专门开设的一门实践教学课程。
主要由基础验证性实验、综合设计性实验、研究开放性实验等部分组成。
课程的目的是使学生能够了解本专业实验研究的基本方法,观察实验过程所出现的各种现象,掌握专业实验仪器和设备的使用方法。
通过对基本物性参数的测定实验,掌握化工产品质量控制的分析检测方法;通过天然产物的提取、分离、纯化综合设计性实验,掌握天然产物的深加工方法及应用;通过结合科研课题,让学生查阅资料、提出实验方案、设计实验路线,进行研究开发性实验。
培养了学生分析问题和解决问题的能力,提高了学生的动手能力和研究兴趣。
Chemical Engineering and Technology Experiment is a practical hands-on course designed and implemented to reflect the unique characteristics of both university and the major of Chemical Engineering and Technology. It is a course that requires the completion of all basic courses and the study of all subject theories of the major of Chemical Engineering and Technology. It primarily comprises of fundamental confirmatory experiment, integrated design experiment and research open experiment. This course helps students understand basic experiment methods in major-related research, observe various outcomes during experiment processes and eventually learn how to test and analyze results during the process of chemical product quality control. This course also introduces the methods and application of deep processing of natural products by allowing students to conduct integrated design experiments about extraction, separation and purification of natural products. Additionally, the course involves various research topics that allow students to search and read literature, design experiment plans and procedures, and perform research open experiments. Eventually this course will improve the students' skills, both theoretic and hands-on, in analyzing and solving problems, while helping develop students' interest in research topics.注:实验类型分:1)演示型(验证型);2)综合型(设计型);3)研究型(创新型)。
化学工程与工艺_化学工程与工艺专业解读

化学工程与工艺_化学工程与工艺专业解读化学工程与工艺专业解读一、专业解析什么就是化学工程与工艺化学工程与工艺就是研究化学工业生产过程中的共同规律,并用化学方法改变物质组成或性质来生产化学产品的一门工程学科。
简单来说,也就是化学在工程实际中的应用。
化学工程与技术学科从19世纪末由于化学品大规模生产的须要而构成和发展的。
当时,为了化工生产的高效率和大型化,根据典型的化学工艺和设备中发生的一些具备共同属性的工程问题,构成了单元操作方式的概念。
20世纪50年代后发展的传达过程原理和化学反应工程并使化学工程学科下降至了代莱阶段。
人类穿着的各种合成纤维的衣物,喝的各种食物的外包装加工,居住的房屋的水泥钢材,以及人们驾车所用的石油天然气,都就是化工研究的方向。
中科院院士陈洪渊就曾经评价化工产业为“国之重器”,能够缔造出来数千万个“新物种”。
化学工程与工艺学什么本科期间化学工程与工艺专业的基础课程主要存有:基础化学、有机化学、物理化学、化工原理、化工热力学、化工传达过程、化学反应工程、化工工艺学、化工设计、过程动态专研掌控等。
学生还要自学很多有关专业的必修课程和报读课程。
各校根据开办专业的方向和侧重于相同,课程设置有所差异。
另外,化工专业就是一个很著重实验和课堂教学的学科,大学期间牵涉的实验和专业课堂教学课程也很多,须要具有一定的动手能力。
大学期间,同学们可以学到一些很有意思的知识,比如,洗发水怎么配比?怎样的配方会有怎样的效果?肥皂、洗涤剂生产工艺怎样最合理?怎样制作擦脸油、雪花膏……学生通常要通过产品设计、物质分离和转变等过程中物质和能量的转化传递规律,掌握产品与工艺开发、生产装置设计从实验室到大规模生产线的放大、过程系统优化、过程安全与环境的理论和方法,掌握物质分离与转变过程及其设备设计与操作的共同规律。
化学工程和化学的区别?化学工程专业是标准的工科专业,而化学专业是典型的理科专业,它更关注的是最基本的科学原理。
化学工程与工艺专业分析化学实验讲义
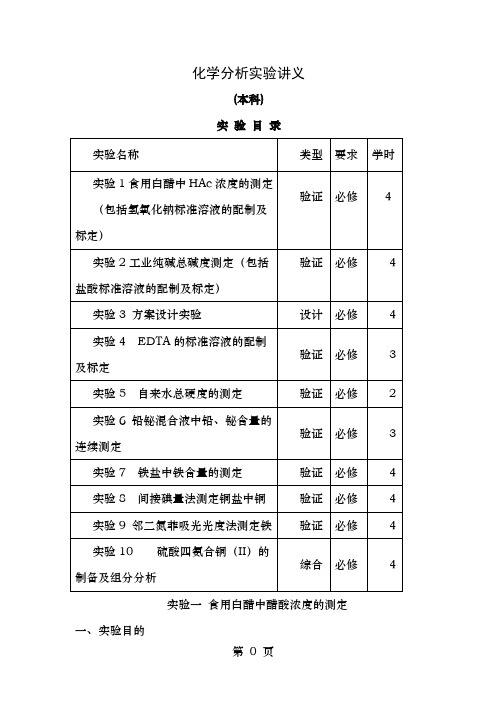
化学分析实验讲义(本科)实验目录实验一食用白醋中醋酸浓度的测定一、实验目的1.了解基准物质邻苯二甲酸氢钾的性质及其应用。
2.掌握NaOH 标准溶液的配制、标定的操作。
3.掌握强碱滴定弱酸的反应原理及指示剂的选择。
4.巩固分析天平操作,熟悉滴定操作方法,学习移液管与容量瓶等量器的正确使用。
二、实验原理1.食用白醋中的主要成份为醋酸,醋酸的Ka=1.8×10-5,可用标准NaOH 溶液直接滴定,滴定终点产物是醋酸钠,滴定突跃在碱性范围内,pHsp≈ 8.7,选用酚酞作指示剂。
从而测得其中醋酸的含量。
HAc+NaOH=NaAc+H 2O2. NaOH 标准溶液采用标定法,这是因为NaOH 固体易吸收空气中的CO 2与水蒸汽,故只能选用标定法来配制。
常用来标定碱标准溶液的基准物质有邻苯二甲酸氢钾、草酸等。
本实验用基准物质邻苯二甲酸氢钾标定,滴定产物为邻苯二甲酸钠钾,滴定突跃在碱性范围内,pHsp≈9,用酚酞作指示剂。
反应式如下:三、仪器台秤、半(全)自动电光分析天平、称量瓶、量筒(10mL)、烧杯、试剂瓶、碱式滴定管(50 mL)、锥形瓶(250mL)、移液管(25 mL )、容量瓶(250 mL )、电炉。
四、试剂NaOH(s)(A.R.)、酚酞指示剂(0.2%乙醇溶液)、食用白醋(市售)。
CO CO+ N a CO + H 2 O CO邻苯二甲酸氢钾(KHC8H4O4)基准物质(烘干温度100-1250C)。
五、实验步骤1.0.1mol/LNaOH标准溶液的配制用台秤称取4.0g NaOH固体于1000mL烧杯中,加去离子水溶解,然后转移至试剂瓶(聚乙烯)中,用去离子水稀释至1000mL,充分摇匀,贴上标签(溶液名称,姓名,配制日期),备用。
2.0.1mol/L NaOH溶液的标定准确称取邻苯二甲酸氢钾0.4~0.8g三份,分别置于250mL锥形瓶中,各加入约40mL热水溶解,冷却后,加入3滴酚酞指示剂,用NaOH溶液滴定至溶液刚好由无色变为微红色且30s内不褪,停止滴定。
化学反应工程与工艺专业实验讲义

实验一反应精馏合成乙酸乙酯一实验目的1 了解反应精馏过程原理及适用场合.2 掌握反应精馏装置的操作方法和反应精馏研究方法。
3 了解反应精馏与常规精馏的区别。
4 学会用色谱-热导检测器分析塔内物料浓度组成。
二实验原理反应精馏法是将化学反应过程与精馏分离过程同时进行生产产品的操作。
由于物理过程与化学过程同时存在,使过程更加复杂。
(1)对可逆平行反应,通过精馏将反应产物中的高沸物或低沸物连续的从系统中排出,可使总转化率超过平衡转化率,大大提高生产效率。
(2)对于异构体混合物分离比较困难时,若其中的某组分能发生化学反应并生成沸点不同的物质,就可以加以分离。
本实验用乙酸、乙醇为原料,加入少量浓硫酸为催化剂通过反应精馏合成乙酸乙酯。
边反应边将乙酸乙酯分离出来,提高乙酸的转化率。
操作方式:间歇过程;塔釜连续进料过程;塔身某处连续进料过程。
产物分析方法:采用色谱-热导检测分析,色谱工作站处理。
GDX分离柱(φ3mm,L 2m) , 柱温110度,汽化温度130度,检测温度120度;载气压力0.04Mpa;桥流100mA.出峰的先后顺序为:H2O , CH3CH2OH , CH3COOH ,CH3COOC2H5.它们的摩尔校正因子分别为:3.03, 2.09, 1.39, 0.91。
三实验装置与试剂反应精馏装置一套,直径20mm, 内装填料,可自动加热、保温、回流控制。
操作过程见说明书。
无水乙醇200mL ;含浓硫酸0.3%(wt)的冰乙酸200mL.四实验步骤1 配置1:1.3(mol)酸醇混合液250mL,加入到塔釜中。
并用色谱准确测其组成。
2 开启色谱-热导检测分析仪及色谱工作站,按分析方法操作。
3 通冷却水,接通电源。
按操作说明书对反应精馏装置加热升温,并开启保温电流。
待塔顶有液体出现时,全回流30分钟。
以微量注射器在塔身不同高度取样口取样分析,作出塔内各组分的浓度分布曲线。
4 开启回流比3:1 ,塔顶开始出产品。
化学工程与工艺专业分析化学实验讲义

化学工程与工艺专业分析化学实验讲义化学工程与工艺专业是一门应用型科学,主要研究化学反应工程原理、化工过程及相关技术的综合性学科。
作为该专业的学生,实验课程是非常重要的一部分,通过实验可以帮助学生更好地理解理论知识、掌握实际操作技能,提高实践能力。
本文将介绍一份分析化学实验讲义,主要包括分析化学实验的目的、原理、实验步骤和结果分析等方面。
一、实验目的本次实验的目的是学习和掌握分析化学中的常用分析技术,并运用这些技术进行物质的定性与定量分析。
通过本次实验,学生应能够了解和掌握气相色谱分析的原理和操作方法,能够正确使用气相色谱仪进行样品分析。
二、实验原理气相色谱是一种常用的分离和分析技术,它基于物质在气相中的分配行为实现物质的分离和定性/定量分析。
其主要原理是通过溶剂和样品之间的分配和移动过程来实现样品中各种组分的分离。
在气相色谱仪中,样品首先被蒸发成气体,然后通过色谱柱中的固定相进行分离,最后通过检测器检测各组分的峰信号,并对其进行定性和定量分析。
三、实验步骤1.样品制备:取适量的待分析物样品,按照一定比例配制成溶液或气体样品。
2.样品进样:将制备好的样品以一定速度进样到气相色谱仪的进样口。
3.色谱柱选择:根据待分析物的性质选择合适的色谱柱。
4.色谱柱调试:根据待分析物的特性进行色谱柱的调试优化,如优化气相流速、柱温等条件。
5.实验测定:开启气相色谱仪,运行待分析物样品,记录峰面积、峰高等数据。
6.数据处理:根据测得的数据进行定性和定量分析,生成实验报告。
四、实验结果与分析通过实验测定,可以得到样品中各组分的峰面积或峰高数据。
通过对比样品和标准品的测定数据,可以进行定性和定量分析。
定性分析主要通过对比待分析物样品的色谱图与标准品的色谱图,判断样品中是否存在目标成分。
定量分析主要通过计算待分析物样品的峰面积或峰高与标准品之间的比例关系,从而推算出待分析物样品中目标成分的含量。
五、实验注意事项1.实验操作要严谨,遵循实验安全规范。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学分析实验讲义(本科)实验目录实验一食用白醋中醋酸浓度的测定一、实验目的1.了解基准物质邻苯二甲酸氢钾的性质及其应用。
2.掌握NaOH标准溶液的配制、标定的操作。
3.掌握强碱滴定弱酸的反应原理及指示剂的选择。
4.巩固分析天平操作,熟悉滴定操作方法,学习移液管和容量瓶等量器的正确使用。
二、实验原理1.食用白醋中的主要成份为醋酸,醋酸的Ka=1.8×10-5,可用标准NaOH 溶液直接滴定,滴定终点产物是醋酸钠,滴定突跃在碱性范围内,pHsp≈ 8.7,选用酚酞作指示剂。
从而测得其中醋酸的含量。
HAc+NaOH=NaAc+H 2O2. NaOH 标准溶液采用标定法,这是因为NaOH 固体易吸收空气中的CO 2和水蒸汽,故只能选用标定法来配制。
常用来标定碱标准溶液的基准物质有邻苯二甲酸氢钾、草酸等。
本实验用基准物质邻苯二甲酸氢钾标定,滴定产物为邻苯二甲酸钠钾,滴定突跃在碱性范围内,pHsp≈9,用酚酞作指示剂。
反应式如下: 三、仪器台秤、半(全)自动电光分析天平、称量瓶、量筒(10mL)、烧杯、试剂瓶、碱式滴定管(50 mL)、锥形瓶(250mL)、移液管(25 mL )、容量瓶(250 mL )、电炉。
四、试剂NaOH(s)(A.R.)、酚酞指示剂(0.2%乙醇溶液)、食用白醋(市售)。
邻苯二甲酸氢钾(KHC 8H 4O 4)基准物质(烘干温度100-1250C )。
五、实验步骤1.0.1mol/LNaOH 标准溶液的配制用台秤称取4.0g NaOH 固体于1000mL 烧杯中,加去离子水溶解,然后转移至试剂瓶 (聚乙烯)中,用去离子水稀释至1000mL ,充分摇匀,贴上标签(溶液名称,姓名,配制日期),备用。
2.0.1mol/L NaOH 溶液的标定准确称取邻苯二甲酸氢钾0.4~0.8g 三份,分别置于250mL 锥形瓶中,各加入约40mL 热水溶解,冷却后,加入3滴酚酞指示剂,用NaOH 溶液滴定至溶液刚好由无色变为微红色且30s 内不褪,停止滴定。
记录终点消耗的NaOH 体积。
根据所消耗NaOH 溶液的体积,计算NaOH 标准溶液的浓度。
平行实验三次。
计算三次结果的相对平均偏差。
3.白醋中醋酸浓度的测定COOH COOK+ NaOHCOOK+ H 2O COONa移取25.00mL食用白醋于250mL容量瓶中,用去离子水稀释到刻度,摇匀。
准确移取25.00mL已稀释的白醋溶液于锥形瓶中,加20-30mL去离子水,加入3滴酚酞指示剂,用NaOH标准溶液滴定至溶液刚好出现淡红色,并在30s内不褪,即为终点。
根据所消耗NaOH溶液的体积,计算原市售白醋中醋酸的含量(g/100mL)。
平行实验三次。
计算三次结果的相对平均偏差。
六、数据记录与处理表格表一表二思考题:1.称取NaOH及KHP各用什么天平?为什么?2.已标定的NaOH在保存时,吸收了空气中的CO2,用它测定HCl溶液的浓度,若用酚酞作指示剂,对测定结果产生何种影响?改用甲基橙为指示剂,结果如何?3.测定食用白醋的醋酸含量,为什么选用酚酞作指示剂?能否用甲基橙或甲基红为指示剂?4.为什么终点时,酚酞变红需半分钟不褪为终点,若半分钟后褪色是由什么引起的?实验二工业纯碱总碱度测定一、实验目的1.掌握HCl标准溶液的配制与标定。
2.掌握用一种标准溶液标定另一种标准溶液的方法3.掌握强酸滴定二元弱碱的过程、突跃范围及指示剂的选择。
4.掌握定量转移操作的基本要点。
5.巩固分析天平操作及移液管、容量瓶、酸式滴定管的操作。
二、实验原理1.工业纯碱的主要成分为NaCO3,可能含有某些钠盐(如NaOH或NaHCO3及NaCl)。
欲测定其总碱度,常用HCl标准溶液滴定。
根据滴定反应最终计量点的产物为饱和二氧化碳溶液,pH=3.8,选用甲基橙为指示剂。
结果以Na2O的质量分数表示总碱度。
HCl+Na2CO3= H2CO3+ NaCl2. 盐酸标准溶液采用间接配制法。
常用于标定酸的基准物质有无水碳酸钠和硼砂。
其浓度还可通过与已知准确浓度的NaOH标准溶液比较进行标定。
可用实验一中所配已标定的NaOH溶液滴定盐酸,以确定盐酸的准确浓度。
化学计量点时pH=7.00,选用甲基橙为指示剂。
三、仪器分析天平、称量瓶、酸式滴定管(50mL)、移液管(20 mL、25mL)、吸耳球、锥形瓶(250mL)、量筒(10mL)、烧杯、试剂瓶、四、试剂浓盐酸(A.R.)、氢氧化钠标准溶液(已知准确浓度)、甲基橙指示剂(0.2%)、工业纯碱样品。
五、实验步骤1.0.1mol/L HCl标准溶液的配制用量筒量取4.5mL浓盐酸(约12 mol/L),倒入烧杯中,用去离子水稀释至500mL 后,转移至试剂瓶中,充分摇匀,贴上标签,备用。
2. 0.1mol/L HCl标准溶液的标定准确移取25.00mL已标定的NaOH标准溶液于锥形瓶,加入20-30mL水,加甲基橙指示剂2滴,摇匀,用待标定的HCl溶液滴定,至溶液恰由黄色变为橙色时为终点,记下读数。
平行三次。
计算HCl标准溶液的准确浓度和三次结果的相对平均偏差。
3.总碱度的测定准确称取纯碱样品0.8-0.9g倾入小烧杯中,加少量水使其溶解。
将溶液定量转入100mL容量瓶中,加水稀释到刻度,充分摇匀。
平行移取试液20.00 mL3份分别放入250 mL锥形瓶中,加水约25 mL,加入2滴甲基橙,用HCl标准溶液滴定由黄色恰变为橙色即为终点。
记录HCl体积。
平行测定三次。
计算试样的总碱度(以氧化钠的质量分数表示)和三次结果的相对平均偏差。
六、数据记录与处理表格表一表二1 2 3称量瓶+试样质量 称量瓶+剩余试样质量 试样质量m (g ) 试样定容体积V 容(mL ) 试样移取体积V移(mL )H C l 终读数(mL ) H C l 初读数(mL ) H C l 体积V H C l (mL )H C l 浓度(C H C l )(mol/L )计算公式 N a 2O %=容移V mV M V c ONa HCl HCl /20002×100N a 2O %平均值 相对平均偏差思考题:1.标准溶液的浓度应保留几位有效数字?2. 在以HCl 溶液滴定混合碱时,怎样使用甲基橙及酚酞两种指示剂来判断试样是由NaOH+ NaCO 3或NaCO 3+NaHCO 3组成的?3.若工业纯碱样品含碳酸钠的质量分数约为75%,其他成分为惰性杂质,请问采用50mL 滴定管时,应称取的试样的质量范围是多少?4.配制500mL 盐酸溶液时,使用哪些玻璃量器,写出名称和规格。
*铵盐中氮含量的测定(甲醛法)一、实验目的1.了解弱酸强化的基本原理2. 掌握甲醛法测定氨态氮的原理及操作方法。
3. 熟练掌握酸碱指示剂的选择原则。
二、实验原理化肥中氮的含量是化肥质量的重要指标。
对于无机肥料氯化铵和硫酸铵等强酸弱碱盐,其氮含量可用酸碱滴定法测定,但由于其质子酸NH4+的酸性太弱(Ka=5.6×10-10),不能直接用NaOH标准溶液滴定,可通过加甲醛使其生成较强酸的方法进行间接滴定,从而测定此类铵盐中的氮含量。
反应式:4NH4++ 6HCHO = (CH2)6N4H++3H++6H2O(CH2)6N4H++3H++4OH-=(CH2)6N4+4H2O用NaOH标准溶液滴定生成的酸,计量点产物为弱碱,pHsp≈ 9,选择酚酞做指示剂。
铵盐中常含游离酸,预先加NaOH中和(甲基红作指示剂)除去,甲醛易被空气中的O2生成甲酸,预先加NaOH中和除去(酚酞作指示剂)三、仪器分析天平、称量瓶、碱式滴定管(50mL)、容量瓶(250mL)、移液管(25mL)、吸耳球、锥形瓶(250mL)、量筒(25 mL)、烧杯四、试剂(NH4)2SO4、甲醛(40%)、甲基红 (0.2%)、酚酞(0.2%)、NaOH(0.1mol·L-1)五、实验步骤1. (NH4)2SO4试样的配制准确称取1.5-1.6g (NH4)2SO4(若试样为试样NH4Cl应称多少?)于小烧杯中,用适量去离子水溶解,定量转移至250mL容量瓶中,用水稀释至刻度,摇匀。
2.甲醛溶液的处理:取原装甲醛(40%)溶液12mL于小烧杯中,用水稀释一倍,加入2滴0.2%酚酞,用0.1mol·L-1NaOH标准溶液中和至甲醛溶液呈淡红色。
(*不记读数)(问:这步操作的目的是什么?)3.铵盐中氮含量的测定:移取试液25.00mL放入250mL锥形瓶中,加入2滴甲基红指示剂,溶液若为红色则小心地滴加0.1mol·L-1NaOH溶液使溶液刚变成亮黄色(*不记读数)。
加入8mL 已中和过的1∶1甲醛溶液和2滴酚酞指示剂,摇匀,静置1min后,用0.1mol·L-1NaOH标准溶液滴定至溶液由红色→亮黄色→微橙红色,持续半分钟不褪色即为终点,记下读数。
平行测定三次。
计算试样中的含氮量(用质量分数表示)和三次结果的相对平均偏差。
六、数据记录与处理表格称量瓶+(NH 4)2SO 4质量 称量瓶+剩余(NH 4)2SO 4质量 (NH 4)2SO 4质量 (g)12(NH 4)2SO 4定容体积V 容(mL ) (NH 4)2SO 4移取体积V移(mL )NaOH 最后读数(mL ) NaOH 最初读数(mL ) NaOH 毫升数(mL )NaOH 浓度(mol/L )计算公式N% =容移V V m /1000M (cV)N NaOH ×100N%平均值 相对平均偏差思考题:1.为什么不能用NaOH 直接滴定(NH 4)2SO 4?2.为什么中和甲醛中的游离酸使用酚酞指示剂,而中和(NH 4)2SO 4试样中的游离酸却使用甲基红指示剂?3.测定铵盐中的氮含量还可以用什么方法?4.碳酸氢铵中的含氮量能否用甲醛法测定?实验三、方案设计实验一、 实验目的1. 培养学生查阅文献的能力。
2. 学习实验方案设计。
3. 综合运用酸碱滴定知识,掌握滴定分析的基本过程。
二、实验题目某含有HCl 和NH4Cl 的混合溶液,其HCl 和NH4Cl 的浓度均约为0.1mol/L ,试设计一分析方案,分别测定它们的准确浓度。
三、设计方案要求:1.写出设计方法的原理(准确滴定的判别、分步滴定的判别、滴定剂的选择、计算计量点pH、选择指示剂、分析结果的计算公式。
)2.所需仪器和试剂(用量、浓度、配制方法)3.实验步骤(含标定、测定)4.实验报告表格设计。
5.讨论.(注意事项、误差分析、体会)(实验后完成)6.参考资料(作者,书(刊)名,出版社,年份:页码)四、过程安排提前一周拟订实验方案,交教师审阅后实施实验。
实验四、EDTA标准溶液的配制与标定一、实验目的1.了解EDTA标准溶液的配制方法和标定原理。
