氯化铵分解实验的创新
氯化铵受热分解的实验探究
氯化铵受热分解的实验探究冯丽红化学是一门自然科学,是以实验为基础的科学。
进行试验探究是培养学生探究能力的一种好方法,也是一种重要的方法。
俗话说三个臭皮匠,顶个诸葛亮。
学生通过自主学习、合作学习,探究性学习,可以探知自己的未知领域;并且能起到加深理解、巩固记忆、拓宽知识面、激发学习兴趣;更能培养和提高观察能力、思维能力、动手能力、创新能力,培养正确的科学态度,学会科学探究的基本方法。
一.发现问题现行苏教版教材,专题4第二单元《生产生活中的含氮化合物》中涉及到氯化铵的分解,试验是这样设计的:取少量氯化铵晶体于试管中,置酒精灯上加热,观察试验现象。
此实验现象类似于碘的升华。
而正确的结论应该是氯化铵受热分解,分解后的氨气和氯化氢气体相遇反应,并且附在试管的中部。
因此此实验无法证实这一点。
课后,我们的化学兴趣小组设计了几个方案来证实这一结果。
二.设计方案由于氯化铵分解生成的是氨气和氯化氢气体,氨气是碱性气体,遇湿润的蓝色石蕊试纸显红色;氯化氢气体是酸性气体,遇湿润的红色石蕊试纸显蓝色。
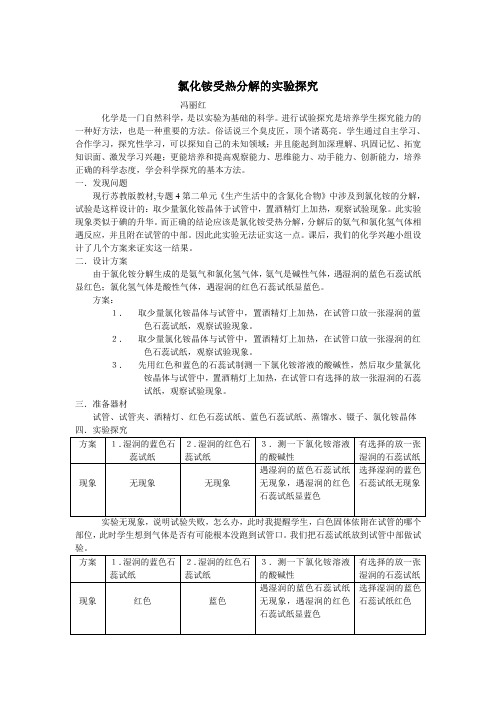
方案:1.取少量氯化铵晶体与试管中,置酒精灯上加热,在试管口放一张湿润的蓝色石蕊试纸,观察试验现象。
2.取少量氯化铵晶体与试管中,置酒精灯上加热,在试管口放一张湿润的红色石蕊试纸,观察试验现象。
3.先用红色和蓝色的石蕊试制测一下氯化铵溶液的酸碱性,然后取少量氯化铵晶体与试管中,置酒精灯上加热,在试管口有选择的放一张湿润的石蕊试纸,观察试验现象。
三.准备器材试管、试管夹、酒精灯、红色石蕊试纸、蓝色石蕊试纸、蒸馏水、镊子、氯化铵晶体四.实验探究部位,此时学生想到气体是否有可能根本没跑到试管口。
我们把石蕊试纸放到试管中部做试这时学生中有人提出这样做试验好象不规范,能否找一个短一点的试管,最后找来微型小试管做实验,现象非常明显。
这时我就问学生,你们三组实验到底哪一组可以作为结论来用呢?刚开始学生们各持己见,有人认为第一、二组实验都可以,比较简单。
氯化铵受热分解实验再改进

氯化铵受热分解实验再改进作者:张宝军来源:《新课程·下旬》2017年第12期一、课本实验的缺陷苏教版高中化学教材必修一第99页“活动与探究”通过加热氯化铵晶体,让学生感知“铵盐受热易分解”这一性质。
课本原有的设计如图1,加热试管中氯化铵晶体,很快就能观察到:试管底部的固体越来越少,产生大量的白烟,一段时间后试管口附近出现大量白色固体,经检验仍为氯化铵。
对于这一现象,所涉及反应原理为NH4Cl [△]NH3+HCl,NH3+HCl=NH4Cl。
按照图1装置进行实验,存在如下两点不足之处:(1)试管中产生的气体无法检验其性质,更不能证明产生了两种气体;(2)因为加热固体碘也会看到同样的现象,所以在此学生会类比、联想、猜测氯化铵固体由底部转移至试管上部,首先“升华”而后“凝华”,老师虽然明白这是一个错误的结论,但却不能通过巧妙的实验设计呈现明显的实验现象揭示其中的奥秘。
二、现有的改进方案笔者教学中也曾遇到同样的问题,通过文献检索,发现多数实验均围绕上述两点不足进行改进,如图2、图3。
采用图2装置进行实验,试纸有明显颜色变化,可观察到Y型管、具支试管中白色固体的出现,但整套装置过于复杂,有悖实验的微型化发展方向,且Y形管易被氯化铵固体堵塞;利用HCl、NH3密度差异,有老师设计了图3装置分离两种气体并进行气体性质的检验,但实际实验的效果并不明显,上端红色试纸稍稍变蓝但下端蓝色试纸几乎看到变红,说明利用密度自主分离效果不佳,而且看不到白烟的再现。
三、实验的创新设计1.实验仪器与药品铁架台、3个直角玻璃管、酒精灯、石棉绒、红色石蕊试纸、蓝色石蕊试纸、NH4Cl晶体、碱石灰、P2O5、蒸馏水。
2.实验装置(右图4)3.实验步骤和现象(1)向直角A中填装NH4Cl固体置于直角处(填料约1.5~2cm长),再在两侧装入少许石棉绒(约0.5cm长),用小玻璃棒推至NH4Cl固体处,最后再在石棉绒的上面分别添加碱石灰及P2O5固体少许(约0.5cm长),具体过程如图5。
氯化铵分解实验异常现象分析(修改版)

氯化铵分解实验异常现象分析施金锋苏州市第三中学2006年12月氯化铵分解实验异常现象分析施金锋摘要:氯化铵分解是中学化学的一个基本实验,笔者在实验过程中意外发现:原氯化铵晶体在加热过程中由白色变褐色,并在加热结束有极少量固体未消失。
为弄清异常现象原因,笔者通过查阅资料分析、设计实验探究,组织学生进行探究性实验,证实异常现象是因为样品中含杂质铁。
关键词:氯化铵分解异常现象杂质铁探究实验1、实验异常氯化铵的分解是高中化学课本(2003年2月人教版《化学》)第二册P11铵盐性质中的一个实验,目的是说明铵盐易分解,书本中是这样描述的:“在试管中加入少量氯化铵晶体,加热,可以看到,加热后不久,在试管上端上有白色固体附着”。
在实际操作过程中,我发现除了上述现象外还看到加热后,片刻晶体即由原来的白色变成褐色。
2、资料收集及探究实验小组成立2.1对于这情况,我收集到如下资料:资料1、氯化铵技术数据如表:数据来源:安徽省肖县化学试剂厂。
资料2:氯化铵厂家提供的铁含量数据化学纯中国海安县校办教学试剂厂(分装)铁 0.001%分析纯无锡市民丰试剂厂铁0.0005%2.2组织成立探究实验小组在班级中以自愿报名、筛选的方式组织了六名学生组成探究实验小组(六名学生为高二第一学期学生)。
3.数据分析及可能原因推测我将所收集到的上述资料数据提供给实验组学生,引导学生查阅资料,讨论分析,并结合教师指导,对实验异常作出初步判断:在加热过程中出现颜色可能是三价铁的缘故。
4.实验探究验证探究实验小组根据实验分析设计探究实验过程及实验结果如下:4.1针对上述异常现象及相关数据分析,按照课本实验要求设计了取三种不同的氯化铵分别实验,观察实验现象,结果如下表4-1。
表4-1:三种氯化铵实验现象记录4.2实验现象进一步肯定了前面可能是铁的推测,对三组实验最终试管底部剩余的固体分别做了针对性的检测实验,操作及结果如下表4-2。
表4-2:剩余固体针对性检测实验:实验结果表明加热过程中的异常是因为铁。
氯化铵的高温分解过程

氯化铵的高温分解过程1. 引言氯化铵(NH4Cl)是一种常见的化学物质,广泛用于工业生产和实验室中。
它在高温下会发生分解反应,产生氨气(NH3)和氯化氢(HCl)。
本文将深入探讨氯化铵的高温分解过程,包括反应机理、影响因素以及其在实际应用中的重要性。
2. 氯化铵的高温分解反应机理氯化铵的高温分解反应基本上是一个放热反应,具体反应机理如下:NH4Cl → NH3 + HCl在高温下,氯化铵分子内部的离子键将会断裂。
氯化铵分子中的氯离子(Cl-)和氨离子(NH4+)分别转化为氯化氢和氨气。
3. 影响氯化铵高温分解的因素(1)温度:温度是影响氯化铵高温分解反应速率的关键因素。
随着温度的升高,分子内部的离子键能量减小,使得反应更容易发生。
一般来说,提高温度可以加快高温分解反应的速率。
(2)反应物浓度:反应物浓度的增加可以增加高温分解反应的速率。
由于氯化铵在固态、液态和气态中都存在,反应速率受到反应物所处相态的影响。
当氯化铵固体粉末的表面积增大,反应速率更快。
(3)反应环境:反应环境也会对高温分解反应产生一定影响。
例如在氯化铵和催化剂共同存在的情况下,反应速率可能会增加。
反应环境中可能会存在其他气体或物质,它们也可能对高温分解产物的生成和分布产生一定影响。
4. 氯化铵高温分解的实际应用氯化铵的高温分解在实际应用中具有广泛的意义和重要性。
以下是氯化铵高温分解的几个应用领域:(1)工业应用:氯化铵高温分解反应是工业中烧碱法制备氨气的核心步骤之一。
在高温反应器中,氯化铵与氢氧化钠(NaOH)发生反应,生成氨气和氯化钠(NaCl)。
(2)实验室应用:氯化铵高温分解的反应产物氨气和氯化氢被广泛应用于实验室中。
氨气可用作溶剂、试剂和气体灭火剂等方面,而氯化氢主要用于有机合成反应。
(3)冶金工业:氯化铵高温分解也在冶金工业中发挥作用。
在炼铁过程中,氯化铵用作焙烧辅助剂,有助于提高炉温和还原铁矿石中的氧化物。
5. 总结与回顾本文深入探讨了氯化铵的高温分解过程,包括反应机理、影响因素以及其在实际应用中的重要性。
氯化铵受热分解

氯化铵受热分解简介氯化铵是一种常见的无机化合物,化学式为NH4Cl。
它常用作肥料、草坪草的清扫剂和医药工业中的传媒盐。
当氯化铵受热时,会发生分解反应,产生氨气和氯气作为副产物。
本文将介绍氯化铵受热分解的反应机理、影响因素以及分解产物的性质。
反应机理氯化铵的分解反应可以用如下化学方程式表示:2NH4Cl(s) → 2NH3(g) + H2(g) + Cl2(g)该反应是一个放热反应,分解产物包括氨气、氢气和氯气。
在反应过程中,氯化铵的晶格结构被打破,形成了氨气、氢气和氯气的气体。
由于氯化铵的分解需要吸收能量,因此加热才能推动反应进行。
影响因素氯化铵受热分解的速率和产物的量可以受到多种因素的影响,包括温度、氯化铵的物质量和反应容器的气压等。
温度是影响分解反应速率的主要因素之一。
一般来说,温度越高,分解反应的速率越快。
这是因为加热会提供所需的能量,使氯化铵分子具备足够的动力克服化学键的能量。
氯化铵的物质量氯化铵的物质量也会影响分解反应的速率和产物的量。
更多的氯化铵分子意味着更多的反应物,可以产生更多的分解产物。
因此,当氯化铵的物质量增加时,产生的氨气、氢气和氯气的量也会增加。
反应容器的气压反应容器的气压对氯化铵的分解反应有一定的影响。
较高的气压可以增加气体分子之间的碰撞频率,从而提高反应速率。
因此,在高压下,氯化铵的分解反应速率会增加。
分解产物的性质氯化铵受热分解的主要产物有氨气、氢气和氯气。
氨气氨气是一种无色气体,具有刺激性气味。
它是一种强碱性物质,在水中可以形成氨水。
氨气可以用于制造化学品、肥料和溶剂等。
氢气是一种无色无味的气体,是最轻的元素。
它在工业上广泛应用于氢气燃料电池、合成氨和氢氧化钠等生产过程中。
氯气氯气是一种黄绿色气体,具有刺激性气味和腐蚀性。
它广泛用于消毒、漂白剂和制备其他氯化物的工业过程中。
安全注意事项在进行氯化铵受热分解实验时,需要注意以下安全事项:1.在通风良好的实验室环境下进行实验,以避免有害气体的积聚。
氯化铵转化新工艺的机理及条件探究

第53卷第3期2021年3月Vol.53No.3Mar.,2021无机盐工业INORGANIC CHEMICALS INDUSTRYDoi:10.11962/1006-4990.2020-0216开放科学(资源服务)标志识码(OSID)氯化铵转化新工艺的机理及条件探究李非心,周建敏1,李铖钰打徐文涛打张昕玥打李欣伟1,王军心,纪志永1'2'3,赵颖颖1'2'3,郭小甫1'2'3,袁俊生1'2'3(1.河北工业大学化工学院/海水资源高效利用化工技术教育部工程研究中心,天津300130;2.河北省现代海洋化工技术协同创新中心;3.河北工业大学化工学院/化工节能过程集成与资源利用国家-地方联合工程实验室)摘要:针对目前纯碱产业氯化铵产能过剩的问题,提岀一种氯化铵转化新思路。
即以固体氯化铵和碳酸镁为原料,采用固相加热反应生成氯化镁、氨气、二氧化碳和水,其中氨气和二氧化碳可回收用于纯碱的生产。
从热力学角度分析了固体氯化铵和碳酸镁的反应机理,探讨了反应温度、反应时间和配料比对氯化铵转化率的影响,进行了正交实验并确定了最优反应工艺条件,对反应产物进行了X射线衍射(XRD)、扫描电镜(SEM)和能谱(EDS)表征。
最佳反应条件:碳酸镁与氯化铵物质的量比为1.820,反应温度为523K,反应时间为120min。
在该反应条件下氯化铵转化率可达94.40%,氯化镁纯度可达工业标准。
关键词:纯碱;氯化铵;氯化镁;反应机理;热力学中图分类号:TQ126.2文献标识码:A文章编号:1006-4990(2021)03-0048-06Study on mechanism and conditions of the new process of ammonium chloride conversionLi Fei1,2,3,Zhou Jianmin1袁Li Chengyu1袁Xu Wentao1,Zhang Xinyue1袁Li Xinwei1,Wang Jun1,2,3,Ji Zhiyong1,2,3袁Zhao Yingying1,2,3袁Guo Xiaofu1,2,3,Yuan Junsheng1,2,3(1.School of Chemical Engineering,Helei University of Technology^,Engineering Research Center f or Chemical Technology of t heEfficient Utilization of S eawater Resources,Tianjin300130,China;2.Collaborative Innovation Center of H elei Modern MarineChemical Technology;3.School of Chemical Engine e ring,He lei University of Technology,Che mical Energy Conservation Process Integration and Resource Utilization National-Local Joint-EngineeringLaboratory)Abstract:Aiming at the problem of excess capacity of ammonium chloride in soda industry, a new way of conversion of ammonium chloride was put forward.Solid ammonium chloride and magnesium carbonate were used as raw materials to produce magnesium chloride,ammonia,carbon dioxide and water by solid-state heating reaction.Ammonia and carbon dioxide can be recycled using for soda production.The reaction mechanism of solid ammonium chloride and magnesium carbonate was investigated from the thermodynamics,and the effects of reaction temperature,reaction time and ratio of ingredients on the conversion of ammonium chloride were discussed.The orthogonal experiment was carried out to determine the optimal reaction conditions,the products were characterized by XRD,SEM and EDS.The results show that the optimum reaction conditions were as follows:the amount-of-substance ratio of magnesium carbonate and ammonium chloride was1.8:2.0,the temperature was 523K and the reaction time was120min.Under the conditions, the conversion ratio of ammonium chloride can reach94.40% and the purity of magnesium chloride can reach the industrial standard.Key words:soda ash;ammonium chloride;magnesium chloride;reaction mechanism;thermodynamics随着中国经济的持续性发展,纯碱产业的发展一直备受关注[1-3]。
案例44 氯化铵分解实验的改进
3.紧接着,用止水夹K1夹住导气管,并打开止水夹K2,发现湿润的pH试纸B变蓝,证明产生了NH3。
4.最后,同时打开止水夹K1、K2,一段时间后,在Y形管中央的三又口处,有白色晶体产生,证明白色晶体是NH4C1,由NH3和HCl反应产生。
创新
设计
后的
优点
通过改进,学生不但可以切身感受到NH4Cl受热不稳定,而且还能够清晰地认识到,NH4Cl受热分解生成的产物一定是NH3和HCl,NH3和HCl气体温度降低后,又反应生成NH4Cl晶体,从而解决了原实验中遇到的困惑。
(2)防止学生产生以上困惑,有的教师讲解该知识点时,特意给学生“NH4C1受热不发生升华”的已知信息,引导学生分析NH4C1的不稳定性。即使如此,【实验1】也无法让学生清晰地判断出NH4C1的分解产物。因此,呈现给学生NH4C1分解的方程式也很牵强。
实验原理
NH4C1加热NH3↑+HCl↑NH3+HClNH4C1
实验仪器
及药品
铁架台、酒精灯、玻璃管、Y形管、止水夹2个、橡胶管、U形管、导管、石棉绒、NH4Cl晶体、NaOH固体、P2O5、pH试纸。
Байду номын сангаас实验
装置
实验
步骤
及现象
1.将NH4Cl晶体放入U形管底部,在U形管的一侧放入含NaOH固体的石棉绒,另一侧放入含P2O5的石棉绒,塞紧后,固定在铁架台上。在U形管的两端出口处分别连有由玻璃管和橡胶管组成的导气管,并在两条导气管的玻璃管中放上湿润的pH试纸,在橡胶管处夹上止水夹。最后,两条导气管末端连在一个Y形管的两端。因为NH3和HCl都特别易溶于水、有刺激性的气体,为保证实验的安全,在Y形管出气口处,连接防倒吸的尾气处理装置,如上图所示。
氯化铵母液连续分解装置研制成功
实 力。
研 究 员分获 国 家最 高科 学 技术 奖 , 另有 5 名 外籍 专家 和 1 个 国 在5 2 个 化学 化 工类 获 奖 项 目中, l 1 个项 目 摘 得 国家 自然
科学 奖 , 1 6 个项 目获得 国家 技术 发 明奖 , 2 5 个项 目获得 国 家 技 术进 步 奖 。 总体 来 看, 化学 化 工领 域 获奖 成果 占 比有 所提 高, 由去 年 的2 0 %升至2 5 %。 获 奖项 目涵 盖了油 气勘 探开 发、
时 还有 微 量 的一 氧 化碳 、 甲烷等 , 也可 通 过调 整 反 应 路 径不 产氢 而 全部 转 化 为 甲烷 。 煤气 化产物 溶解 在超 临 界水 中 成 混合工质 可发 电、 供热 ( 蒸汽) , 还可 生产高附加值的化工产品, 实 现 煤 炭 的高效、 洁净 、 无污 染 转 化 和利 用 。 此
与低温窑 的首端 相连 。 记者在试 验 装置
化 氢 气 体也 是 干 燥 的 , 干 燥 的 氯 化 氢 无腐蚀 , 整 套 设 备用 3 0 4 不 锈 钢 可 耐
久 使 用 。氯化铵 母 液 连 续 进 入 装 置 ,
产出合格 的氨水 和 氯化 氢产 品。 氯 化铵 母 液催 化 分 解 是纯 碱 制 造 技术进步的关键所在 , 氯化 铵 母 液 催 化 分解 对 于 氨 碱 法 来 说可 以彻 底 消除
新 能 源 构建 、 新 材 料 创 制 、资源 循 环 利 用和 节 能 减 排 等 领
善 民生 构 建环 境 友好 型 行 业 形 象 , 化 工 科 技 展 现 出越 来 越
从保 障 国家 能源 和 重要 原 材料 的供 应 能 力, 到 致 力于 改 化 学 化 工类 项 目5 2 项, 约 占1 / 4 , 化 工 界展 现 出雄 厚 的创 新 域 ,
铵盐加热分解实验报告
一、实验目的1. 了解铵盐加热分解的原理和过程。
2. 掌握铵盐加热分解实验的操作步骤。
3. 通过实验验证铵盐加热分解产生的气体和固体产物。
二、实验原理铵盐是一类含有铵根离子(NH4+)的盐类,加热时,铵盐会分解生成氨气(NH3)和相应的酸。
不同类型的铵盐在加热过程中,其分解产物和分解条件可能有所不同。
三、实验材料与仪器1. 实验材料:- 氯化铵(NH4Cl)- 硫酸铵((NH4)2SO4)- 硝酸铵(NH4NO3)- 碳酸氢铵(NH4HCO3)- 硝酸(HNO3)- 盐酸(HCl)- 硫酸(H2SO4)- 磷酸(H3PO4)- 氢氧化钠(NaOH)- 湿润红色石蕊试纸2. 实验仪器:- 试管- 烧杯- 铁架台- 酒精灯- 热水浴- 玻璃棒- 移液管四、实验步骤1. 取一定量的氯化铵放入试管中,用玻璃棒搅拌,使其充分混合。
2. 将试管固定在铁架台上,用酒精灯加热试管,观察氯化铵加热分解的现象。
3. 当氯化铵开始分解时,用湿润红色石蕊试纸检验产生的气体,观察试纸是否变蓝。
4. 分别取一定量的硫酸铵、硝酸铵、碳酸氢铵放入试管中,重复步骤2-3,观察不同铵盐加热分解的现象。
5. 取一定量的硝酸、盐酸、硫酸、磷酸放入试管中,分别加热,观察是否有气体产生。
6. 取一定量的氢氧化钠放入试管中,加入适量的水溶解,观察溶液的变化。
五、实验结果与分析1. 氯化铵加热分解:加热氯化铵时,产生白色烟雾,湿润红色石蕊试纸变蓝,证明产生了氨气。
2. 硫酸铵加热分解:加热硫酸铵时,产生刺激性气味,湿润红色石蕊试纸变蓝,证明产生了氨气。
3. 硝酸铵加热分解:加热硝酸铵时,产生白色烟雾,湿润红色石蕊试纸变蓝,证明产生了氨气。
4. 碳酸氢铵加热分解:加热碳酸氢铵时,产生白色烟雾,湿润红色石蕊试纸变蓝,证明产生了氨气。
5. 硝酸、盐酸、硫酸、磷酸加热:加热硝酸、盐酸、硫酸、磷酸时,均无气体产生。
6. 氢氧化钠溶液:加入水溶解氢氧化钠时,溶液无明显变化。
关于铵盐分解的实验与探究
关于铵盐分解的实验与探究作者:林猛来源:《中国化工贸易·中旬刊》2018年第02期摘要:铵盐是重要的化合物,无论是在化学还是在日常的生活、工业中都有广泛的应用,而在铵盐的日常认知中,化学实验是重要的手段,本文主要阐述了铵盐分解的实验要点,根据现有的两种实验方法,找出其在实验中存在的不足,并给出相应的建议。
关键词:铵盐;冷却;实验铵盐的分解主要是指其热分解情况,是给出质子(即H+)的过程。
在这一过程中,主要的实验方法有两种,但是这两种实验方法都有其不足,在实际操作中容易引起误导,因此,在实践中,我们要不断探索新的实验技巧和实验方法,找出其具体的实践应用。
1 铵盐的性质氨气与不同的酸作用可得到各种相应的盐,这种盐成为铵盐。
如氨气和盐酸、硫酸、硝酸、磷酸、碳酸相作用时可得到不同的铵盐,铵盐的性质皆为晶体,均是易溶于水的盐,在受热条件下均能分解,形成氨气和相应的酸,常伴有吸热现象。
受热时,氯化铵分解生成氨和氯化氢,冷却时它们又重新生成氯化铵。
由于形成铵盐的酸的特性不同,铵盐分解的规律也不同,热分解情况与对应的酸有关,铵盐分解反应的通式为NH4X=NH3+HX,在水溶液中水解呈弱酸性,一般非氧化性酸的铵盐热分解产物为NH3与对应酸,如NH4Cl,NH4Br,(NH4)3PO4等。
氧化性酸的铵盐热分解比较复杂,产物有N2或其氧化物出现,强酸铵盐与弱酸铵盐相比,弱酸铵盐的稳定性差,如(NH4)2CO3在常温就缓慢分解成NH3、CO2和水蒸气而损失。
铵盐分解的实质是铵离子给出质子(即H+)的过程。
一般来讲对应的酸根离子结合质子的能力越强,则对应的铵盐越容易分解。
例如卤化铵的热稳定性NH4F2 铵盐分解的实验要点化学是一门以实验为基础的科学,在化学课的学习中,实验是其中一部分,在化学中,不但要学好方程式,打好理论基础,同时也要学好相应的实验,通过实验更好的了解理论知识,掌握知识要点。
2.1 传统的铵盐分解实验一是最常用的实验方法:传统的铵盐检验时通常可以将铵盐溶解于水中,然后向其中加入强碱溶液,用湿润的红色石蕊试纸检验产生的气体的性质,若试纸变蓝色,则表明有氨气产生,对应的盐中含有铵盐。
