氨基酸、多肽与蛋白质7年制
第17章氨基酸和蛋白质-新(4)

(一)两性电离和等电点
分子内部酸性基团和碱性基团所形成的盐称 为内盐。内盐分子中包含正、负离子两部分, 所以又称为两性离子(zwitter-ion)或偶极 离子。偶极离子即可与较强的酸反应,又可 与较强的碱反应,表现出两性化合物的特性。
(二)蛋白质的高级结构
蛋白质分子的多肽链并不是以完全伸展的线 状形式存在,而是通过分子中Cα —H、Cα — N单键的旋转而盘曲、折叠形成特定的三维 空间结构,这种空间结构称为蛋白质的高级 结构。
1.蛋白质的二级结构
蛋白质的二级结构主要指的是多肽链中 原子的空间排布。
N原子上的孤电子对与羰基之间形成共 轭体系,使得C—N单键具有部分双键性质, 限制了肽键的自由旋转。实际上,肽键具有 平面结构,称为肽键平面。其中Cα 1、羰基 碳和氧、氮和氢以及Cα 2共六个原子在同一 平面上,氧原子和氢原子呈反式。
中性氨基酸的pI在5.1~6.5之间
(二)显色反应
α -氨基酸与水合茚三酮在水溶液中加热时, 能放出二氧化碳,并生成紫色的化合物,称 为罗曼氏紫。
O OH
-
R-CH-COO
2
+ OH
N+ H3
O
ONH4 O
N=
O
O
+ RCHO + CO2
水合茚三酮
罗曼氏紫
此反应灵敏度高,是鉴定α -氨基酸简 便而迅速的方法,常用于层析时显色。还可 根据颜色的深浅程度及放出的二氧化碳的量 测定α -氨基酸的含量。
a- 螺旋(b)
(2)β—折叠 又称为β—片层结构。β—折 叠指多肽链呈一种铺开的折扇形状,相邻两 个氨基酸残基的距离约700pm。若干条多肽 链或一条多肽链的若干片段平行排列,维系 和固定β—折叠的作用力仍然是氢键。 β-折叠有两种类型,一种是多肽链从N-末端 到C-末端的排列是同方向的,称为平行β-折 叠,另一种是从N-末端到C-末端的排列是反 方向的叫反平行β-折叠。
蛋白质的构件-氨基酸及多肽

氮、碳的运输
氨基酸可作为氮、碳的运输工具,将 氮、碳从细胞质运至线粒体、叶绿体 等细胞器。
多肽在生物体内的功能
激素和生长因子
多肽可以作为激素和生长因子的 活性分子,调节机体的生长发育
、代谢和免疫等生理过程。
细胞间通讯
多肽可以作为神经递质、激素 等细胞间通讯的分子,影响细 胞间的信息交流。
酶抑制剂和激活剂
多肽可以作为酶抑制剂或激活 剂,调节酶的活性,进而影响 代谢过程。
抗病原体和肿瘤
多肽可以作为免疫调节剂,具 有抗病原体和肿瘤的作用。
氨基酸与多肽相互影响在生物体内的功能
合成与分解
蛋白质的构件-氨基 酸及多肽
目 录
• 氨基酸 • 多肽 • 氨基酸与多肽的关系 • 氨基酸与多肽在生物体内的作用
01
CATALOGUE
氨基酸
氨基酸的种类
二十种氨基酸
在生物体内,存在二十种不同种 类的氨基酸,它们是蛋白质的基
本组成单位。
非标准氨基酸
除了二十种标准氨基酸外,还有一 些非标准氨基酸在某些生物体中存 在,如鸟氨酸、同型半胱氨酸等。
不同种类的氨基酸在多肽中的排列顺序和空间构象,决定了多肽的生物活性和功能 。
氨基酸与多肽的功能关系
氨基酸是构成人体组织和器官的 基本物质,参与生命活动的调节
和代谢。
多肽具有多种生物活性,可以作 为信号分子、生长因子、激素等 ,参与细胞生长、分化、代谢等
过程。
某些多肽具有抑制或促进酶活性 、调节免疫反应、抗肿瘤等作用 ,在医药、保健品等领域具有广
THANKS
氨基酸、多肽与蛋白质

形成一级结构的化学键:
•肽键(主要化学键) •二硫键
目录
一级结构是蛋白质空间构象和特异生物学功能 的基础,但不是决定蛋白质空间构象的唯一因素。
目 目录 录
三、多肽链中的局部特殊构象是 蛋白质的二级结构
Genome Project) 。
21世纪,蛋白质组学 (Proteomic) 。
目录
一、蛋白质的生物学重要性
1. 蛋白质是生物体重要组成成分 分布广:所有器官、组织都含有蛋白质;细胞的 各个部分都含有蛋白质。 含量高:蛋白质是细胞内最丰富的有机分子,占 人体干重的 45%,某些组织含量更高, 例如脾、肺及横纹肌等高达80%。
目录
O NH2-CH-C H
甘氨酸
+
OH
O NH-CH-C H
甘氨酸
H
OH
-HOH
O O NH2-CH-C-N-CH-C H HH OH
甘氨酰甘氨酸
目录
肽键
* 肽是由氨基酸通过肽键缩合而形成的化合
物。 * 两分子氨基酸缩合形成二肽,三分子氨基
酸缩合则形成三肽……
* 由十个以内氨基酸相连而成的肽称为寡肽
目录
1951年, Pauling采用X(射)线晶体衍射发现了蛋
白质的二级结构——α-螺旋(α-helix)。
1953年,Frederick Sanger完成胰岛素一级序列测定。
1962年,John Kendrew和Max Perutz确定了血红蛋
白的四级结构。
20世纪90年代以后,后基因组计划(Post-Human
下公式推算出蛋白质的大致含量: 100克样品中蛋白质的含量 ( g % ) = 每克样品含氮克数× 6.25×100 1/16%
第十六章 氨基酸、多肽和蛋白质

OH R CH COOH +N2
+ H2O
若定量测定反应中所释放的N2的体积,即可计算出 氨基酸的含量,此方法称为van Slyke氨基氮测定法,常
用于氨基酸和多肽的定量分析。
第二节 肽
一、肽的结构和命名
肽是氨基酸残基之间彼此通过酰胺键相连而成的一 类化合物。 肽分子中的酰胺键又称为肽键(peptide bond)。 二肽可视为一分子氨基酸中的-COO―与另一分子氨基 酸中的NH3+脱水二成的。肽也是以两性离子的形式存在。
OH
H+
等电点 脱水
OH
H+
- - 带负电荷 脱水
OH
H
+
- - - -
(五)蛋白质的颜色反应 蛋白质分子内含有许多肽键和某些带有特殊基团的 氨基酸残基,可以与不同试剂产生特有的颜色反应,利 用此性质可鉴别蛋白质。
反应名称 试剂 颜色 作用基团 缩二脲反应 强碱、稀硫酸铜溶液 紫色或紫红色 肽键 茚三酮反应 稀茚三酮溶液 蓝紫色 氨基 蛋白黄反应 浓硝酸、再加碱 深黄色或橙红色 苯环 亚硝酰铁氢化钠 亚硝酰铁氢化钠溶液 红色 巯基
(五)氧化脱氨反应 氨基酸中的氨基能被 H2O2 或 KMnO4 等强氧化剂所氧 化,脱氨而生成α―酮酸。
[O]
R CH COOH NH2
R CH COOH + H2O NH
R C COOH + NH3 O
(六)氨基酸与亚硝酸的反应 氨基酸与亚硝酸作用,可定量释放氮气
+ NH3 R CH COO
+ H2NO2
使蛋白质发生沉淀的现象称为盐析(saltingout)。常用
的盐析剂有(NH4)2SO4、Na2SO4、NaCl和MgSO4等。
有机化学氨基酸
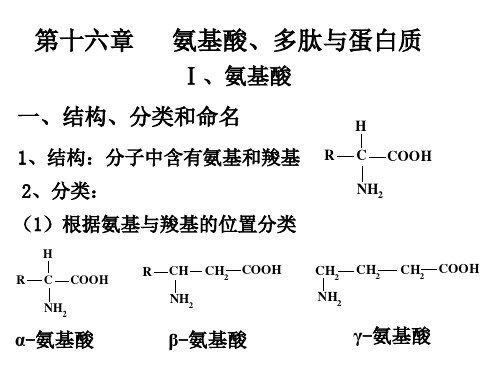
氨基酸、多肽与蛋白质
Ⅰ、氨基酸
一、结构、分类和命名
1、结构:分子中含有氨基和羧基
R
H C NH2 COOH
2、分类:
(1)根据氨基与羧基的位置分类
H R C NH2 COOH
R
CH NH2
CH2 COOH
CH2 NH2
CH2
CH2 COOH
α-氨基酸
β-氨基酸
γ-氨基酸
中性氨基酸
(2) 碱性氨基酸
水蛭素多肽——抗血栓分子药理 1884年Haycraft首先发现新鲜医用水蛭Hirud medicinalis提取物含抗凝血物质,但直至1955年Mark wardt等从医用水蛭中才分离出水蛭素(hirudin,HV),共有 7种异构体。1984年Dodt首先测出其一级结构,确认HV是 一条含65个左右氨基酸的多肽。HV酶是血液凝固、止血过程 和血栓形成的中心酶之一。它专一性地水解纤维蛋白原上的 Agr-Gly键,使之转变成纤维蛋白;纤维蛋白相互作用会进一 步形成血栓。HV的2个结构域通过不同的机制分别和凝血酶 相互作用,抑制其活性。其C端长链通过和凝血酶的纤维蛋白 原识别部位结合,拮抗凝血酶对纤维蛋白原的识别。而HV的N 末端核心结构域通过和凝血酶的活性部位结合而抑制它的催 化活性。临床实验结果也表明,HV的抗栓作用不需要其它因 子的作用;又不会引起出血等副作用。其效果超过小分子肝 素。因此被认为是2010年前最强的可逆性凝血酶直接抑制剂。 全球约有20亿美元市场销售量。
+
O
C O
内盐(偶极离子或两性离子)
-
+
HC l
RCH
+
COOH
+
Cl
NH3
蛋白质制备多肽的研究概况

蛋白质制备多肽的研究概况摘要:近几年来,众多学者致力于此方面的研究,开发出了多种动植物蛋白资源多肽食品。
多肽具有多种重要的生理功能:营养平衡作用、抗溃疡、抗风湿、类胰岛素作用、降血脂、调节血压、提高免疫、抗菌、抗病毒、抗衰老等作用。
目前利用天然蛋白水解法生产活性肽应用广泛。
本文论述了不同来源的蛋白质水解制备肽的研究应用进展。
关键词:蛋白质;多肽;应用;功能蛋白质是人体必需的营养成分之一,FAO/WHO规定每人每天应摄入蛋白质70~75 g,而我国人民实际摄入量只有65 g,在我国人民的膳食结构中,碳水化合物所占比重较大,而蛋白质所占比重较小,因此开发食品蛋白资源,改善人民膳食结构,提高我国人民蛋白质摄入数量和质量是一项十分紧迫的任务。
将难于被人体吸收的食品蛋白质水解成易于被吸收的多肽是完成上述任务的关键。
多肽具有以下特点。
首先,多肽是信息的使者,可引起多种生理活动和调节生化反应。
其次,生物活性高, 1×l0-7mol/L就可发挥活性。
其三,分子小,结构易于改造,较易人工化学合成。
其四,透过多肽的片断可以深入研究蛋白质的性质,并且为改变和合成新的蛋白质提供基础材料。
多肽功能是多方面的:营养平衡作用、抗溃疡、抗风湿、类胰岛素作用、降血脂、调节血压、提高免疫、抗菌、抗病毒、抗衰老等作用。
由于多肽具有多种重要的生理功能,因此人们一直热衷于多肽的结构和功能研究,研究方法也是层出不穷。
1 蛋白质水解肽的制备蛋白水解方式主要有化学水解和酶水解。
化学水解是利用强酸强碱水解蛋白,虽然简单价廉,但由于反应条件剧烈,生产过程中氨基酸受损严重,L-氨基酸易转化成D-氨基酸,形成氯丙醇等有毒物质,且难以按规定的水解程度控制水解过程,故较少采用;而生物酶水解是在较温和的条件下进行的,能在一定条件下定位水解分裂蛋白质产生特定的肽,且易于控制水解进程,能够较好的满足肽生产的需要。
反应产物与原料蛋白具有相同的氨基酸组成,并具有特殊的理化性能与生理功能,成为蛋白制品的发展方向[1-2]。
多肽到蛋白质发生的变化

多肽到蛋白质发生的变化
多肽到蛋白质发生的变化可以概括为以下几个步骤:
1. 氨基酸连接:多肽和蛋白质都由氨基酸组成,多肽是由少量氨基酸连接而成,而蛋白质则由较长的氨基酸序列连接而成。
在转化过程中,多肽的氨基酸序列会经过蛋白质合成机制中的翻译过程,氨基酸通过肽键连接起来,形成较长的氨基酸序列。
2. 折叠与构象变化:在蛋白质的转化过程中,氨基酸序列会逐渐折叠成特定的三维结构。
这种折叠是由非共价相互作用力(如氢键、离子键、疏水相互作用)和共价连接(如二硫键)共同作用形成的。
折叠后的蛋白质具有特定的构象,这决定了其功能和活性。
3. 翻译后修饰:除了氨基酸连接和折叠外,蛋白质转化过程中还可能发生其他修饰。
这包括翻译后修饰,如磷酸化、醋酸化、甲基化等,以及修饰后的切割,如蛋白质酶的切割。
4. 蛋白质功能:蛋白质的转化不仅仅是指其从多肽到蛋白质的过程,还包括其功能的发挥。
蛋白质的多样性功能基于其特定的氨基酸序列和结构。
蛋白质可以发挥催化酶、抗体、结构支持、传导信号等多种功能。
总之,多肽到蛋白质的转化过程是一个复杂且精确的过程,它涉及多个步骤,包括氨基酸连接、折叠与构象变化、修饰及蛋白质功能的发挥。
这些步骤都对蛋白质的最终结构和功能产生重要影响。
7.2 蛋白质与多肽类药物的制备

(3)生物状态:动物饱食后宰杀,胰脏中的胰岛素 含量增加,对提取胰岛素有利,但胆囊收缩素的分 泌使胆汁排空,对胆汁的收集不利。严重再生障碍 性贫血症患者尿中的EPO含量增加。
(4)原料来源:血管舒缓素可分别从猪胰脏和猪 颚下腺中提取,而稳定性以颚下腺来源为好,因其 不含蛋白水解酶。 (5)原料解剖学部位:猪胰脏中,胰尾部分含激 素较多,而胰头部分含消化酶较多。如分别摘取则 可提高各产品的收率。 胃膜素以采取全胃粘膜为好,胃蛋白酶则以采取 胃底部粘膜为好,因胃底部粘膜富含消化腺。
目前试图合成大的蛋白质以及建立快速简便的合 成方法是多肽合成化学的特征。
在多肽合成中,一般需要以下几个主要步骤: ①氨基保护和羧基活化;
②羧基保护和氨基活化;
③接肽和除去保护基团。
三、 多肽类药物
(一)概述 活性多肽是生化药物中非常活跃的一个领域,生 物体内已知的活性多肽主要是从内分泌腺、组织器 官、分泌细胞和体液中产生或获得的。
(二)主要多肽类药物的制备
1、胸腺素(Thymocln) 胸腺激素制剂总的说来都与调节免疫功能有关。
(1)结构和性质 胸腺素组分5是由在80℃热稳定的 40~50种多肽组成的混合物,分子量在1000~15000之 间,等电点在3.5~9.5之间。 为了便于不同实验室对这些多肽的鉴别和比较,根 据它们的等电点以及在等电聚焦分离时的顺序而命名。 共分三个区域:α区包括等电点低于5.0的组分,β区包 括等电点在5.0~7.0之间的组分,γ区则指其等电点在 7.0以上者(此区内组分很少)。对分离的多肽进行免 疫活性测定,有活性的称为胸腺素。
等电聚焦电泳除了用于分离蛋白质外,也可用于 测定蛋白质的等电点。
2、根据蛋白质分子形状和大小的不同来纯化蛋白质
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、蛋白质的分子组成和结构 (一)分子组成: 组成蛋白质的元素:
主要有C、H、O、N和S。 有些蛋白质含有少量磷或金属元素铁、铜、锌、 锰、钴、钼,个别蛋白质还含有碘 。
32 目 录
蛋白质元素组成的特点:
蛋白质的含氮量平均为16%。 体内含氮物质以蛋白质为主,测定生物样品 含氮量,可根据以下公式推算蛋白质大致含量:
蛋白质的二级结构主要以α螺旋和 -折叠为主, 许多蛋白质既有α螺旋又有 -折叠。
分类 相同蛋白
亚家族 家族
超家族
序列相似程度
95 % 80~95 % 50~80% 25~50%
37 目 录
(二)蛋白质的分子结构
蛋白质分子由氨基酸构成一条多肽链,分 子量大,能折叠成一定的形状,形成具有空 间结构的大分子。
蛋白质的分子结构:蛋白质分子各原子的 空间排布和相互关系。
38 目 录
O
因为氨基酸脱水缩合使基团不全。
26 目 录
多肽链 (polypeptide chain): 许多氨基酸通过肽键连接而成的一种链状结构。
主链结构: 氨基酸残基通过肽键连接而成的结构。
侧链结构:氨基酸残基 R基团结构。
OO O
‖‖‖
NH2-CH-C━NH-CH-C━NH-CH-C------NH-CH-COOH
2 目录
蛋白质的生物学重要性 Protein derives from Greek protos, meaning “first” or “foremost”.
1. 蛋白质是生物 体重要组成成分(结构蛋白)
分布广:所有器官、组织都含有蛋白质; 细胞的各个部分都含有蛋白质。
含量高:占人体干重的45%, 某些组织,例如脾、肺及横纹肌等高达80%。
∣∣∣
∣
R1 R2 R3
Rn
氨基末端(N 末端):多肽链中有自由氨基的一端 羧基末端(C 末端):多肽链中有自由羧基的一端 多肽链方向性:从氨基末端走向羧基末端
27 目 录
N末端
C末端
牛核糖核酸酶
28 目 录
(二)体内存在多种重要的生物活性肽
1.谷胱甘肽是体内重要的还原剂
谷胱甘肽 (glutathione, GSH)
∣
∣
∣
∣
R
R
R
R
43 目 录
(一)肽键是一个刚性的平面(肽键平面)
O
O–
‖
∣
Cα–C –N–Cα → Cα–C = N+–Cα
∣
∣
H
H
键长: C–N:0.149 C=N:0.127 肽键:0.132
肽键具有部分双键性质
44 目 录
肽键平面:参与肽键的 6个原子C1、C、O、N、 H、C2位于同一平面, 此一平面称之。
一条多肽链所有原子的空间排布。
四级结构:多条肽链之间原子的空间排布。
39 目 录
三、蛋白质的一级结构 由氨基酸残基的排列顺序决定
蛋白质一级结构 :(primary structure) 指蛋白质分子,从N端到C端的氨基酸残基排 列顺序。
形成一级结构的化学键: 肽键(主要化学键)、二硫键
40 目 录
34 目 录
分类 脂蛋白
糖蛋白 核蛋白 磷蛋白 血红素蛋白 黄素蛋白
金属蛋白
结合蛋白质及其辅基
辅基
举例
脂类
血浆脂蛋白(VLDL、LDL、 HDL等)
糖基或糖链
胶原蛋白、纤连蛋白等
核酸
核糖体
磷酸基团
酪蛋白(casein)
血红素(铁卟啉) 血红蛋白、细胞色素c
黄素核苷酸(FAD、琥珀酸脱氢酶 FMN)
18 目 录
(二) 氨基酸具有特征性的滴定曲线
甘 氨 酸 滴 定 曲 线
19 目 录
(三)紫外吸收性质 含共轭双键的氨基酸
色氨酸、酪氨酸的 最大吸收峰在 280nm 附近。
测定280nm的光吸 收值是分析溶液中蛋 白质含量的快速简便 的方法。
芳香族氨基酸的紫外吸收
20 目 录
(四)氨基酸参与多种化学反应 1、氨基酸分解生成氨气: 氨基酸定量和蛋白质定量 2、生成萤光氨基酸: 二硝基氟苯(DNFB) N-末端氨基酸测定
一级结构是蛋白质空间构象和特异生物学功能 的基础,但不是决定蛋白质空间构象的唯一因素。
细胞的环境因素影响蛋白质分子的空间构象。
41 目 录
蛋白质数据库
Genebank:ห้องสมุดไป่ตู้NCBI网站:
National Center for Biotechnology Information /
H H OH
甘氨酸
-HOH
O
O
NH2-CH-C-N-CH-C
H H H OH
肽键
甘氨酰甘氨酸
25 目 录
肽:氨基酸通过肽键缩合而形成的化合物。
OO O
‖‖‖
NH2-CH-C━NH-CH-C━NH-CH-C------NH-CH-COOH
∣∣∣
∣
R1 R2 R3
Rn
二肽:两分子氨基酸残基缩合形成 三肽:三分子氨基酸残基缩合形成,…… 寡肽:十个以内氨基酸相连,(oligopeptide) 多肽:由更多的氨基酸相连,(polypeptide) 蛋白质:51个氨基酸 氨基酸残基 (residue): 肽链中的氨基酸分子;
CHRH3
C OO-
C
+NH3
H
L-氨基酸的丙甘通氨氨式酸酸
8 目录
二、20种氨基酸的分类: 根据侧链结构和性质不同
(一)非极性疏水性氨基酸 (二)极性中性氨基酸 (三)芳香族氨基酸 (四)酸性氨基酸 (五)碱性氨基酸
9 目录
(一)非极性疏水性氨基酸: 侧链是非极性(疏水)的氨基酸 订正P53
O
O
O
‖
‖
‖
‖
NH2-CH-C━NH-CH-C━NH-CH-C------NH-CH-C-
∣
∣
∣
∣
R
R
R
R
1951年Linus Pauling等提出蛋白质α螺旋结构
1952年丹麦科学家(Linderstrom-Lang)建议:
一级结构:氨基酸的排列顺序,线性结构。
二级结构:主链原子的空间排布。
三级结构:主链和侧链原子的空间排布。
铁
铁蛋白
锌
乙醇脱氢酶
钙
钙调蛋白
锰
丙酮酸羧化酶
铜
细胞色素氧化酶
35 目 录
•根据蛋白质形状,可分为: 纤维状蛋白质:1:10 球状蛋白质
36 目 录
根据蛋白质结构与功能的关系:
功能相似、结构相似(结构域、模体)、序列相似
根据同源蛋白质序列相似程度分类 同源蛋白:来自同一祖先(功能相似)的蛋白
质,氨基酸序列相似程度>25%。
5 目录
第一节 氨基酸
Amino Acids
6目 录
一、组成人体蛋白质的20种氨基酸 均属于L-α-氨基酸
COOH ∣
H2N-Cα-H ∣
R
L-α-氨基酸
COOH ∣
H-Cα-NH2 ∣
R
D-α-氨基酸
自然界中氨基酸300余种, 人体蛋白质氨基酸20种,均属 L-氨基酸(甘氨 酸除外)。
7 目录
10 目 录
(二)极性中性氨基酸: 侧链是极性、不带电荷的氨基酸
-OH、-SH、-CO-N2H
11 目 录
(三)芳香族氨基酸: 侧链含芳香基团的氨基酸 (苯基、酚基和吲哚基)
12 目 录
(四)酸性氨基酸: 侧链含负性解离基团的氨基酸(羧基)
13 目 录
(五)碱性氨基酸 侧链含正性解离基团氨基酸 氨基、胍基和咪唑基
3 目录
2. 蛋白质具有重要的生物学功能(功能蛋白)
1)作为生物催化剂(酶) 2)代谢调节作用 3)免疫保护作用 4)物质的转运和存储 5)运动与支持作用 6)参与细胞间信息传递
3. 氧化供能
4 目录
什么是蛋白质? 蛋白质( protein)是由许多氨基酸
(amino acids)通过肽键(peptide bond) 相连形成的高分子含氮化合物。
21 目 录
3、生成Schiff碱:氨基酸代谢重要反应过程
醛 氨基酸
Schiff碱
4、茚三酮反应
氨基酸与茚三酮共热,生成蓝紫色化合 物,最大吸收峰为570nm,吸收峰值与氨基 酸含量成正比,氨基酸定量分析方法。
5、2个氨基酸成肽反应
22 目 录
第二节
多肽和蛋白质
Polypeptides and Proteins
29 目 录
GSH功能: GSH的巯基具有还原性:保护蛋白质或酶分子 的巯基免遭氧化,维持蛋白质或酶活性状态。 GSH还原H2O2 GSH与致癌剂或药物结合
H2O2
2GSH
GSH过氧 化物酶
NADP+
GSH还原酶
2H2O
GSSG
NADPH+H+
30 目 录
2.体内有许多激素属寡肽或多肽
3. 神经肽是脑内一类重要的肽 在神经传导过程中起重要作用的肽类。
第四章
氨基酸、多肽与蛋白质
Amino Acids,Peptides and Proteins
1目 录
病例:老年痴呆症 蛋白质结构变化引起疾病
记忆力明显减退,经常 忘记刚刚说过的话或做 过的事,对于熟悉的人 或物品,不能回忆其名 称。语言不流畅,经常 间断,与人交流困难, 睡眠欠佳,表情淡漠, 反应迟钝。
46 目 录
(二)蛋白质二级结构的主要形式: 肽键平面通过C旋转或折叠形成的主链结构。
• -螺旋 ( -helix ) • -折叠 ( -pleated sheet ) • -转角 ( -turn ) • 无规卷曲 ( random coil ) 维系二级结构的主要化学键: 氢键
