烷烃烯烃化学性质总结26页PPT
合集下载
烷烃的结构与性质课件(共24张PPT)人教版选择性必修3

(4)分解反应:隔绝空气,1000℃以上
知识精讲
(1)甲烷的稳定性
常温下,甲烷与强氧化剂、强酸、强碱反应探究
操作指南 打开输液袋下方开关,缓慢挤压输液袋
KMnO4溶液
溶液颜色变 化情况
滴加酚酞的NaOH溶液 滴加石蕊的H2SO4溶液
结论
通常情况下,CH4的化学性质比较—— 与强氧化剂、强酸、强碱—————
H
单键、σ键、sp3杂化、正四面体结构
知识精讲
根据烷烃的分子结构,
写出相应的结构简式和分 子式,分析他们在组成和 名称 结构上的相似点。
结构简式
分子 式
碳原子 分子中共价
的杂化 键的类型
方式
甲烷
CH4
CH4
sp3
σ键
乙烷
CH3CH3
C2H6
sp3
σ键
甲烷 乙烷
丙烷
丙烷
CH3CH2CH3
C3H8 sp3
σ键
丁烷 CH3CH2CH2CH3 C4H10 sp3
σ键
丁烷
戊烷 CH3CH2CH2CH2CH3 C5H12 sp3
σ键
戊烷
知识精讲
➢烷烃的结构特点 (1)烷烃的结构与甲烷相似 (2)其分子中的碳原子都采取sp3杂化,以伸向四面体四个顶点方向 的sp3杂化轨道与其他碳原子或氢原子结合,形成σ键。 (3)烷烃分子中的共价键全部是单键,单键可以旋转。
一氯乙烷 CH3CH2Cl
1种
二氯乙烷 CH3CHCl2 CH2ClCH2Cl
2种
三氯乙烷 CH3CCl3
CH2ClCHCl2
2种
四氯乙烷 CH2ClCCl3 CHCl2CHCl2
2种
烷烃和烯烃知识点总结-2024鲜版

随着碳链的增长,烷烃的沸点、熔点 逐渐升高,密度逐渐增大。
化学性质
烷烃相对稳定,不易发生加成反应, 但可在一定条件下发生取代反应、氧 化反应等。
6
02
烯烃概述
2024/3/28
7
定义与结构特点
1
烯烃是一类含有碳-碳双键的不饱和烃,通式为 CnH2n。
2
烯烃的分子结构中,碳-碳双键是由一个σ键和一 个π键组成的,π键的存在使得烯烃具有不饱和性 。
2024/3/28
17
其他重要反应类型
氧化反应
烷烃和烯烃都可在一定条件下发生氧化反应,生 成相应的醇、酮、酸等化合物。
裂解反应
在高温或催化剂存在下,烷烃和烯烃可发生裂解 反应,生成较小分子的烃类化合物。
ABCD
2024/3/28
聚合反应
烯烃可发生聚合反应,生成高分子化合物,如聚 乙烯、聚丙烯等。
烷基化反应
2024/3/28
22
06
实验室安全注意事项及环保要 求
2024/3/28
23
实验室安全注意事项
严格遵守实验室规章制度
在进入实验室之前,必须熟悉并遵守实验室的各项规章制度,尤其是关于安全方面的规
定。
注意火源和易燃物品
烷烃和烯烃都是易燃物质,因此要远离火源,禁止在实验室吸烟或使用明火。同时,要 妥善存放易燃物品,避免其泄漏或挥发。
石油气
低碳数的烷烃和烯烃在常温下呈 气态,可作为石油气使用,用于 民用燃料和工业原料。
2024/3/28
20
化学工业中的应用
合成橡胶
烯烃可以通过聚合反应合成橡胶,如丁苯橡胶、顺丁橡胶 等,广泛应用于轮胎、密封件等领域。
01
合成塑料
化学性质
烷烃相对稳定,不易发生加成反应, 但可在一定条件下发生取代反应、氧 化反应等。
6
02
烯烃概述
2024/3/28
7
定义与结构特点
1
烯烃是一类含有碳-碳双键的不饱和烃,通式为 CnH2n。
2
烯烃的分子结构中,碳-碳双键是由一个σ键和一 个π键组成的,π键的存在使得烯烃具有不饱和性 。
2024/3/28
17
其他重要反应类型
氧化反应
烷烃和烯烃都可在一定条件下发生氧化反应,生 成相应的醇、酮、酸等化合物。
裂解反应
在高温或催化剂存在下,烷烃和烯烃可发生裂解 反应,生成较小分子的烃类化合物。
ABCD
2024/3/28
聚合反应
烯烃可发生聚合反应,生成高分子化合物,如聚 乙烯、聚丙烯等。
烷基化反应
2024/3/28
22
06
实验室安全注意事项及环保要 求
2024/3/28
23
实验室安全注意事项
严格遵守实验室规章制度
在进入实验室之前,必须熟悉并遵守实验室的各项规章制度,尤其是关于安全方面的规
定。
注意火源和易燃物品
烷烃和烯烃都是易燃物质,因此要远离火源,禁止在实验室吸烟或使用明火。同时,要 妥善存放易燃物品,避免其泄漏或挥发。
石油气
低碳数的烷烃和烯烃在常温下呈 气态,可作为石油气使用,用于 民用燃料和工业原料。
2024/3/28
20
化学工业中的应用
合成橡胶
烯烃可以通过聚合反应合成橡胶,如丁苯橡胶、顺丁橡胶 等,广泛应用于轮胎、密封件等领域。
01
合成塑料
烷烃和烯烃 课件 高中化学课件

应,但酸性KMnO4溶液氧化乙烯时,会产生一些其他气体混 杂在乙烷中,而乙烯与 Br 2 发生加成反应,不会产生其他气 体。 答案 B
(1)概念:由相对分子质量小的化合物分子结合成相对分 子质量较大的高分子化合物的反应。如加聚反应、缩聚反 应。 nCH2=CH2 ― ― →
催化剂
(2)加聚反应的反应机理是:碳碳双键断裂后,小分子彼
此拉起手来,形成高分子化合物。可以用下式表示:
二、烯烃的顺反异构 是不是所有的烯烃都能形成顺反异构? 并不是所有的烯烃都能形成顺反异构,双键同侧连接两 个相同的原子或原子团的烯烃就不能形成顺反异构。 产生顺反异构的条件是:构成双键的任意一个碳原子上 所连接的 2个原子或原子团都要不相同。如果用 a、 b 表示双 键碳原子上不同的原子或原子团,那么,因双键所引起的顺 反异构如下所示:
相对密度
相对密度-分子中的C原子数 1.2 1 0.8 0.6 0.4 0.2 0 0 5 10 15 20 分子中的C原子数
相对密度
二、烷烃、烯烃性质的比较
1.物理性质递变规律 随着碳原子数的增多: (1)状态:由气态到液态,再到固态。 (2)溶解性:都不易溶于水,易溶于有机溶剂。
(3)熔、沸点:熔、沸点逐渐升高。
沸点-分子中的C原子数 400 300 200
沸点
100 0 -100 0 -200 分子中的C原子数 5 10 15 20
沸点-分子中的C原子数 400 300 200
沸点
100 0 -100 0 -200 分子中的C原子数 5 10 15 20
相对密度-分子中的C原子数 1.2 1 0.8 0.6 0.4 0.2 0 0 5 10 15 20 分子中的C原子数
典例导析
烷烃和烯烃课件

(1)1,2-加成:
CH2 CH—CH CH2+Br2
(2)1,4-加成:
CH2 CH—CH CH2+Br2
烷烃的结构与性质
问题探究
1.根据教材表格完成下面两个图。
提示
烷烃分子中碳原子数与沸点或相对密度变化曲线图
2.在1.01×105 Pa下,测得的某些烷烃的沸点如下表所示:
物质名称
沸点/℃
正丁烷 CH3(CH2)2CH3
般指烯烃分子中的双键。
顺式异构体:两个相同的原子或原子团在双键同一侧的为顺式异
构体。
反式异构体:两个相同的原子或原子团分别在双键两侧的为反式
异构体。
顺反异构体产生的条件:(1)存在碳碳双键;(2)每一个双键碳原子
上连有不同的原子或原子团。
2.顺反异构体的化学性质基本相同,物理性质有一定的差异
态,其他为液态或固态
随着分子中碳原子数的增加,烯烃的熔、沸点逐渐
熔、沸点
升高
密度
随着分子中碳原子数的增加,相对密度逐渐增大,但
相对密度均小于 1
溶解性
烯烃都不溶于水,易溶于有机溶剂
3.化学性质
烯烃分子里含有碳碳双键,它决定了烯烃的主要化学性质。
(1)氧化反应
①能使KMnO4酸性溶液褪色,常用于烯烃的检验。
黑烟。
(4)受热分解:
分子中含碳原子较多的烷烃在受热时会发生分解,烷烃分解产物
中有烯烃。
典例引领
【例题1】 某有机物结构简式如图,下列说法错误的是(
)
A.该有机物属于饱和烃
B.该有机物可由两种单炔烃分别与氢气加成得到
C.该烃与2,3-二甲基丁烷互为同系物
D.该烃的一氯取代物有5种
CH2 CH—CH CH2+Br2
(2)1,4-加成:
CH2 CH—CH CH2+Br2
烷烃的结构与性质
问题探究
1.根据教材表格完成下面两个图。
提示
烷烃分子中碳原子数与沸点或相对密度变化曲线图
2.在1.01×105 Pa下,测得的某些烷烃的沸点如下表所示:
物质名称
沸点/℃
正丁烷 CH3(CH2)2CH3
般指烯烃分子中的双键。
顺式异构体:两个相同的原子或原子团在双键同一侧的为顺式异
构体。
反式异构体:两个相同的原子或原子团分别在双键两侧的为反式
异构体。
顺反异构体产生的条件:(1)存在碳碳双键;(2)每一个双键碳原子
上连有不同的原子或原子团。
2.顺反异构体的化学性质基本相同,物理性质有一定的差异
态,其他为液态或固态
随着分子中碳原子数的增加,烯烃的熔、沸点逐渐
熔、沸点
升高
密度
随着分子中碳原子数的增加,相对密度逐渐增大,但
相对密度均小于 1
溶解性
烯烃都不溶于水,易溶于有机溶剂
3.化学性质
烯烃分子里含有碳碳双键,它决定了烯烃的主要化学性质。
(1)氧化反应
①能使KMnO4酸性溶液褪色,常用于烯烃的检验。
黑烟。
(4)受热分解:
分子中含碳原子较多的烷烃在受热时会发生分解,烷烃分解产物
中有烯烃。
典例引领
【例题1】 某有机物结构简式如图,下列说法错误的是(
)
A.该有机物属于饱和烃
B.该有机物可由两种单炔烃分别与氢气加成得到
C.该烃与2,3-二甲基丁烷互为同系物
D.该烃的一氯取代物有5种
第30讲 烷烃、烯烃、炔烃 课件

2019高考一轮总复习 • 化学
第30讲
烷烃、烯烃、炔烃
2019高考一轮总复习 • 化学
一、烷烃[通式:CnH2n+2(n≥1)] 1.烷烃的物理性质:随着分子中碳原子数的递增,呈现规律性的变化:沸点逐渐 升高,相对密度逐渐增大;常温下的存在状态,由气态逐渐过渡到液态、固态。 2.烷烃的化学性质:烷烃能够发生取代反应、氧化反应、分解反应等。
2019高考一轮总复习 • 化学
自测5 下列说法中正确的是 ( D ) A.炔烃分子中所有的碳原子在同一条直线上 B.分子组成符合CnH2n-2通式的链烃,一定是炔烃 C.炔烃既易发生加成反应,又易发生取代反应 D.炔烃既可使溴水褪色,又可使酸性KMnO4溶液褪色 答案 D A项,炔烃分子中与
与水反应的化学方程式为:③ CH2==CH2+H2O
CH3CH2OH。
与HCl反应:CH2 ==CH2+HCl
与H2反应:CH2==CH2+H2
CH3CH2Cl。
CH3CH3。
(3)加聚反应:④
是单体,—CH2—CH2—称为链节,n是聚合度。 其他烯烃的化学性质和乙烯相似。
。其中CH2==CH2
合图知苯环以外的所有碳原子不可能共直线。
2019高考一轮总复习 • 化学
1-1 下列关于
(
的说法正确的是
D )
A.所有原子在同一平面上 B.最多有9个碳原子在同一平面上 C.有7个碳原子可能在同一直线上 D.最多有4个碳原子在同一直线上
2019高考一轮总复习 • 化学
答案 D 该有机物的结构为
2019高考一轮总复习 • 化学
自测1 (1)烷烃的特征反应为取代反应,1 mol甲烷和0.5 mol氯气发生取 代反应只生成CH3Cl吗? (2)能否用CH3CH3的取代反应制取纯净的CH3CH2Cl?
第30讲
烷烃、烯烃、炔烃
2019高考一轮总复习 • 化学
一、烷烃[通式:CnH2n+2(n≥1)] 1.烷烃的物理性质:随着分子中碳原子数的递增,呈现规律性的变化:沸点逐渐 升高,相对密度逐渐增大;常温下的存在状态,由气态逐渐过渡到液态、固态。 2.烷烃的化学性质:烷烃能够发生取代反应、氧化反应、分解反应等。
2019高考一轮总复习 • 化学
自测5 下列说法中正确的是 ( D ) A.炔烃分子中所有的碳原子在同一条直线上 B.分子组成符合CnH2n-2通式的链烃,一定是炔烃 C.炔烃既易发生加成反应,又易发生取代反应 D.炔烃既可使溴水褪色,又可使酸性KMnO4溶液褪色 答案 D A项,炔烃分子中与
与水反应的化学方程式为:③ CH2==CH2+H2O
CH3CH2OH。
与HCl反应:CH2 ==CH2+HCl
与H2反应:CH2==CH2+H2
CH3CH2Cl。
CH3CH3。
(3)加聚反应:④
是单体,—CH2—CH2—称为链节,n是聚合度。 其他烯烃的化学性质和乙烯相似。
。其中CH2==CH2
合图知苯环以外的所有碳原子不可能共直线。
2019高考一轮总复习 • 化学
1-1 下列关于
(
的说法正确的是
D )
A.所有原子在同一平面上 B.最多有9个碳原子在同一平面上 C.有7个碳原子可能在同一直线上 D.最多有4个碳原子在同一直线上
2019高考一轮总复习 • 化学
答案 D 该有机物的结构为
2019高考一轮总复习 • 化学
自测1 (1)烷烃的特征反应为取代反应,1 mol甲烷和0.5 mol氯气发生取 代反应只生成CH3Cl吗? (2)能否用CH3CH3的取代反应制取纯净的CH3CH2Cl?
烷烃、烯烃和炔烃的物理性质和化学性质(原创)

CH≡CH+H2O
CH2=CH2OH(不稳定)→CH3CHO(最后生成乙醛)
加聚反应
无
实验室制法
CaC2+2H2O→C2H2↑+Ca(OH)2
特殊性质
或
用途
CH4 C+2H2
C16H34பைடு நூலகம்C8H18+ C8H16
一个大烷烃分子裂解成一个小烷烃分子和一个烯烃分子。
顺反异构,同侧为顺,异侧为反。
乙炔俗名电石气,用于焊接金属;乙烯用作催熟剂和有机化工基本原料,甲烷俗名天然气,用于燃料。
碳原子数越多,熔沸点越高;相同碳原子数,支链越多,熔沸点越低。
碳原子数越多,熔沸点越高;相同碳原子数,支链越多,熔沸点越低。
溶解性
不溶于水,易溶于有机溶剂
不溶于水,易溶于有机溶剂
不溶于水,易溶于有机溶剂
密度
碳原子数越多,密度越大,但始终小于水的密度。
碳原子数越多,密度越大,但始终小于水的密度。
碳原子数越多,密度越大,但始终小于水的密度。
溶解性密度化学性质概述氧化反应燃烧现象不溶于水易溶于有机溶剂不溶于水易溶于有机溶剂碳原子数越多密度越大但始碳原子数越多密度越大但始终终小于水的密度
烷烃
烯烃(重点)
炔烃
通式
CnH2n+2全部单键
CnH2n只有一个双键
CnH2n-2只有一个三键
代表物
CH4
CH2=CH2
CH≡CH
电子式
熔沸点
变化规律与烯炔烃类似。常温下C1~C4为气态,C5~C16为液态。C17以上为固态。
CnH2n-2+(3n-1/2)O2→nCO2+(n-1)H2O
燃烧现象
火焰呈淡蓝色,安静燃烧。
CH2=CH2OH(不稳定)→CH3CHO(最后生成乙醛)
加聚反应
无
实验室制法
CaC2+2H2O→C2H2↑+Ca(OH)2
特殊性质
或
用途
CH4 C+2H2
C16H34பைடு நூலகம்C8H18+ C8H16
一个大烷烃分子裂解成一个小烷烃分子和一个烯烃分子。
顺反异构,同侧为顺,异侧为反。
乙炔俗名电石气,用于焊接金属;乙烯用作催熟剂和有机化工基本原料,甲烷俗名天然气,用于燃料。
碳原子数越多,熔沸点越高;相同碳原子数,支链越多,熔沸点越低。
碳原子数越多,熔沸点越高;相同碳原子数,支链越多,熔沸点越低。
溶解性
不溶于水,易溶于有机溶剂
不溶于水,易溶于有机溶剂
不溶于水,易溶于有机溶剂
密度
碳原子数越多,密度越大,但始终小于水的密度。
碳原子数越多,密度越大,但始终小于水的密度。
碳原子数越多,密度越大,但始终小于水的密度。
溶解性密度化学性质概述氧化反应燃烧现象不溶于水易溶于有机溶剂不溶于水易溶于有机溶剂碳原子数越多密度越大但始碳原子数越多密度越大但始终终小于水的密度
烷烃
烯烃(重点)
炔烃
通式
CnH2n+2全部单键
CnH2n只有一个双键
CnH2n-2只有一个三键
代表物
CH4
CH2=CH2
CH≡CH
电子式
熔沸点
变化规律与烯炔烃类似。常温下C1~C4为气态,C5~C16为液态。C17以上为固态。
CnH2n-2+(3n-1/2)O2→nCO2+(n-1)H2O
燃烧现象
火焰呈淡蓝色,安静燃烧。
《烷烃化学性质》课件
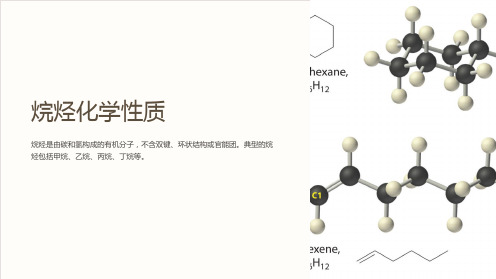
烷烃化学性质
烷烃是由碳和氢构成的有机分子,不含双键、环状结构或官能团。典型的烷 烃包括甲烷、乙烷、丙烷、丁烷等。
介绍烷烃
碳与氢的有机分子
烷烃是由碳和氢构成的有机分子,不含双键、 环状结构或官能团。
重要的石油成分
烷烃是石油的主要成分,是化学工业中重要的 原料。
常见的烷烃
典型的烷烃包括甲烷、乙烷、丙烷、丁烷等。
广泛应用
烷烃用于燃料、溶剂、制造合成橡胶、聚合物、 医药等。Biblioteka 化学性质1 不活泼的特性
烷烃不活泼,难以与其他分子反应。
2 易燃烧
烷烃容易燃烧,生成CO2和H2O。
3 高温高压下的消磨反应
在高温高压下,烷烃可以发生消磨反应,如裂解和芳构化。
反应机理
1
消磨反应
消磨反应在高温高压下发生,影响反应的是分子中的碳、氢以及它们的有序排列 方式。
2
芳构化反应
芳构化反应也对烷烃中的碳、氢及其有序排列方式起着决定性作用。
结论
不活泼的特性
烷烃化学性质主要体现在其不活泼的特性。
消磨反应与芳构化反应
消磨反应和芳构化反应是烷烃反应的主要机理。
重要的应用价值
烷烃在化学工业中有重要的应用价值。
烷烃是由碳和氢构成的有机分子,不含双键、环状结构或官能团。典型的烷 烃包括甲烷、乙烷、丙烷、丁烷等。
介绍烷烃
碳与氢的有机分子
烷烃是由碳和氢构成的有机分子,不含双键、 环状结构或官能团。
重要的石油成分
烷烃是石油的主要成分,是化学工业中重要的 原料。
常见的烷烃
典型的烷烃包括甲烷、乙烷、丙烷、丁烷等。
广泛应用
烷烃用于燃料、溶剂、制造合成橡胶、聚合物、 医药等。Biblioteka 化学性质1 不活泼的特性
烷烃不活泼,难以与其他分子反应。
2 易燃烧
烷烃容易燃烧,生成CO2和H2O。
3 高温高压下的消磨反应
在高温高压下,烷烃可以发生消磨反应,如裂解和芳构化。
反应机理
1
消磨反应
消磨反应在高温高压下发生,影响反应的是分子中的碳、氢以及它们的有序排列 方式。
2
芳构化反应
芳构化反应也对烷烃中的碳、氢及其有序排列方式起着决定性作用。
结论
不活泼的特性
烷烃化学性质主要体现在其不活泼的特性。
消磨反应与芳构化反应
消磨反应和芳构化反应是烷烃反应的主要机理。
重要的应用价值
烷烃在化学工业中有重要的应用价值。
烷、烯、炔烃小结

要点二
详细描述
炔烃是一种不饱和烃,其分子中含有一个或多个碳碳三键。 炔烃的通式为CnH2n-2,其中n表示碳原子数。当n=2时, 炔烃的分子式为C2H2,这是最简单的炔烃。随着碳原子数 的增加,炔烃的同分异构体数量也会增加。同分异构体的存 在取决于碳链的长度和支链的数量与位置。例如,戊炔有三 种同分异构体,己炔有八种同分异构体。
04 烷、烯、炔烃的比较
结构特点比较
01
02
03
烷烃
碳原子之间通过单键连接, 呈饱和状态,结构简单。
烯烃
含有碳碳双键,具有不饱 和性,结构相对复杂。
Байду номын сангаас炔烃
含有碳碳三键,高度不饱 和,结构最为复杂。
物理性质比较
烷烃
熔点、沸点较高,相对密度小于水,不溶于水。
烯烃
熔点、沸点较低,相对密度一般小于水,部分溶 于水。
THANKS
烷、烯、炔烃小结
目录
CONTENTS
• 烷烃 • 烯烃 • 炔烃 • 烷、烯、炔烃的比较
01 烷烃
烷烃的通式与同分异构体
烷烃的通式
CnH2n+2,其中n表示碳原子数。
同分异构体
烷烃的同分异构体包括直链烷烃和支链烷烃,如正丁烷和异丁烷。
烷烃的物理性质
状态
随着碳原子数的增加,烷烃由气态逐渐变为液 态,最后变为固态。
熔沸点
烷烃的熔点和沸点随着碳原子数的增加而升高。
密度
烷烃的密度随着碳原子数的增加而增大。
烷烃的化学性质
取代反应
烷烃在光照条件下可发生取代反应,如卤代反应。
氧化反应
烷烃在氧气存在下可发生燃烧反应,生成二氧化碳和水。
裂化反应
