九年级上册化学化学方程式归纳练习及答案
九年级上学期化学方程式汇总 (附答案)

九年级上学期化学方程式汇总姓名:一、氧气的性质:(1)单质与氧气O2的反应:(化合反应)1. 镁在空气中燃烧:2Mg + O22MgO2. 铁在氧气中燃烧:3Fe + 2O2Fe3O43. 铜在空气中受热:2Cu +O22CuO4. 氢气中空气中燃烧:2H2 + O22H2O5. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O22P2O 56. 硫粉在空(氧)气中燃烧:S + O2SO27. 碳在空(氧)气中充分燃烧:C + O2CO28. 碳在空(氧)气中不充分燃烧:2C + O22CO(2)化合物与氧气O2的反应:9. 一氧化碳在空气中燃烧:2CO + O22CO210. 甲烷在空气中燃烧:CH4 + 2O2CO2 + 2H2O11. 酒精在空气中燃烧:C2H5OH + 3O22CO2 + 3H2O(3)氧气O2的制取:12.拉瓦锡研究空气的成分实验:2HgO 2Hg+ O2↑13.加热高锰酸钾:2KMnO4K2MnO4 + MnO2 + O2↑实验室制氧气原理114.加热氯酸钾(二氧化锰):2KClO32KCl + 3O2↑实验室制氧气原理215.过氧化氢在二氧化锰催化下分解:2H2O2 2H2O+ O2↑实验室制氧气原理3二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 2H2↑+ O2↑17.二氧化碳可溶于水:H2O + CO2==H2CO3三、质量守恒定律:18.镁在空气中燃烧:2Mg + O22MgO19.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu20.氢气还原氧化铜:H2 + CuO Cu + H2O21.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑四、碳C和碳的氧化物:(1)碳C的化学性质22. 碳在氧气中充分燃烧:C + O2CO223.木炭还原氧化铜:C+ 2CuO 2Cu + CO2↑24.焦炭还原氧化铁:3C+ 2Fe2O34Fe + 3CO2↑(2)煤炉中发生的三个化合反应:25.煤炉的底层:C + O2CO226.煤炉的中层:CO2 + C 2CO27.煤炉的上部蓝色火焰的产生:2CO + O22CO2(3)二氧化碳CO2的制法与性质:28.大理石CaCO3与稀盐酸HCl反应(实验室制二氧化碳):CaCO3 + 2HCl == CaCl2 + H2O + CO2↑29.碳酸不稳定而分解:H2CO3 == H2O + CO2↑30.高温煅烧石灰石:CaCO3CaO + CO2↑31.生石灰溶于水:CaO + H2O == Ca(OH)232.石灰水Ca(OH)2与二氧化碳CO2反应(鉴别二氧化碳CO2):Ca(OH)2 + CO2 === CaCO3 ↓+ H2O (4)一氧化碳CO的性质:33.一氧化碳还原氧化铜:CO+ CuO Cu + CO234.一氧化碳的可燃性:2CO + O22CO2其它反应:35.灭火器的原理(碳酸钠与稀盐酸反应):Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑36. 锌和稀硫酸(实验室制氢气H2)Zn + H2SO4 = ZnSO4 + H2↑37.金属铁的治炼原理:3CO+ Fe2O3 2Fe + 3CO2。
初三化学方程式练习题及答案

初三化学方程式练习题及答案化学方程式是描述化学反应过程的重要工具,它由反应物、产物和反应条件组成。
熟练掌握化学方程式的书写对于初三化学学科的学习至关重要。
下面是一些针对初三学生的化学方程式练习题及答案,帮助大家巩固知识点。
1. 氢气与氧气发生反应生成水的化学方程式是什么?答案:2H₂ + O₂ → 2H₂O解析:根据氢气和氧气的元素符号H₂和O₂,以及反应生成的水的元素符号H₂O,我们可以得到方程式2H₂ + O₂ → 2H₂O。
2. 碳酸钙分解产生二氧化碳和氧化钙的化学方程式是什么?答案:CaCO₃ → CO₂ + CaO解析:根据碳酸钙的元素符号CaCO₃,二氧化碳的元素符号CO₂,以及氧化钙的元素符号CaO,我们可以得到方程式CaCO₃ → CO₂ + CaO。
3. 氮气与氢气反应生成氨的化学方程式是什么?答案:N₂ + 3H₂ → 2NH₃解析:根据氮气的元素符号N₂,氢气的元素符号H₂,以及氨的元素符号NH₃,我们可以得到方程式N₂ + 3H₂ → 2NH₃。
4. 硫酸与钠氢碳酸反应生成二氧化碳、水和硫酸钠的化学方程式是什么?答案:H₂SO₄ + NaHCO₃ → CO₂ + H₂O + Na₂SO₄解析:根据硫酸的元素符号H₂SO₄,钠氢碳酸的元素符号NaHCO₃,以及产物二氧化碳、水和硫酸钠的元素符号CO₂、H₂O 和Na₂SO₄,我们可以得到方程式H₂SO₄ + NaHCO₃ → CO₂ +H₂O + Na₂SO₄。
5. 磷酸与钠氢碳酸反应生成二氧化碳、水和磷酸钠的化学方程式是什么?答案:H₃PO₄ + NaHCO₃ → CO₂ + H₂O + Na₃PO₄解析:根据磷酸的元素符号H₃PO₄,钠氢碳酸的元素符号NaHCO₃,以及产物二氧化碳、水和磷酸钠的元素符号CO₂、H₂O 和Na₃PO₄,我们可以得到方程式H₃PO₄ + NaHCO₃ → CO₂ +H₂O + Na₃PO₄。
(必考题)初中九年级化学上册第五单元《化学方程式》经典习题(含答案解析)

(必考题)初中九年级化学上册第五单元《化学方程式》经典习题(含答案解析)一、选择题1.如图是“尾气催化转换器”将汽车尾气中有毒气体转化为无毒气体的微观示意图,其中不同的圆球代表不同的原子。
下列说法错误的是( )A .该反应一定不是化合反应B .图中的反应物全部是化合物C ..参加反应的两种分子个数比为1:1D .该反应生成了三种生成物 2.图中表示氢原子,表示氮原子,在一定条件有如下图反应发生,下列有关叙述错误的是A .该反应为化合反应B .该反应前两种物质均为单质C .该反应前后三种物质的化学计量数之比为4:1:2D .一个分子中含有三个氢原子和一个氮原子3.下图是某个化学反应的微观模拟示意图。
从图中获得的有关信息不正确...的是A .反应前后原子种类和个数个数不变B .反应前是混合物,反应后是化合物C .化学反应中分子可分为原子D .该反应为分解反应4.刚刚过去的9月27日,我省太原卫星发射中心用长征四号乙运载火箭,以一箭双星的方式成功发射环境减灾二号A 、B 卫星。
此次发射所使用的燃料为四氧化二氮和偏二甲肼,其燃烧的反应为2822422C H N +2N O 2CO 3N 4X ↑+↑+点燃,其中X 的化学式为A .NH 3B .N 2OC .H 2OD .C 2H 45.在一个密闭的容器中放入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下,下列说法正确的是物质甲乙丙丁反应前质量/g93221反应后质量/g x3417A.乙是该反应的催化剂B.x的值为2C.丙可能是单质D.该反应可能是水通电分解6.甲型H1N1流感的蔓延,是对人类健康的重大威胁。
从中草药“八角”中提取莽草酸是生产抗甲型H1N1流感药物“达菲”的主要原料,其化学式为C7H10O5.下列关于莽草酸的说法中,不正确的是A.莽草酸是由碳、氢、氧三种元素组成的B.莽草酸可在氧气中完全燃烧生成CO2和H2OC.莽草酸中含有7个碳原子、10个氢原子和5个氧原子D.莽草酸的相对分子质量为1747.某反应的微观示意图如下,下列说法正确的是A.生成物一定是混合物B.化学反应前后原子的种类不变C.该反应的生成物一定是氧化物D.反应后各元素化合价不变8.一定条件下,甲、乙、丙、丁四种物质在密闭容器中反应,测得反应前后各物质的质量分数如图所示,下列说法正确的是()A.丁一定是该反应的催化剂B.该反应中甲、丙的质量比为 1∶5C.该反应中乙、丙的质量比为 2∶5D.该反应一定是分解反应9.某反应过程的微观示意图如图。
九年级上册化学化学方程式归纳练习及答案

九年级上册化学化学方程式归纳练习及答案一、各物质在氧气中燃烧方程式及现象)1、磷在空气中燃烧:(验证空气含量,书P27现象:2、碳在氧气中燃烧现象:3、硫在氧气中燃烧(比较其在空气中燃烧的现象)现象:4、铁在氧气中燃烧(注:铁在空气中不燃烧)现象:5、镁在氧气中燃烧现象:二、实验室制氧气原理:(氧气的物理性质、收集方法、检验、验满)6、过氧化氢溶液制氧气:7、加热氯酸钾制氧气:8、加热高锰酸钾制氧气:(装置、操作步骤及注意事项书P37)三、水的电解(氢气的物理性质、收集方法、验纯及用途,书P)79-809、结论:1、2、与正极相连的气体为_______,与负极相连的气体为_______,正负极生成气体的体积比为__________,可用八个字概括_______________________四、碳在空气中燃烧(碳几种单质的物理性质及用途,碳的化学性质)10、(氧气不足)(氧气充足)五、碳的还原性11、碳还原氧化铜:现象:12、碳还原氧化铁13、二氧化碳通入炽热的碳层六、二氧化碳(物理性质、制取原料、收集方法、验证、验满、注意事项)14、实验室制法:15、工业制法:16、二氧化碳通入紫色石蕊溶液,溶液变红:17、加热变红的溶液又变红(碳酸的不稳定性)18、检验CO2:现象:七、一氧化碳(物理性质、化学性质)19、可燃性(火焰呈______色):20、还原性(还原氧化铁)21、还原氧化铜:22、甲烷燃烧:23、氢气在空气中燃烧:24、乙醇在空气中燃烧:25、实验室制氢气:答案一、各物质在氧气中燃烧方程式及现象1、4P + 5O2 2P2O5(验证空气含量,书P27)现象:2、C + O2 CO2现象:3、S + O2 SO2(比较其在空气中燃烧的现象)现象:4、3Fe + 2O2 Fe3O4(注:铁在空气中不燃烧)现象:5、2Mg + O22MgO现象:二、实验室制氧气原理:(氧气的物理性质、收集方法、检验、验满)6、2H2O22H2O+O2↑7、2KClO3 2KCl + 3O2↑8、2KMnO4 K2MnO4+ MnO2+ O2↑(装置、操作步骤及注意事项书P34-35)三、水的电解(氢气的物理性质、收集方法、验纯及用途,书P46-47)9、2H2 O 2H2↑+ O2↑结论:1、2、与正极相连的气体为_______,与负极相连的气体为_______,正负极生成气体的体积比为__________,可用八个字概括_______________________四、碳在空气中燃烧(碳几种单质的物理性质及用途,碳的化学性质)10、2C + O2 2CO(氧气不足) C + O2CO2(氧气充足)五、碳的还原性11、C+ 2CuO 2Cu + CO2↑现象:12、3C+ 2Fe2O34Fe + 3CO2↑13、C+ CO22CO六、二氧化碳(物理性质、制取原料、收集方法、验证、验满、注意事项)14、CaCO3+ 2HCl === CaCl2+ H2O + CO2↑(实验室制法)15、CaCO3 CaO + CO2↑16、CO2 + H2O === H2CO3(碳酸可以使紫色石蕊溶液变_________)17、H2 CO3=== H2O + CO2↑(碳酸的不稳定性)18、Ca(OH)2 + CO2==== CaCO3↓+ H2O(检验CO2)现象:七、一氧化碳(物理性质、化学性质)19、CO + O2 2CO2(火焰呈______色)20、CO + Fe2 O32Fe + 3CO221、CO+ CuO Cu + CO222、CH4 + 2O2CO2+ 2H2O 23、2H2+ O22H2O24、C2 H5OH + 3O22CO2+ 3H2O25、Zn+H2SO4===ZnSO4+H2↑(实验室制氢气)。
人教版初中九年级化学上册第五单元《化学方程式》知识点总结(含答案解析)(1)
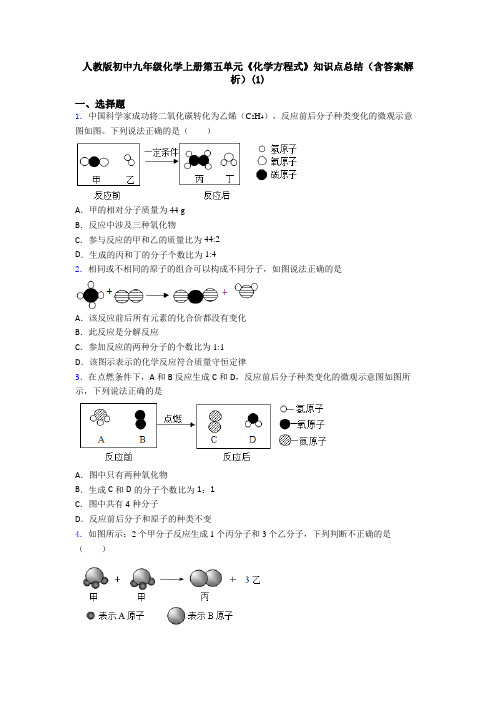
人教版初中九年级化学上册第五单元《化学方程式》知识点总结(含答案解析)(1)一、选择题1.中国科学家成功将二氧化碳转化为乙烯(C2H4),反应前后分子种类变化的微观示意图如图。
下列说法正确的是()A.甲的相对分子质量为44 gB.反应中涉及三种氧化物C.参与反应的甲和乙的质量比为44:2D.生成的丙和丁的分子个数比为1:42.相同或不相同的原子的组合可以构成不同分子,如图说法正确的是A.该反应前后所有元素的化合价都没有变化B.此反应是分解反应C.参加反应的两种分子的个数比为1:1D.该图示表示的化学反应符合质量守恒定律3.在点燃条件下,A和B反应生成C和D,反应前后分子种类变化的微观示意图如图所示,下列说法正确的是A.图中只有两种氧化物B.生成C和D的分子个数比为1:1C.图中共有4种分子D.反应前后分子和原子的种类不变4.如图所示:2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是()A .根据质量守恒定律可推知,1个乙分子中含有2个A 原子B .该反应前后一定有元素的化合价发生了改变C .该反应中甲、乙和丙的分子个数比是2:2:3D .该反应属于分解反应5.在一密闭容器中有A 、B 、C 、D 四种物质,一定条件下充分反应测得反应前后各物质的质量如表所示。
则下列说法中正确的是 物质 A B C D 反应前的质量/g 18 18 5 3 反应后的质量/g30待测9A .该反应一定是化合反应B .C 物质在该反应中一定是催化剂 C .反应后待测的C 物质的质量为0gD .参加反应的A 、B 、D 三种物质的质量比为3:2:16.当空气中受到 SO 2污染时,可通过飞机喷洒石灰石粉末,使空气中 SO 2含量降低,该过程发生反应为:32422CaCO +2SO +X=2CaSO +2CO ,则 X 的化学式为( ) A .CaO B .O 3C .O 2D .CO7.用和分别代表两种不同单质A 2和B 2的分子,A 2和B 2在一定条件下发生化学反应生成新物质X ,微观过程如下图所示。
九年级上册化学化学方程式归纳练习及答案

1.【练习题】写出下列反应的化学方程式:
氯气和氢气的燃烧反应:
2HCl(g)+O2(g)→2H2O(g)+Cl2(g)
2.【练习题】写出下列反应的化学方程式:
硫酸钠溶液与氢氧化钠溶液反应:
Na2SO4(aq)+2NaOH(aq)→Na2SO4(aq)+2H2O(l)
3.【练习题】写出下列反应的化学方程式:
硫酸钡和铝粉反应:
BaSO4(s)+2Al(s)→Ba(AlO2)2(s)+SO2(g)
4.【练习题】写出下列反应的化学方程式:
硝酸铵溶液与氢氧化钠溶液的反应:
NH4NO3(aq)+ NaOH(aq)→NaNO3(aq)+H2O(l)+ NH3(g)
5.【练习题】写出下列反应的化学方程式:
金属铝与氯气反应:
2Al(s)+3Cl2(g)→2AlCl3(s)
6.【练习题】写出下列反应的化学方程式:
硝酸钠溶液和氢氧化钾溶液反应:
NaNO3(aq)+ KOH(aq)→KNO3(aq)+ H2O(l)
7.【练习题】写出下列反应的化学方程式:
氢氧化铝和氯化钠反应:
Al(OH)3(aq) + 3NaCl(aq) → AlCl3(aq) + 3NaOH(aq)
8.【练习题】写出下列反应的化学方程式:
碳酸钠溶液和氯化钠溶液的反应:
Na2CO3(aq)+ NaCl(aq)→2NaCl(aq)+ CO2(g)+H2O(l)
9.【练习题】写出下列反应的化学方程式:
铝粉和硫酸钠的反应:
2Al(s)+ 3Na2SO4(aq)→ Al2(SO4)3(aq) + 6Na(aq)
10.【练习题】写出下列反应的化学方程式:
硫酸铝和硫酸钠的反应:。
人教版初中九年级化学上册第五单元《化学方程式》知识点复习(含答案解析)

人教版初中九年级化学上册第五单元《化学方程式》知识点复习(含答案解析)一、选择题1.在一个密闭容器中放入甲、乙、丙、丁四种物质,使其在一定条件下发生化学反应,一段时间后测得反应数据如下表所示,下列说法正确的是()物质甲乙丙丁反应前的质量/g36234反应后的质量/g待测20320A.丙一定是该反应的催化剂B.待测值为0C.该反应生成的乙与丁的质量比为1:1D.该反应的基本反应类型是分解反应2.下列说法中正确并符合质量守恒定律解释的是()A.10g酒精和50g水混匀后形成60g酒精溶液B.红磷在氧气中燃烧,反应后得到30g P2O5,则参加反应的O2和磷的总质量一定为30g C.2L氢气和1L氧气反应,生成3L水,这符合质量守恒定律D.2g氢气和8g氧气完全反应,生成10g水,这符合质量守恒定律3.相同或不相同的原子的组合可以构成不同分子,如图说法正确的是A.该反应前后所有元素的化合价都没有变化B.此反应是分解反应C.参加反应的两种分子的个数比为1:1D.该图示表示的化学反应符合质量守恒定律4.下列选项中,化学基本观念所对应的客观事实不相符的是A.守恒观:化学反应前后元素种类不变B.微粒观:所有原子中都含有质子、中子和电子C.转化观:二氧化碳和氧气在一定条件下可以相互转化D.辩证观:塑料可用于蔬菜大棚,但也会造成“白色污染”5.某化学反应前后分子变化的微观示意图如下,下列说法不正确的是A.该反应属于氧化反应B.参加反应A、B两物质的分子个数比为1∶1C.生成物C和D的质量比为14∶27 D.该反应前后有两种元素的化合价发生了改变6.在一个密闭容器中,有甲、乙、丙、丁四种物质在一定条件下充分反应,测得反应前后各物质的质量如下表,下列说法错误的是物质甲乙丙丁反应前质量/g522022反应后质量/g待测11285A.该反应是分解反应B.甲可能该反应的催化剂C.乙、丙变化的质量比为9:8 D.反应后甲的质量为07.某密闭容器内发生的化学反应,测得反应数据如下表,下列说法正确的是()物质M N P Q反应前质106901838量/g反应后质35X8047量/gA.X=0B.M 一定是化合物C.该反应属于化合反应D.P 与 M 的质量变化比为 16:78.如图所示是某反应前后的微观示意图,“○”和“●”表示两种不同的原子。
化学人教版(2024新教材)九年级上册5.2 化学方程式 课时练含答案(1)

5.2化学方程式一、选择题.下图是工业上制取乙醇反应的微观示意图(其中““”代表碳原子,“下列叙述不正确的是().反应前后两种有机物的质量比为14:2313.请应用质量守恒定律的有关知识,完成下列各题.)化合价在反应前后没有变化的元素是什么元素?)写出该反应的化学方程式。
)反应中乙和丙得到质量之比是多少?.如图是载人飞船动力源发生反应的微观示意图,该反应的化学方程式.消毒与清洁对公共场所和家庭是至关重要,需要如二氧化氯(剂(有效成分是NaClO)、酒精(C2H5OH))、洁厕灵(有效成分是盐酸)等)参加反应的A、B两种物质的质量比为(填最简整数比))请以此反应为例从微观角度解释质量守恒定。
)图中有种氧化物。
)参加反应的A和B的质量比为。
)该反应的化学方程式。
参考答案1.D 2.C 3.B 4.D 5.D 6.C 7.B 8.C 9.B 10.D 11.D 12.C 13.2H 2O通电2H 2↑+O 2↑用带火星的木条接近a 管尖嘴部分16:118CO120g14.(1)N 2(或氮气)(2)O (或氧元素)(3)1∶2(4)22∶7(或7∶22)15.(1)H (或氢元素)(2)2322MnO 45O 46H O ΔNH NO ++(3)4:316.2N 2H 4+N 2O 4=3N 2+4H 2O 7:617.+42ClO Na12:3:8149g18.(1)15:8(2)化学反应前后原子的种类、数量、质量不改变19.(1)2(2)17:22(3)()322222NH +CO CO NH +H O一定条件下。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
九年级上册化学化学方程式归纳练习及答案
一、各物质在氧气中燃烧方程式及现象
1、磷在空气中燃烧:(验证空气含量,书P27)
现象:
2、碳在氧气中燃烧
现象:
3、硫在氧气中燃烧(比较其在空气中燃烧的现象)
现象:
4、铁在氧气中燃烧(注:铁在空气中不燃烧)
现象:
5、镁在氧气中燃烧
现象:
二、实验室制氧气原理:(氧气的物理性质、收集方法、检验、验满)
6、过氧化氢溶液制氧气:
7、加热氯酸钾制氧气:
8、加热高锰酸钾制氧气:(装置、操作步骤及注意事项书P37)
三、水的电解(氢气的物理性质、收集方法、验纯及用途,书P79-80)
9、
结论:1、
2、
与正极相连的气体为_______,与负极相连的气体为_______,正负极生成气体的体积比为__________,可用八个字概括_______________________
四、碳在空气中燃烧(碳几种单质的物理性质及用途,碳的化学性质)
10、(氧气不足)(氧气充足)
五、碳的还原性
11、碳还原氧化铜:
现象:
12、碳还原氧化铁
13、二氧化碳通入炽热的碳层
六、二氧化碳(物理性质、制取原料、收集方法、验证、验满、注意事项)
14、实验室制法:
15、工业制法:
16、二氧化碳通入紫色石蕊溶液,溶液变红:
17、加热变红的溶液又变红(碳酸的不稳定性)
18、检验CO2:
现象:
七、一氧化碳(物理性质、化学性质)
19、可燃性(火焰呈______色):
20、还原性(还原氧化铁)
21、还原氧化铜:
22、甲烷燃烧:
23、氢气在空气中燃烧:
24、乙醇在空气中燃烧:
25、实验室制氢气:
答案
一、各物质在氧气中燃烧方程式及现象
1、4P + 5O2 2P2 O5(验证空气含量,书P27)
现象:
2、C + O2 CO2
现象:
3、S + O2 SO2 (比较其在空气中燃烧的现象)
现象:
4、3Fe + 2O2 Fe3O4 (注:铁在空气中不燃烧)
现象:
5、2Mg + O2 2MgO
现象:
二、实验室制氧气原理:(氧气的物理性质、收集方法、检验、验满)
6、2H 2O 22H 2O+O 2↑
7、2KClO32KCl + 3O2 ↑
8、2KMnO4 K2 MnO4 + MnO2 + O2 ↑(装置、操作步骤及注意事项书P34-35)
三、水的电解(氢气的物理性质、收集方法、验纯及用途,书P46-47)
9、2H2 O 2H2 ↑+ O2↑
结论:1、
2、
与正极相连的气体为_______,与负极相连的气体为_______,正负极生成气体的体积比为__________,可用八个字概括_______________________
四、碳在空气中燃烧(碳几种单质的物理性质及用途,碳的化学性质)
10、2C + O2 2CO(氧气不足)C + O2 CO2 (氧气充足)
五、碳的还原性
11、C+ 2CuO 2Cu + CO2 ↑
现象:
12、3C+ 2Fe2O34Fe + 3CO2↑
13、C+ CO22CO
六、二氧化碳(物理性质、制取原料、收集方法、验证、验满、注意事项)
14、CaCO 3+ 2HCl === CaCl2 + H2 O + CO2↑(实验室制法)
15、CaCO3CaO + CO2 ↑
16、CO2 + H2O === H2 CO3(碳酸可以使紫色石蕊溶液变_________)
17、H2 CO3 === H2 O + CO2↑(碳酸的不稳定性)
18、Ca(OH) 2 + CO2 ==== CaCO 3↓+ H2 O(检验CO2)
现象:
七、一氧化碳(物理性质、化学性质)
19、CO + O2 2CO2(火焰呈______色)
20、CO + Fe2 O32Fe + 3CO2 21、CO+ CuO Cu + CO2
22、CH4 + 2O2 CO2 + 2H2 O 23、2H2 + O2 2H2 O
24、C2 H5OH + 3O2 2CO2 + 3H2 O
25、Zn+H2SO4===ZnSO4+H2↑(实验室制氢气)
九年级上册化学方程式总结
化学反应化学方程式反应现象反应现象反应
类型1 红磷在空气中燃烧 4 P + 5 O2 点燃 2 P2O5 红磷在空气中燃烧,产生大量
白烟
化
合
反2 硫在空气中燃烧S + O2 点燃SO2硫在空气中燃烧淡蓝色火焰,
有刺激性气味的气体
硫在氧气中燃烧蓝紫色火焰,有刺激性气味
的气体。
3 铝在氧气中燃烧
4 Al + 3 O2 点燃 2 Al2O3铝在空气中不能燃烧在纯氧中可燃,现象是剧烈燃烧,发出白光,
生成白色固体(Al2O3)
4 碳在空气中燃烧(充分)C + O2点燃CO2碳在氧气中燃烧发出白光,没有火焰在空气
中发出红光
.. . …。
