第九章 氧化还原反应和电化学基础
氧化还原和电化学的基本原理

氧化还原和电化学的基本原理氧化还原反应是化学反应中的一类重要反应,广泛应用于各个领域。
电化学是研究电和化学反应之间的关系的学科。
本文将介绍氧化还原和电化学的基本原理,包括氧化还原反应的定义、特征以及电化学中的重要概念和原理。
一、氧化还原反应的定义与特征氧化还原反应是指反应物中的某个物质从一种氧化态转变为另一种氧化态的过程。
在氧化还原反应中,通常涉及到电子的转移。
其中,氧化是指反应物中的某个物质失去电子,而还原则是指反应物中的另一个物质获得电子。
具体来说,氧化态的特征是原子或离子带有正电荷,而还原态的特征是原子或离子带有负电荷。
氧化还原反应可以通过电子转移、离子转移或原子转移来实现。
氧化还原反应的重要性不言而喻。
在自然界和人类活动中,氧化还原反应广泛存在。
例如,金属的生锈、电池的工作原理、火焰的燃烧等等都是氧化还原反应。
二、电化学的重要概念和基本原理电化学是研究电和化学反应之间的关系的学科。
在电化学中,有几个重要的概念和基本原理需要了解。
1. 电解和电沉积电解是指通过外加电源将电能转化为化学能的过程。
在电解过程中,电流通过电解质溶液,从阳极流向阴极,导致氧化还原反应的发生。
电解质溶液被电流分解成两个反应性离子,其中一个被氧化成阳离子,而另一个则被还原成阴离子。
电沉积是电化学过程中的另一个重要现象。
它是指通过电解,在电极表面生成一个物质的过程。
通常,电流通过电解质溶液中的金属离子,使其在电极上还原成金属,形成电沉积物。
2. 电化学电位电化学电位是评价化学物质在电极上的氧化还原能力的一种物理量。
它反映了电化学反应的方向和强度。
电化学电位由标准电极电位和溶液中的离子活度共同决定。
在电化学中,标准电极电位是指某种物质在标准状态下与标准氢电极之间的电位差。
标准氢电极被规定为标准电位为0的电极。
根据标准电极电位的大小,可以判断物质的氧化还原能力。
3. 电化学电池和电动势电化学电池是将化学能转化为电能的装置。
它由两个电极和电解质溶液组成,电极上发生氧化还原反应,产生电流。
氧化还原反应与电化学

氧化还原反应与电化学氧化还原反应是一种在化学反应中非常重要的类型,它涉及物质的电荷转移和电子流动。
与氧化还原反应密切相关的是电化学,电化学则是研究电荷转移和电流在化学反应中的应用。
本文将探讨氧化还原反应与电化学之间的联系以及它们在现实生活中的应用。
一、氧化还原反应氧化还原反应(简称氧化反应和还原反应)是指物质中原子氧化态和还原态发生变化的过程。
在氧化反应中,物质失去电子并增加氧化态;而在还原反应中,物质获得电子并减少氧化态。
氧化还原反应是一种相互联系的电子流动过程,其中一个物质被氧化,同时另一个物质被还原。
氧化还原反应具有普遍性和广泛性。
它们在自然界和工业生产中都起着非常重要的作用。
例如,许多金属的氧化反应会导致它们产生锈蚀,损失金属的本来特性和价值。
此外,许多生化反应,如呼吸和新陈代谢中产生的能量,也是通过氧化还原反应进行的。
二、电化学基础电化学是研究电荷转移与电流在化学反应中的应用的科学学科。
它探究了氧化还原反应如何与电流和电势相关,并通过控制电流和电势来实现对化学反应的控制和调节。
电化学中的两个重要概念是电解和电池。
电解是一种利用外加电流引起氧化还原反应的过程。
在电解中,阳极发生氧化反应,阴极发生还原反应。
电池是一种将化学能转化为电能的装置,其中氧化还原反应是产生电流的基础。
三、氧化还原反应在电化学中的应用氧化还原反应在电化学中有许多实际应用。
以下是几个常见的例子:1. 腐蚀防护:通过将金属制品镀上一层不易被氧化的物质,例如使用电镀技术将锌镀在铁上,可以防止金属产生氧化反应,减缓腐蚀的速度。
2. 电解水制氢:电解水是一种将水分解为氢气和氧气的反应。
通过将电流通过含水溶液中的两个电极,可以将水分解为氢气和氧气,从而产生可用于能源和化学反应的氢气。
3. 电池技术:电池是一种将化学能转化为电能的设备。
它基于氧化还原反应,通过控制金属离子和氧化物之间的电子传递来产生电流。
电池在我们日常生活中被广泛使用,例如干电池、锂电池和燃料电池。
氧化还原反应和电化学基础

8
⑷ 离子型化合物中,元素的氧化数等于该 ⑸ 离共子价所型带化的合电物荷中数,,共如用:电N子aC对I。偏向于电负性大 的原子 ,两原子的形式电荷数即为它们的氧化数, 如:HCI。 ⑹ 中性分子中,各元素原子氧化数的代数和为9 零。
S4O62- 4x+(-2)×6=-2 x=2.5 H5IO6 I:+7 ; S2O32- S:+2 例:求MnO4-中Mn的氧化值
2×3
0
+5
Zn+ HNO3
+2
+2
Zn(NO3)2+ NO + H2O
3 ×2
56
配系数
先配变价元素,再用观察法配平其 它元素原子的系数。
15
用氧化数表示氧化还原的状态 对于离子化合物的氧化还原反应来说,电 子是完全失去或完全得到的。但是,对于共价化 合物来说,在氧化还原反应中,有电子的偏移, 但还没有完全的失去或得到,因此用氧化数来表 示就更为合理。
16
例如:
H2+Cl2=2HCl 这个反应的生成物是共价化合物,氢原子的电子 没有完全失去,氯原子也没有完全得到电子,只是形成 的电子对偏离氢,偏向氯罢了。用氧化数的升降来表示 就是氯从0到-1,氢从0到+1。这样,氧化数的升高就是 氧化,氧化数的降低就是还原。在氧化还原反应里,一 种元素氧化数升高的数值总是跟另一种元素氧化数降低 的数值相等的。
11
一、氧化值的定义
在氧化还原反应中,电子转移引起某些原子的价 电子层结构发生变化,从而改变了这些原子的带电状 态。为了描述原子带电状态的改变,表明元素被氧化 的程度,提出了氧化态的概念。表示元素氧化态的的 数值称为元素的氧化值,又称氧化数。
无机化学-氧化还原反应及电化学基础

6-3 电池电动势和电极电势
第二十七页,共69页。
6-3 电池电动势和电极电势
E 甘汞参比电极
构成: 由Hg/Hg2Cl2/KCl溶液组成;
2) 电极反响: H 2 C 2 g (s )l 2 e 2 H (l) g 2 C (a l)q 3) 电极电势:
-3,
; E 0.280V
电极符号:Pt2, H H2︱H2 +e(c ) H2PtC , C2l2l (p2 )︱eC l- (2c)Cl
“︱〞表示气体与溶液之间的界面,即气液界面
(p) 表示压力;
第十四页,共69页。
6-2 原电池
2 电极的类型和电池符号:
C 离子电极 组成:由同一种元素的不同氧化态的两种离子的溶液; 例:Fe3+/Fe2+电极
第十九页,共69页。
6-2 原电池
2.2 电池符号:
负极: 离子电极
电池反响:
电M 池符号4 : 8 n H O 5 F 2 e M 2 5 F n 3 4 e H 2 O
(-) Pt︱Fe2+ (c1), Fe3+(c2)‖MnO4+ (c3), H+(c4),Mn2+(c5)︱Pt (+)
和绿色Cr2(SO4)3,配平反响方程;
氧化数确定:
反响物: K2Cr2O7 [+6] FeSO4
[+2]
A
生成物: Cr2(SO4)3 [+3] Fe2(SO4)3 [+3]
每个Cr原子变化数=3
B
每个Fe原子变化数=1
C 总氧化数降低(2x3)x1
D
C 2 O 4 2 r 2 3 F 2 1 e H 4 2 C 3 2 r 3 F 3 7 e H 2 O
无机化学:第九章 氧化还原反应与电化学基础解析

第九章氧化还原反应和电化学基础一、氧化还原反应方程式的配平1、元素的氧化数(氧化值)(中学:化合价)❖定义:氧化数是某一个元素的荷电数,这种荷电数由假设把每个键中的电子数指定给电负性更大的原子而求得。
❖本质:a、离子化合物中,即正、负离子所带的电荷数;b、极性化合物中,即元素的一个原子提供参与共价键的电子数,其中电负性小,共用电子对离得较远的元素为正氧化数,电负性大、共用电子以离得较近的元素为负氧化数。
『①单质的氧化数为0-1;②在配合物中,当自由基或原子团作为配体时,其氧化数均看作 1;2❖定义:凡有电子得失或共用电子对偏移发生的反应。
氧化——失去电子或共用电子对偏离的变化,相应的物质称为“还原剂”;还原——得到电子或共用电子对接近的变化,相应的物质称为“氧化剂”。
❖氧化剂还原剂——氧化还原反应中,失去电子、氧化数升高的物质(发生氧化反应)因此,凡元素氧化数发生变化的过程,就是氧化还原反应!3、氧化还原反应方程式的配平方法与应用(一)氧化数法:适用于任何氧化还原反应❖依据:还原剂氧化数的升高总值 = 氧化剂氧化数降低总值例1:KMnO4 + FeSO4 + H2SO4 ==①根据反应事实,写出反应产物,注意介质酸碱性:KMnO4 + FeSO4 + H2SO4==MnSO4 +Fe2(SO4)3 + K2SO4 + H2O②调整计量系数,使氧化数升高值 = 降低值:+7 +2 +2 +3KMnO4 + 5 FeSO4 + H2SO4==MnSO4 + 5/2 Fe2(SO4)3 + K2SO4 + H2O③若出现分数,可调整为最小正整数:2 KMnO4 +10 FeSO4 + H2SO4==2 MnSO4 + 5 Fe2(SO4)3 + K2SO4 + H2O法2:配平各元素原子数(观察法)——先配平非H、O原子,后配平H、O原子。
①配平K+、SO42-数目 SO42-:左11,应+7;右182 KMnO4 + 10 FeSO4 + 8 H2SO4 ==2 MnSO4 + 5 Fe2(SO4)3 + K2SO4 + H2O②配平H+数目 H+:左2,应 8 H2O2 KMnO4 +10 FeSO4 + 8 H2SO4==2 MnSO4 +5 Fe2(SO4)3 + K2SO4 + 8 H2O③配平(或核对)O原子数目:已平衡。
氧化还原反应电化学基础N
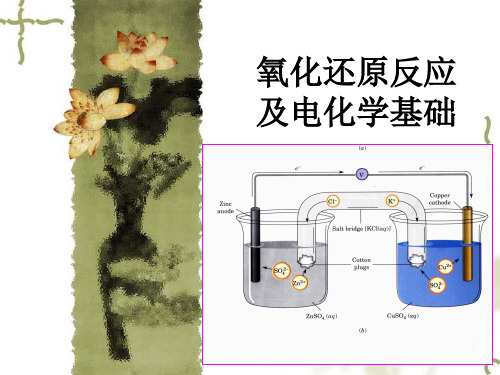
这一反应可在下列装置中分开进行
盐桥:在U型管中装 满用饱和KCl溶液和 琼胶作成的冻胶。 盐桥的作用:使Cl向锌盐方向移动, K+向铜盐方向移动, 使Zn盐和Cu盐溶液 一直保持电中性, 从而使电子不断从 Zn极流向Cu极。
这种装置能将化学能转变为电能,称为原电池。
正极(铜电极): Cu2+ + 2eCu 负极(锌电极): Zn Zn2+ + 2e正、负两极分别发生的 反应,称为电极反应。 电池反应:Zn + Cu2+ = Cu + Zn2+(总反应)
例:
H5I O6 S2 O S4 O
2 3 2 6
I的氧化值为 7 S的氧化值为 2 S的氧化值为 2.5 8 Fe的氧化值为 3
Fe3O 4
2、氧化还原半反应和氧化还原电对
氧化还原反应的方程式可分解成两个“半反应”。 反应中,氧化剂(氧化型)在反应过程中氧化数降 低生成氧化数较低的还原型; 还原剂(还原型)在反应 过程中氧化数升高转化为氧化数较高的氧化型。 由一对氧化型和还原型构成的共轭体系称为氧化还 原电对,可用“氧化型/还原型”表示。
Fe3+
溶液中,另一铂片插入到含有MnO4- 、Mn2+ 及H+ 的溶液
正极反应: MnO4- + 8H+ + 5e- = Mn2+ + 4H2O 电池反应: MnO4- + 8H+ + 5Fe2+ = Mn2+ + 5Fe3+ + 4H2O
电池符号:
(-)Pt|Fe2+(c1),Fe3+(c2)||MnO4-(c3),H+(c4),Mn2+(c5)|Pt (+)
09 第九章 氧化还原反应

化学与材料科学学院
殷焕顺
2.离子--电子法(ion-electron method)
配平原则:整个反应中氧化剂和还原剂得失电子 数相等;反应前后各元素的原子总数相等。
例如:酸性条件下 K2Cr2O7 与KI反应 (1) 写出基本离子反应 (氧化还原产物) Cr2O72- + I- → Cr3+ + I2 (2) 把离子方程式分成氧化和还原两个半反应 氧化半反应:2I- →I2 还原半反应:Cr2O72- → 2Cr3+
化学与材料科学学院
殷焕顺
练习:写出电池符号。 Cu(s)+Cl2(105Pa) = Cu2+(1mol· -1)+Cl-(1mol· -1) L L (-) Cu | Cu2+(1mol/L) || Cl-(1mol/L) | Cl2(105Pa) | Pt (+) 写出原电池的电极反应和电池反应 (-) Pt| H2 (105Pa)| H+(1.0M)||Ag+(1.0 M)|Ag(+) 正极: Ag++e ⇌ Ag(还原反应) 负极: H2 ⇌ 2H+ +2e (氧化反应) 电池反应: 2Ag++H2 ⇌ 2H++2Ag
化学与材料科学学院
殷焕顺
三、氧化还原反应式的配平 (balancing of oxidation-reduction equation ) 两种方法:
氧化数法
(the oxidation number method)
离子——电子法
(ion-electron method)
化学与材料科学学院
殷焕顺
化学与材料科学学院
殷焕顺
从电势看金属活性顺序
电对
K+/ K Ca 2+/Ca Na+/Na Mg2+/Mg Al3+/Al Zn2+/Zn Fe2+/Fe Sn2+/Sn
氧化还原反应及电化学基础

+1,-1 +2,-1
3) 共价化合物中,成键电子对偏向电负性大的元素。
O: -2 (H2O 等);-1 (H2O2); -0.5 (KO2 超氧化钾) H: +1 (一般情况);-1 (CaH2 、NaH)
原电池,在恒温、恒压下,体系自由能降低等于体系所作的最大电功,则:
1) 电池G电=动– 势WmaEx 和 G
③ 盐桥(琼脂 + 强电解质KCl, KNO3等,作用是补充电荷、 维持电荷平衡)
2)电极反应:
正极(Cu): 负极(Zn):
Cu2+ + 2e = Cu Zn- 2e = Zn2+
3)电池反应及电池符号: Zn + Cu2+ = Zn2+ + Cu
(-)Zn | Zn2+ (c1) || Cu2+ (c2) | Cu (+)
历 年代
氧化反应
还原反应
认 识
史 18世纪末
与氧化合
从氧化物夺取氧
不
发 19世纪中 化合价升高
化合价降低
断 深
展 20世纪初
失去电子
得到电子
化
例如: Fe + Cu2+ = Fe2+ + Cu 称为全(总)反应
电子转移
氧化
Fe - 2e
Fe2+
(氧化)半反应
Cu2+ + 2e 还原 Cu (还原)半反应
2)标准电极电势的测定
将待测的标准电极与标准氢电极组成原电池,在 25ºC下,用检流计确定
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
无机化学
第九章 氧化还原反应和电化学基础
1 氧化还原反应方程式的配平
2 电极电势
3 电解及其应用
4 金属的腐蚀与防腐
无机化学
第一节 氧化还原反应方程式的配平
1
氧化数法
2
离子-电子法
无机化学
一、氧化数法
1.氧化数
①离子化合物中,元素的氧化数等于相应的离子电荷数。
②共价化合物中,将共用电子对看作归电负性较大的元 素的原子单独所有,再比照离子化合物确定氧化数。 ③复杂离子中,各元素原子氧化数的代数和等于离子电 荷数。分子中各元素原子氧化数的代数和为零。
相等; ②原子守恒 ③电子守恒
无机化学
二、离子-电子法
2.配平方法
①将反应式中主要反应物、生成物改写成离子符号
②将上述反应分解成两个半反应 ③分别配平两个半反应,使每个半反应两边的各元素 原子数目及电荷数目分别相等。 ④根据得、失电子总数相等的原则,将两个半反应合
并为一个配平的离子反应。
⑤补入合适的阴、阳离子,把离子方程式改成分子方 程式。
无机化学
二、金属的防腐
1.制成耐腐蚀合金
2.隔离法
3.化学处理法 (1)钢铁发蓝 (2)钢铁磷化 4.电化学保护法
5.使用缓蚀剂
无机化学
Thank you
无机化学
3.判断氧化还原反应进行的次序
无机化学
第三节 电解及其应用
1
电解
2
电解的应用
无机化学
一、电解
1.电解原理
无机化学
一、电解
无机化学
一、电解
2.放电次序
无机化学
二、电解的应用
1.电化学工业
以电解的方法制取化工产品的工业称为电化学工业。
无金属化合物中提炼金属的过程称为
电冶金。
无机化学
二、电解的应用
3.电镀
应用电解原理在某些金属制品表面镀上一层其他金
属或合金的过程称为电镀。
无机化学
第四节 金属的腐蚀与防腐
1
金属的腐蚀
2
金属的防腐
无机化学
一、金属的腐蚀
1.化学腐蚀
单纯由化学反应引起的腐蚀称为化学腐蚀。
2.电化学腐蚀 金属与电解质溶液接触发生电化学反应而引起的腐 蚀称为电化学腐蚀。
2.标准电极电势的概念
电极反应有关的离子浓度为
,有关气体压力
为100kPa,温度为25℃这样的状态称标准状态。处于标准 状态的电极称做标准电极,其电极电势称为标准电极电势, 用 表示。
无机化学
二、电极电势
3.标准电极电势的测定
①将待测电极与标准氢电极组成原电池
②测出该原电池的标准电动势 。
③由电流流动方向确定原电池的正、负极。
无机化学
一、氧化数法
2.配平方法
氧化还原反应是有电子转移的反应,也即有元素的
氧化数发生变化的反应。 根据反应前后元素氧化数的变化就可以配平氧化还 原反应,这种配平方法就称氧化数法。 ①氧化数升高的总数与氧化数降低的总数相等
②反应前后各元素的原子总数相等
无机化学
二、离子-电子法
1.配平原则
①反应过程中氧化剂得电子总数与还原剂失电子总数
无机化学
第二节 电极电势
1
原电池
2
电极电势
标准电极电势的应用
3
无机化学
一、原电池
1.原电池的工作原理
无机化学
一、原电池
2.原电池的几个基本概念
(1)半电池
(2)电极 (3)电极反应和电池反应 (4)电对
无机化学
一、原电池
3.原电池符号
无机化学
二、电极电势
1.标准氢电极
无机化学
二、电极电势
无机化学
二、电极电势
4.标准电极电势的意义
标准电极电势值越大,表明标准状态下电对中氧化型
物质的氧化能力越强,对应的还原型物质的还原能力越弱; 反之,值越小,表明电对中氧化型物质的氧化能力越弱, 对应还原型物质的还原能力越强。
无机化学
三、标准电极电势的应用
1.比较氧化剂、还原剂的相对强弱 2.判断氧化还原反应的方向
