禽流感病毒中和实验整理
H9N2亚型禽流感病毒HA蛋白中和抗原表位的分析的开题报告

H9N2亚型禽流感病毒HA蛋白中和抗原表位的分析的开题
报告
题目:H9N2亚型禽流感病毒HA蛋白中和抗原表位的分析
一、研究背景
近年来,H9N2亚型禽流感病毒在全球范围内广泛传播,成为世界范围内一个严
重的家禽和人类健康问题。
由于病毒的高变异性,现有的预防和治疗手段已经无法满
足对病毒的有效控制,因此急需研究H9N2亚型禽流感病毒的中和抗原表位,以帮助
开发有效的疫苗和药物。
二、研究目的
本研究旨在通过分析H9N2亚型禽流感病毒HA蛋白的中和抗原表位,了解
H9N2亚型禽流感病毒在人体免疫系统中诱导中和抗体的机理,为控制和预防H9N2亚型禽流感病毒提供科学依据。
三、研究内容
1. 采集H9N2亚型禽流感病毒HA蛋白样本。
2. 通过Western blotting和ELISA等方法鉴定HA蛋白的免疫原性。
3. 构建HA蛋白的三维结构模型,预测可能的中和抗原表位。
4. 利用生物信息学和功能分析等方法验证中和抗原表位的有效性。
5. 尝试与免疫动物进行免疫实验,观察中和抗体的产生情况。
四、研究意义
本研究将对深入理解H9N2亚型禽流感病毒的免疫学特性和病毒的传播机制等方面具有重要的基础性和应用性意义,为防控病毒的传播和预防病毒感染提供科学支持。
五、研究进展
目前已经采集到了H9N2亚型禽流感病毒HA蛋白的样本,正在进行免疫原性的
鉴定,并进行三维结构模型的构建。
接下来将根据模型预测可能的中和抗原表位,进
一步开展验证和研究工作。
病毒中和试验测定法
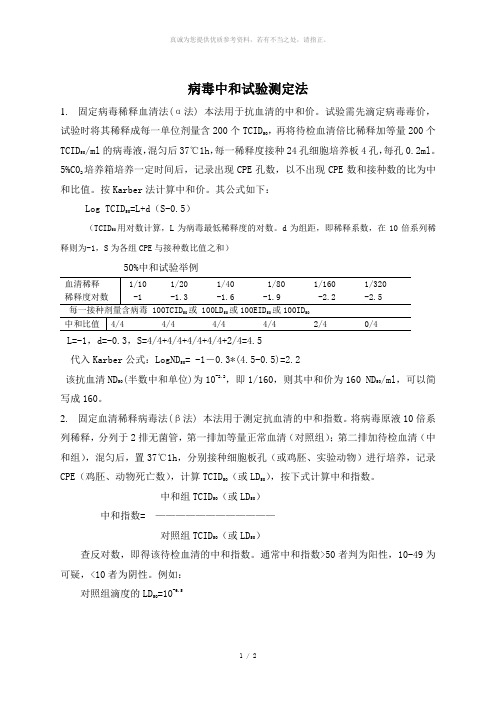
1 / 2病毒中和试验测定法1. 固定病毒稀释血清法(α法) 本法用于抗血清的中和价。
试验需先滴定病毒毒价,试验时将其稀释成每一单位剂量含200个TCID 50,再将待检血清倍比稀释加等量200个TCID 50/ml 的病毒液,混匀后37℃1h ,每一稀释度接种24孔细胞培养板4孔,每孔0.2ml 。
5%C02培养箱培养一定时间后,记录出现CPE 孔数,以不出现CPE 数和接种数的比为中和比值。
按Karber 法计算中和价。
其公式如下:Log TCID 50=L+d (S-0.5)(TCID 50用对数计算,L 为病毒最低稀释度的对数。
d 为组距,即稀释系数,在10倍系列稀释则为-1,S 为各组CPE 与接种数比值之和)50%中和试验举例50505050L=-1,d=-0.3,S=4/4+4/4+4/4+4/4+2/4=4.5代入Karber 公式:LogND 50= -1-0.3*(4.5-0.5)=2.2该抗血清ND 50(半数中和单位)为10-2.2,即1/160,则其中和价为160 ND 50/ml ,可以简写成160。
2. 固定血清稀释病毒法(β法) 本法用于测定抗血清的中和指数。
将病毒原液10倍系列稀释,分列于2排无菌管,第一排加等量正常血清(对照组);第二排加待检血清(中和组),混匀后,置37℃1h ,分别接种细胞板孔(或鸡胚、实验动物)进行培养,记录CPE (鸡胚、动物死亡数),计算TCID 50(或LD 50),按下式计算中和指数。
中和组TCID 50(或LD 50) 中和指数= ———————————— 对照组TCID 50(或LD 50)查反对数,即得该待检血清的中和指数。
通常中和指数>50者判为阳性,10-49为可疑,<10者为阴性。
例如:对照组滴度的LD 50=10-6.5中和组滴度的LD=10-4.550中和指数=10(6.5-4.5)=102.0=100中和指数的对数Log=Log100=2.0一般来说,以10倍稀释进行滴度测定,Log10=1。
禽流感实验室检测技术方案

禽流感实验室检测技术方案禽流感,这个让无数人闻之色变的词汇,已经成为我们生活中无法回避的一部分。
如何快速、准确地检测出禽流感病毒,成为了当务之急。
今天,就让我来为大家详细介绍一下禽流感实验室检测技术方案。
我们需要明确检测的目标。
禽流感病毒有多种亚型,我们要检测的是哪些亚型,需要根据实际情况来确定。
一般来说,H5和H7亚型的禽流感病毒对我国养殖业和公共卫生安全威胁较大,因此,我们将重点检测这两种亚型。
我们要选择合适的检测方法。
目前,实验室检测禽流感病毒的主要方法有病毒分离、血清学检测和分子生物学检测。
病毒分离是传统的检测方法,准确性较高,但操作复杂,耗时较长。
血清学检测通过检测抗体来判断病毒感染情况,速度快,但准确性相对较低。
分子生物学检测,尤其是实时荧光定量PCR技术,具有高灵敏度、高特异性、快速简便等优点,成为近年来禽流感病毒检测的主流方法。
下面,我将详细介绍实时荧光定量PCR技术在禽流感实验室检测中的应用。
一、实验材料1.样本:采集疑似感染禽流感的家禽咽喉拭子、泄殖腔拭子等。
2.试剂:实时荧光定量PCR试剂盒、病毒提取试剂盒等。
3.仪器:实时荧光定量PCR仪、离心机、恒温箱等。
二、实验步骤1.样本处理:将采集的拭子样本放入病毒提取试剂盒中,按照说明书操作,提取病毒RNA。
2.模板制备:将提取的病毒RNA与实时荧光定量PCR试剂盒中的缓冲液、酶混合,进行模板制备。
4.结果分析:观察实时荧光定量PCR仪上的扩增曲线和溶解曲线,判断样本是否为阳性。
三、注意事项1.实验过程中要严格遵循无菌操作原则,防止样本污染。
2.实验室人员要具备一定的分子生物学实验技能,确保实验顺利进行。
3.实验结果要及时记录,并与临床诊断相结合,为疫情防控提供有力支持。
通过实时荧光定量PCR技术,我们可以快速、准确地检测出禽流感病毒,为我国养殖业和公共卫生安全保驾护航。
当然,实验室检测只是禽流感防控工作的一部分,我们还需要加强疫情监测、疫苗接种、生物安全等措施,共同抵御禽流感病毒的侵袭。
禽流感病毒H7N9实验活动风险评估报告

禽流感病毒H7N9实验活动风险评估报告一、生物因子(一)一般特性H7N9禽流感病毒是一种新型禽流感病毒,属于甲型流感病毒中的一种,既往仅在禽间发现,未发生人感染的情况。
2013年3月底在我国上海率先出现全球首例人感染H7N9禽流感病例,并逐渐蔓延至全国多个地区。
H7N9型禽流感已经纳入我国法定传染病监测报告系统,为乙类报告传染病,目前尚未有疫苗推出。
该病毒感染以发热及呼吸道症状为主,目前尚不具备有效的人传染人的特性。
截至2014年2月28日,全球已有实验室确诊病例375例,死亡115例,病例分布于北京、上海、江苏、浙江、安徽、山东、河南、福建等地,以长江三角洲地区为多。
甲型流感病毒根据病毒表面的血凝素(HA)和神经氨酸酶(NA)的差异可以分为多个亚型,HA可分为16个亚型,NA可分为9个亚型。
禽流感病毒中H3、H5、H7、H9亚型可以传染给人。
由于2013年3月底才出现人感染H7N9禽流感病例,因此对这个病毒的生物学特点、致病力、传播力,还没有足够充分的依据进行分析判断,对其实验操作的风险评估参照以往人感染高致病性H5N1禽流感病毒的风险评估进行。
(二)来源甲型流感病毒除感染禽外,还可感染人、猪、马、水貂和海洋哺乳动物。
可感染人的禽流感病毒亚型为H5N1、H7N9、H9N2、H7N7、H7N2、H7N3。
此次发现的人感染H7N9禽流感病毒为一种新型重配的禽流感病毒,其内部基因来自于H9N2禽流感病毒。
2013年4月初,中国科学院病原微生物与免疫学重点实验室对H7N9禽流感病毒进行基因溯源研究显示,H7N9禽流感病毒基因来自于东亚地区野鸟和中国上海、浙江、江苏鸡群的基因重配,而病毒自身基因变异可能是H7N9型禽流感病毒感染人并导致高死亡率的原因。
研究结果初步显示,H7N9禽流感病毒暂未发现在猪群中的进化痕迹,提示猪在这次病毒基因重配中未发挥中间宿主的作用。
研究人员表示,H7N9禽流感病毒的8个基因片段中,H7片段与浙江鸭群中分离的禽流感病毒相似,对浙江鸭群中的病毒再进行追溯,与东亚地区野鸟中分离的禽流感病毒基因相似;N9片段与东亚地区野鸟中分离的禽流感病毒相似。
禽流感灭杀实验报告(3篇)

第1篇一、实验目的本实验旨在探究不同消毒剂对禽流感病毒的灭杀效果,为禽流感的防控提供科学依据。
二、实验材料1. 实验动物:鸡胚(10日龄)2. 实验病毒:禽流感病毒(H5N1)3. 消毒剂:甲醛、次氯酸钠、酚类消毒剂、氧化剂、碱类消毒剂4. 实验器材:高压灭菌锅、无菌操作台、显微镜、培养皿、移液器、消毒液、无菌水等三、实验方法1. 禽流感病毒悬液的制备将禽流感病毒接种于鸡胚,培养至10日龄,收集病毒悬液,经1000倍稀释后备用。
2. 消毒剂配制根据不同消毒剂的浓度要求,配制相应浓度的消毒液。
3. 消毒效果实验将制备好的禽流感病毒悬液分别与不同浓度的消毒剂混合,置于37℃恒温箱中处理30分钟。
处理后,将混合液接种于鸡胚,观察鸡胚的死亡情况。
4. 数据分析根据鸡胚的死亡情况,计算不同消毒剂的灭杀率,并进行统计分析。
四、实验结果1. 甲醛消毒剂甲醛消毒剂对禽流感病毒的灭杀效果显著,不同浓度下,病毒灭杀率均在90%以上。
2. 次氯酸钠消毒剂次氯酸钠消毒剂对禽流感病毒的灭杀效果较好,不同浓度下,病毒灭杀率均在80%以上。
3. 酚类消毒剂酚类消毒剂对禽流感病毒的灭杀效果一般,不同浓度下,病毒灭杀率在60%左右。
4. 氧化剂消毒剂氧化剂消毒剂对禽流感病毒的灭杀效果较好,不同浓度下,病毒灭杀率在70%以上。
5. 碱类消毒剂碱类消毒剂对禽流感病毒的灭杀效果较好,不同浓度下,病毒灭杀率在80%以上。
五、讨论本实验结果表明,甲醛、次氯酸钠、氧化剂和碱类消毒剂对禽流感病毒具有较强的灭杀效果,可作为禽流感防控过程中的消毒剂选择。
酚类消毒剂灭杀效果较差,不建议使用。
六、结论1. 甲醛、次氯酸钠、氧化剂和碱类消毒剂对禽流感病毒具有较强的灭杀效果,可用于禽流感防控过程中的消毒。
2. 实验结果为禽流感防控提供了科学依据,有助于提高禽流感防控效果。
3. 在实际应用中,应根据具体情况选择合适的消毒剂,并严格按照操作规程进行消毒,以确保消毒效果。
禽流感病毒中和实验整理

禽流感病毒中和实验及其他方法(一)实验材料1、中和反应实验材料(1)病毒:)的滴定。
一般为鸡胚尿囊病毒液,进行中和实验前,需要进行病毒滴度(TCID50(2)血清样品包括待检血清和阳性以及阴性对照血清。
人血清实验前需要56℃ 30分钟灭活,动物血清需RDE处理。
-20℃储存,避免多次反复冻融。
(3)MDCK细胞和细胞培养试剂1)MDCK细胞(狗肾上皮细胞)2)MDCK细胞培养液:DMEM+5%牛血清+抗生素,过滤除菌500毫升 DMEM(修饰的Eagles培养基)5.5毫升 100×抗生素(100单位/毫升青霉素+100微克/毫升链霉素)5.5毫升 100×L-Glutamine(2毫摩尔)25.5毫升 56℃、30分钟加热灭活的牛血清3)胰酶 / EDTA(4)其它1)平底96孔微量培养板2)病毒稀释液:DMEM+1%牛血清白蛋白+抗生素,即配即用。
429毫升 DMEM66毫升 7.5%牛血清白蛋白(BSA)5毫升 100×抗生素3)TPCK-胰酶(使用浓度为2微克/毫升)4)固定液:80%的丙酮,即配即用,4℃保存400毫升丙酮100毫升 PBS,PH 7.22、ELISA实验材料(1)抗体1:鼠抗流感病毒甲型核蛋白克隆抗体(2)抗体2:辣根过氧化物酶标记的羊抗鼠IgG(3)洗涤液:PBS+0.05%TWEEN-204升 PBS,PH 7.22毫升 TWEEN-20(4)封闭液:PBS+1%牛血清白蛋白+0.05%TWEEN-20867毫升PBS,PH 7.2132毫升牛血清白蛋白1毫升TWEEN-20(5)底物和底物溶液:常用的辣根过氧化物酶(HRP)所用底物为磷苯二胺(OPD)底物溶液为PH5.0磷酸盐-柠檬酸缓冲液(0.05M)底物和底物溶液:10毫克OPD20毫升柠檬酸缓冲液(含0.015%双氧水)即配即用磷酸盐-柠檬酸缓冲液,PH5.058.8克柠檬酸三钠1升蒸馏水用盐酸调节PH为5.0加0.015%双氧水,(临用前加入)* 如果使用磷酸盐-柠檬酸缓冲液胶囊(Sigma)1个胶囊加入100毫升蒸馏水,临用前配制(6)终止反应液:1N硫酸(28毫升浓硫酸+1升蒸馏水)3、其他细胞培养和酶联免役吸附实验的常用设备和仪器(参照英文讲义)备注:A.以上实验材料购自Gibco,,Hyclone,Dynatech,Kirkegaard&Perry和Sigma 公司,材料编号(CAT#)参照英文讲义。
标准操作规程(SOP)——流感禽流感微量中和抗体检测

标准操作规程(SOP)——一、目的微量中和试验是一种敏感性高、特异性强的血清学方法,用于测定血清中的病毒特异性中和抗体水平。
中国国家流感中心的所有技术人员,必须按照本文件相关的操作规程,进行流感/禽流感微量中和抗体检测实验,以确保实验的准确性。
二、范围适用于中国国家流感中心的所有技术人员进行流感/禽流感微量中和抗体检测。
三、责任进行流感/禽流感微量中和抗体检测的技术人员需严格按照规定进行操作。
四、程序(一)生物安全要求H5,H7亚型高致病性禽流感病毒,H2N2亚型流感病毒的操作需要在生物安全3级(BSL-3)实验室中进行。
其余流感病毒的操作需要在生物安全2级(BSL-2级)实验室中进行。
操作人员必须严格按照相应实验室的要求做好个人防护。
(二)材料1.中和反应实验材料(1)病毒:一般采用接种鸡胚尿囊腔后收获的流感/禽流感病毒液,在-70℃中保存,并且注意避免反复冻融。
进行中和试验之前,需先进行病毒滴度(TCID50)的滴定。
具体步骤如下,1)病毒的稀释:可采取对数或者半对数稀释的方法。
以下介绍半对数稀释法。
取1管冻存病毒尿囊液,用病毒培养液进行1:100稀释。
第一列4个孔每孔加入146μL 1:100稀释过的病毒液,其它各列每孔加入100 μL 病毒培养液。
然后用多道加样器从第一孔吸46μL 至第二孔,做系列半对数稀释,使之成为10-2、10-2.5、10-3、10-3.5……10-7。
每孔含有100μL 病毒液。
2)每孔加入100μL MDCK 细胞悬液(1.5×104细胞/孔),37℃,5%CO 2培养箱孵育18~22h 。
每一滴度作平行4孔。
3)细胞固定、ELISA 操作如下述。
4)OD 值 〉2倍MDCK 细胞对照OD 值判定为阳性5)病毒滴度计算见组织细胞半数感染量滴定SOP 。
(2)血清样品:包括待检血清、阳性及阴性血清对照。
如果待检血清有可能需要多次检测,则需将待检血清进行小量分装,-20℃至-70℃保存均可,避免多次反复冻融。
中和试验

中和试验中和试验是病毒或毒素与相应的抗体结合后,失去对易感动物的致病力的试验方法。
所属分类:免疫学概述动物受到病毒感染后,体内产生特异性中和抗体,并与相应的病毒粒子呈现特异性结合,因而阻止病毒对敏感细胞的吸附,或抑制其侵入,使病毒失去感染能力。
中和试验(Neutralization Test)是以测定病毒的感染力为基础,以比较病毒受免疫血清中和后的残存感染力为依据,来判定免疫血清中和病毒的能力。
两种试验方法介绍中和试验常用的有两种方法:一种是固定病毒量与等量系列倍比稀释的血清混合,另一种是固定血清用量与等量系列对数稀释(即十倍递次稀释)的病毒混合。
(一) 定血清-稀释病毒法(病毒中和试验)1.病毒毒价的测定毒价单位:衡量病毒毒价(毒力)的单位过去多用最小致死量(MLD),即经规定的途径,以不同的剂量接种试验动物,在一定时间内能致全组试验动物死亡的最小剂量。
但由于剂量的递增与死亡率递增不呈线性关系,在越接近100%死亡时,对剂量的递增越不敏感。
而一般在死亡率越接近50%时,对剂量的变化越敏感,故现多改用半数致死量(LD50)作为毒价测定单位,即经规定的途径,以不同的剂量接种试验动物,在一定时间内能致半数试验动物死亡的剂量。
用鸡胚测定时,毒价单位为鸡胚半数致死量(ELD50)或鸡胚半数感染量(EID50)。
用细胞培养测定时,用组织细胞半数感染量(TCID50)。
在测定疫苗的免疫性能时,则用半数免疫量(IMD50)或半数保护量(PD50)。
(1) LD50的测定(以流行性乙型脑炎病毒为例)。
测定方法:将接种病毒,并已发病濒死的小鼠,无菌法取脑组织,称重、加稀释液充分研磨,配制成10-1悬液,3 000r/min离心20分钟,取上清液,以10倍递次稀释成10、10、10……10,每个稀释度分别接种5只小鼠,每只脑内注射0.03ml,逐日观察记录各组的死亡数。
本例高于50%病毒稀释度的对数-6,距离比例为0.5,称释系数的对数为-1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
禽流感病毒中和实验及其他方法(一)实验材料1、中和反应实验材料(1)病毒:)的滴定。
一般为鸡胚尿囊病毒液,进行中和实验前,需要进行病毒滴度(TCID50(2)血清样品包括待检血清和阳性以及阴性对照血清。
人血清实验前需要56℃ 30分钟灭活,动物血清需RDE处理。
-20℃储存,避免多次反复冻融。
(3)MDCK细胞和细胞培养试剂1)MDCK细胞(狗肾上皮细胞)2)MDCK细胞培养液:DMEM+5%牛血清+抗生素,过滤除菌500毫升 DMEM(修饰的Eagles培养基)5.5毫升 100×抗生素(100单位/毫升青霉素+100微克/毫升链霉素)5.5毫升 100×L-Glutamine(2毫摩尔)25.5毫升 56℃、30分钟加热灭活的牛血清3)胰酶 / EDTA(4)其它1)平底96孔微量培养板2)病毒稀释液:DMEM+1%牛血清白蛋白+抗生素,即配即用。
429毫升 DMEM66毫升 7.5%牛血清白蛋白(BSA)5毫升 100×抗生素3)TPCK-胰酶(使用浓度为2微克/毫升)4)固定液:80%的丙酮,即配即用,4℃保存400毫升丙酮100毫升 PBS,PH 7.22、ELISA实验材料(1)抗体1:鼠抗流感病毒甲型核蛋白克隆抗体(2)抗体2:辣根过氧化物酶标记的羊抗鼠IgG(3)洗涤液:PBS+0.05%TWEEN-204升 PBS,PH 7.22毫升 TWEEN-20(4)封闭液:PBS+1%牛血清白蛋白+0.05%TWEEN-20867毫升PBS,PH 7.2132毫升牛血清白蛋白1毫升TWEEN-20(5)底物和底物溶液:常用的辣根过氧化物酶(HRP)所用底物为磷苯二胺(OPD)底物溶液为PH5.0磷酸盐-柠檬酸缓冲液(0.05M)底物和底物溶液:10毫克OPD20毫升柠檬酸缓冲液(含0.015%双氧水)即配即用磷酸盐-柠檬酸缓冲液,PH5.058.8克柠檬酸三钠1升蒸馏水用盐酸调节PH为5.0加0.015%双氧水,(临用前加入)* 如果使用磷酸盐-柠檬酸缓冲液胶囊(Sigma)1个胶囊加入100毫升蒸馏水,临用前配制(6)终止反应液:1N硫酸(28毫升浓硫酸+1升蒸馏水)3、其他细胞培养和酶联免役吸附实验的常用设备和仪器(参照英文讲义)备注:A.以上实验材料购自Gibco,,Hyclone,Dynatech,Kirkegaard&Perry和Sigma 公司,材料编号(CAT#)参照英文讲义。
B.实验材料的配制,例如0.25%的胰酶等,请参照黄桢祥主编的医学病毒学基础及实验技术一书。
(二)质量控制病毒中和实验技术是一个相当复杂的过程,参与中和反应的因素有病毒、抗血清和宿主细胞。
这些因素的变化都会影响中和实验的结果。
因此,对中和实验的整个过程进行严格的质量控制。
每次测定必须设立阳性和阴性血清对照,阳性和阴性细胞对照,以及对病毒使用剂量进行滴定。
1、血清对照血清对照包括人或动物血清阳性和阴性对照。
即血清中含有(阳性对照)或不含有(阴性对照)对测定病毒特异性的中和抗体。
血清对照一般分装成多份,-20℃保存,并避免反复冻融使用。
(1)阴性血清对照1)动物血清一般来自未免疫或未感染动物,即与待检血清同种动物的正常血清。
2)人血清一般来自与待检血清年龄相同的正常人群,该人群未曾暴露于待检病毒。
3)测定过程中,阴性对照血清与待检血清应处于相同稀释水平。
(2)阳性血清对照1)动物血清一般来自免疫后或感染后动物。
2)人血清一般采用急性期和恢复期双份血清做对照。
* 人血清使用前须经加热灭活处理,动物血清则须经霍乱滤液RDE(即受体破坏酶)处理,以排除非特异性反应因素。
2、病毒和细胞对照每次实验必须设立阳性和阴性细胞对照,以及对加入病毒工作液进行滴定检查,以便获得准确可靠的实验结果。
(1)阳性和阴性细胞对照一般设立4个重复孔为阳性细胞对照,即将细胞与100倍组织细胞半数感染剂量(100TCID)的病毒进行混合培养。
同时设立4个孔为阴性细胞对照,即将细胞与病50毒稀释液进行混合培养。
阳性细胞对照:50微升病毒稀释液+50微升病毒+100微升MDCK细胞。
阴性细胞对照:100微升病毒稀释液+100微升MDCK细胞(2)病毒工作液滴度检查的100微升病毒液,然后进行2倍稀释,再与MDCK 一般第1孔加入含有200TCID50细胞进行混合培养。
)病毒滴度检查:50微升2倍系列稀释病毒液(第1孔为100TCID50 +50微升病毒稀释液+100微升MDCK细胞(1.5×104细胞/孔)(三)实验步骤1、病毒滴度测定(组织培养半数感染量-TCID滴定)50(1)流感病毒制备利用鸡胚尿囊腔接种法制备流感病毒,收获尿囊液,血凝实验测定病毒的存在,分装后-70℃冻存。
(2)病毒的稀释1)取1管冻存病毒尿囊液,1:100稀释(100微升病毒液+9.9毫升稀释液)2)第1排孔加入146微升1:100稀释过的病毒液,然后做系列半对数稀释,使之成10-2、10-2.5、10-3、10-3.5……10-7。
每孔含100微升病毒液,每个稀释度重复4孔,详细操作参见图1。
* 人流感病毒一般在胰酶存在的条件下才能感染MDCK细胞,因此病毒稀释液中需加入2微克/毫升的TPCK-胰酶。
某些毒性很高的禽流感病毒在无胰酶存在的条件下即可感染MDCK细胞,因此在测定新病毒滴度时,最好配制含有和不含有胰酶的两种稀释液,以获得最佳结果。
(3)MDCK细胞的准备1)使用前2天将MDCK细胞1:100传代,使之70~90%成片,处于对数生长期的细胞对病毒具有最大的敏感性,细胞过度生长以及代数太高(大于30代)将使细胞对病毒的敏感性降低。
2)弃去细胞培养液,用5毫升胰酶 / EDTA洗细胞一次,然后弃去。
温箱中消3)加4到5毫升胰酶 / EDTA覆盖细胞(162cm2的细胞培养瓶)37℃ 5%CO2化10~20分钟。
4)待细胞开始脱落时,加5~10毫升MDCK细胞培养液,吹打分散细胞,并将细胞转入离心管中,用PBS洗2次,以去除牛血清。
5)将细胞悬浮于病毒稀释液中,用1毫升吸管充分吹打分散细胞,在细胞计数板上计数细胞数量。
6)用病毒稀释液将细胞稀释成1.5×105细胞/毫升。
7)加100微升细胞(1.5×104细胞/孔)于已稀释好病毒的微量细胞培养板中。
温箱中培养18-22小时。
8)在37℃ 5%CO2(4)测定组织细胞半数感染剂量(TCID50)1)弃去微量培养板中的细胞液,250微升PBS洗细胞一次。
2)弃去PBS(不要让细胞干燥),加入100微升/孔固定液。
3)覆盖微量培养板,于室温固定细胞10分钟。
4)弃去固定液,让微量培养板室温干燥。
5)用ELISA检测细胞感染(参见ELISA部分)6)利用ELISA检测仪,于490纳米波长,测定每孔吸光度(OD)值,计数细胞阴性对照孔的平均OD值。
7)若含有不同稀释度病毒孔平均OD值是细胞阴性对照孔平均OD值的2倍以上,则判断为病毒生长阳性。
/100微升(参见附8)根据Reed和Muench方法对病毒滴度进行计算,最终获得TCID50录和表2)。
流感病毒。
9)在进行中和实验前,稀释病毒液,使之50微升中含有100TCID502、病毒微量中和实验(1)待检血清的准备和稀释1)检测对一种病毒的中和抗体需要10微升血清,每份血清需要进行至少1次重复测定(共需至少20微升血清/每种病毒),每块板可检测11份样品。
2)人血清需56℃加热灭活30分钟。
3)实验设计请参照图2。
4)每孔中加入50微升病毒稀释液。
5)第1排中(A1-A11)再加入40微升病毒稀释液,使之成为90微升/孔。
6)加入10微升待检血清于第1排A1-A11。
7)将待检血清作系列倍比稀释(A-H)使之成为1:10、1:20、1:40……1:1280。
(2)病毒的准备/50微升。
根据病毒特性选择是否在病毒稀释液中加入TPCK 1)稀释病毒至100TCID50胰酶(大约5毫升/每板)。
2)除细胞阴性对照孔(4孔)外,每孔加入50微升病毒工作液。
3)加50微升病毒稀释液于细胞阴性对照孔。
4)选择1列孔做病毒工作液滴度核实。
第1孔加入200TCID/100微升病毒工作液,50做系列倍比稀释,使之成100TCID50,50,25,12,6……0.7。
然后每孔加入50微升病毒稀释液,使体积至100微升/孔。
5)摇匀病毒-血清混合物,放37℃温箱作用2小时。
(3)MDCK细胞的准备。
(参见病毒滴定测定部分)加100微升细胞液(1.5×104细胞/孔)于含有病毒-血清混合物以及倍比稀释病毒工作液的微量板中,37℃温箱孵育18-22小时。
* 当测定大量样品时,每叠培养板一般不超过4-5块,各叠板之间要保持一定距离,以确保混合物受热均匀,从而达到良好的中和效果。
(4)细胞的固定1)弃去微量培养板中的细胞液。
2)250微升PBS洗细胞一次。
3)弃去PBS(不要让细胞干燥),加入100微升/孔固定液。
4)覆盖微量培养板,于室温固定细胞10分钟。
5)弃去固定液,让微量培养板室温干燥。
3、酶联免疫吸附实验(ELISA)ELISA的基本原理是:酶结合物与相应抗体或抗原特异性结合,再遇酶底物时,在酶的强烈催化下使原来无色的底物产生化学反应,即形成有色的产物,便可用肉眼或分光光度计定量检测其含量。
该方法具有特异性、敏感性、快速性和简易性等优点。
在流感病毒微量中和实验中,酶结合物(HRP标记的羊抗鼠IgG抗体)与存在于MDCK细胞膜上的病毒核蛋白抗原-核蛋白单克隆抗体复合物结合,HRP酶催化OPD,使无色底物形成橙黄色化合物,再由ELISA检测仪测定吸光度值,从而获得中和抗体滴度。
(1)实验操作1)用250微升PBS洗涤微量培养板3次,以去除残余的丙酮。
2)用封闭液1:4000(或最佳稀释度)稀释抗体1(抗流感病毒核蛋白-NP单克隆抗体)3)每孔加入稀释后的100微升抗体1,室温作用1小时。
4)用250微升洗涤液洗板4次以除去抗体1。
5)用封闭液1:2000(或最佳稀释度)稀释抗体2(HRP标记的羊抗鼠IgG)。
6)每孔加入稀释后的100微升抗体2,室温作用1小时。
7)用250微升洗涤液洗涤板6次以除区抗体2。
8)每孔加OPD底物100微升(10毫升OPD+20毫升柠檬酸缓冲液+10微升30%双氧水,即用即配)。
9)室温放10分钟左右显色,直至细胞阳性对照孔变橙黄色,而细胞阴性对照孔尚未变色时,每孔加1M硫酸100微升终止反应。
10)在ELISA测定仪上(490纳米)读出每孔OD值。
(2)结果判定下列公式用于判定中和反应结果(细胞阳性对照平均OD值—细胞阴性对照平均OD值)/2+细胞阴性对照平均OD值=XX=细胞半数感染阈值,每孔OD值低于X值时,判定为中和反应阳性,中和反应阳性的血清最高稀释度即为血清中的和抗体滴度。
