《氧化还原反应》课件
合集下载
氧化还原反应ppt课件

根据下列反应判断有关物质还原性强弱的顺序 A
H2SO3 + I2 + H2O === 2HI + H2SO4
2FeCl3 + 2HI === 2FeCl2 + 2HCl + I2 A.H2SO3 > I- > Fe2+ B.I- > Fe2+ > H2SO3 C.Fe2+ > I- > H2SO3 D.Fe2+ > H2SO3 >I-
电子的得失、共用电子对的偏移
氧化反应 还原反应 二者关系
元素化合价
电子的转移
升高
失电子(偏离)
降低
得电子(偏向)
二者是同时进行的
1.下列变化过程中,元素失去电子的是( D )
A.MnO2 → Mn2+
B.CuO → CuCl2
C.Ag+ → Ag2O
D.Sn2+ → Sn4+
2.下列说法正确的是( D ) A.有得、失氧的反应才是氧化还原反应 B.氧化还原反应中,氧化反应与还原反应是先后进行的 C.有电子得失的反应才是氧化还原反应 D.凡是有化合价升降的反应,都是氧化还原反应
高温
C + H2O ===== H2 + CO
CuO + H2 ==== Cu + H2O
物质 CuO
C H2O
C CuO H2
氧化(还原)反应 还原 氧化 还原 氧化 还原 氧化
化合价变化 降低 升高 降低 升高 降低 升高
化合价升高 —— 氧化反应
化合价降低 —— 还原反应
化合价升高,发生氧化反应
Zn + 2HCl ==== ZnCl2 + H2↑
化合价
得失电子
《氧化还原反应》》PPT课件

精选ppt
8
第5讲 氧化还原反应
❖考 向 互 动
探究•
还原剂失去电子被氧化后
5.氧化产氧物化剂、得还到原电子产被物还原后
•
氧化产物是得指到
______________失_去_________的生成物。
• 还原产物是指
________________________的生成物。
• 6.氧化性、还原性
• 氧化性是指物质________电子的性质。
被还原为 Mn2+。浓硫酸,一般被还原为 SO2。浓硝酸一般被还
原为 NO2。Fe3+被还原为 Fe2+。
③过氧化物:如 H2O2,一般被还原为水。
(2)常见还原剂
①活泼的金属单质:如 K、Na、Mg、Al 等。
②非金属离子及低价态化合物:S2-、H2S、I-、SO2、SO23-
等。
③低价阳离子:Fe2+、Cu+等。
❖考
向 (4)依据反应的条件及反应的剧烈程度
互 动 探
反应条件要求越低,反应越剧烈,对应物质的氧化性或 还原性越强,如是否加热、反应温度高低、有无催化剂和反
究 应物浓度大小等。
例如:
第5讲 氧化还原反应
❖考
向 (5)依据氧化还原的程度
互 动 探
相同条件下: ①不同氧化剂作用于同一种还原剂,氧化产物价态高的
❖考 向 互 动 探 究
❖典 型
第5讲 氧化还原反应
易
错
必
纠
❖教 师 备 用 习 题
考纲要求
1.了解氧化还原反应的本质是电子的转移。 2.了解常见的氧化还原反应,能判断反应中的氧化剂、 还原剂、氧化产物、还原产物。 3.能判断氧化还原反应中电子转移的方向和数目。 4.掌握物质氧化性、还原性强弱的比较方法。 5.能运用原子守恒、得失电子守恒、电荷守恒,进行 氧化还原反应的有关计算。
人教版化学必修一氧化还原反应ppt33张课件
单质还原性逐渐减弱:K>Ca>Na>Mg>Al>Zn>Fe…
2.元素处于最低价态时,只能做还原剂:Cl-、S2-、I- 元素处于最高价态时,只能做氧化剂:KMnO4、 FeCl3、H2SO4、HNO3
阳离子氧化性逐渐增强: K+<Ca2+<Na+<Mg2+<Al3+<Zn2+<Fe 2+…
3.归中规律 同种元素不同价态间发生氧坏反应时,高价+ 低价 中间价态,即“只靠拢,不交叉。”
例:在KClO3+6HCl(浓)===KCl+3Cl2+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为 。
3、这是从电子得失的角度看(也是氧化还原反应的实质):
因此,有电子转移(得失或电子对偏移)的反应都是氧化还原反应。
Fe + 2HCl = FeCl2 + H2 ↑
2e-
CH4 + 2O2 = CO2 + 2H2O
8e-
-4 0 +4 -2
0 +1 +2 0
有单质参加的
有单质生成的
三、氧还反应中电子转移的表示方法
1.双线桥法:
(1)标出反应中化合价发生变化的元素的化合价,判断其升降。
(2)画线条,箭头由反应物指向生成物中同种元素。
(3)在桥上标明电子“得”“失”电子,同时用a×b e-形式表示得、失电子数。 a—得、失电子的原子总数 b—每个原子得失电子数(a,b为1时可省略)
如: 2Fe+3Cl2 =2FeCl3 Fe+S= FeS 则氧化性:Cl2 > S
氧化还原反应ppt课件

失2C氧u物O质+ CC高=u温O2C、u +Fe2COO32
Fe2O3 +还3 C原O反=高应温2Fe + 3 CO2
氧化反应和还原反应是同时发生的,这样的反应称为氧化还原反应。
2CuO + C 高==温= 2Cu + CO2↑ 失去氧,被还原,发生还原反应
CuO 还原反应 Cu O
Fe2O3 + 3CO ==高=温 2Fe + 3CO2
练习:以上面的双线桥表示形式为例,对下面的反应进
行双线桥分析: (1)Zn + 2HCl = ZnCl2 + H2↑
失去1x2e-,化合价升高,被氧化,发生氧化反应
0 +1
Zn + 2HCl
+2
0
= ZnCl2 + H2↑
得到2×1e-,化合价降低,被还原, 发生还原反应
典例 〔变式训练 2〕根据下列两个氧化还原反应回答问题: ①2KClO3=M=△n=O==2 2KCl+3O2↑ ②MnO2+4HCl(浓)==△===MnCl2+Cl2↑+2H2O
NaCl+H2SO4==Na2SO4+2HCl
人教版必修第一册
网第一章 物质及其变化
科
第三节 氧化还原反应 1.3.1 氧化还原反应
学
钢铁会生锈
食物会腐败
都因为发生了氧化还原反应
补充维生素为何能延缓皮肤老化?
1.从得失氧角度认识氧化还原反应
物质
反应物
发生的反应(氧化反应或还氧反应) 已学知识
(1得)氧请物根质据初中C学、过的CO氧化反应和还氧反应的知识氧,分化析反以应下反应,完成下表。
根据是否有 化合价变化
氧化还原反应 非氧化还原反应
氧化还原反应-ppt课件

第三节 氧 化 还 原 反 应
第一课时 氧化还原反应
【学习目标】
1.理解氧化还原反应的特征,学会识别和判断氧化还原反应。 2.从微观角度理解氧化还原的本质,建立氧化还原反应的认知模型。 (重难点)
一些常见元素化合价口诀 正一氢氨钾钠银,正二钙钡和镁锌。 三铝四硅五价磷,二三铁,二四碳。 二四六硫都齐全,铜汞二价最常见
3.从电子转移的角度认识氧化还原反应 ①对于金属与非金属的反应:2Na Cl2
+
2NaCl
+11 2 8 1
Na
Cl
7 8 2 +17
-e-
钠离子带正电荷
氯离子带负电荷
+ e-
+11 2 8 Na+
Na+ Cl-
8 8 2 +17
Cl化合价升降的原因——电子得失
② 对于非金属与非金属的反应
化合价升降原因: 共用电子对的偏移
Cl2+H2O=HCl+HClO
小结:
失电子 化合价升高
被氧化
得电子 化合价降低
被还原
(本质判据) (特征判据)
氧化反应 还原反应
规律:升、失、氧;降、得、还
问题1 氧化还原反应是否一定要有氧的参与?
Fe+CuSO4
Cu+FeSO4
氧化还原反应的特征现象:
问题2 问题3
反应前后元素化合价发生变化。 ——判断依据
有单质参加或生成的化学反应一定是氧化还原反应吗?
3O2
2O3
在氧化还原反应中一种元素被氧化,则一定有另一种元素被还 原,这句话对吗?
ቤተ መጻሕፍቲ ባይዱ
不对,可以是同一种元素既被氧化、又还原。
一、氧化还原反应
第一课时 氧化还原反应
【学习目标】
1.理解氧化还原反应的特征,学会识别和判断氧化还原反应。 2.从微观角度理解氧化还原的本质,建立氧化还原反应的认知模型。 (重难点)
一些常见元素化合价口诀 正一氢氨钾钠银,正二钙钡和镁锌。 三铝四硅五价磷,二三铁,二四碳。 二四六硫都齐全,铜汞二价最常见
3.从电子转移的角度认识氧化还原反应 ①对于金属与非金属的反应:2Na Cl2
+
2NaCl
+11 2 8 1
Na
Cl
7 8 2 +17
-e-
钠离子带正电荷
氯离子带负电荷
+ e-
+11 2 8 Na+
Na+ Cl-
8 8 2 +17
Cl化合价升降的原因——电子得失
② 对于非金属与非金属的反应
化合价升降原因: 共用电子对的偏移
Cl2+H2O=HCl+HClO
小结:
失电子 化合价升高
被氧化
得电子 化合价降低
被还原
(本质判据) (特征判据)
氧化反应 还原反应
规律:升、失、氧;降、得、还
问题1 氧化还原反应是否一定要有氧的参与?
Fe+CuSO4
Cu+FeSO4
氧化还原反应的特征现象:
问题2 问题3
反应前后元素化合价发生变化。 ——判断依据
有单质参加或生成的化学反应一定是氧化还原反应吗?
3O2
2O3
在氧化还原反应中一种元素被氧化,则一定有另一种元素被还 原,这句话对吗?
ቤተ መጻሕፍቲ ባይዱ
不对,可以是同一种元素既被氧化、又还原。
一、氧化还原反应
《氧化还原反应》PPT课件(完美版)

应属于氧化还原反应,但不属于四种基本反应类型中的
任何一种。
《 氧 化 还 原 反应》 PPT课件
《 氧 化 还 原 反应》 PPT课件
(2)有单质参加或生成的反应一定是氧化还原反应吗?
提示:不一定。反应3O2
2O3中有单质参加或生
成,但元素的化合价没有变化,不属于氧化还原反应。
《 氧 化 还 原 反应》 PPT课件
《 氧 化 还 原 反应》 PPT课件
《 氧 化 还 原 反应》 PPT课件
2.文字表述
(1)置换反应_一__定__是氧化还原反应。(填“一定”“不 一定”或“一定不”,下同) (2)复分解反应__一__定__不___是氧化还原反应。 (3)化合反应和分解反应_不__一__定__是氧化还原反应。 ①有单质参加的化合反应_一__定__是氧化还原反应。
(4)Na2O+H2O====2NaOH属于氧化还原反应。( ) 提示:×。此反应中各元素的化合价均没有发生变化,因 此为非氧化还原反应。
《 氧 化 还 原 反应》 PPT课件
《 氧 化 还 原 反应》 PPT课件
【情境·思考】 《中国诗词大会》是央视首档全民参与的诗词节目,节 目以“赏中华诗词、寻文化基因、品生活之美”为基 本宗旨,力求通过对诗词知识的比拼及赏析,带动全民 重温那些曾经学过的古诗词,分享诗词之美,感受诗词 之趣,从古人的智慧和情怀中汲取营养,涵养心灵。
《 氧 化 还 原 反应》 PPT课件
《 氧 化 还 原 反应》 PPT课件
(3)当反应中有一种元素被氧化时,一定有另一种元素 被还原。 ( ) 提示:×。可能是同种元素化合价的升降,如 2H2O2====2H2O+O2↑。
《 氧 化 还 原 反应》 PPT课件
氧化还原反应ppt课件

化合价降低,被还原,发生还原反应
+2
0 高温 0
+4
2CuO + C = 2Cu + CO2
有氧参与的反应
化合价升高,被氧化,发生氧化反应
一、氧化还原反应
凡有元素化合价升降的化学反应都是氧化还原反应。
化合价降低,被还原,发生还原反应
+1
0
0
+2
无氧参与的反应
化合价升高,被氧化,发生氧化反应
(2019·抚顺高一期末)下列化学反应中,不属于氧化还原反应的是
解析 A项,氧化性:Z2>W2,不符合题给信息,反应不能发生; B项,氧化性:Z2>X2,符合题给信息,反应能发生; C项,氧化性:Y2>W2,不符合题给信息,反应不能发生; D项,氧化性:X2>Z2,不符合题给信息,反应不能发生。
二、氧化性、还原性强弱比较
(3)根据反应的难易(反应条件)比较下列物质的氧化性强弱
√A.CaCO3+2HCl===CaCl2+CO2↑+H2O
B.Fe+CuSO4===Cu+FeSO4 高温
C.Fe2O3+3CO===== 2Fe+3CO2 D.2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
判断正误
(1)氧化还原反应中一定有氧元素的得失(× ) (2)氧化还原反应中得电子的物质发生还原反应(√ ) (3)氧化还原反应中所有元素的化合价都一定发生变化(× ) (4)一个反应中可以只有元素化合价升高,而无元素化合价降低(× ) (5)有单质参加的反应一定是氧化还原反应(× )
②Fe+S
△ =====
FeS
可判断氧化性:氯气__>__硫。
1.下列微粒:①Al3+ ②Cl- ③N2 ④S2- ⑧MnO-4 。既具有氧化性又具有还原性的是
+2
0 高温 0
+4
2CuO + C = 2Cu + CO2
有氧参与的反应
化合价升高,被氧化,发生氧化反应
一、氧化还原反应
凡有元素化合价升降的化学反应都是氧化还原反应。
化合价降低,被还原,发生还原反应
+1
0
0
+2
无氧参与的反应
化合价升高,被氧化,发生氧化反应
(2019·抚顺高一期末)下列化学反应中,不属于氧化还原反应的是
解析 A项,氧化性:Z2>W2,不符合题给信息,反应不能发生; B项,氧化性:Z2>X2,符合题给信息,反应能发生; C项,氧化性:Y2>W2,不符合题给信息,反应不能发生; D项,氧化性:X2>Z2,不符合题给信息,反应不能发生。
二、氧化性、还原性强弱比较
(3)根据反应的难易(反应条件)比较下列物质的氧化性强弱
√A.CaCO3+2HCl===CaCl2+CO2↑+H2O
B.Fe+CuSO4===Cu+FeSO4 高温
C.Fe2O3+3CO===== 2Fe+3CO2 D.2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
判断正误
(1)氧化还原反应中一定有氧元素的得失(× ) (2)氧化还原反应中得电子的物质发生还原反应(√ ) (3)氧化还原反应中所有元素的化合价都一定发生变化(× ) (4)一个反应中可以只有元素化合价升高,而无元素化合价降低(× ) (5)有单质参加的反应一定是氧化还原反应(× )
②Fe+S
△ =====
FeS
可判断氧化性:氯气__>__硫。
1.下列微粒:①Al3+ ②Cl- ③N2 ④S2- ⑧MnO-4 。既具有氧化性又具有还原性的是
高中化学必修一第二章第三节-氧化还原反应优秀课件

Fe + CuSO4 = FeSO4 + Cu
0
+1 -1 +2 -1 0
Zn + 2HCl = ZnCl2 + H2
+1 -2 +1 +1 -1 +1 -1 +1 -2
NaOH + HCl = NaCl + H2O
不仅有得失氧的化学反响是氧化复原反响, 只要化学反响前后化合价有变化的反响 都是氧化复原反响
高温
CuO + H2 Cu + H2O
H2得到氧,被氧化,发生氧化反响
CuO失去氧,被复原,发生复原反响
思考与交流
以上反响在得氧和失氧的同时元素的化合价 有什么变化? 找出氧化反响和复原反响与元素化合价变化 的关系。
2、从化合价角度分析:
发生复原反响,被复原,化合价降低,
0
+2 -2 高温
0
+4 -2
标出反响前后 反响物升价(降价)元素 标出“得到或
各元素化合价 指向生成物对应元素 失去m×ne-
失去4e-,化合价升高,被氧化 本卷须〞知:
〔1〕箭头由反响物指向生成物,
+2
0 高温 0 +4
2CuO + C 2Cu + CO2
箭头箭尾指向化合价变化的元素 〔2〕注明“得到〞“失去〞
得到2×2e-,化合价降低,被复原
C. 有电子转移的化学反响一定是氧化复原反响。
D. 在氧化复原反响中,一种元素的化合价升高,
就必然另一种元素的化合价一定降低。
二、氧化剂和复原剂
1、氧化剂和复原剂
化合价降低,得电子,被复原
+2
0 △ 0还是+咱1哥俩好啊!
0
+1 -1 +2 -1 0
Zn + 2HCl = ZnCl2 + H2
+1 -2 +1 +1 -1 +1 -1 +1 -2
NaOH + HCl = NaCl + H2O
不仅有得失氧的化学反响是氧化复原反响, 只要化学反响前后化合价有变化的反响 都是氧化复原反响
高温
CuO + H2 Cu + H2O
H2得到氧,被氧化,发生氧化反响
CuO失去氧,被复原,发生复原反响
思考与交流
以上反响在得氧和失氧的同时元素的化合价 有什么变化? 找出氧化反响和复原反响与元素化合价变化 的关系。
2、从化合价角度分析:
发生复原反响,被复原,化合价降低,
0
+2 -2 高温
0
+4 -2
标出反响前后 反响物升价(降价)元素 标出“得到或
各元素化合价 指向生成物对应元素 失去m×ne-
失去4e-,化合价升高,被氧化 本卷须〞知:
〔1〕箭头由反响物指向生成物,
+2
0 高温 0 +4
2CuO + C 2Cu + CO2
箭头箭尾指向化合价变化的元素 〔2〕注明“得到〞“失去〞
得到2×2e-,化合价降低,被复原
C. 有电子转移的化学反响一定是氧化复原反响。
D. 在氧化复原反响中,一种元素的化合价升高,
就必然另一种元素的化合价一定降低。
二、氧化剂和复原剂
1、氧化剂和复原剂
化合价降低,得电子,被复原
+2
0 △ 0还是+咱1哥俩好啊!
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
19
高锰酸钾分解
《氧化还原反应》课件
⑵用单线桥表示电子转移情况
表示氧化剂和还原剂之间元素的电子转移情况时,将 氧化剂中降价元素与还原剂中升价元素用直线连接起来, 箭头从还原剂指向氧化剂,线上标出电子转移总数,称 为“单线桥法”
2e-
M +4nO2+4HC -1l(浓)加 ==热 =+M 2nCl2+C0l2↑+2H2O
H2、C、CO、NH3
《氧化还原反应》课件
• 小结: • 强氧化剂与强还原性相遇时,一般都会发生氧化
还原反应。 如:H2SO4(浓)与金属、H2S、S2-、HI、I-、 HBr、Br-、Fe2+、P等。 Cl2与金属、H2S、S2-、HI、I-、HBr、Br-、 Fe2+、H2、SO2H2SO3等。 HNO3与金属、H2S、S2-、HI、I-、HBr、Br-、 Fe2+、P、SO2、H《2氧S化O还原3等反应》。课件
氧化还原反应
《氧化还原反应》课件
第1讲 氧化还原反应 概念
《氧化还原反应》课件
一、氧化还原反应的基本概念
1、氧化还原反应的概念: 在反应中有元素化合价变化的化学反应
(1)实质:有电子的转移(得失或偏移) (2)特征:有元素化合价升降
这是概念判断的根本 依据
《氧化还原反应》课件
【例1】 下列反应中不属于氧化还原反应的是( C )
A 、Cl2+H2O==HCl+HClO B、3CO+Fe2O3==2Fe+3CO2 C、CaCO3+SiO2==CaSiO3+CO2↑ D、3CuS+8HNO3==3Cu(NO3)2+2NO↑+3S↓+4H2O
《氧化还原反应》课件
练习1:判断下列那些为氧化还原反应,并说出理由 ①IBr + H2O = HBr + HIO; ②KOH+Cl2=KCl +KClO+H2O ; ③NaH+H2O =NaOH+H2 ;
《氧化还原反应》课件
相关概念的辨析
氧化反应: 物质所含元素化合价升高的过程 还原反应: 物质所含元素化合价降低的过程
氧 化 性: 物质(元素、离子)具有得到电子的性质或能力 还 原 性: 物质(元素、离子)具有失去电子的性质或能力
氧 化 剂: 所含元素化合价降低的反应物 还 原 剂: 所含元素化合价升高的物质
氧化产物: 还原剂失去电子被氧化后的产物 还原产物: 氧化剂得到《电氧化子还原被反还应》原课件后的产物
2、相关概念:
升失氧化,还原剂
得电子 化合价降低 发生还原反应 具有氧化性
氧化剂 + 还原剂
还原产物 + 氧化产物
失电子 化合价升高 发生氧化反应 具有还原性
《氧化还原反应》课件
相互联系:
化
氧 化 性
∆
1)3Cu+8HNO3(稀)=== 3Cu(NO3)2+2NO↑+4H2O
参考答案:
化合价升高,失去3 × 2e- ,被氧化
3Cu+8HNO3(稀) ==∆= 3Cu(NO3)2+2NO↑+4H2O
化合价降低,得到2× 3e-,被还原
《氧化还原反应》课件
17
2)氯酸钾与二氧化锰混合加热
化合价升高,失去6×2e-,被氧化
(5)氧化产物和还原产物质量比为1:1
A、①②④
B、③④⑤
C、①②③⑤
D、④
《氧化还原反应》课件
10
【例3】在11P+15CuSO4+24H2O= 5Cu3P+6H3PO4+15H2SO4
的反应中,P元素发生的变化是( C) A. 被氧化. B. 被还原 C. 既被氧化又被还原 D.既未被氧化又未被还原
物
《氧化还原反应》课件
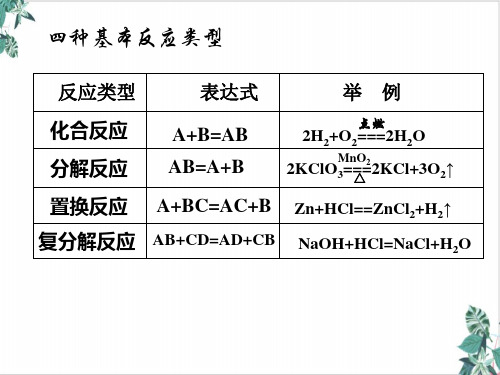
2、四大基本反应类型与氧化还原反应间的关系
分解反应 化合反应
氧化还原反应 置换反应
复分解反应
《氧化还原反应》课件
【例2】在 CaH2+2H2O=Ca(OH)2+2H2↑
的反应中,下列叙述正确的是
(1)H2是氧化产物
C
(2)H2是还原产物
(3)H2O是氧化剂
(4)CaH2中氢元素,既被氧化又被还原;
《氧化还原反应》课件
11
(【0例6广4】东)下列反应中,氧化剂与还原剂物质的
量的关系为1:2的是 A. O3+2KI+H2O=2KOH+I2+O2
AD
B. 2CH3COOH+Ca(ClO)2=2HClO+ Ca(CH3COO)2
C. I2+2NaClO3=2NaIO3+Cl2 D. 4HCl+MnO2=MnCl2+Cl2↑+H2O
2KC+5lO-23=M=n=△O=2 2K-C1 l
+
0
3O2↑
化合价降低,得到2×6e-,被还原
《氧化还原反应》课件
18
3)硫与KOH溶液反应
化合价升高,失去4e-,被氧化
0
-2 +4
3S + 6KOH == 2K2S +K2SO3+3H2O
化合价降低,得到2×2e-,被还原
《氧化还原反应》课件
具有
氧 化
表现
剂
合 价 降 低
得 到 电 子
还
还
还
被 还
原 反
生成 原 产
原 具有 性
原应
物
性质 反应物 特征 实质 过程 反应 产物 性质
(同时存在)
(总数相等)(同时进行同时消失)(同时生成)
化
还 原 性
具有
还 原 表现 剂
合 价 升 高
失 去 电 子
被 氧
氧
化 反
生成
氧 化 产
具有
氧 化 性
化应
• (4)过氧化物: Na2O2 、 H2O2 等。
《氧化还原反应》课件
• 2.常见的还原剂 • (1)活泼金属: K、Na、Mg、Al 等。 • (2)非金属离子及低价态化合物: • S2-、H2S、I-、SO2、H2SO3、Na2SO3 等。 • (3)低价阳离子: Fe2+ 。 • (4)非金属单质及其氢化物:
《氧化还原反应》课件
• 1.常见的氧化剂
• (1)非金属单质:如 Cl2、 O2 、Br2等。 • (2) 含 有 高 价 态 元 素 的 化 合
物:浓H2SO4、 HNO3、KMnO4、 MnO2 、
•
KClO3 、 HClO 、 NaClO 等。
• (3)某些金属性较弱的金属的高价态离子: Fe3+ 。
3.电子转移及氧化还原关系的表示方法 ---单线桥和双线桥
⑴用双线桥表示电子转移的结果和氧化还原反应的各种关系
重点:(1)双箭号(从与失电子及总数(氧化剂得电子总数等于还原剂失
电子总数)
《氧化还原反应》课件
【例5】 用双线桥法表示下列反应的电子转 移方向和数目,并指出氧化剂、还原剂、氧 化产物、还原产物。
