人教版九年级化学上册 第3单元 课题2 原子的结构 练习题
最新九年级化学上册02全练版课题2 原子的结构

第三单元物质构成的奥秘课题2 原子的结构基础过关全练知识点1 原子的构成1.(2021江苏泰州中考)含有“氚”的核废水直接排放会对人类生存环境造成一定的影响。
氚原子的原子核内含有1个质子和2个中子,其核外电子数是( )A.1B.2C.3D.62. (2022 湖南临湘期中)下列关于原子的叙述正确的是( )A.物质都是由原子直接构成的B.任何一种原子都含有质子、中子和电子C.原子是由质子和中子构成的D.原子是由原子核和核外电子构成的3.(2021福建泉州实验中学第二次月考)下图为某原子结构模型的示意图,其中①、②、③是构成该原子的三种不同粒子。
下列说法错误的是( )A.有的原子中不含②B.原子的质量主要集中在②和③上C.原子中①与③的数目一定相同D.原子中①与②的数目一定相同4.(2022 宁夏银川金凤期中)在分子、原子、质子、中子、电子这几种粒子中,找出符合下列条件的粒子填在相应的横线上:(1)化学变化中可再分的粒子:。
(2)化学变化中最小的粒子:。
(3)带正电荷的粒子:。
(4)不显电性的粒子:。
(5)在同一原子中数目相等的粒子:。
(6)决定原子质量大小的粒子主要是。
(7)质量最小的粒子:。
知识点2 原子核外电子排布5.(2022独家原创)我国的“天宫”空间站的核心舱“天和号”选择了柔性砷化镓薄膜电池来供电,它不仅薄如蝉翼,还不受太空恶劣环境影响。
如图是镓原子的结构示意图,下列说法错误的是( )A.镓原子的核外第一层有2个电子B.镓原子在化学反应中容易失去3个电子C.镓原子核内的质子数为31、中子数为0D.镓原子的核外有4层电子6.(教材P55变式题)下图形象地表示了氯化钠的形成过程。
下列相关叙述中,不正确的是( )A.钠原子易失去一个电子,氯原子易得到一个电子B.钠原子失去一个电子形成钠离子后,原子核没有发生变化C.氯离子和钠离子相互作用,形成了新物质氯化钠D.氯化钠是由带电的离子构成的,因此氯化钠是显电性的7.(2022河南鹿邑期中)根据下列粒子的结构示意图回答问题。
九年级化学人教版上册第三单元题二 原子的结构(2)

课题二原子的结构(2)【知识要点】1.元素(组成物质的基本成分)的化学性质与原子结构的关系(1)稀有气体的原子最外层电子数为8个(氦为2个),它们的化学性质比较稳定。
一般认为最外层电子数为个的结构为稳定结构(只有一个电子层的则为2个)。
(2)金属的原子最外层电子数一般少于个,在化学反应中易最外层电子,使次外层变成最外层,通常达到8个电子的稳定结构。
(3)非金属的原子最外层电子数一般个,在化学反应中易电子,使最外层达到8个电子的稳定结构。
(4)一般情况下,原子的最外层电子数相同,其化学性质相似。
2.离子(1)带电的原子或原子团叫离子。
带电的离子叫阳离子,如Na+ 、NH+ ,带电的离子叫阴离子,如Cl-、CO32-。
(2)原子与离子的比较异:①原子一般(填“稳定”或“不稳定”),而离子比较。
②原子不显电性,而离子。
③表示方法不同,如钠原子表示为,钠离子表示为。
同:都是构成物质的粒子;质量、体积都很;在不停;有间隙。
(3)构成物质的粒子有、和。
3.相对原子质量。
(1)定义:以一种碳原子原子质量的为标准,其他原子的质量跟它相比较所得到的比值。
(2)计算公式:某原子的相对原子质量(Ar)=。
(3)原子的质量主要集中在原子核上。
相对原子质量≈+。
(4)相对原子质量是一个比值,其单位为“1”,而质量单位是“千克”。
【要点分析】例1 某粒子的结构示意图如下.下列对该粒子的判断中,错误的是()A. 原子核内有17个质子B. 该粒子是原子C. 在化学反应中易失去电子D. 该粒子属于非金属原子解析圆圈中数字17代表质子数,A选项正确;示意图中质子数与核外电子数相等,表示是原子结构,B选项正确;由于最外层有7个电子,所以容易得到电子,属于非金属原子,故C选项错误,D选项正确。
答案 C例2下列粒子结构示意图能表示原子的是_________;表示阳离子的是_________;表示阴离子的是_________。
解析 原子结构示意图中,弧线表示电子层,弧线上面的数字表示该层的电子数;当质子数=核外电子数时,为原子的结构示意图;质子数>核外电子数时,是阳离子的结构示意图;质子数<核外电子数时,是阴离子结构示意图。
课题2-原子的结构 第1课时(分层练习)-2023-2024学年九年级化学上册(原卷版+解析版)

课题2?原子的结构第1课时(分层练习)-2023-2024学年九年级化学上册(原卷版+解析版)一、单选题1.(2023秋·九年级课时练习)下列对原子结构的认识错误的是A.原子核体积很小B.原子核带正电C.原子内部有很大的空间D.原子是实心的球体【答案】D【解析】略2.(2023秋·福建泉州·九年级校考阶段练习)下列关于科学家对原子结构的认识中,对应错误的是A.汤姆生发现原子中含有电子B.道尔顿提出原子学说C.拉瓦锡发现了质子D.卢瑟福发现了原子核【答案】C【详解】A、汤姆生发现原子中含有电子,正确;B、道尔顿提出原子学说,正确;C、拉瓦锡发现了空气的成分,证明了空气是一种混合物,错误;D、卢瑟福发现了原子核,正确;故选C。
3.(2023秋·九年级课时练习)原子是由A.电子和中子构成的B.质子和中子构成的C.质子和电子构成的D.原子核和电子构成的【答案】D【详解】A、原子是由原子核与电子构成,不是电子和中子构成的,错误;B、原子是由原子核与电子构成,不是质子和中子构成的,错误;C、原子是由原子核与电子构成,不是质子和电子构成的,错误;D、原子是由原子核与电子构成,正确。
故选D。
4.(2023秋·山东德州·九年级统考期中)2023年4月13日,倭国政府正式决定将福岛第一核电站的上百万吨核污水排入大海,多国对此表示反对。
核污水中含有氚,如图为氚原子结构示意图,由图可知氚原子A.含有2个质子B.核电荷数为1C.相对原子质量为4 D.核外电子数为2【答案】B【分析】本题考查原子结构。
【详解】A、由图可知,原子中有一个质子,故A不符合题意;B、原子结构中,质子数等于核电荷数,因此是1,故B符合题意;C、相对原子质量约等于质子数加中子数,因此为1+2=3,故C不符合题意;D、质子数等于核外电子数,因此电子数为1,故D不符合题意;故选B。
【分析】本题难度不大,结合原子结构进行辨析即可。
人教版九年级化学第3单元 课题2 原子的结构(有答案)
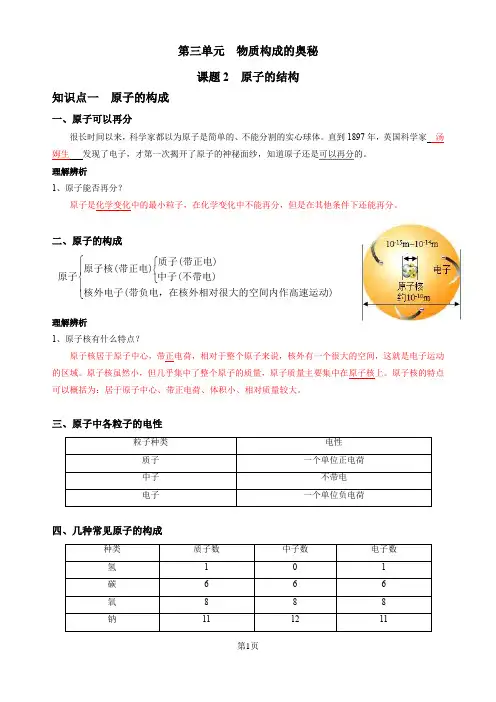
第三单元 物质构成的奥秘课题2 原子的结构知识点一 原子的构成一、原子可以再分很长时间以来,科学家都以为原子是简单的、不能分割的实心球体。
直到1897年,英国科学家 汤姆生 发现了电子,才第一次揭开了原子的神秘面纱,知道原子还是可以再分的。
理解辨析1、原子能否再分?原子是化学变化中的最小粒子,在化学变化中不能再分,但是在其他条件下还能再分。
二、原子的构成⎧⎧⎨⎪⎨⎩⎪⎩质子(带正电)原子核(带正电)原子中子(不带电)核外电子(带负电,在核外相对很大的空间内作高速运动)理解辨析1、原子核有什么特点?原子核居于原子中心,带正电荷,相对于整个原子来说,核外有一个很大的空间,这就是电子运动的区域。
原子核虽然小,但几乎集中了整个原子的质量,原子质量主要集中在原子核上。
原子核的特点可以概括为:居于原子中心、带正电荷、体积小、相对质量较大。
三、原子中各粒子的电性四、几种常见原子的构成理解辨析1、原子一定是由质子、中子、核外电子构成的吗?原子一般由质子、中子、电子这三种粒子构成,但某种氢原子中只有一个质子和一个核外电子,无中子。
五、原子中各种粒子之间的关系1、原子中,质子所带正电荷总数与核外电子所带负电荷总数相等,中子不带电,整个原子不显电性。
2、在原子中,核电荷数=质子数=核外电子数。
3、不同种类的原子,核内质子数不相等。
例题1、下列关于原子的叙述,正确的是( C)A.原子是不能再分的粒子B.一切原子的原子核都是由质子和中子构成的C.原子核内质子数等于核外电子数D.原子核内质子数必等于中子数例题2、有关原子带电情况的解释正确的是(B)A.原子中质子带浮负电,电子带正电B.原子核带正电C.电子不带电D.电子和中子电荷中和使得原子不带电例题3、在分子、原子、质子、中子、电子、原子核这些粒子中选择填空:(1)能保持物质化学性质的粒子是分子;(2)化学变化中的最小微粒是原子;(3)能直接构成物质的粒子是分子、原子;(4)构成原子核的粒子是质子、中子;(5)带正电的粒子是质子、原子核;(6)带负电的粒子是电子;(7)不带电的粒子是中子;(8)质量与氢-1原子质量近似相等的粒子是质子、中子;(9)质量最小的的是电子;(10)在同一原子中数目相等的是质子、电子。
人教版九年级化学上册 3.2 原子的结构 同步练习题 含详细答案

3.2 原子的结构一.选择题(共19小题)1.碳12是指含6个中子的碳原子。
下列对氧16和氧18两种氧原子的说法正确的是()A.质子数相同B.质量相同C.电子数不相同D.16和18表示原子个数2.氚是氢的一种同位素,氚原子含有1个质子和2个中子。
下列示意图能正确表示氚原子结构的是()A.A B.B C.C D.D3.知识梳理有助于我们对已学知识的巩固,如图是某同学学习物质结构层次后以氧气为例进行的梳理,下列选项中与a、b、c对应的是()A.原子、原子核、核外电子B.原子核、原子、核外电子C.原子、核外电子、原子核D.核外电子、原子核、原子4.绝大多数原子的原子核中含有()A.质子、中子、电子B.质子、电子C.中子、电子D.质子、中子5.最近,美国科学家宣布其发现的二种超重新元素是错误的;俄罗斯科学家则宣布发现了114号超重新元素,其相对原子质量为289,质子数为114.下列说法正确的是:(已知:相对原子质量=质子数+中子数)()A.114号元素原子的中子数为175B.114号元素原子的中子数为403C.科学家宣布自己的研究成果错误是可耻的D.科学研究成果是不可能有错误的6.核电荷数少于核外电子数的一定是()A.分子B.原子C.阳离子D.阴离子7.某微粒核内有n个质子,核外有(n﹣1)个电子,此粒子是()A.阳离子B.阴离子C.分子D.原子8.有A、B两种原子,已知A的原子的质子数为a,A3+和B n﹣的电子排布相同,则B原子的核电荷数为()A.a+3﹣n B.a﹣3+n C.a+3+n D.a﹣3﹣n9.下列关于钠原子和钠离子的说法中,正确的是()A.它们的核外电子数相同B.它们的性质完全相同C.钠原子的质量比钠离子大的多D.它们的质子数和中子数都相同10.某阴离子X2﹣的核外有18个电子,核内有18个中子,则X的相对原子质量为()A.54 B.38 C.36 D.3411.下列关于微观粒子的说法,正确的是()A.原子是由分子构成的B.原子中含有质子、中子和核外电子C.原子若失去核外电子,则会变成阴离子D.原子若得到核外电子,则会变成阳离子12.2010年2月19日德国重粒子研究中心宣布原子序数为112号的元素符号为Cn,其相对原子质量为277.下列有关112号元素的说法正确的是()A.该元素原子的核电荷数为277B.该元素原子的质子数为165C.该元素原子的中子数为112D.该元素原子的核外电子数为11213.某些花岗岩石材中含有放射性元素氡,会影响人体健康.一种氡原子的质子数为86,相对原子质量为222,这种氡原子的核外电子数为()A.50 B.86 C.136 D.22214.1991年,我国著名化学家张青莲教授与另一位科学家合作,测定了铟(In)元素的相对原子质量新值.铟元素的核电荷数为49,相对原子质量为115.铟原子的中子数为()A.164 B.115 C.66 D.4915.某元素的相对原子质量是31,原子核外有三个电子层,最外层有5个电子,则该元素原子核中的中子数是()A.12 个B.15 个C.16 个D.17 个16.牙膏中的含氟化合物对牙齿有保护作用。
九年级化学上册 第三单元课题2 原子的结构拓展训练

课题2 原子的结构基础闯关全练拓展训练1.下列关于原子核的说法中,错误的是( )A.原子核位于原子的中心,带正电荷B.原子核位于原子的中心,带负电荷C.原子核在原子中所占的体积非常小D.原子的质量主要集中在原子核上答案 B 原子是由带正电的原子核和带负电的核外电子构成的,故B错误。
2.下列粒子结构示意图中,表示阳离子的是( )答案 C A项,质子数<电子数,表示阴离子;B、D项,质子数=电子数,表示原子;C项,质子数>电子数,表示阳离子。
能力提升全练拓展训练1.不显电性的一组是( )A.质子、中子、电子B.原子核、原子、分子C.中子、电子、原子D.中子、原子、分子答案 D 分子、原子、中子不显电性,质子、原子核带正电,电子带负电。
2.关于原子的下列叙述中,正确的是( )A.所有原子的原子核都是由质子和中子构成的B.原子是化学变化中的最小粒子C.原子中不存在带电粒子,故整个原子不显电性D.原子只能构成分子,不能构成物质答案 B 有一种氢原子的原子核内没有中子,A项错误;原子是由带正电的原子核和带负电的电子构成的,由于核电荷数=核外电子数,所以整个原子不显电性,C项错误;原子既可以构成分子,也可以直接构成物质,如银、铜等金属都是由原子直接构成的,D项错误。
3.已知甲原子与乙原子的质量比为a∶b,而乙原子与碳12原子的质量比为c∶d,则甲原子的相对原子质量为( )A. B. C. D.答案 A 碳12原子的相对原子质量为12,由乙原子与碳12原子的质量比为c∶d,可知乙原子的相对原子质量为;又知甲原子与乙原子的质量比为a∶b,则甲原子的相对原子质量为。
故选A。
三年模拟全练拓展训练(2018福建莆田二十五中上学期期中,14,★☆☆)四种微粒的结构示意图如下,其中表示原子的是( )A. B.C. D.答案 C 因为原子不显电性,因此原子核内质子数=核外电子数,故选C。
A、B表示阴离子,D表示阳离子。
课题2原子的结构(第1课时分层作业)九年级化学上册(人教版)
课题2 原子的结构第1课时【基础达标】1.( 2023·永川区一模)在原子里质子数等于()A.电子数B.中子数C.中子数和电子数之和D.中子数和电子数之差【答案】A【解析】在原子中,核电荷数=核内质子数=核外电子数。
故选A。
2.氢原子核发生聚变时会释放一种不带电的微观粒子,这种微观粒子是()A.质子B.中子C.电子D.原子核【答案】B【解析】中子不带电,质子、电子、原子核都带电,因此氢原子核发生聚变时会释放一种不带电的微观粒子是中子。
故选B。
3.如图为氧的原子结构示意图,其中“x” 的数值是()A.2B.4C.6D.8【答案】D【解析】原子中,核内质子数等于核外电子数,则图中的x=2+6=8,故选D。
4.氦3是一种如今已被世界公认的高效、安全的核聚变原料,其原子核中质子数为2、中子数为1。
氦3的原子结构示意图是()【答案】A【解析】根据在原子中,质子数核外电子数,氦3原子中质子数为2,所以氦3核外电子数也是2,所以1个“氦3”原子中,含有2个质子、1个中子和2个电子,故其原子的结构示意图为,故选A。
5.对“原子的构成”同学们有以下认识,其中不正确...的是()A.原子核中质子数一定等于中子数B.核外电子在离核远近不同的区域中运动C.原子由居于中心的原子核和核外电子构成D.原子核的体积与整个原子的体积相比要小很多【答案】A【解析】A.原子核中质子数不一定等于中子数,例如普氢原子中,质子数为1,中子数为0,钠原子质子数为11,中子数为12,故A错误;B.核外电子具有的能量不同,核外电子在离核远近不同的区域中运动,能量低的电子离核较近,能量高的电子离核较远,故B正确;C.科学家研究发现,原子是由居于中心的原子核和核外电子构成的,故C正确;D.原子核的半径大约是原子半径的十万分之一,原子核的体积与整个原子的体积相比要小很多,故D正确。
故选A。
6.( 2023·中山市一模)如图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子。
九年级化学人教版上册课时练《3.2 原子的结构》 练习题试卷含答案解析
部编版九年级化学上册第三单元物质构成的奥秘《课题2 原子的结构》课时作业一、单选题1.下列物质由离子构成的是A.氢气B.氯化钾C.金刚石D.二氧化碳2.下列说法正确的是A.原子都是由质子、中子、电子三种粒子构成的B.分子与原子的主要区别是分子大,原子小C.不同种原子之间的本质区别是核电荷数不同D.在原子中,质子数等于中子数3.下列对分子、原子、离子的认识正确的是()A.同种分子排列方式不同,化学性质不同B.在干冰中,分子因相互作用而静止不动C.同种原子按不同方式结合,可以构成不同的物质D.原子得失电子形成离子后,原子核发生了变化4.下列物质由离子构成的是A.汞B.氧气C.氯化钠D.二氧化碳5.如下图是五种微粒的结构示意图,下列说法正确的是A.①①属于金属元素B.①的微粒符号是Al3+C.①①①属于阳离子D.①①位于元素周期表的同一周期6.如图为某粒子结构示意图,下列说法错误的是A.该粒子属于非金属元素B.该粒子核外电子数为17C.该粒子具有3个电子层D.在化学反应中,该元素原子易得电子形成Cl-7.关于分子和原子两种微粒的叙述正确的是A.分子可分,原子不可分B.分子大原子小C.同种原子可能构成不同的分子D.分子是保持物质化学性质的最小微粒8.某微粒M的结构示意图如下,关于该微粒的说法正确的是A.M的原子易失电子B.x只能为7C.M为金属元素D.x为8时,M为阴离子9.“宏观辨识与微观探析”是化学学科的核心素养之一,下列说法正确的是①化学变化中,原子核不发生改变①向气球吹气的过程中分子之间的间隔发生了变化①同种分子构成的物质是纯净物①表示的微粒都是离子A.①①①B.①①C.①①D.①①①①10.如图是五种微粒的结构示意图,下列说法不正确的是A.上述五种微粒只涉及四种元素B.①①①表示的微粒性质较稳定C.①①①属于原子,①①属于阴离子D.①①对应元素组成化合物的化学式为NaF二、课内填空11.构成物质的粒子有_____、___________和___________等。
九年级化学上册第三单元课题2原子的结构习题2
《原子的结构》一、选择题1.原子和分子的区别是:()A.分子在化学反应中分成原子,但在化学反应中原子不可再分B.分子一定比原子大C.分子能构成物质,而原子只能构成分子D.在化学反应中分子和原子都可以变成另一种分子和原子,区别在于它们发生的是不同的变化2.已知一个质子数和中子数都是6的碳原子的质量是千克,则一个氧原子的质量是:()A.16克B.16C.千克D.千克3.在原子中,质子数等于:()A.中子数B.核外电子总数C.相对原子质量D.中子数和电子数之和4.下列原子各1克,所含原子个数最多的是:()A.氧原子B.铁原子C.氢原子D.氯原子5.一滴水能分成许许多多个水分子,分子又可分成原子,原子又由中子、质子、电子等构成,这些微粒中,一定能保持水的化学性质的是()A.水分子B.构成水分子的原子C.中子和质子D.电子6.原子和分子的根本区别是()A.是否能直接构成物质B.是否能保持物质的化学性质C.是否在化学反应中发生种类的变化D.是否能构成单质7.下列关于原子的说法错误的是()A.原子是化学变化中的最小微粒B.原子是最小的微粒C.原子核带正电荷,但原子不显电性D.分子能直接构成物质而原子不能8.原子中决定相对原子质量大小的是()A.质子数和中子数B.质子数和电子数C.中子数和电子数D.核电荷数和电子数9.下列各种原子各1克,所含原子个数最多的是()A.氧原子B.铁原子C.氢原子D.氯原子10.下列各式中,表示两个氢原子的是()A.2H B.C.D.11.碳的原子量是()A.12克B.12 C.千克D.1/12克12.在原子中()A.质子数一定等于中子数B.质子数一定等于电子数C.质子数、中子数、电子数三者都相等D.原子核所带电量跟核外电子的电量相等13.下列关于原子的叙述正确的是()A.物质都是由原子直接构成的B.原子是由质子和电子构成的C.原子是由质子和中子构成的D.原子是由原子核和核外电子构成的二、填空题1.硫原子的相对原子质量(原子量)为32,质子数是16,则中子数是______,电子数是______,核电荷数是______。
九年级化学上册原子的结构练习题
3。
2 原子的结构练习题【知识点1】原子的构成1、下列说法不正确的是( )A、原子是不可分割的实心球体B、原子核带正电,核外电子带负电C、原子本身不显电性,但原子中存在着带电粒子D、所有的原子的原子核都是由质子和中子构成的2、原子不显电性的原因是( )A、构成原子的各种粒子均不带电B、原子核外电子数大于核内质子数C、核内质子数等于中子数D、原子核所带电量与核外电子所带电量相等,电性相反3、根据元素的核电荷数不能确定的是()A、原子核内质子数B、原子核内中子数C、原子核外电子数D、都不能确定4、碘(I)被公认为人类的“智慧元素”。
已知碘原子核外有53个电子,下列说法错误的是()A、碘元素是非金属元素B、碘原子核内中子数为53C、碘原子质子数为53D、碘原子核电荷数为535、我国南海海底蕴藏着丰富的锰结核—-——-—含有锰、铁、铜等金属的矿物。
已知锰原子的质子数为25,相对原子质量为55,则锰原子的电子数为()A、25B、30C、55D、806、已知一种碳原子可用于测定文物的年代,该原子的原子核内含有6个质子和8个中子,则核外电子数为() A、2 B、6 C、8 D、147、下列关于原子的叙述中,不正确的是()A、原子是化学变化中的最小粒子B、原子可以直接构成物质C、原子不带电是因为原子中不存在带电的粒子D、核外电子在原子核外的空间里作高速运动8、牙膏中的含氟化合物对牙齿有保护作用。
一种氟原子的原子核内有9个质子和10个中子,该原子的核电荷数为( ) A、7 B、9 C、10 D、199、反电子、反质子跟普通电子、质子的质量、电量均相等,电性相反。
反氢原子是由反质子和反电子构成。
1997年年初和年底,欧洲和美洲的研究机构分别制造出9个和7个反氢原子,这是人类探索反物质的一大进步。
请推测反氢原子的结构可能是()A、由一个带正电荷的质子与一个带负电荷的电子构成B、由一个带负电荷的质子与一个带正电荷的电子构成C、由一个不带电荷的中子与一个带负电荷的电子构成D、由一个带负电荷的质子与一个带负电荷的电子构成【知识点2】原子的核外电子排布10、如图是钠原子的结构示意图,下列有关钠原子的叙述不正确的是( )A、质子数为11B、最外层电子数为1C、核外有3个电子层D、核外电子总数为1011、是氯原子的结构示意图,该原子的核电荷数是_______,共有_______个电子层,第二层上有______个电子,最外层上的电子数是_______12、如图是四种粒子的结构示意图。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课题2 原子的结构
一、选择题
1.如图是钠与氯气(Cl2)反应生成氯化钠的模拟图。
下列说法中错误的是()
A.每个钠原子失去1个电子形成钠离子
B.每个氯原子得到1个电子形成氯离子
C.钠离子和氯离子由于静电作用而结合成化合物氯化钠
D.氯化钠由氯化钠分子构成
2.石门山森林公园环境优美,空气清新,有丰富的负离子,空气中氧分子得到电子就能形成负离子(如O2﹣),O2﹣与O2比较,不相同的是()
A.质子数B.含氧原子个数
C.电子数D.相对原子质量之和
3.关于原子的说法不正确的是()
A.是构成物质的一种粒子B.是化学变化中的最小粒子
C.在化学反应中可以再分D.是由原子核和核外电子构成
4.下列有关微观粒子的说法中,正确的是()
A.花香四溢,是因为分子在不断运动
B.大多数物体受热时体积增大,是因为受热时分子体积增大
C.分子可以再分,原子不可再分
D.氧原子在化学反应中容易失去电子
5.2019年度诺贝尔化学奖授予了开创“飞秒(10﹣15s)化学”新领域的科学家,使运用激光光谱技术观测化学反应时分子中原子运动成为可能.你认为该技术不能观测到的是()
A.原子中原子核的内部结构
B.化学反应中原子的运动
C.化学反应中生成物分子的形成
D.化学反应中反应物分子的分解
6.“朝核问题”引发了国际关注,核问题的关键是核能的如何利用。
已知某种核原料的原子核中含有1个质子和2个中子,下列说法不正确的是()
A.该原子是一种氢原子B.该元素是非金属元素
C.该原子核外有3个电子D.该原子相对原子质量为3
二、非选择题
1. 2019•南康区模拟)明月山国家森林公园丰富的负氧离子(O2﹣)是国家标准的35倍,堪称“天然氧吧”.一个O2﹣与O2分子比较,相同的是.
A、质子数
B、电子数
C、化学性质
D、.
2.Al和Al3+属于同一种元素,因为它们的相同.Al和Al3+属于(相同或不同)的粒子,因为它们核外的电子总数(相同或不同).
3.美国为首的北约在科索沃战场上投下了至少10t贫铀弹,不少人患上了“巴尔干综合症”.贫铀弹的主要成分是低放射性的铀.铀原子的相对原子质量为238,核电荷数为92,中子数为146,质子数为,电子数为.
4.电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集中分布的呢?1910年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验.实验做法如图:绝大多数α粒子穿过金箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来.【猜想与假设】α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的.
【解释与结论】
(1)若原子质量、正电荷在原子内均匀分布,则极少数α粒子就(填“会”或“不会”)发生大角度散射.卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是.
(2)科学家对原子结构的探究经历了三个过程,通过α粒子散射实验,你认为原子结构为以下的
5.某粒子的质子数为13,中子数比质子数多1,该粒子的相对原子质量为,该粒子所含粒子总数为.
6.探究原子结构的奥秘.
【情景提供】19世纪以前,人们一直以为原子是不可分的,直到1887年,汤姆生发现了带负电的电子后,才引起人们对原子结构模型的探索.
【提出问题】电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集中分布的呢?
【进行实验】1910年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验.
实验做法如图:
(1)放射源﹣放射性物质放出α粒子(带正电荷),质量是电子质量的7000倍;
(2)金箔﹣作为靶子,厚度1um,重叠了3000层左右的原子;
(3)荧光屏﹣α粒子打在上面发出闪光;
(4)显微镜﹣通过显微镜观察闪光,且通过360度转动可观察不同角度α粒子的到达情况.
【收集证据】绝大多数α粒子穿过金箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹
了回来.
【猜想与假设】α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的.
【解释与结论】
(1)若原子质量、正电荷在原子内均匀分布,则极少数α粒子就(填“会”或“不会”)发生大角度散射.卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是.
(2)1um金箔包含了3000层金原子,绝大多数α粒子穿过后方向不变,说明;A.原子的质量是均匀分布的B.原子内部绝大部分空间是空的
(3)科学家对原子结构的探究经历了三个过程,通过α粒子散射实验,你认为原子结构为以下的.
A.
道耳顿模型特点:不可再分的实心球体
B.
汤姆生模型特点:正负电荷均匀分布
C.
卢瑟福模型特点:核位于原子中心,质量集中在核上.
7.从微观角度了解物质及其变化,有助于把握物质组成及其变化的本质。
(1)氯原子在反应中易(选填“得到”或“失去”)1个电子。
(2)构成氯化钠的粒子是。
(3)由图可知,元素的原子失去电子后,其化合价会(选填“升高”或“降低”)。
(4)原子核外电子层数与元素所在周期表中的周期数相同可知,钠元素在元素周期表中应排在第周期。
参考答案
一、1.D 2. C 3.C 4. A 5. A 6.C
二、1. 由题意可知,“空气中氧分子得到电子就能形成负氧离子”,在形成离子时得到一个电子,不变的是质子;所以二者不相同的是电子数;化学性质不相同,而氧原子个数都为2;中子数也不变,所以氧原子个数不变,质子数不变.
故答案为:A;含氧原子个数等.
2.因Al和Al3+两种粒子都具有13个质子,质子数(或核电荷数)相同,属于同一种元素;又由于两种微粒的核外电子总数不同,则它们是同种元素的不同微粒.
故答案为:质子数(或核电荷数);不同;不同;
3.根据在原子中:原子序数=质子数=核外电子数,铀的相对原子质量为238,核电荷数为92,所以电子数=质子数=92.
故答案为:92;92.
4.(1)极少数α粒子散射的原因是受到了一个体积小但质量相对而言较大的粒子的斥力,这说明原子质量、正电荷在原子内并不是均匀分布的;由原子的结构可知,原子核集中了原子的大部分质量,且体积很小.
(2)由α粒子散射实验可推断,原子是由具有原子中心带正电的原子核和核外带负电的电子构成,与C模型最相符.
答案:(1)不会;原子核;C.
5.原子不显电性,所以原子的核内质子数和核外电子数相等,某原子的核内质子数为13,所以它的核外电子数也是13,因为中子数比质子数多1,所以它的中子数是14.
则该原子的相对原子质量为:13+14=27.
该原子中所含微粒总数(质子、中子、电子)为13+13+14=40.
故答案为:27;40.
6.原子是由原子核和核外电子构成的,原子核体积小,质量大,原子的质量主要集中在原子核上,原子核外有一个非常大的空间,核外电子围绕原子核作高速运动.
(1)若原子质量、正电荷在原子内均匀分布,则极少数α粒子就不会发生偏转,大多数发生偏转,而大多数发生了偏转,说明原子的质量主要集中在原子核上,且正电荷不是均匀分布的.
(2)原子核外有一个非常大的空间,使绝大多数α粒子穿过后方向不变
(3)原子结构如图C.
故答案为:(1)不会,原子核(2)B (3)C
7.(1)从得失电子的角度看,反应中氯原子最外层电子数为7,大于4个,易得到1个电子,形成相对稳定结构;
(2)氯化钠是由钠离子和氯离子构成的;
(3)由图可知,元素的原子失去电子后,其化合价将升高;
(4)电子层数决定周期数,钠原子核外有3个电子层,钠元素在元素周期表中应排在第三周期。
答案:
(1)得到;
(2)钠离子和氯离子;
(3)升高;
(4)三。
