【VIP专享】碱标准溶液浓度标定英文翻译
酸碱滴定实验英文版Titrating a Hydrochloric Acid solution with a standard sodium hydroxide solution

concentration of standard solution required to complete the titration, we calculate the concentration of the unknown solution. There are several ways in which to express solution concentration. Two commonly used concentration expressions are molarity and normality. The molarity (M, mol L–1) of a solution is the number of moles of solute per liter of solution. The normality (N, equiv L–1) of a solution is the number of equivalents of solute per liter of solution, as shown in Equation 1, in which V is the volume of solution. number of equivalents V (liters)
Background Information
Quality-control personnel in many industries are faced with the task of determining whether or not a process is being satisfactorily carried out, or whether or not a product meets specifications. For example, steel manufacturers use “pickle” baths to remove oxide coatings from their product. Unless the acid concentration in these baths is within a specific range, the pickling process will produce unsatisfactory results. Homeowners with pools or spas use commercial acids to treat the water and clean the filters. Acid concentrations for these products are printed on the labels, and it is essential that the product meet the advertised specifications. Monitoring the acid concentration in a pickle bath or in a commercial acid is critical to the success of the product involved. Titration is a convenient volumetric method for accurately determining the concentration or mass of a component in a solution. Titration involves the addition from a buret of a solution of known concentration, called a standard solution, to a measured volume of a solution of unknown concentration, until the reaction between the solutions is complete. From the stoichiometry of the titration reaction and the volume and
氢氧化钠溶液的标定

例2 :氢氧化钠溶液的标定1.目的用标准物邻苯二甲酸氢钾(KHP )标定氢氧化钠(NaOH )溶液。
2.测量步骤干燥并称取滴定标准物KHP 。
配制NaOH 溶液后,将标准物(KHP )溶解,并用NaOH 溶液滴定。
具体的测定步骤见流程图1 3.被测量1000KHP KHPNaOH KHP Tm P c M V ⋅⋅=⋅ [mol/l]其中, NaOH c :NaOH 溶液的浓度[mol/l]1000:由[ml]转化为[l]的换算系数HKP m :滴定标准物KHP 的质量[g]KHP P :滴定标准物的纯度,以质量分数表示KHP M :KHP 的摩尔质量[g/mol] T V :NaOH 溶液的滴定体积[ml]4.不确定度来源的识别:分析测量不确定度的来源是评估不确定度中最困难的一环。
因为,一方面有些不确定度来源可能被忽略,另一方面有些来源可能会被重复计算。
绘制因果图的目的是防止这类问题发生的一个可行的方法。
制作因果图的第一步就是先画出被测量计算公式中的所有参数。
然后,分析每个参数的测量步骤,进一步将所有不可忽略的影响量添加在每一个分支干上,直到影响因素变得微不足道为止。
称重为减量称量,在因果图上应画出皮重称量(m 皮)和毛重称量(m 毛)两条支干。
每一次称重都会有随机变化和天平校准带来的不确定度。
天平校准本身有两个可能的不确定度来源:灵敏度和校准函数的线性。
如果称量是用同一台天平且称量范围很小,则灵敏度带来的不确定度可忽略不计。
图1 标定NaOHV(T)P(KHP)c(NaOH)M(KHP)图2 第一步:画出被测量计算公式中的所有参数的因果图m(KHP)图3 第二步:增加称量步骤不确定度来源的因果图图4 第三步:所有来源的因果图在称量和体积测量中都包含了重复性。
因此,将各重复性分量合并为总试验的一个分量,并且利用方法确认的数值将其量化是合理的,由此将因果图的修订为图5。
图5 第四步:将重复性合并的因果图5.不确定度分量的量化:NaOH 溶液的标定包括以下步骤:ⅰ)将标准物KHP 干燥。
标准溶液配制和标定

1、氢氧化钠标准滴定溶液1.1配制称取110 g氢氧化钠,溶于100 ml无二氧化碳的水中,摇匀,注人聚乙烯容器中,密闭放置至溶液清亮。
按表1的规定,用塑料管量取上层清液,用无二氧化碳的水稀释至1 000MI,摇匀。
表11.2 标定按表2 的规定称取于105℃--110℃电烘箱中干燥至恒重的工作基准试剂邻苯二甲酸氢钾,加无二氧化碳的水溶解,加2滴酚酞指示液(10 g/L),用配制好的氢氧化钠溶液滴定至溶液呈粉红色,并保持30 s。
同时做空白试验。
表2氢氧化钠标准滴定溶液的浓度〔c(NaOH)],数值以摩尔每升(mol/ L)表示,按式(1)计算:m×1000c(NaOH)= -------------(V1-V2)M式中:m—邻苯二甲酸氢钾的质量的准确数值,单位为克(9);V1 —氢氧化钠溶液的体积的数值,单位为毫升(mL);V2 一空白试验氢氧化钠溶液的体积的数值,单位为毫升(mL);M一邻苯二甲酸氢钾的摩尔质量的数值,单位为克每摩尔(g/mol)【M(KHC8H4O4)= 204.22 】2、硫酸标准滴定溶液2.1配制按表3的规定量取硫酸,缓缓注人1 000 mL水中,冷却,摇匀。
表32.2标定按表4的规定称取于270℃—300℃高温炉中灼烧至恒重的工作基准试剂无水碳酸钠,溶于50m l.水中,加5甲基红—亚甲基蓝指示剂(或滴澳甲酚绿一甲基红指示液),用配制好的硫酸溶液滴定至溶液由绿色变为紫色(绿色变为暗红色),煮沸2 min,冷却后继续滴定至溶液再呈紫色(暗红色)。
同时做空白试验。
表4硫酸标准滴定溶液的浓度[c(1/2H2SO4)],数值以摩尔每升(mol/L)表示m×1000c(1/2H2SO4)= -------------(V1-V2)M式中:m—无水碳酸钠的质量的准确数值,单位为克(g);V1—硫酸溶液的体积的数值,单位为毫升(mL) ;V2—空白试验硫酸溶液的体积的数值,单位为毫升(mL) ;M—无水碳酸钠的摩尔质量的数值,单位为克每摩尔(g/mol)[M(1/2Na2CO3 )=52.994]3、氯化钠标准溶液(1ml含1mg氯离子):称取基准试剂或者优级纯的3-4g氯化钠置于瓷坩埚内,于高温炉内升温至500度灼烧10分钟,然后放入干燥器内冷却至室温,然后准确称取1.649g氯化钠,先溶于少量除盐水,然后在容量瓶中稀释至1000ml。
碱浓度分析仪标定(polymetron)标准工艺卡
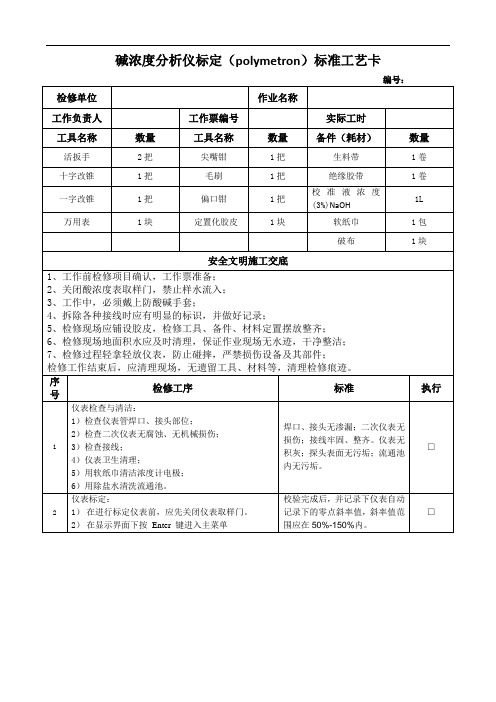
□
3
仪表回装:
1)检查要回装的浓度探头是否完好,并回装到流通池内,回装时上下用力要均匀,小心损坏设备,安装好后应紧密、牢固,无渗漏现象。
浓度探头完好且安装牢固、无渗漏。
□
4
取样流量调整为10~20L/h或100~120ml/min,就地与上位机显示值一致。
_______________浓度分析仪校验记录
标液值
斜率
3%NaOH
标定前
标定后
结论
校验人:日期:年月日
检修工作结束后,应清理现场,无遗留工具、材料等,清理检修痕迹。
序号
检修工序
标准
执行
1
仪表检查与清洁:
1)检查仪表管焊口、接头部位;
2)检查二次仪表无腐蚀、无机械损伤;度计电极;
6)用除盐水清洗流通池。
焊口、接头无渗漏;二次仪表无损伤;接线牢固、整齐。仪表无积灰;探头表面无污垢;流通池内无污垢。
按Enter键出现
按提示从液体中取出电极,并按Enter键出现
当测量值稳定后,仪器自动进入到下一步
注:符号闪烁10 ~ 20秒到下一步
按提示把探头浸入校准液中
当测量值稳定后,按OK后出现
此时的校准值可改变,后按Enter键出现
通过按 键可以录入校准日期确认校准参数按ENTER键保存,按ESC键退出校准不保存校准参数,如标定不合格得重新进行标定。
□
5
□工作结束:
□1)检修后将设备擦拭干净;
□2)清扫检修现场,清点工具。
仪表无灰尘;现场整洁,工具齐全。
□
1、检修原因:
2、检修过程:
碱标准溶液浓度标定英文翻译

2.2
Record the project
I
II
III
Weighing bottle+ potassium hydrogen phthalate (before)
Weighing bottle + potassium hydrogen phthalate (back)
The quality of phthalic acid potassium hydrogen
3参考文献:
1.高烽科技论文写作规范和写作技巧100例。北京:防空工业出版社,2005
2.曾剑芬(译)科技论文写作与发表教程。北京:电子工业出版社,2006
3.展海军、李建伟无机及分析化学实验郑州:郑州大学出版社,2007
4.南京大学化学实验教学组编。大学化学实验北京:高等教育出版社,1999
5.沈君朴主编。实验无机化学。第二版天津:天津大学出版社,1992
13.9953g
13.4295g
0.5658g
13.4295g
13.0270g
0.4025g
13.0270g
12.5567g
0.4703g
NaOH final readings
NaOH initial readings
28.01ml
0.41ml
21.00ml
0.10ml
23.02ml
0.12ml
V(NaOH)
2.8%
2.3 the conclusion
NaOH标准溶液的配制与标定

酸式滴定管操作要点---重点训练
酸式滴定管的操作:左手控制旋塞, 拇指在前,食指和中指在后,手指向 内扣住旋塞,勿使手心顶住旋塞造成 渗液;演示!
锥形的操作:右手握住锥形瓶,滴定 管管尖伸进瓶口为宜,手腕摇动使溶 液作同一方向的圆周运动;演示!
溶液滴入速度不能成流水状放出;
酸式滴定管操作要点---重点训练
3、装滴定剂 摇匀溶液-润洗滴定管2~3次(10~15ml/
次)-装液(零刻度以上)
4、排气泡,调零并记录初始读数 5、滴定 酸式:勿顶活塞,防漏液 用
手腕摇动锥形瓶
碱式:挤压玻璃珠偏上部位,防气泡。 近终点时,要“半滴”操作-冲洗 观察颜色变化和读数
滴定管垂直,视线与刻度平行,读至小数 点后两位
半滴滴法:将旋塞稍稍转动,使有 半滴溶液悬于管口,将锥形瓶与管 口接触,使液滴流出,并用洗瓶以 蒸馏水冲下。演示!
滴定管读数—重点训练
从滴定管架上取下滴定管; 保持竖直; 无色或浅色溶液:读取视线与弯月面
下缘实线最低点相切处的刻度;有色 溶液:读取视线与液面两侧最高点呈 水平处的刻度;
滴定管读数—重点训练
排液、洗涤 酸式滴定管长期放置-夹纸片
酸碱滴定管 操作练习—重点训练
(1) 滴定管的准备
试漏:演示! 涂油或选择合适的玻璃珠和乳胶管: 演示! 洗涤滴定管:10 mL洗液自来水 蒸馏水洗三遍,每次10 mL;
标准溶液的装入: 润洗:510mL标准溶液洗23次,
标准溶液直接装入滴定管,不得 借用任何别的器皿。(润洗的目 的是什么?) 赶气泡:酸式滴定管和碱式滴定 管操作不同; 演示! 调节液面:在0.00mL处或稍下一 点位置,读取初体积。
酸氢钾三份,分别放入三个已编号的250mL锥 形瓶中,加50mL水溶解——2~3d酚酞—— NaOH溶液滴定——微红色(30S内不褪)— —记录VNaOH,计算C NaOH和标定结果
naoh标准滴定溶液的配制与标定

NaOH标准滴定溶液的配制与标定1. 导言在化学实验中,NaOH标准滴定溶液的配制与标定是一个基础且重要的实验操作。
NaOH是氢氧化钠的化学式,是一种强碱,用于酸碱中和反应和分析化学实验中。
而标准滴定溶液则是指溶液的浓度已知,并且可以用于准确测定其他溶液中特定成分的溶液。
正确配制和标定NaOH标准滴定溶液对实验结果的准确性至关重要。
2. NaOH标准滴定溶液的配制(1)原料准备NaOH标准滴定溶液的配制需要准备高纯度的氢氧化钠固体和去离子水。
固体氢氧化钠通常需在密闭容器中保存,避免吸收空气中的二氧化碳和水分,从而影响浓度的准确性;而去离子水则需要先通过去离子纯水设备处理,以保证水质的纯净度。
(2)溶液配制取一定质量的氢氧化钠固体溶于一定体积的去离子水中,搅拌并充分溶解,制成一定浓度的NaOH溶液。
在此过程中需要严格控制溶质的用量与溶剂的数量,确保所得溶液的浓度准确。
(3)浓度测定经溶解后的NaOH溶液需要进行浓度测定。
浓度的测定方法有多种,如酸碱滴定法、化学分析法等,其中最常用的是酸碱滴定法。
利用已标定好的盐酸标准溶液,滴定NaOH溶液,从而得出NaOH溶液的浓度。
3. NaOH标准滴定溶液的标定(1)实验器材准备进行NaOH标准滴定溶液的标定需要准备酸碱滴定所需的一系列实验器材,如滴定管、容量瓶、烧杯、酸碱指示剂等。
(2)标定操作将需要标定的NaOH溶液定量取入容量瓶中,加入适量的酸碱指示剂;然后使用已标定好的酸或碱标准溶液,逐滴加入直至溶液呈现颜色变化;通过滴定消耗的酸碱标准溶液的体积计算出NaOH溶液的浓度。
4. 个人理解与观点NaOH标准滴定溶液的配制与标定是一项基础实验,但其操作要求仍然较为复杂。
在实际操作中,需要严格控制每一步的操作,确保结果的准确性。
密切注意氢氧化钠固体的保存和溶解过程中的安全性,以免对实验者造成伤害。
在标定过程中,更需要严格按照标定方法来进行操作,以避免测量误差的出现。
氢氧化钠标准溶液浓度的标定及醋酸溶液中HAC含量的测定

氢氧化钠标准溶液浓度的标定及醋酸溶液中HAC含量的测定实验四氢氧化钠标准溶液浓度的标定及醋酸溶液中HAC含量的测定一. 实验目的学会用基准物质标定溶液浓度的方法掌握酸碱滴定法的基本原理学会用已标定的标准溶液来测定未知物的含量熟悉移液管和容量瓶的使用2二. 实验原理滴定分析是将一种已知准确浓度的标准溶液滴加到被测试样的溶液中,直到化学反应完全为止,然后根据标准溶液的浓度和体积求得被测试样中组份含量的一种方法。
在进行滴定分析时,一方面要会配制滴定剂溶液并能准确测定其浓度;另一方面要准确测量滴定过程中所消耗滴定剂的体积。
酸碱滴定中常用盐酸和氢氧化钠溶液作为滴定剂,由于浓盐酸易挥发,氢氧化钠易吸收空气中的水分和二氧化碳,故此滴定剂无法直接配制准确,只能先配制近似浓度的溶液,然后用基准物质标定其浓度。
3选用一个滴定的标准物质,主要考虑有几点:1. 稳定性,包括热、氧化、还原、结晶水等方面2.该物质的纯度3.足够大的分子量,降低称量误差,一般>0.2g三. 仪器和试剂(一)NaOH标准溶液浓度的标定仪器:碱式滴定管、锥形瓶(250ml)、移液管(25或20ml)、洗耳球试剂:邻苯二甲酸氢钾、NaOH(0.2 mol/L)、酚酞指示剂、HAc(0.2 mol/L)6三. 实验内容(一)NaOH标准溶液浓度的标定1 称取邻苯二甲酸氢钾三份,0.8-1.2g/份,放入250ml锥形瓶中,加50ml蒸馏水,温热使之溶解、冷却。
加酚酞指示剂2滴。
2 润洗碱式滴定管3次,装入NaOH标准溶液,排出尖端气泡,读初始读数、记录,用NaOH溶液滴定至微红出现,暂停滴定,若30秒内不褪色,则为滴定终点,停止滴定,记录体积,计算NaOH标准溶液的浓度。
7(二)醋酸溶液中HAc含量的测定1 吸取25 ml醋酸溶液放于250ml锥形瓶中,加入酚酞指示剂2滴2 润洗碱式滴定管3次,装入NaOH标准溶液,排出尖端气泡,读初始读数、记录,用NaOH溶液滴定至微红出现,暂停滴定,若30秒内不褪色,则为滴定终点,停止滴定,记录体积。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1. 高烽 科技论文写作规范和写作技巧 100 例。北京:防空工业出版社,2005 2. 曾剑芬(译)科技论文写作与发表教程。 北京:电子工业出版社,2006 3. 展海军、李建伟 无机及分析化学实验 郑州:郑州大学出版社,2007
对全部高中资料试卷电气设备,在安装过程中以及安装结束后进行高中资料试卷调整试验;通电检查所有设备高中资料电试力卷保相护互装作置用调与试相技互术关,通系电1,力过根保管据护线生高0不产中仅工资2艺料22高试2可中卷以资配解料置决试技吊卷术顶要是层求指配,机置对组不电在规气进范设行高备继中进电资行保料空护试载高卷与中问带资题负料2荷试2,下卷而高总且中体可资配保料置障试时2卷,32调需3各控要类试在管验最路;大习对限题设度到备内位进来。行确在调保管整机路使组敷其高设在中过正资程常料1工试中况卷,下安要与全加过,强度并看工且25作尽52下可22都能护可地1关以缩于正小管常故路工障高作高中;中资对资料于料试继试卷电卷连保破接护坏管进范口行围处整,理核或高对者中定对资值某料,些试审异卷核常弯与高扁校中度对资固图料定纸试盒,卷位编工置写况.复进保杂行护设自层备动防与处腐装理跨置,接高尤地中其线资要弯料避曲试免半卷错径调误标试高方中等案资,,料要编试求5写、卷技重电保术要气护交设设装底备备置。4高调、动管中试电作线资高气,敷料中课并设3试资件且、技卷料中拒管术试试调绝路中验卷试动敷包方技作设含案术,技线以来术槽及避、系免管统不架启必等动要多方高项案中方;资式对料,整试为套卷解启突决动然高过停中程机语中。文高因电中此气资,课料电件试力中卷高管电中壁气资薄设料、备试接进卷口行保不调护严试装等工置问作调题并试,且技合进术理行,利过要用关求管运电线行力敷高保设中护技资装术料置。试做线卷到缆技准敷术确设指灵原导活则。。:对对在于于分调差线试动盒过保处程护,中装当高置不中高同资中电料资压试料回卷试路技卷交术调叉问试时题技,,术应作是采为指用调发金试电属人机隔员一板,变进需压行要器隔在组开事在处前发理掌生;握内同图部一纸故线资障槽料时内、,设需强备要电制进回造行路厂外须家部同出电时具源切高高断中中习资资题料料电试试源卷卷,试切线验除缆报从敷告而设与采完相用毕关高,技中要术资进资料行料试检,卷查并主和且要检了保测解护处现装理场置。设。备高中资料试卷布置情况与有关高中资料试卷电气系统接线等情况,然后根据规范与规程规定,制定设备调试高中资料试卷方案。
碱式滴定管(50ml) 锥形瓶(250ml) 称量瓶 洗瓶 分析天平 1.3 反应机理
酸碱标准溶液是采用间接法配制的,其浓度必须用基准物质来标定,标定 碱的基准物常用邻苯二甲酸氢鉀或草酸。与 NaOH 反应:
KHC8H4O4 +NaOH → KNaC8H4O4 + H2O
1 实验分析与讨论
2.1 用减量法准确称取邻苯二甲酸氢 0.4—0.6g 于锥形瓶中,同时称取三份,各 加 50ml 蒸馏水溶解,必要时可小火温热溶解。冷却后加入 2 滴酚酞指示剂,用 欲标定的 NaOH 标准溶液滴定,近终点时要逐逐滴或半滴加入,直至被滴定溶 液由无色至微红色半分钟不褪,即为终点。
碱标准溶液浓度标定
摘要: 酸碱标准溶液是采用间接法配制的,其浓度必须用基准物质来标定。也 可根据酸碱溶液中已标出其中一种溶液的浓度,然后按它们的体积比 V(NaOH)/V(HCl)来计算出另一种标准溶液OH 标准溶液
引言 NaOH 标准溶液可用邻苯二甲酸氢钾(KHC8H4O4,M=204.2),以酚酞为指
2.2
记录项目
称量瓶+邻苯二甲酸氢钾(前) 13.9953g 13.4295g
称量瓶+邻苯二甲酸氢钾(后) 0.5658g
邻苯二甲酸氢钾质量 NaOH 最终读数 NaOH 最初读数
V(NaOH)
c(NaOH) c(NaOH)
个别测定的平均偏差
相对平均偏差
I
28.01ml 0.41ml
27.60ml
0.1005mol/L 0.0944moi/L
+0.0020
2.3 结论
(1)c(NaOH)=1000*m(KHC8H4O4)/M(KHC8H4O4)* V(NaOH) C(HCI)=0.0895mol/L
(2)由于在配制溶液过程中读数存在偏差,滴定过程中,读数存在偏差, 造成相对平均偏差较大。标定溶液浓度时称量不需要准确测量 KHC8H4O4 的质量, 因为公式中 KHC8H4O4 的质量是实际称得的质量,称量在 0.5000±0.0500 范围内 都是允许的。
示剂进行标定,它易提纯,易干燥,无结晶水,不吸潮,摩尔质量大,是一种 较好的基准物质。
实验部分
1.1 主要原料
邻苯二甲酸氢钾(天津金汇太亚化学试剂有限公司 ) 0.4—0.6g, 蒸馏水 (郑州市金水区喜星纯水厂), 酚酞指示剂(山东泰安新泰峰磊化工有限公 司), NaOH 标准溶液(实验室自配)
1.2 主要设备
对全部高中资料试卷电气设备,在安装过程中以及安装结束后进行高中资料试卷调整试验;通电检查所有设备高中资料电试力卷保相护互装作置用调与试相技互术关,通系电1,力过根保管据护线生高0不产中仅工资2艺料22高试2可中卷以资配解料置决试技吊卷术顶要是层求指配,机置对组不电在规气进范设行高备继中进电资行保料空护试载高卷与中问带资题负料2荷试2,下卷而高总且中体可资配保料置障试时2卷,32调需3各控要类试在管验最路;大习对限题设度到备内位进来。行确在调保管整机路使组敷其高设在中过正资程常料1工试中况卷,下安要与全加过,强度并看工且25作尽52下可22都能护可地1关以缩于正小管常故路工障高作高中;中资对资料于料试继试卷电卷连保破接护坏管进范口行围处整,理核或高对者中定对资值某料,些试审异卷核常弯与高扁校中度对资固图料定纸试盒,卷位编工置写况.复进保杂行护设自层备动防与处腐装理跨置,接高尤地中其线资要弯料避曲试免半卷错径调误标试高方中等案资,,料要编试求5写、卷技重电保术要气护交设设装底备备置。4高调、动管中试电作线资高气,敷料中课并设3试资件且、技卷料中拒管术试试调绝路中验卷试动敷包方技作设含案术,技线以来术槽及避、系免管统不架启必等动要多方高项案中方;资式对料,整试为套卷解启突决动然高过停中程机语中。文高因电中此气资,课料电件试力中卷高管电中壁气资薄设料、备试接进卷口行保不调护严试装等工置问作调题并试,且技合进术理行,利过要用关求管运电线行力敷高保设中护技资装术料置。试做线卷到缆技准敷术确设指灵原导活则。。:对对在于于分调差线试动盒过保处程护,中装当高置不中高同资中电料资压试料回卷试路技卷交术调叉问试时题技,,术应作是采为指用调发金试电属人机隔员一板,变进需压行要器隔在组开事在处前发理掌生;握内同图部一纸故线资障槽料时内、,设需强备要电制进回造行路厂外须家部同出电时具源切高高断中中习资资题料料电试试源卷卷,试切线验除缆报从敷告而设与采完相用毕关高,技中要术资进资料行料试检,卷查并主和且要检了保测解护处现装理场置。设。备高中资料试卷布置情况与有关高中资料试卷电气系统接线等情况,然后根据规范与规程规定,制定设备调试高中资料试卷方案。
