正电子类放射性药品备案批件
国家药监局关于发布锝标记及正电子类放射性药品检验机构评定程序的公告

国家药监局关于发布锝标记及正电子类放射性药品检
验机构评定程序的公告
文章属性
•【制定机关】国家药品监督管理局
•【公布日期】2024.03.07
•【文号】国家药监局公告2024年第21号
•【施行日期】2024.03.07
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
国家药监局公告
2024年第21号
关于发布锝标记及正电子类放射性药品检验机构评定程序的
公告
为落实《国家药监局关于改革完善放射性药品审评审批管理体系的意见》,鼓励有能力和条件的药品检验机构开展锝标记及正电子类放射性药品检验能力的建设,增加有资质的检验机构,国家药监局组织制定了锝标记及正电子类放射性药品检验机构评定程序,现予发布,自发布之日起施行。
中国食品药品检定研究院依职责做好相关检验机构建设的指导工作。
特此公告。
附件:国家药监局锝标记及正电子类放射性药品检验机构评定程序
国家药监局
2024年3月7日。
5.核发《放射性药品使用许可证》验收标准

附件二核发《放射性药品使用许可证》验收标准根据国务院《放射性药品管理办法》的有关规定,结合医疗机构使用放射性药品的实际情况,制定本验收标准(以下简称《标准》)。
一、《放射性药品使用许可证》的申请和审批1.凡使用放射性药品的医疗机构须向所在省、自治区、直辖市药品监督管理部门提出申请,填写《放射性药品使用许可证申请表》(一式四份),并按本《标准》第三项规定报送有关资料。
2.省、自治区、直辖市药品监督管理部门收到申请单位全部资料之日起30个工作日内,按本《标准》要求,及时对申请单位进行验收检查。
经检查验收合格并征求同级卫生、环保部门同意后,发给《放射性药品使用许可证》。
二、《放射性药品使用许可证》的类别1. 《放射性药品使用许可证》(第一类)2.《放射性药品使用许可证》(第二类)3.《放射性药品使用许可证》(第三类)4. 《放射性药品使用许可证》(第四类)三、申报资料1.《放射性药品使用许可证申请表》;2. 医疗机构自查报告;3. 诊、治项目及使用放射性药品品种;4. 各类人员简况及上岗资历证明。
包括受教育情况,学历学位证书(复印件),工作经历,技术职务,科研成果等;5. 仪器、设备和房屋设施情况;6. 有关规章制度;7. 《医疗机构执业许可证》复印件;8. 当地卫生、公安、环保部门分别发放的《放射工作卫生许可证》复印件,《放射性同位素工作登记证》复印件和环境影响评价批文的复印件。
四、许可条件(一)《放射性药品使用许可证》(第一类)1.放射性药品使用范围使用体外诊断用各种含放射性核素的分析药盒。
2. 人员(1)具有医学院校毕业、经核医学专业培训半年以上,并获中级以上专业技术职务的人员;(2)具有中专以上文化程度、经核医学(放免)专业培训,从事本专业三年以上的技术人员;(3)操作放射性物质的人员应持有卫生行政部门发给的《放射工作人员证》。
3. 仪器与设备(1)具有表面沾污监测仪、加样器、 计数器或液体闪烁计数器、恒温水浴箱、离心机、冰箱等;(2)具有满足辐射防护要求的储存、操作、废弃物处置等设备;(3)具有洗刷、清洁等器具和设备。
《放射性药品使用许可证》许可条件对照表
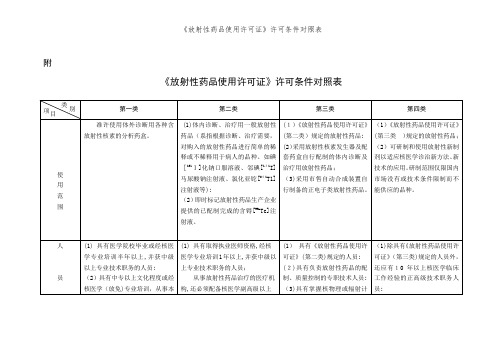
《放射性药品使用许可证》许可条件对照表
第一类
第二类
第三类
第四类
使
用
范
围
准许使用体外诊断用各种含放射性核素的分析药盒。
(1)体内诊断、治疗用一般放射性药品(系指根据诊断、治疗需要,对购入的放射性药品进行简单的稀释或不稀释用于病人的品种。如碘[131I]化钠口服溶液、邻碘[131I]马尿酸钠注射液、氯化亚铊[201T1]注射液等);
(1)具有《放射性药品使用许可证》(第二类)规定的人员;
(2)具有负责放射性药品的配制、质量控制的专职技术人员;
(3)具有掌握核物理或辐射计量专业知识的技术人员。
(1)除具有《放射性药品使用许可证》(第三类)规定的人员外,还应有10年以上核医学临床工作经验的正高级技术职务人员;
(2)具有核医学技术专业高级职务的人员;
(2)实验室内墙壁表面平整、光洁,操作区的地面应易于去污、清洁;
(3)实验室内设通风橱;具有放射性药品用具的洗刷和消毒设施等;
(4)具备防昆虫和防尘设施;
(5)具有满足辐射防护要求的存放放射性药品和废弃污物的设施;
(6)具有安全防盗设施。
达到《放射性药品使用许可证》(第二类)的要求;制备正电子类放射性药品的还应有相应的制备和放射防护设施。
腺疾病治疗的必须配备甲功仪。
(1)达到《放射性药品使用许可证》(第二类)规定的相应条件;
(2)具有保证无菌操作的净化设备;制备正电子类放射性药品还应具备加速器、自动合成装置、高能正电子成像设备;
(3)具备储存配套药盒的冷冻或冷藏设备和满足辐射防护要求的存放放射性药品和废弃污物的设备;
(4)具备与所用放射性药品质
(2)即时标记放射性药品生产企业提供的已配制完成的含锝[99mTc]注射液。
核发放射性药品使用许可证验收标准

核发放射性药品使用许可证验收标准一、根据《放射性药品管理办法》,参照国家核发《放射性药品使用许可证》验收标准(2003版)及《药品GMP》放射性药品附录,制订本标准。
二、许可证类别及药品使用范围(一)第一类:使用体外诊断用各种含放射性核素的分析药盒。
(二)第二类:1.体内诊断、治疗用一般放射性药品(系指根据诊断、治疗需要,对购入的放射性药品进行简单的稀释或不稀释用于病人的品种。
如碘[131I]化钠口服溶液、邻碘[131I]马尿酸钠注射液、氯化亚铊[201T1]注射液等);2.即时标记放射性药品生产企业提供的已配制完成的含锝[99mTc]注射液。
(三)第三类:1.《放射性药品使用许可证》(第二类)规定的放射性药品;2.采用放射性核素发生器及配套药盒自行配制的体内诊断及治疗用放射性药品;3.采用市售自动合成装置自行制备的正电子类放射性药品。
(四)第四类:1.《放射性药品使用许可证》(第三类)规定的放射性药品;2.可研制和使用放射性新制剂以适应核医学诊治新方法、新技术的应用。
研制范围仅限国内市场没有或技术条件限制而不能供应的品种。
三、结果评定本标准设评定条款一类共九项30条,其中设否决条款2条(条款号前加“**”);重点条款10条(条款号前加“*”);一般条款18条。
二类共九项29条,其中设否决条款2条(条款号前加“**”);重点条款10条(条款号前加“*”);一般条款17条。
三类共九项67条,其中设否决条款6条(条款号前加“**”);重点条款20条(条款号前加“*”);一般条款41条。
四类共九项74条,其中设否决条款7条(条款号前加“**”);重点条款22条(条款号前加“*”);一般条款45条。
四、评定内容35、开展体内放射性药品诊断:必须配备经标定的活度计(井型电离室)、功能测定仪(甲功仪或肾图仪)或显像设备(闪烁照相机或单光子发射计算机断层仪);开展体内放射性药品治疗:必须配备经标定的活度计(井型电离室)、显像设备(闪烁照相机或单光子发射计算机断层仪);开展甲状腺疾病治疗的必须配备甲功仪(二、三、四类)。
核发放射性药品使用许可证验收标准

核发放射性药品使用许可证验收标准一、根据《放射性药品管理办法》,参照国家核发《放射性药品使用许可证》验收标准(2003版)及《药品GMP》放射性药品附录,制订本标准。
二、许可证类别及药品使用范围(一)第一类:使用体外诊断用各种含放射性核素的分析药盒。
(二)第二类:1.体内诊断、治疗用一般放射性药品(系指根据诊断、治疗需要,对购入的放射性药品进行简单的稀释或不稀释用于病人的品种。
如碘[131I]化钠口服溶液、邻碘[131I]马尿酸钠注射液、氯化亚铊[201T1]注射液等);2.即时标记放射性药品生产企业提供的已配制完成的含锝[99mTc]注射液。
(三)第三类:1.《放射性药品使用许可证》(第二类)规定的放射性药品;2.采用放射性核素发生器及配套药盒自行配制的体内诊断及治疗用放射性药品;3.采用市售自动合成装置自行制备的正电子类放射性药品。
(四)第四类:1.《放射性药品使用许可证》(第三类)规定的放射性药品;2.可研制和使用放射性新制剂以适应核医学诊治新方法、新技术的应用。
研制范围仅限国内市场没有或技术条件限制而不能供应的品种。
三、结果评定本标准设评定条款一类共九项30条,其中设否决条款2条(条款号前加“**”);重点条款10条(条款号前加“*”);一般条款18条。
二类共九项29条,其中设否决条款2条(条款号前加“**”);重点条款10条(条款号前加“*”);一般条款17条。
三类共九项67条,其中设否决条款6条(条款号前加“**”);重点条款20条(条款号前加“*”);一般条款41条。
四类共九项74条,其中设否决条款7条(条款号前加“**”);重点条款22条(条款号前加“*”);一般条款45条。
四、评定内容35、开展体内放射性药品诊断:必须配备经标定的活度计(井型电离室)、功能测定仪(甲功仪或肾图仪)或显像设备(闪烁照相机或单光子发射计算机断层仪);开展体内放射性药品治疗:必须配备经标定的活度计(井型电离室)、显像设备(闪烁照相机或单光子发射计算机断层仪);开展甲状腺疾病治疗的必须配备甲功仪(二、三、四类)。
医疗机构制备正电子类放射性药品质量管理规范

附件5:医疗机构制备正电子类放射性药品质量管理规范第一章总则第一条根据《中华人民共和国药品管理法》和《放射性药品管理办法》等规定,参照《药品生产质量管理规范》的基本原则,制定本规范。
第二条医疗机构正电子类放射性药品系指由医疗机构利用本单位的医用回旋加速器生产的正电子类放射性核素制备的放射性药品。
第三条本规范适用于具有Ⅲ类以上(含Ⅲ类)《放射性药品使用许可证》的医疗机构。
第四条国家食品药品监督管理局和省、自治区、直辖市食品药品监督管理局(药品监督管理局)负责对医疗机构正电子类放射性药品进行质量监督。
第五条本规范是医疗机构正电子类放射性药品制备和质量管理的基本准则,适用于正电子类放射性药品制备的全过程。
第二章机构与人员第六条医疗机构应具有从事正电子类放射性药品制备和质量管理的专职人员,人员职责明确。
应配备专门从事加速器、自动合成模块操作的专业人员。
应有放射性药品质量控制与检测人员。
第七条放射性药品制备和质量管理负责人应具有核医学专业知识、具有化学或药学相关专业大学学历,有能力对放射性药品制备过程和质量控制中的实际问题作出正确的判断和处理,对本规范的实施和产品质量负责。
第八条医疗机构制备正电子类放射性药品时应有各自独立的制备和质量控制人员,不得由同一人兼任。
第九条从事正电子类放射性药品制备操作人员应具有基础理论知识和实际操作技能,经专业技术及辐射防护知识培训,并取得岗位操作证书。
第十条从事正电子类放射性质量检验的人员应经中国药品生物制品检定所或国家食品药品监督管理局授权的药品检验机构专业技术培训,并取得培训合格证书。
第十一条医疗机构制备正电子类放射性药品时应指定辐射防护负责人员,负责本单位开展相关辐射防护工作。
第三章房屋与设施第十二条医疗机构制备正电子类放射性药品应当有整洁的制备环境,制备区域的设计应当附合国家关于辐射防护的有关规定,并经当地环境保护部门认可。
存放易燃、易爆危险品的场所应有防爆和消防设施。
《放射性药品使用许可证》许可条件对照表
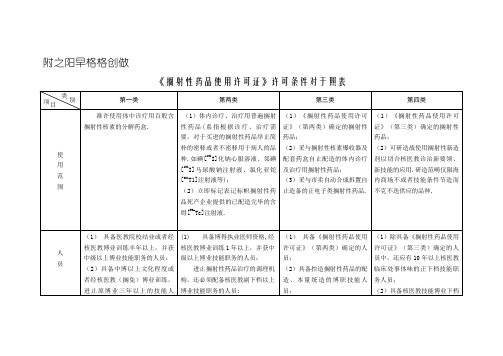
(1) 具备表面沾污监测仪;
(2)配备谦脚辐射防备央供的储躲、支配、兴弃物处置设备;
(3)启展体内搁射性药品诊疗:必须配备经标定的活度计(井型电离室)、功能测定仪(甲功仪或者肾图仪)或者隐像设备(闪烁照相机或者单光子收射估计机断层仪);
启展体内搁射性药品治疗:必须配备经标定的活度计(井型电离室)、隐像设备(闪烁照相机或者单光子收射估计机断层仪);启展甲状
(3)支配搁射性物量的人员应持有卫死止政部散收给的《搁射处事人员证》.
(1)具备博得执业医师资格,经核医教博业训练1年以上,并获中级以上博业技能职务的人员;
进止搁射性药品治疗的调理机构,还必须配备核医教副下档以上博业技能职务的人员;
(2)具中博以上文化程度或者经核医教博业训练,进止原博业三年以上的技能人员;
(2)真验室设透气办法,具备器具洗刷战卫死浑净办法;
(3)具备防昆虫战防尘办法;
(4)具备谦脚辐射防备央供的存搁含搁射性核素的分解药盒战兴弃污物的办法;
(5)具备仄安防匪办法.
(1)具备与诊疗战治疗相切合的真验室战病房;使用含等效活度GBq以上的碘[131I]或者其余核素搁射性药品治疗的调理机构应有博用病房;
附之阳早格格创做
《搁射性药品使用许可证》许可条件对于照表
第一类
第两类
第三类
第四类
使
用
范
围
准许使用体中诊疗用百般含搁射性核素的分解药盒.
(1)体内诊疗、治疗用普遍搁射性药品(系指根据诊疗、治疗需要,对于买进的搁射性药品举止简朴的密释或者不密释用于病人的品种.如碘[131I]化钠心服溶液、邻碘[131I]马尿酸钠注射液、氯化亚铊[201T1]注射液等);
医疗机构制备正电子类放射性药品管理暂行规定

医疗机构制备正电子类放射性药品管理暂行规定关于印发医疗机构制备正电子类放射性药品管理暂行规定的通知国药管安[2000]496号2年1月19日发布各省、自治区、直辖市药品监督管理局、卫生厅(局):随着医疗事业的发展,医疗机构设置PET中心(正电子发射断层仪,医用小型回旋加速器及自动合成仪),用以制备使用含正电子类放射性核素药品的情况日益增多。
鉴于这类放射性核素的物理半衰期很短(如氟[18F]T1/2=110分钟,碳[11C]T1/2=20分钟等),大部分需要在医疗机构内自行制备,然后合成放射性药品供病人使用,因此,必须加强此类药品的管理。
根据《中华人民共和国药品管理法》和《放射性药品管理办法》等有关规定,现下达《医疗机构制备正电子类放射性药品管理暂行规定》,请转发有关单位遵照执行。
国家药品监督管理局中华人民共和国卫生部二○○○年十月十九日《医疗机构制备正电子类放射性药品管理暂行规定》第一条根据《中华人民共和国药品管理法》、《放射性药品管理办法》的有关规定,结合制备、使用正电子类放射性药品的医疗机构(简称PET中心)的实际情况,制定本暂行规定。
第二条PET中心系指配备正电子发射断层仪、医用小型回旋加速器及自动合成装置的医疗机构。
第三条凡制备正电子类放射性药品的医疗机构必须遵守本规定。
第四条PET中心制备正电子类放射性药品必须具有第三类《放射性药品使用许可证》。
第五条PET中心制备正电子类放射性药品应向国家药品监督管理局安全监管司和所在地省级药品监督管理局备案。
第六条正电子类放射性药品的制备需经本单位药事委员会审核同意。
研制的新药如已有国家药品质量标准的,应不低于该标准;如无国家标准,应将起草的标准报国家授权的药检所复核。
第七条PET中心负责人应具有较全面的核医药学专业知识,并具高级技术职称;具有专门从事加速器、自动合成仪运行、保养的专业人员;具有药品质量控制与检验的人员。
第八条PET中心的环境应符合国家有关辐射防护的规定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
附件4:
正电子类放射性药品备案批件
受理
号:
批件号:
省、自治区、直辖市食品药品监督管理局
(药品监督管理局)盖章
年月日
填写说明
1.受理号:(省、自治区、直辖市简称)+年号+叁位数字顺序号;
例如:(京)-2005001
2.批件号:(省、自治区、直辖市简称)+ZHDY+年号+叁位数字顺序号;例如:(京)ZHDY2005001
3.药品标准:应写明国家标准或经中国药品生物制品检定所复核的注册标准;
4.药品备案号:(省、自治区、直辖市简称)+ZHDYBA+年号+叁位数字顺序号;例如:(京)ZHDYBA2005001
5.药品备案有效期:自备案批准之日起五年;
6.各省、自治区、直辖市食品药品监督管理局(药品监督管理局)根据备案批件的样式自行印制批件。
