初中化学还原反应
初中化学认识化学反应的氧化和还原过程

初中化学认识化学反应的氧化和还原过程化学是一门研究物质的性质和变化的科学,而化学反应是物质发生变化的基本过程。
在化学反应中,氧化与还原是非常重要的过程。
本文将详细介绍初中化学中认识化学反应的氧化和还原过程。
一、氧化与还原的基本概念氧化与还原是指在化学反应中,某种物质失去电子称为氧化,而另一种物质获得电子称为还原。
氧化和还原过程是相互联系、相互影响的,它们总是同时进行。
二、氧化与还原反应的特征氧化与还原反应具有以下特征:1. 电子转移:在氧化和还原过程中,电子被转移。
氧化物能够接受电子,成为还原剂,而还原剂能够失去电子,成为氧化剂。
2. 氧化与还原是共生的:氧化和还原过程总是同时进行的,它们是相互联系的。
3. 氧化与还原过程可以发生在同一物质中:在某些反应中,一个物质不仅能够同时氧化和还原,还可以是氧化剂和还原剂。
三、氧化和还原反应的实例氧化和还原反应在日常生活中随处可见,以下是一些常见的实例:1. 金属的氧化:金属与氧气反应会生成金属氧化物,如铁与氧气反应生成铁氧化物(生锈)。
2. 非金属的还原:氧气与非金属反应会发生还原。
例如,氧与碳反应生成二氧化碳。
3. 金属和非金属的反应:金属和非金属的反应也涉及到氧化和还原过程。
例如,铜和硫反应生成硫化铜。
四、氧化还原反应的符号表示方法氧化还原反应可以用化学方程式来表示,其中有两种常用的方法:1. 变价法:变价法是根据元素的氧化态变化来表示。
例如,将铁与氧气反应的方程式用变价法表示为:Fe + O₂ → Fe₂O₃2. 氧化数法:氧化数法是根据元素的氧化数(元素的电荷状态)来表示。
例如,铁的氧化数从0变为+3,氧的氧化数从0变为-2:Fe⁰ + O₂⁰ → Fe³⁺ + O²⁻五、氧化剂和还原剂在氧化还原反应中,氧化剂接受电子,还原剂失去电子。
以下是一些常见的氧化剂和还原剂:1. 氧化剂:氧气(O₂)、过氧化氢(H₂O₂)和高锰酸钾(KMnO₄)等都是常见的氧化剂。
最新初中化学还原反应
【生】(小组合作探究并回答)(1)对流层大气基本上不能直接吸收太阳辐射的能量;对流层大气对太阳辐射的吸收具有选择性;波长较短的蓝色光最易被散射,因此散射也具有选择性,对流层的反射作用不具有选择性。
【师】回答得非常好,那么晴朗的天空为什么呈蔚蓝色呢,请同学们结合投影图片思考回答。
实验装置:
1、 操作步骤:先通CO再加热(排尽试管内空气,防止加热时爆炸)。看到明显现象后,先停止加热,再停止通入CO
A、黑色固体逐渐变为红色:CO + CuO ====CO2+ Cu
2、现象及化学方程式B、澄清石灰水变浑浊:CO2+ Ca(OH)2==== CaCO3+H2O
C、气体燃烧,产生蓝色火焰:2CO + O2==== 2CO2
一、对流层大气的受热过程
(一)大气对太阳辐射的吸收情况
【师】(提问)大气对太阳辐射的削弱作用,主要表现为哪几种形式?
【生】(看书后回答)主要表现为吸收、散射和反射。
投影:大气对太阳辐射的削弱作用表
复习提问:在太阳辐射能中,波长由短到长,主要分为哪几类光?各波段能量分别占太阳辐射能量的多少?各类光的波长范围大约是多少?
【生】(读表后回答)按波长由短到长分别有紫外光、可见光、红外光。紫外光占太阳辐射能的比例为7%,波长范围是0.40微米以下。可见光占太阳辐射能的比例是50%,波长范围是
0.40~0.76微米之间。红外光占太阳辐射能的比例是43%,波长范围是大于0.76微米。
【师】(激励性评价并提问)这些光线在经过大气时被大气削弱的情况是否相同,为什么?
3、结论:CO + CuO ====CO2+ Cu
还原性
初中化学掌握氧化还原反应的判断和平衡技巧

初中化学掌握氧化还原反应的判断和平衡技巧化学是一门研究物质组成、性质和变化规律的科学,其中氧化还原反应是化学学习中非常重要的一部分。
准确判断氧化还原反应并掌握平衡技巧是初中化学学习的关键。
本文将介绍初中化学掌握氧化还原反应的判断和平衡技巧。
一、氧化还原反应的判断在化学实验或化学方程式中,氧化还原反应的判断是非常关键的。
我们可以通过以下几个方面来判断氧化还原反应:1. 氧化态的变化:氧化还原反应中,物质的氧化态会发生变化。
通常来说,元素的氧化态为0,当元素失去电子时,其氧化态增大;当元素获得电子时,其氧化态减小。
因此,观察化学方程式中反应物和生成物氧化态的变化可以初步判断氧化还原反应。
2. 电子的转移:氧化还原反应中,电子的转移是必不可少的。
氧化反应指的是物质失去电子,还原反应指的是物质获得电子。
因此,观察化学方程式中电子的转移情况也可以帮助我们判断氧化还原反应。
3. 氧化剂和还原剂:氧化还原反应中,氧化剂是指能够氧化其他物质的物质,而还原剂是指能够还原其他物质的物质。
通过观察化学方程式中的物质,我们可以判断出哪些是氧化剂,哪些是还原剂。
通过以上几个方面的观察和判断,我们可以有效地确定一个反应是否是氧化还原反应。
二、氧化还原反应的平衡技巧氧化还原反应中,平衡方程式的编写是非常重要的,这涉及到了化学计算和实验操作的准确性。
以下是一些掌握平衡技巧的方法:1. 氧化态法:在编写氧化还原反应的平衡方程式时,可以通过氧化态法来进行平衡。
首先,确定反应物和生成物的氧化态,然后平衡氧化态变化相等的物质,最后根据需要平衡其他物质。
2. 电子法:在编写氧化还原反应的平衡方程式时,可以通过电子法来进行平衡。
首先,确定反应物和生成物的氧化态变化,然后根据电子的转移情况平衡反应物和生成物的电子数目。
3. 氧、氢法:在编写氧化还原反应的平衡方程式时,可以通过氧、氢法来进行平衡。
首先,平衡含有氧和氢的物质,然后再平衡其他物质。
初中化学氧化还原反应分析

初中化学氧化还原反应分析在初中化学的学习中,氧化还原反应是一个非常重要的概念。
它不仅是化学反应的重要类型之一,还与我们的日常生活和许多实际应用密切相关。
首先,让我们来理解一下什么是氧化还原反应。
简单地说,氧化还原反应是一种在反应过程中,元素的化合价发生变化的化学反应。
在氧化还原反应中,存在着氧化剂和还原剂。
氧化剂在反应中能够得到电子,使其他物质被氧化,自身被还原;而还原剂则会失去电子,使自身被氧化,其他物质被还原。
比如说,铜和氧气在加热的条件下生成氧化铜这个反应。
铜的化合价从 0 价升高到了+2 价,失去了电子,发生了氧化反应,所以铜在这里是还原剂。
而氧气的化合价从0 价降低到了-2 价,得到了电子,发生了还原反应,氧气就是氧化剂。
那么,如何判断一个反应是否为氧化还原反应呢?最直接的方法就是观察元素的化合价是否发生了变化。
如果有元素的化合价在反应前后发生了改变,那么这个反应就是氧化还原反应;反之,如果所有元素的化合价都没有变化,那它就不是氧化还原反应。
比如氢气和氧气反应生成水,氢元素的化合价从 0 价升高到了+1 价,氧元素的化合价从 0 价降低到了-2 价,这显然是一个氧化还原反应。
再比如碳酸钙在高温下分解为氧化钙和二氧化碳,在这个反应中,各元素的化合价都没有发生变化,所以它不是氧化还原反应。
氧化还原反应在生活中有着广泛的应用。
比如金属的冶炼,像炼铁,就是利用一氧化碳将铁矿石中的氧化铁还原为铁单质。
在电池中,也发生着氧化还原反应,通过化学反应实现了电能的转化和储存。
接下来,我们深入探讨一下氧化还原反应的本质。
氧化还原反应的本质是电子的转移。
在氧化还原反应中,电子从还原剂转移到氧化剂。
这种电子的转移导致了元素化合价的升降。
例如,在锌和稀硫酸的反应中,锌原子失去了两个电子变成了锌离子,这两个电子转移给了氢离子,使其变成了氢气。
这里的电子转移就是氧化还原反应的本质。
了解氧化还原反应的规律对于我们学习化学也非常重要。
初中化学八大反应类型

初中化学八大反应类型
化学反应是化学学科的核心内容之一,可以通过观察物质的性质和变化来了解化学反应的本质。
在初中化学中,化学反应可以分为八大类型,分别为合成反应、分解反应、置换反应、氧化还原反应、酸碱反应、沉淀反应、气体反应和有机反应。
1. 合成反应:两个或多个物质结合成一个新的物质。
如:2Na + Cl2 → 2NaCl。
2. 分解反应:一种物质分解为两种或更多的物质。
如:2H2O →2H2 + O2。
3. 置换反应:一种元素被另一种元素取代,形成新的化合物。
如:Zn + CuSO4 → ZnSO4 + Cu。
4. 氧化还原反应:涉及到电子转移的化学反应,包括氧化和还原两个反应。
如:2Mg + O2 → 2MgO。
5. 酸碱反应:酸和碱相互反应,产生盐和水。
如:HCl + NaOH →NaCl + H2O。
6. 沉淀反应:两种溶液混合在一起时,形成一种不溶于水的固体沉淀。
如:AgNO3 + NaCl → AgCl↓ + NaNO3。
7. 气体反应:涉及到气体的化学反应,包括氧化和还原两个反应。
如:2H2 + O2 → 2H2O。
8. 有机反应:涉及到有机物的化学反应,包括加成反应、消除反应、置换反应等。
如:C6H12O6 → 2C2H5OH + 2CO2。
以上八大反应类型是初中化学中最基础的反应类型,了解这些反
应类型可以帮助我们理解化学反应的本质和规律。
初中化学知识点归纳物质的氧化还原性和氧化还原反应

初中化学知识点归纳物质的氧化还原性和氧化还原反应一、物质的氧化还原性在化学反应中,物质的氧化还原性是一个重要的性质。
氧化还原性主要指物质在化学反应中能够失去电子(即被氧化)或者得到电子(即被还原)的能力。
1. 氧化性氧化性是指物质能够使其他物质失去电子而自身得到电子的性质。
通常,具有氧化性的物质会与其他物质发生氧化反应,同时自身被还原。
例如,金属常常具有氧化性,能够与非金属发生反应,使非金属物质失去电子。
2. 还原性还原性是指物质能够使其他物质得到电子而自身失去电子的性质。
具有还原性的物质常常能够与带有氧或其他电负性较大元素的物质发生反应,将其氧化成较高价态。
二、氧化还原反应氧化还原反应是指物质之间电子的转移过程,其中一个物质失去电子称为氧化剂,另一个物质得到电子称为还原剂。
在氧化还原反应中,氧化剂和还原剂是相互转化的。
1. 氧化剂氧化剂是指在氧化还原反应中能够接受其他物质的电子而自身被还原的物质。
氧化剂具有较强的氧化性,能够促使其他物质失去电子。
常见的氧化剂有氧气、过氧化氢、高锰酸钾等。
2. 还原剂还原剂是指在氧化还原反应中能够提供电子给其他物质而自身被氧化的物质。
还原剂具有较强的还原性,能够使其他物质得到电子。
常见的还原剂有金属、非金属元素、还原金属离子等。
三、实例分析1. 燃烧燃烧是一种常见的氧化还原反应,也是氧化剂和还原剂发生作用的典型例子。
以燃烧木材为例,木材中的碳和氢与空气中的氧发生反应,产生二氧化碳和水。
在这个反应中,氧气作为氧化剂接受了木材中碳和氢的电子,而木材中的碳和氢则被氧气氧化成了二氧化碳和水。
2. 金属的腐蚀金属的腐蚀也是一种常见的氧化还原反应。
以铁的腐蚀为例,铁与空气中的氧发生反应,产生了铁的氧化物即铁锈。
在这个反应中,铁被氧化成了铁离子,氧则被还原成了氧化物。
这个反应会导致铁的表面出现腐蚀,破坏了铁的性质和外观。
3. 电池的工作原理电池的工作原理也是基于氧化还原反应。
初中化学方程式和计算
初中化学方程式和计算
一、酸碱反应
1.氢氧化钠与硫酸钠反应:
NaOH+H2SO4→Na2SO4+2H2O
此反应是一个酸碱反应,即氢氧化钠(NaOH)作为酸,硫酸钠(H2SO4)作为碱,通过反应生成了硫酸钠和水。
2.硫酸钠与氢氧化钾反应:
KOH+H2SO4→K2SO4+2H2O
此反应也是酸碱反应,即氢氧化钾(KOH)作为酸,硫酸钠(H2SO4)作为碱,通过反应生成了硫酸钾和水。
二、氧化还原反应
1.亚硫酸钠的氧化反应:
Na2S2O3→Na2SO4+S
此反应是一个氧化还原反应,即亚硫酸钠(Na2S2O3)由于被氧化,产生了硫酸钠(Na2SO4)和硫(S)。
2.氢氧化钙的氧化反应:
Ca(OH)2→CaO+H2O
此反应也是氧化还原反应,即氢氧化钙(Ca(OH)2)由于被氧化,产生了氧化钙(CaO)和水(H2O)。
三、按照相应的定律和计算
1.热力学定律和计算:
根据热力学第二定律,可以知道,在反应期间会产生热量,从而改变系统的熵。
熵可以通过计算给出,这叫做熵增(ΔS)。
例如,对于氢氧化钠与硫酸钠的反应,可以写出ΔS=ΔS(NaOH)+ΔS(H2SO4)-ΔS(Na2SO4)-2ΔS(H2O)。
2.热化学定律和计算:
根据热化学第一定律,可以知道。
初中化学还原反应
初中化学还原反应Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】还原反应一、C 还原氧化铜1、实验装置2、操作:(1)将炭和氧化铜混合均匀,放入大试管中高温加热(2)将生成的气体通入澄清石灰水(3)看到明显的现象后,先将导管移出石灰水,在停止加热(防止倒吸使试管炸裂)3、现象及化学方程式黑色固体逐渐变为红色大试管 C+2CuO====2Cu+CO2澄清石灰水变浑浊小试管CO 2+Ca(OH)2====CaCO 3+H 2O思考:1CO 2外,还可能有CO ,生成该气体的化学方程式: C+CO 22相关化学反应:2Fe 2O 32 2FeO+C====2Fe+CO 2 CO 2+C====2CO 二、H 2还原氧化铜实验装置:1、操作顺序:氢——灯——灯——氢(先通氢气的目的:排尽试管中的空气,防止加热时爆炸)2、现象:黑色粉末逐渐变为红色,试管内壁出现水雾3、实验结论:氢气和氧化铜加热条件下反应生成铜和水H 2+CuO====H 2O+Cu三、CO 还原氧化铜实验装置:1、操作步骤:先通CO 再加热(排尽试管内空气,防止加热时爆炸)。
看到明显现象后,先停止加热,再停止通入COA 、黑色固体逐渐变为红色:CO+CuO====CO 2+Cu2、现象及化学方程式B 、澄清石灰水变浑浊:CO 2+Ca(OH)2+H 2OC 、气体燃烧,产生蓝色火焰:2CO+O 2====2CO 2 3、结论:CO+CuO====CO 2+Cu还原性4、通过该实验可得到CO 的性质可燃性5、装置C 的作用:进行尾气处理(防止气体污染空气)。
初中化学氧化还原反应复习专题
初中化学氧化还原反应复习专题有关氧化还原反应的基本规律一氧化性和还原性1.物质的氧化性及还原性与核心元素化合价的关系2.氧化性、还原性强弱比较的方法(1)根据元素的活动性顺序比较如:Fe+CuSO4===FeSO4+Cu 金属还原性:Fe>Cu在反应中Fe是__________________,Cu___________________。
(2)根据氧化还原反应方程式比较氧化性:氧化剂>氧化产物还原性:还原剂>还原产物(3)根据氧化还原反应发生的条件来判断: 如:MnO2+4HCl(浓) =====△MnCl2+C12↑+2H2O核心元素化合价实例性质最高价KMn+7O4、Fe+3Cl3、浓HN+5O3、浓H2S+6O4只有______________中间价SO+42、Na2S+4O3、Fe+2SO4、S0既有___________ 又有__________ 最低价Fe0、Na0、K I-1只有___________2KMnO4+16HCl(浓)=2MnCl2+5C12↑+8H2O+2KCl后者比前者容易(不需要加热),可判断氧化性 KMnO4>MnO2 (4)根据反应速率的大小来判断:如:2Na2SO3+O2=2Na2SO4(快), 2H2SO3+O2=2H2SO4(慢),2SO2+O2催化剂Δ2SO3,其还原性: Na2SO4>H2SO3>SO2题组一氧化性和还原性比较1 (2019·石家庄期中)已知X2、Y2、Z2、W2四种物质的氧化性由强到弱的顺序为W2>Z2>X2>Y2下列氧化还原反应能发生的是( )A.2NaW+Z2===2NaZ+W2 B.2NaX+Z2===2NaZ+X2C.2NaW+Y2===2NaY+W2 D.2NaZ+X2===2NaX+Z22 已知常温下,在溶液中可发生如下反应:Ce4++Fe2+===Fe3++Ce3+,Sn2++2Fe3+===2Fe2++Sn4+。
初中化学常见化学反应类型
初中化学常见化学反应类型化学反应是物质发生变化的过程,常见化学反应类型主要包括合成反应、分解反应、置换反应、还原反应、氧化反应和酸碱反应等。
下面将逐一介绍这些常见化学反应类型。
一、合成反应合成反应(Synthesis Reaction),也叫做化合反应或组成反应,是指两种或两种以上的物质在一定条件下结合形成一种新物质的化学反应。
合成反应的通式可以表示为:A + B → AB。
例如:1. 2H₂ + O₂ → 2H₂O这是一个合成水的反应,由氢气和氧气反应生成水。
2. CaCO₃ → CaO + CO₂这是石灰石分解反应,石灰石在高温下分解成氧化钙和二氧化碳。
二、分解反应分解反应(Decomposition Reaction),是指一种物质在一定条件下,被分解成两种或两种以上的物质的化学反应。
分解反应的通式可以表示为:AB → A + B。
例如:1. 2H₂O → 2H₂ + O₂这是水分解反应,水分解成氢气和氧气。
2. 2KClO₃ → 2KCl + 3O₂这是高锰酸钾分解反应,高锰酸钾分解成氯化钾和氧气。
三、置换反应置换反应(Replacement Reaction),也称为置换反应或交换反应,是指一个元素和一个化合物之间发生的反应,其中该元素取代了化合物中的元素。
置换反应的通式可以表示为:A + BC → AC + B。
例如:1. 2Al + 3CuCl₂ → 2AlCl₃ + 3Cu这是铜在盐酸溶液中被铝取代的反应,生成氯化铜和铝。
2. Zn + H₂SO₄ → ZnSO₄ + H₂这是锌和硫酸反应生成硫酸锌和氢气的反应。
四、还原反应还原反应(Reduction Reaction),是指化学反应中电子的转移,即物质失去氧化剂给予的氧,或者获得电子。
还原反应的通式可以表示为:A + B → AB。
例如:1. 2Na + Cl₂ → 2NaCl这是钠和氯气反应生成氯化钠的反应。
2. CuO + H₂ → Cu + H₂O这是氧化铜还原成铜和水的反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初中化学还原反应Prepared on 21 November 2021
还原反应
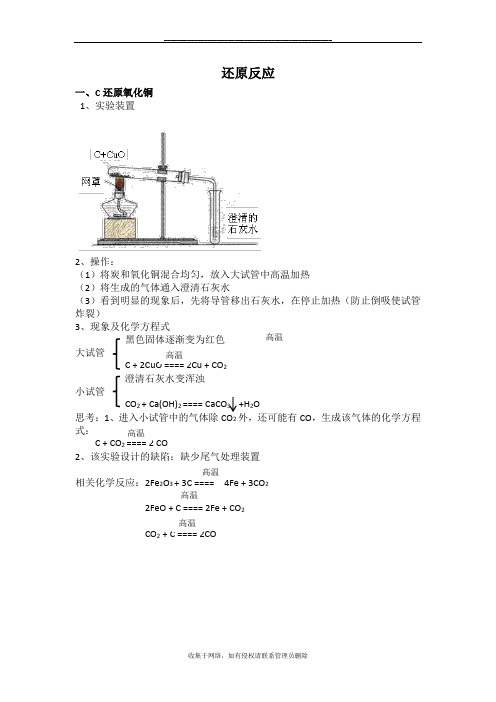
一、C 还原氧化铜
1、实验装置
2、操作:
(1)将炭和氧化铜混合均匀,放入大试管中高温加热
(2)将生成的气体通入澄清石灰水
(3)看到明显的现象后,先将导管移出石灰水,在停止加热(防止倒吸使试管炸裂)
3、现象及化学方程式
黑色固体逐渐变为红色大试管 C+2CuO====2Cu+CO
2澄清石灰水变浑浊
小试管
CO 2+Ca(OH)2====CaCO 3
+H 2
O
思考:1
CO 2外,还可能有CO ,生成该气体的化学方程
式: C+CO 22
相关化学反应:2Fe 2O 32 2FeO+C====2Fe+CO 2 CO 2+C====2CO 二、H 2还原氧化铜
实验装置:
1、操作顺序:氢——灯——灯——氢(先通氢气的目的:排尽试管中的空气,防止加热时爆炸)
2、现象:黑色粉末逐渐变为红色,试管内壁出现水雾
3、实验结论:氢气和氧化铜加热条件下反应生成铜和水
H 2+CuO====H 2O+Cu
三、CO 还原氧化铜
实验装置:
1、操作步骤:先通CO 再加热(排尽试管内空气,防止加热时爆炸)。
看到明显现象后,先停止加热,再停止通入CO
A 、黑色固体逐渐变为红色:CO+CuO====CO 2+Cu
2、现象及化学方程式B 、澄清石灰水变浑浊:CO 2+Ca(OH)2+H 2O
C 、气体燃烧,产生蓝色火焰:2CO+O 2====2CO 2 3、结论:CO+CuO====CO 2+Cu
还原性
4、通过该实验可得到CO 的性质
可燃性
5、装置C 的作用:进行尾气处理(防止气体污染空气)。
